Regra de Markovnikov
Em físico-química orgânica, a regra de Markovnikov é uma observação, relacionada à reação de adição eletrofílica.Foi formulada pelo químico russo Vladimir Vasilevich Markovnikov em 1870.[1][2]
Esta regra diz que, numa reação reação química encontrada particularmente em química orgânica, a regra estabelece que, quando se adiciona um composto assimétrico do tipo H-X (normalmente um hidrácido) a um alceno ou alcino, o átomo de hidrogênio lábil, ácido, liga-se ao átomo de carbono com maior número de hidrogênios (o dobro ou o triplo de ligações com o maior número de átomos de hidrogênio), e o grupo halogênio (X) se une ao átomo de carbono de dupla ou tripla ligação com o menor número de átomos de hidrogênio (o outro carbono da dupla ligação.[3][4][5]
- CH2=CH-CH3 + HCl → CH3-CHCl-CH3
- CH2=CH-CH2-CH3 + HBr → CH3-CHBr-CH2-CH3
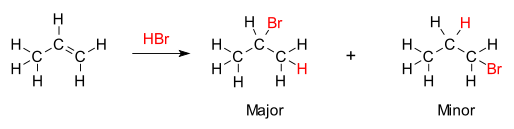
Note-se que esta regra deriva de o carbono menos substituído, ao ser rodeado por mais hidrogênios, ter maior eletronegatividade, pelo que tem maior tendência a atrair/captar o eletrófilo - componente positivo - enquanto que o outro carbono envolvido na ligação dupla tem maior tendência a captar o nucleófilo, pois ao ser mais substituído tende a constituir um dipolo menos negativo.
O mesmo é verdade quando um alceno reage com água em uma reação catalisada por ácidos mineraiss, para produzir álcoois. O grupo hidroxilo (OH) se une ao átomo de carbono que tem o maior número de ligações carbono-carbono, enquanto que o átomo de hidrogênio se une ao átomo de carbono no outro extremo da ligação dupla, o que tem o maior número de ligações carbono-hidrogênio.
A base química para a regra de Markovnikov é a formação do carbocátion mais estável, durante o processo de adição. A adição do átomo de hidrogênio a um dos átomos de carbono origina uma carga formal positiva no outro átomo de carbono, formando um carbocátion intermediário. Quanto mais substituído está um carbocátion (mais ligações tem a outro átomo de carbono ou outros substituintes eletrodoadores), mais estável é, devido ao efeito indutivo, hiperconjugação e impedimento estérico. O produto principal da reação de adição será o que tenha o intermediário mais estável. Em consequência, o produto principal da adição do HX (onde X é um halogênio, átomo ou grupo funcional mais eletronegativo que o átomo de hidrogênio) a um alceno tem o átomo de hidrogênio na posição menos substituída e o grupo X na posição mais substituída. É importante notar que, entretanto, também se formará o carbocátion menos estável, ainda que em menor grau, e tenderá a formar o produto minoritário com a disposição dos átomos na forma oposta.
Como uma técnica mnemônica, pode-se resumir em "o rico se torna mais rico e o pobre se torna mais pobre" (ou ainda mais resumidamente, “dinheiro atrai dinheiro”): um átomo de carbono rico em substituintes ganhará mais substituintes, e o átomo de carbono com mais átomos de hidrogênio unidos ganhará mais átomos de hidrogênio.
Contexto histórico[editar | editar código-fonte]
Uma das reações orgânicas nas que Markovnikov baseou sua regra foi a que ocorre entre o iodeto de hidrogênio com o brometo de vinilo (efetuada pela primera vez em 1865). Em outra manifestação de sua regra, observou que o átomo de halogênio se uniu ao átomo de carbono que já levava um átomo de halogênio. A hidrólise de halogenetos germinais do produto inicial de reação com óxido de prata úmido ou hidrogenado a etanal provou que a substituição era 1,1.

Tem sido observado[2] que a publicação original de Markovnikov de 1869 era superficial e que não foi realizado muito trabalho experimental. A própria regra apareceu apenas como uma nota de rodapé em um artigo de 26 páginas, o que pode ajudar a explicar por que levou 60 anos até que tal regra tivesse sido aceita.
Regra de Anti-Markovnikov[editar | editar código-fonte]
Quando o mecanismo seguido pela reação impede a formação de um intermediário carbocátion, a reação pode seguir outros mecanismos que também são regiosseletivos, mas contrários às predições da regra de Markovnikov, como a adição de radical livre.[5]
Tais reações são ditas serem anti-Markovnikov, dado que o átomo de halogênio se une ao átomo de carbono menos substituído. Esta reação é exatamente oposta à reação de Markovnikov quanto a seus resultados, e daí seu nome. Novamente, do mesmo modo que com a carga positiva, o radical é mais estável quando está na posição mais substituída.
O comportamento anti-Markovnikov se extende a outras reações químicas distintas às simples adições aos alcenos. Uma manifestação anti-Markovnikov é observada na hidratação del fenilacetileno que, catalisada com ouro, produz a acetofenona esperada, mas com um catalisador especial de rutênio [nota 1] o outro regioisômero 2-fenilacetaldeído:[6]

O comportamento anti-Markovnikov também pode se manifestar em certas reações de transposição. Em uma substituição nucleofílica formal catalisada por cloreto de titânio (IV) no composto 1 enantiopuro no esquema a seguir, se formam os dois produtos racêmicos 2a e 2b:[7]

Esta distribuição do produto pode ser pensada como sendo que a perda do grupo hidroxilo em 1 produza o carbocátion terciário A, que se rearranja ao aparentemente menos estável carbocátion secundário B. O cloro pode aproximar-se a este centro a partir de duas faces, conduzindo à mistura observada de isômeros.
Porém, talvez o exemplo mais conhecido de adição anti-Markovnikov é a hidroboração.[8]
Um novo método de adição anti-Markovnikov foi descrito por Hamilton e Nicewicz, o qual usa moléculas aromáticas e energia leve de um díodo de baixa energia para transformar o alceno em um radical cátion.[9][10]
Notas
Referências
- ↑ Markovnikoff, W. (1870). «Ueber die Abhängigkeit der verschiedenen Vertretbarkeit des Radicalwasserstoffs in den isomeren Buttersäuren». Annalen der Pharmacie. 153 (1): 228–259. doi:10.1002/jlac.18701530204
- ↑ a b Was Markovnikov’s Rule an Inspired Guess? Peter Hughes 1152 Journal of Chemical Education • Vol. 83 No. 8 August 2006
- ↑ Organic Chemistry, 6th Edition, by John McMurry. Section 6.9, page 187
- ↑ Additions to Alkenes: Regiochemistry
- ↑ a b Ajikumar Aryangat; The MCAT Chemistry Book; Nova Press, 2015. pg 209-219
- ↑ Highly Active in Situ Catalysts for Anti-Markovnikov Hydration of Terminal AlkynesAurélie Labonne, Thomas Kribber, and Lukas Hintermann Org. Lett.; 2006; 8(25) pp 5853 - 5856; (Letter) doi:10.1021/ol062455k
- ↑ TiCl4 Induced Anti-Markovnikov Rearrangement Mugio Nishizawa, Yumiko Asai, and Hiroshi Imagawa Org. Lett.; 2006; 8(25) pp 5793 - 5796; (Letter) doi:10.1021/ol062337x.
- ↑ Georg Thieme; [ Science of Synthesis: Houben-Weyl Methods of Molecular Transformations Vol. 6: Boron Compounds]; Verlag, 2014. pg 1150 -1152
- ↑ Carmen Drahl; Light-Driven Reaction Modifies Double Bonds With Unconventional Selectivity; Chemical & Engineering News; Volume 91 Issue 15, p. 8, News of The Week Issue Date: April 15, 2013, Web Date: April 11, 2013.
- ↑ David S. Hamilton and David A. Nicewicz; Direct Catalytic Anti-Markovnikov Hydroetherification of Alkenols; J. Am. Chem. Soc., 2012, 134 (45), pp 18577–18580. DOI: 10.1021/ja309635w
