Tricoleucemia
| Leucemia de células cabeludas ou Tricoleucemia | |
|---|---|
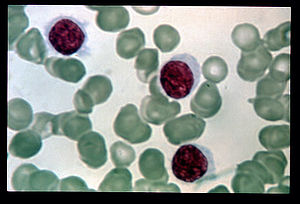
| Sangue com a presença de células cabeludas | |
| Especialidade | hematologia |
| Classificação e recursos externos | |
| CID-10 | C91.4 |
| CID-9 | 202.4 |
| CID-ICD-O | 9940/3 |
| CID-11 | e 1528295930 82152208 e 1528295930 |
| DiseasesDB | 5589 |
| MedlinePlus | 000592 |
| eMedicine | med/937 |
| MeSH | D007943 |
Tricoleucemia, Leucemia de células cabeludas ou Leucemia de células pilosas é uma neoplasia de células B que tem características projeções citoplasmáticas sendo chamadas de células cabeludas ou, do inglês, "Hair Cells". Esta é geralmente classificada como um sub-tipo de leucemia linfóide crônica. Não é uma doença comum, representando cerca de 2% de todas as leucemias.
Originalmente conhecida como leucemia histiocítica, reticulose maligna, ou mielofibrose linfóide em publicações antes de 1920, esta doença foi formalmente nomeada como leucemia reticuloendoteliose por Bertha Bouroncle e seus colegas da Universidade de Ohio (Ohio State University College of Medicine) em 1958. Seu nome atual comum foi cunhado em 1966[1] derivado da aparência de suas células na visualização microscópica.
Classificação
[editar | editar código-fonte]Além da forma clássica duas variantes têm sido descritas: a leucemia de células cabeludas-variante [1][ligação inativa] e a variante japonesa. A variante não japonesa é mais difícil de tratar do que a forma "clássica" e do que a variante japonesa.
Leucemia de células cabeludas-variante, é geralmente descrita como uma variante prolinfocítica de célula cabeluda.[2] Ela foi descrita pela primeira vez em 1980 por um jornal da Universidade de Cambridge.[3] Cerca de 10% dos pacientes com leucemia de células cabeludas tem esta forma de doença, representando entre 60-75 de casos novos de leucemia de células cabeludas variante por ano nos Estados Unidos. Enquanto que a forma clássica afeta principalmente homens, a forma variante é um tanto dividida uniformemente entre homens e mulheres.[4] Embora a doença possa aparecer em qualquer idade, a idade média no momento do diagnóstico é maior que 70 anos.[5]
Similar a Leucemia prolinfocítica B, a leucemia de células cabeludas-variante é uma doença mais agressiva que a leucemia linfocítica crônica. O tratamento desta forma da doença tem uma probabilidade menor de sucesso do que a forma clássica e remissões tendem a ser menores. Muitos tratamentos, como com Interferon-alfa, protocolo CHOP e agentes alquilantes como ciclofosfamida, fornecem pouco benefício.[4] Pentostatin e cladribina fornecem algum benefício para muitos pacientes desta forma variante, mas com curta remissão e porcentagem de resposta mais baixa que a forma clássica. Mais da metade dos pacientes respondem parcialmente a esplenectomia.[4]
A forma variante difere da forma clássica principalmente nestes aspectos:
- Contagem de leucócitos baixa, às vezes em excesso com 100.000 células por microlitro;
- Desenvolvimento mais agressivo da doença que requer um tratamento mais frequente;
- Células com um largo e incomum nucléolo em comparação a seu tamanho;
- Pouco excesso de fibronectina (que é produzida na forma clássica)[6]) o que interfere na biopsia de medula óssea; e
- Pouca ou nenhuma expressão para CD25 (também chamada de Interleucina-2 [IL-2] cadeia receptor alfa ou p55) na superfície das células.[7]
A falta de CD25, que é parte do receptor para hormônio imunoregulador, pode explicar porque casos desta forma variante são normalmente resistentes ao tratamento por hormônios sistema imune.[2]
A forma variante, que tem alta proporção de células cabeludas sem um gene tumor supressor p53 funcional, tem maior probabilidade de se transformar em uma doença de alto grau. Daniel Catovsky sugeriu uma típica transformação similar a transformação da leucemia linfocítica crônica em Síndrome de Richter[4] em aproximadamente 6% de um grupo de pacientes.[8] Entre os pacientes desta forma variante, os casos mais agressivos normalmente têm menor quantidade de atividade do gene p53.[9]
Leucemia de células cabeludas-variante japonesa é mais fácil de ser tratada.
Sintomas
[editar | editar código-fonte]Nesta leucemia, o acumulo de "células cabeludas" bloqueia a medula óssea, o que significa que a medula tem dificuldade de produzir células normais suficientes: leucócitos para luta contra infecções, glóbulos vermelhos para transportar oxigênio, e plaquetas para evitar sangramentos. Consequentemente, pacientes geralmente apresentam infecções, anemia e seus sintomas relacionados, e/ou sangramento fácil.[10]
A maioria dos sintomas são vagos, surgindo relatos como "fadiga persistente" ou "não estar se sentindo bem". Muitas das células leucêmicas acumulam-se no baço e causam o seu aumento; isto pode ser um efeito colateral que faz a pessoa ter a sensação de sentir-se cheia mesmo quando ela não se alimenta em excesso.
A leucemia de células cabeludas é normalmente diagnosticada depois de um exame de rotina. O hemograma mostra uma baixa contagem inesperada de um ou mais tipos de células sanguíneas (glóbulos brancos, glóbulos vermelhos e/ou plaquetas). Ou o diagnóstico surge depois da presença de hematoma ou infecção inexplicáveis, como uma repetida pneumonia em pacientes aparentemente sadios.
A função plaquetária pode estar um tanto prejudicada em pacientes com leucemia de células cabeludas, embora isto não tenha algum significado prático.[11] Isto pode levar a leves hematomas ou sangramentos em casos de pequenos cortes.
Pacientes com alto grau de tumor podem ter níveis reduzidos de colesterol,[12] especialmente em pacientes com baço aumentado.[13] O nível de colesterol retorna a valores mais normais com o sucesso do tratamento.
Causa
[editar | editar código-fonte]A causa é desconhecida, mas geralmente é aceito que ela não é causada pelo uso de tabaco, radiação ionizante, pesticidas, ou por produtos químicos industriais.[14] A possibilidade de que esta doença seja causada por um acidente casual durante a divisão celular rotineira não deve ser excluída.
Diagnóstico
[editar | editar código-fonte]
O diagnóstico pode começar com um simples teste como o hemograma, mas o uso dele é inadequado para o dianóstico. O hemograma geralmente mostra uma baixa contagem para leucócitos, hemácias, e plaquetas , ou seja, uma pancitopenia (três tipos celulares diminuídos). Entretanto, se houver a presença de células típicas desta leucemia, as chamadas células cabeludas ou do inglês "hairy cells", fornece-se a primeira indicação para o dianóstico. O hemograma geralmente apresenta neutropenia (diminuição do número de neutrófilos) e monocitopenia (diminuição do número de monócitos). Na forma variante, a monocitopenia não está presente.
A maioria dos pacientes precisa da biopsia da medula óssea para um diagnóstico apropiado. A biopsia da medular é usada para confirmar a presença de células cabeludas e também a ausência de alguma doença secundária. O aspirado medular pode ser difícil pela fibrose causada pela produção de fibronectina pelas células cabeludas.
Células cabeludas são células mononucleares com nucléolo central ou excêntrico. A morfologia núcelo é variável podendo ser oval, redondo, convoluto ou em forma de rim. A cromatina tende a ter padrão reticular. Seu citoplasma tem quantidade variável com projeções. Estas células anormais podem ser vistas no hemograma ou na medula óssea. Na forma clássica, a célula cabeluda tem maior relação núcleo/citoplasmática e núcleo mais central do que a forma clássica.
O diagnóstico pode ser confirmado visualizando estas células com coloração especial, conhecida como fosfatase ácida tártaro-resistente. Porém a forma variante é fraco-positiva para esta coloração.
Também é possível através da citometria de fluxo identificar proteínas características da superfície celular. As células desta leucemia são positivas para CD19, CD20, CD22, CD11c, CD25 e CD103.[15] A forma variante, que compartilha características com a célula B da leucemia prolinfocítica, não expressa CD25 (também chamada de receptor Interleucina-2 receptor, alfa).
Diagnóstico diferencial
[editar | editar código-fonte]- Linfoma esplênico com linfócitos com vilosidades circulantes: A doença apresenta esplenomegalia sem linfoadenopatia assim como a leucemia de células cabeludas. Porém a linfocitose não é tão comum, podendo ser achado células plasmocitóides circulantes. A coloração fosfatase ácida tártaro-resistente pode ser fracamente positiva ou negativa. E as células não expressam CD103 positivo.
Tratamento
[editar | editar código-fonte]Nem todos necessitam de tratamento. Geralmente o tratamento é dado quando os sintomas da doença interferem com a vida cotidiana do paciente, ou quando os leucócitos ou plaquetas caem em perigosos níveis muito baixos. Nem todos os pacientes necessitam de tratamento imediatamente após o dianóstico, e cerca de 10% dos pacientes não irão necessitar de tratamento.
Demora no tratamento é menos importante que de um tumor sólido. Diferente de muitos cânceres, o sucesso do tratamento não depende em tratar a doença no estágio inicial. Já que o atraso no tratamento não afeta o seu sucesso, não há padrão para como tratar a doença rapidamente. Entretanto, a espera muito longa pode causar outros problemas como uma infecção que deve ser evitado pelo tratamento correto para restaurar a função do sistema imune. Se há a presença de um número alto de células cabeludas no momento do tratamento isso pode tra piores efeitos colaterais, alguns destes efeitos colaterais são principalmente causados pela resposta natural do corpo humano na morte de células cabeludas. Isto pode resultar em hospitalização de pacientes cujo tratamento poderia ser totalmente feito em consultório médico.
Uso de uma única droga é normal. Não como a maoria dos cânceres, somente uma droga é normalmente dada ao paciente. Embora a monoterpaia seja normal, terapia combinada (usando terapia de primeira linha e terapia de segunda linha) está sendo estudada é mais usada em casos refratários. É pouco evidente se a combinação de rituximab com cladribina ou pentostatin irá produzir algum benefício prático no paciente.[2] Terapia combinada quase nunca é usada em pacientes novos. Por causa do grande sucesso no tratamento monoterápico com o análogo de purina, o benefício adicional de um tratamento imediato com uma segunda droga em um paciente novo é pouco usado. Por exemplo, um ciclo inicial de cladribina ou pentostatin dá uma média de remissão de 10 anos nos pacientes; um rituximab adicional dá em média somente 3 ou 4 anos. Em casos mais difíceis, entretanto, o benefício de uma única primeira droga pode ser reduzido e a combinação pode trazer algum benefício.
Terapia de primeira linha: Análogo da purina
[editar | editar código-fonte]Cladribina (2CDA) e pentostatin (DCF) são as duas mais comuns terapias de primeira linha. Cladribina é uma espécie de quimioterapia leve que pode ser administrada por injeções sob a pele, por infusões venosas em poucas horas, ou por uma bomba por pacientes que necessitam de gotejamento venoso, 24 horas por dia durante 7 dias. A maioria dos pacientes recebe cladribina por infusão intravenosa uma vez ao dia por 5 a 7 dias, mas muitos pacientes tem a opção de tomar a droga uma vez por semana por 6 meses. As diferentes dosagens usadas com cladribina são aproximadamente iguais em efeito e em segurança.[16] Poucos pacientes tem um efeito colateral significante do que fadiga e febre causada pode células cancerígenas morrendo, embora complicações como infecção e falha renal aguda sejam relatadas.
Pentostatin é quimicamente similar a cladribina, e tem sucesso e efeitos colaterias similares, mas é administrada em períodos mais longos, geralmente uma dose por infusão intravenosa a cada duas semana por 3 a 6 meses.
Embora quimicamente similar, fludarabina não é usada no tratamento desta leucemia.
Durante as semanas que seguem o tratamento, o sistema imune está severamente comprometido, mas a medula óssea do paciente começará a produzir novas células sanguíneas normais. O tratamento geralmente tem longa remissão. Aproximadamente 85% dos pacientes atingem uma resposta completa tanto ao tratmento com cladribina quanto a do pentostatin, embora esta não seja a cura permanente. Se as células malignas voltarem, o tratmento deve ser repetido e o paciente deve entrar em remissão novamente, embora estranhamente o sucesso com o repetido tratamento entre em declínio.[17] A remissão varia significantemente, de 1 ano a mais de 20 anos. A média de pacientes com intervalo livre de tratamento é de aproximadamente 10 anos.
Pacientes que não respondem a estas drogas têm chance reduzida de responder com sucesso a outros tratamentos. Entretanto, há outras opções.
Terapia de segunda linha: imunoterapia
[editar | editar código-fonte]Se um paciente é resistente tanto a cladribina quanto ao pentostatin, então a terapia de segunda linha é usada.
Anticorpos Monoclonais O tratamento mais comum para doenças cladribine-resistente é infundir anticorpo monoclonal que destrói as células cancerígenas B. Rituximab é a droga mais usada. Muitos pacientes recebem a infusão intravenosa por várias horas a cada semana por 4 a 8 semanas. Uma publicação de 2003 relatou 2 pacientes com resposta parcial e 10 com resposta completa for a 15 pacientes com recaída (dentre os 80% de resposta completa).[18] A média de pacientes (incluindo os que não respondem ao tratamento) que não necessitam de um posterior tratamento é de mais de 3 anos. Um estudo da Clínica Scripps de Los Angeles, relata que o suo de 8 doses têm maior resposta que o uso de 4, o que atinge somente 25% de resposta.[19] Rituximab tem grande sucesso induzindo uma completa resposta na Tricoleucemia.[20]
O maior efeito colateral do Rituximab é reação alérgica, que pode ser severa especialmente na primeira infusão. Esta reação é causada por anticorpos agrupando-se durante a infusão e acionando o sistema complemento. Embora a maioria dos pacientes esteja sendo controlada por drogas antialérgicas, algumas severas e até fatais reações tem ocorrido. Conseqüentemente, a primeira dose é sempre dada com a hospitalização do paciente, embora subseqüentes infusões possam ser dadas sem a hospitalização. Normalmente, remissões são menores do que o uso de drogas de primeira linha, mas remissões hematológicas com vários anos de duração não sejam incomuns.
Outros anticorpos monoclonais como Alemtuzumab, Ibritumomab tiuxetan e I-131 Tositumomab podem ser considerados para casos refratários.
Interferon-alfa Interferon-alpha é um hormônio sistema imune que é muito útil para um pouco número de pacientes, e um tanto útil para a maior parte dos pacientes. Em aproximadamente 65% dos pacientes,[21] a droga ajuda a estabilizar a doença.[22]
O programa de dosagem típica injeta pelo menos 3 milhões de unidades de Interferon-alfa três vezes por semana, embora o protocolo original comece com diárias injeções por seis meses.
Alguns pacientes toleram IFN-alpha muito bem pelas primeiras semanas, enquanto outros apresentam febre persistente. Pode ser que 40% dos pacientes desenvolvam depressão. É possível que, pela manutenção de um nível estável de hormônio no corpo, estas injeções diárias possam causar pouco efeito colateral em alguns pacientes. Os efeitos colaterais podem ser reduzidos bebendo-se pelo menos dois litros de água por dia, evitando-se cafeína e álcool.
Uma diminuição nas contagens de células sanguíneas é normalmente vista entre 1 e 2 meses de tratamento. A maior parte dos pacientes pioram sua contagem de células em poucas semanas após o início do tratamento, embora alguns pacientes comecem a melhorar este quadro dentre 2 semanas.[23]
Demora aproximadamente 6 meses para descobrir se a terapia foi útil. O critério de avaliação para o sucesso do tratamento inclui:
- normalização do nível de hemoglobina (maior 12.0 g/dL),
- uma normal ou pouco baixa contagem de plaquetas (acima de 100.000/μl) , e
- uma normal ou pouco baixa contagem absoluta de neutrófilo (maior que 1.500 /µL).[23]
Se bem tolerado, pacientes tomam o hormônio por 12 a 18 meses. Uma tentativa pode ser feita para parar o tratamento, mas a maioria dos pacientes descobre que eles precisam continuar a tomar a droga para o sucesso do tratamento. Estes pacientes continuam a tomar estas drogas indefinidamente, até a doença começar a ficar resistente a este hormônio, ou o corpo humano produz uma resposta imune que limita a habilidade funcional da droga. Poucos pacientes são capazes de atingir remissão continua depois de tomar a droga por 6 meses a 1 ano. Isto pode ser mais comum quando a terapia com o IFN-alpha é iniciada logo após outra terapia. Interferon-alpha é considerada a droga de escolha para mulheres grávidas com tricoleucemia ativa.
Interferon-alpha trabalha na resposta das células cabeludas a droga que tem induzida sua apoptose através do TNF-alpha.[24] IFN-alpha trabalha melhor nas células da tricoleucemia clássica que não aderem a vitronectina ou fibronectina, o que sugere que estes pacientes que tem uma menor fibrose em sua medula óssea podem responder melhor a terapia do Interferon-alfa.
Terapia experimental
[editar | editar código-fonte]Outros tratamentos
[editar | editar código-fonte]Referências
[editar | editar código-fonte]- ↑ «"Hairy" Cells in Blood in Lymphoreticular Neoplastic Disease and "Flagellated" Cells of Normal Lymph Nodes -- SCHREK and DONNELLY 27 (2): 199 -- Blood». Consultado em 10 de setembro de 2007
- ↑ a b «A variant form of hairy cell leukemia resistant to alpha-interferon: clinical and phenotypic characteristics of 17 patients -- Sainati et al. 76 (1): 157 -- Blood». Consultado em 10 de setembro de 2007
- ↑ Cawley JC, Burns GF, Hayhoe FG (1980). «A chronic lymphoproliferative disorder with distinctive features: a distinct variant of hairy-cell leukaemia». Leuk. Res. 4 (6): 547-59. PMID 7206776
- ↑ a b c d Matutes E, Wotherspoon A, Brito-Babapulle V, Catovsky D (2001). «The natural history and clinico-pathological features of the variant form of hairy cell leukemia». Leukemia. 15 (1): 184-6. PMID 11243388
- ↑ Ya-In C, Brandwein J, Pantalony D, Chang H (2005). «Hairy cell leukemia variant with features of intrasinusoidal bone marrow involvement». Arch. Pathol. Lab. Med. 129 (3): 395-8. PMID 15737038
- ↑ «The bone marrow fibrosis of hairy-cell leukemia is caused by the synthesis and assembly of a fibronectin matrix by the hairy cells -- Burthem and Cawley 83 (2): 497 -- Blood». Consultado em 10 de setembro de 2007
- ↑ «Phenotypic analysis of hairy cell leukemia: "variant" cases express the interleukin-2 receptor beta chain, but not the alpha chain (CD25) -- de Totero et al. 82 (2): 528 -- Blood». Consultado em 10 de setembro de 2007
- ↑ Matutes E, Wotherspoon A, Catovsky D (2003). «The variant form of hairy-cell leukaemia». Best Pract Res Clin Haematol. 16 (1): 41-56. PMID 12670464
- ↑ Vallianatou K, Brito-Babapulle V, Matutes E, Atkinson S, Catovsky D (1999). «p53 gene deletion and trisomy 12 in hairy cell leukemia and its variant». Leuk. Res. 23 (11): 1041-5. PMID 10576509
- ↑ «Hairy Cell Leukemia Treatment - National Cancer Institute». Consultado em 7 de setembro de 2007. Arquivado do original em 14 de maio de 2008
- ↑ Zuzel M, Cawley JC, Paton RC, Burns GF, McNicol GP (1979). «Platelet function in hairy-cell leukaemia». J. Clin. Pathol. 32 (8): 814-21. PMID 512041
- ↑ «wiley.com». Consultado em 7 de setembro de 2007[ligação inativa]
- ↑ «Mechanisms behind hypocholesterolaemia in hairy cell leukaemia -- Juliusson et al. 311 (6996): 27 -- BMJ». Consultado em 7 de setembro de 2007
- ↑ Clavel J, Mandereau L, Cordier S; et al. (1995). «Hairy cell leukaemia, occupation, and smoking». Br. J. Haematol. 91 (1): 154-61. PMID 7577624
- ↑ «Clinical Flow Cytometry Case #54». Consultado em 7 de setembro de 2007. Arquivado do original em 9 de outubro de 2007
- ↑ «Cladribine in a weekly versus daily schedule for untreated active hairy cell leukemia: final report from the Polish Adult Leukemia Group (PALG) of a prospective, randomized, multicenter trial -- Robak et al. 109 (9): 3672 -- Blood». Consultado em 10 de setembro de 2007
- ↑ Else M, Ruchlemer R, Osuji N; et al. (2005). «Long remissions in hairy cell leukemia with purine analogs: a report of 219 patients with a median follow-up of 12.5 years». Cancer. 104 (11): 2442-8. PMID 16245328. doi:10.1002/cncr.21447
- ↑ «Rituximab in relapsed or refractory hairy cell leukemia -- Thomas et al. 102 (12): 3906 -- Blood». Consultado em 10 de setembro de 2007
- ↑ «Phase 2 study of rituximab in the treatment of cladribine-failed patients with hairy cell leukemia -- Nieva et al. 102 (3): 810 -- Blood». Consultado em 10 de setembro de 2007
- ↑ «Successful treatment of hairy cell leukemia variant with rituximab - Leukemia and Lymphoma». Consultado em 10 de setembro de 2007
- ↑ «eMedicine - Hairy Cell Leukemia : Article by Emmanuel C Besa, MD». Consultado em 10 de setembro de 2007
- ↑ «NEJM -- Alpha interferon for induction of remission in hairy-cell leukemia». Consultado em 10 de setembro de 2007
- ↑ a b Ratain MJ, Golomb HM, Vardiman JW, Vokes EE, Jacobs RH, Daly K (1985). «Treatment of hairy cell leukemia with recombinant alpha 2 interferon». Blood. 65 (3): 644-8. PMID 3971043
- ↑ Baker PK, Pettitt AR, Slupsky JR; et al. (2002). «Response of hairy cells to IFN-alpha involves induction of apoptosis through autocrine TNF-alpha and protection by adhesion». Blood. 100 (2): 647-53. PMID 12091360