Ácido benzoico: diferenças entre revisões
| Linha 163: | Linha 163: | ||
==== Do bromobenzeno ==== |
==== Do bromobenzeno ==== |
||
[[Bromobenzeno]] |
[[Bromobenzeno]] p474MJJGGGGDDFDDDDSSode ser convertgido a ácido benzóico por "carbonação" do intermediário [[brometo de fenilmagnésio]]:<ref>{{cite book | title = Introduction to Organic Laboratory Techniques: A Small Scale Approach | author = Donald L. Pavia | year = 2004 | publisher = Thomson Brooks/Cole | isbn = 0534408338 | pages = 312–314}}</ref> |
||
:<big>C<sub>6</sub>H<sub>5</sub>MgBr + CO<sub>2</sub> → C<sub>6</sub>H<sub>5</sub>CO<sub>2</sub>MgBr</big> |
:<big>C<sub>6</sub>H<sub>5</sub>MgBr + CO<sub>2</sub> → C<sub>6</sub>H<sub>5</sub>CO<sub>2</sub>MgBr</big> |
||
:<big>C<sub>6</sub>H<sub>5</sub>CO<sub>2</sub>MgBr + HCl → C<sub>6</sub>H<sub>5</ |
:<big>C<sub>6</sub>H<sub>5</sub>CO<sub>2</sub>MgBr + HCl → C<sub>6</sub>H<sub>5</sJEFERSON FERREIRA DE SA TELES DE DEUS |
||
ub>CO<sub>2</sub>H + MgBrCl</big> |
|||
== Ocorrência == |
== Ocorrência == |
||
Revisão das 19h43min de 21 de maio de 2014
| Ácido benzoico Alerta sobre risco à saúde | |
|---|---|

| |

| |
| Nome IUPAC | Benzoic acid, benzene carboxylic acid |
| Outros nomes | Carboxibenzeno, E210, ácido dracílico |
| Identificadores | |
| Número CAS | |
| PubChem | |
| KEGG | |
| MeSH | |
| ChEBI | |
| Número RTECS | DG0875000 |
| SMILES |
|
| InChI | 1/C7H6O2/c8-7(9)6-4-2-1-3-5-6/
h1-5H,(H,8,9)/f/h8H |
| Referência Beilstein | 636131 |
| Referência Gmelin | 2946 |
| 3DMet | |
| Propriedades | |
| Fórmula molecular | C6H5COOH |
| Massa molar | 122.12 g/mol |
| Aparência | Cor Cristalina |
| Densidade | 1,27 g·cm-3 [1] |
| Ponto de fusão |
122,1 °C [1] |
| Ponto de ebulição |
250 °C [1] |
| Solubilidade em água | Solúvel (água quente) 3.4 g/l (25 °C) |
| Solubilidade em metanol, éter dietílico | Solúvel |
| Acidez (pKa) | 4.21 |
| Estrutura | |
| Estrutura cristalina | Monoclínico |
| Forma molecular | planar |
| Momento dipolar | 1.72 D em Dioxano |
| Farmacologia | |
| Riscos associados | |
| MSDS | ScienceLab.com |
| Principais riscos associados |
Irritante |
| NFPA 704 | |
| Frases R | R22, R36 |
| Frases S | S24 |
| Ponto de fulgor | 121 °C (394 K) |
| LD50 | 1700 mg·kg-1 (Ratos, via oral) [2] |
| Compostos relacionados | |
| Outros aniões/ânions | Benzamida, Cloreto de benzoíla, Benzoato de metila, Benzoato de benzila |
| Ácidos carboxílicos relacionados | Ácido fenilacético, Ácido hipúrico (N-benzoil-glicina), Ácido salicílico (2-hidroxi-benzoico), Niacina (um N substitui um CH do anel aromático) Ácido toluico (3 isômeros, ácido metilbenzoico) |
| Compostos relacionados | Benzeno, Benzaldeído, Álcool benzílico |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
O ácido benzóico, C6H5C(O)OH, é um composto aromático classificado como ácido carboxílico (ou especificamente, ácido monocarboxílico). Este ácido fraco e seus sais são usados como conservante de alimentos e ocorre naturalmente em certas plantas.
Seu anel aromático é similar ao do benzeno e é o mais simples ácido carboxílico aromático. Apresenta-se como um sólido cristalino incolor.
O ácido benzóico é um importante precursor para a síntese de muitas outras substâncias orgânicas. Entre os derivados do ácido benzóico se encontram o ácido salicílico e o ácido 2-acetilsalicílico (ou o-acetilsalicílico), também conhecido como aspirina.
- Fórmula molecular: C7H6O2 ou C6H5C(O)OH
- Massa molecular: 122 u
Nomenclatura
- Oficial: Ácido benzeno monocarboxílico
- Usual: Ácido benzóico
História
O ácido benzoico foi descoberto no século XVI. Como foi obtido pela primeira vez da essência do benjoeiro foi denominado ácido benzóico. A destilação seca de goma de benjoim primeiramente foi descrita por Nostradamus (1556), e posteriormente por Aleixo Pedemontanus (1560) e Blaise de Vigenère (1596).[3]
Justus von Liebig e Friedrich Wöhler determinaram a composição do ácido benzóico em 1832.[4] Eles também investigaram como o ácido hipúrico está relacionada com o ácido benzóico.
Em 1875, Salkowski descobriu capacidade antifúngicas do ácido benzóico, que foi usado por um longo tempo na preservação por conteúdo de benzoato de amora-branca-silvestre.[5]
Produção
Preparações industriais
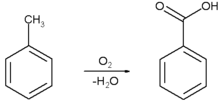
Ácido benzóico é produzido comercialmente por oxidação parcial do tolueno com oxigênio. O processo é catalisado por naftalenatos de cobalto ou manganês. O processo usa matérias primas baratas, resultando em alto rendimento, e é considerado ambientalmente adequado ("verde").
A capacidade de produção dos lang=br é estimada em 126 mil toneladas por ano, muito do que é consumido internamente ou na preparação de outros produtos químicos industriais.
Também é produzido a partir do benzeno, reagindo com o cloreto de metanoíla, tendo como catalisadores o cloreto de alumínio ou o cloreto de cobre (I), primeiramente produzindo aldeído benzóico (benzaldeído):
Depois, procedendo-se a oxidação do aldeído benzóico e chegando-se ao ácido benzóico:
Síntese laboratorial
O ácido benzóico é barato e facilmente disponível, de modo que a síntese em laboratório de ácido benzóico é praticada principalmente por seu valor pedagógico. É uma preparação comum de graduação em química.
Para todas as sínteses, ácido benzóico pode ser purificado por recristalização da água devido à sua alta solubilidade em água quente e baixa solubilidade em água fria. O não uso de solventes orgânicos para a recristalização torna esta experiência particularmente segura. Outros solventes de recristalização possíveis incluem ácido acético (anidro ou em solução aquosa), benzeno, éter de petróleo, e mistura de etanol e água.[6]
Por hidrólise
Como qualquer outra nitrila ou amida, benzonitrila e benzamida podem ser hidrolisadas a ácido benzóico ou a sua base conjugada em condições ácidas ou básicas.
A partir do benzaldeído
A disproporcionação induzida por base do benzaldeído, a reação de Cannizzaro, resulta em iguais quantidades de benzoato e álcool benzílico; o segundo pode ser removido por destilação.
Do bromobenzeno
Bromobenzeno p474MJJGGGGDDFDDDDSSode ser convertgido a ácido benzóico por "carbonação" do intermediário brometo de fenilmagnésio:[7]
- C6H5MgBr + CO2 → C6H5CO2MgBr
- C6H5CO2MgBr + HCl → C6H5</sJEFERSON FERREIRA DE SA TELES DE DEUS
ub>CO2H + MgBrCl
Ocorrência
- Na natureza é encontrado em bálsamos e resinas vegetais, como a de benjoeiro, na goma de benjoim, no bálsamo de tolu e no bálsamo do Peru.[8]
- Na urina do boi e do cavalo na forma combinada.
Aplicações e usos
- Como germicida na preservação de alimentos, na síntese de corantes, como adjuvante farmacológico: ainti-fúngico, segundo a 3ºedição da farmacopéia.
Derivados
- Benzoato de sódio: usado como antipirético
- Benzoato de metila: usado na indústria de perfumes
Questões relacionadas à saúde
Em contato com vitamina C (alimentos, frutas etc) resulta na quebra do ácido benzóico em benzeno em pequenas proporções. Sendo assim, bebidas que contém vitamina C e utiliza ácido benzóico como conservante em sua composição, podem conter também benzeno como resultado dessa reação.
Referências
- ↑ a b c Registo de Benzoesäure na Base de Dados de Substâncias GESTIS do IFA, accessado em 22 de Agosto de 2007
- ↑ (en) « Ácido benzoico » em ChemIDplus
- ↑ Neumüller O-A (1988). Römpps Chemie-Lexikon 6 ed. Stuttgart: Frankh'sche Verlagshandlung. ISBN 3-440-04516-1. OCLC 50969944
- ↑ Liebig J, Wöhler F (1832). «Untersuchungen über das Radikal der Benzoesäure». Annalen der Chemie. 3: 249–282. doi:10.1002/jlac.18320030302
- ↑ Salkowski E (1875). Berl Klin Wochenschr. 12: 297–298
- ↑ D. D. Perrin; W. L. F. Armarego (1988). Purification of Laboratory Chemicals 3rd ed. [S.l.]: Pergamon Press. 94 páginas. ISBN 0-08-034715-0
- ↑ Donald L. Pavia (2004). Introduction to Organic Laboratory Techniques: A Small Scale Approach. [S.l.]: Thomson Brooks/Cole. pp. 312–314. ISBN 0534408338
- ↑ SAFFIOTI, WALDEMAR; Fundamentos de Química; Companhia Editora Nacional; São Paulo, Brasil; 1968.