Molibdopterina
| Molibdopterina Alerta sobre risco à saúde | |
|---|---|

| |
| Identificadores | |
| Número CAS | |
| PubChem | |
| MeSH | |
| Propriedades | |
| Fórmula molecular | C10H10N5O6PS2 + grupos R |
| Massa molar | 394,33 g/mol (R=H) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
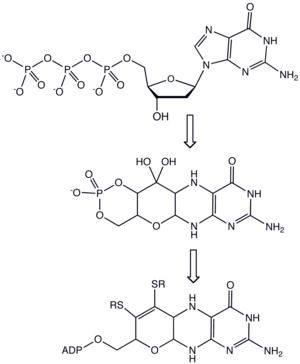
As molibdopterinas, após reação com molibdénio ou tungsténio na forma de molibdato ou tungstato, são uma classe de cofatores encontrados na maioria das enzimas de molibdénio (Mo) e em todas as enzimas de tungsténio (W). Termos sinónimos de molibdopterina são MPT e piranopterina-ditiolato.
A nomenclatura desta biomolécula pode ser confusa: a molibdopterina per se não contém molibdénio, sendo, isso sim, o nome do ligando que se ligará eventualmente ao metal ativo. Após a complexação da molibdopterina com o molibdato, o ligando completo é usualmente chamado cofator de molibdénio.
A molibdopterina consiste de uma piranopterina, um composto heterocíclico complexo que apresenta um pirano ligado a uma anel de pterina. Adicionalmente, o anel de pirano tem dois tiolatos, os quais servem como ligandos em molibdo- e tungstoenzimas. Em alguns casos, o grupo alquil-fosfato é substituído por um nucleótido de alquil-difosfato. Entre as enzimas que contêm o cofator de molibdopterina contam-se xantina oxidase, DMSO redutase, sulfito redutase e a nitrato redutase.
As únicas enzimas que contêm molibdénio e que não têm molibdopterinas são as nitrogenases (enzimas que fixam o azoto=). Estas contêm um centro de ferro-enxofre de um tipo muito diferente, que geralmente também contém molibdénio. Contudo, se o molibdénio estiver presente, encontra-se diretamente ligado a outros átomos metálicos.[1]
Biossíntese[editar | editar código-fonte]
A biossíntese da molibdopterina começa com trifosfato de guanosina. Duas reações enzimáticas convertem este trifosfato no fosfato cíclico da piranopterina. Uma destas enzimas utiliza SAMs radicais, frequentemente associados a reações formadoras de ligações C-X. Esta piranopterina intermédia é então convertida em molibdopterina por meio da ação de mais três enzimas. Nesta conversão, é formado o eneditiolato, embora os substituintes do enxofre sejam ainda desconhecidos. O enxofre é extraído do perssulfureto de cisteinilo de uma forma que faz lembrar a biossíntese das proteínas ferro-enxofre. O monofosfato é adenilado (ligado a ADP) num passo que ativa o cofator para a ligação a Mo ou W. Estes metais são importados na forma dos seus oxianiões, molibdato e tungstato. Finalmente, Mo ou W é inserido para produzir o cofator de molibdopterina. Em algumas enzimas, com a xantina oxidase, o metal está ligado a uma molibdopterina, enquanto noutras enzimas, como a DMSO redutase, o metal esta ligado a dois cofatores de molibdopterina.[2]
Os modelos para os locais ativos de enzimas que contêm molibdopterina baseiam-se numa classe de ligandos conhecidos como ditiolenos.[3]
Versão contendo selénio, e capacidade de ligação ao tungsténio ativo[editar | editar código-fonte]
Não se concluiu até ao momento que o tungsténio seja necessário ou usado nos eucariontes, mas é um nutriente essencial para algumas bactéricas. Por exemplo, enzimas chamadas oxirredutases usam o tungsténio de modo semelhante ao molibdénio, utilizando-o num complexo tungsténio-pterina com molibdopterina. Então, a molibdopterina pode complexar tanto com o molibdénio como com o tungsténio usados pela bactéria. As enzimas que usam o tungsténio tipicamente reduzem ácidos carboxílicos livres a aldeídos.[4] A primeira enzima que requer tungsténio a ser descoberta requer também selénio, e neste caso o par tungsténio-selénio poderá funcionar de modo análogo ao par molibdénio-enxofre de algumas enzimas que requerem cofator de molibdénio.[5] Sabe-se que uma das enzimas da família das oxirredutases que por vezes utiliza o tungsténio (a H formato desidrogenase bacteriana) utiliza uma versão selénio-molibdénio da molibdopterina.[6] Embora tenha sido descoberta em bactérias uma xantina desidrogenase portadora de tungsténio que contém tungsteno-molibdopterina e também selénio não ligado a proteínas, não foi ainda descrito de modo definitivo um complexo de molibdopterina de selénio-tungsténio.[7]
Enzimas que utilizam a molibdopterina[editar | editar código-fonte]
Enzimas que usam a molibdopterina como cofator ou grupo prostético:[1] Cofator de: xantina oxidase, DMSO redutase, sulfito oxidase, nitrato redutase, etilbenzeno desidrogenase, gliceraldeído-3-fosfato ferredoxina oxirredutase, arsenato redutase.
Grupo prostético de: formato desidrogenase, purina hidroxilase, tiossulfato redutase.
Referências
- ↑ a b Structure, synthesis, empirical formula for the di-sulfhydryl. Accessed Nov. 16, 2009.
- ↑ Schwarz, G. and Mendel, R. R. (2006). «Molybdenum cofactor biosynthesis and molybdenum enzymes». Annu. Rev. Plant Biol. 57: 623–647. PMID 16669776. doi:10.1146/annurev.arplant.57.032905.105437
- ↑ Kisker, C.; Schindelin, H.; Baas, D.; Rétey, J.; Meckenstock, R.U.; Kroneck, P.M.H. (1999). «A structural comparison of molybdenum cofactor-containing enzymes». FEMS Microbiol. Rev. 22 (5): 503–521. PMID 9990727. doi:10.1111/j.1574-6976.1998.tb00384.x PubMed
- ↑ Lassner, Erik (1999). Tungsten: Properties, Chemistry, Technology of the Element, Alloys and Chemical Compounds. [S.l.]: Springer. pp. 409–411. ISBN 0306450534
- ↑ Stiefel, E. I. (1998). «Transition metal sulfur chemistry and its relevance to molybdenum and tungsten enzymes» (PDF). Pure & Appl. Chem. 70 (4): 889–896. doi:10.1351/pac199870040889
- ↑ Khangulov SV, Gladyshev VN, Dismukes GC, Stadtman TC (março de 1998). «Selenium-Containing Formate Dehydrogenase H from Escherichia coli: A Molybdopterin Enzyme That Catalyzes Formate Oxidation without Oxygen Transfer». Biochemistry. 37 (10): 3518–28. PMID 9521673. doi:10.1021/bi972177k
- ↑ Schräder T, Rienhöfer A, Andreesen JR (1999). «Selenium-containing xanthine dehydrogenase from Eubacterium barkeri». Eur. J. Biochem. 264 (3): 862–71. PMID 10491134
- Este artigo foi inicialmente traduzido, total ou parcialmente, do artigo da Wikipédia em inglês cujo título é «Molybdopterine», especificamente desta versão.
