Estereoquímica: diferenças entre revisões
| Linha 401: | Linha 401: | ||
== Conformações em sistemas cíclicos == |
== Conformações em sistemas cíclicos == |
||
===Análise conformacional de sistemas cíclicos=== |
|||
Os sistemas cíclicos são compostos que contêm átomos de carbono ligados em forma de anel (aliciclo) e podem ter um heteroátomo na sua estrutura (heterociclo). Devido à natureza da sua estrutura, estes compostos têm propriedades diferentes dos seus análogos de cadeia aberta; os ciclos têm rotação limitada e uma distorção de comprimentos de ligação e ângulos de ligação que gera uma instabilidade no anel, conhecida como tensão de anel. |
|||
A tensão do anel está composta de pelo menos quatro tipos: tensão angular ou tensão de Baeyer, tensão de alongamento, tensão conformacional ou tensão de Pitzer ea tensão estérica ou tensão de Dunitz-Schomaker<ref>{{cite book|last1=Geerlings,|first1=Prof|title=Structure, bonding and reactivity of heterocyclic compounds|date=2014|publisher=Springer|location=[S.l.]|isbn=978-3-642-45148-5}}</ref>. |
|||
====Tensão angular (Tensão de Baeyer ou Tensão clássica)==== |
|||
Em 1874 Le Bel e Van't Hoff propuseram a geometria tetraédrica do carbono sp<sup>3</sup> com ângulos de 109,2<sup>o</sup>. Baeyer propôs uma teoria para a tensão do anel, em que o desvio dos ângulos internos em relação aos ângulos de um tetraedro, gera uma tensão interna no anel e seu desvio depende do tamanho do anel; assim a tensão angular decresce na serie ciclopronano-ciclobutano e dopis aumenta proporcionalmente ao número de membros no composto cíclico<ref name="juaristi">{{cite book|last1=Juaristi|first1=E.|last2=Stefani|first2=H.|title=Introdução à Estereoquímica e á análise conformacional|date=2012}}</ref> (Figura b). No entanto, a teoria da tensão de Baeyer não é consistente com os resultados experimentais, porque baseia-se na suposição incorreta que todos os anéis são planares. A teoria de Baeyer só é aplicável a pequenos anéis, mas não, a anéis de mais de seis membros devido a que têm uma conformação não planar <ref name="Gupta">{{cite book|last1=Gupta|first1=R. R.|last2=Kumar|first2=M.|last3=Gupta|first3=V.|title=Heterocyclic Chemistry: Volumen I|date=1998}}</ref>. |
|||
[[File:Estrutura do carbono de hibridação sp3.png|frame|center|Estrutura do carbono de hibridação sp<sup>3</sup>]] |
|||
[[File:Ângulos internos de para alguns sistemas ciclicos.png|frame|center|Ângulos internos de alguns sistemas cíclicos]] |
|||
O desvio ou distorção do ângulo de ligação (d) pode ser calculado a partir de: |
|||
<math>d = 1/2(129,28 - \alpha)</math> |
|||
Onde α é o ângulo interno no cicloalcano. O fator ½ indica que a tensão e distribuída em duas ligações<ref>{{cite book|last1=Sangal|title=krishna’s Advanced Organic Chemistry|date=2010}}</ref>. |
|||
A tensão angular (energia necessária para a distorção do ângulo de ligação do seu valor normal, E(Ѳ)) é proporcional ao quadrado do desvio do ângulo de ligação(d) , e é representado como<ref name="Gupta"></ref>: |
|||
<math>E(\theta) = (K_{\theta}/2)d^{2}</math> |
|||
Onde K<sub>Ѳ</sub> é a constante de força de flexão. |
|||
====Tensão de alongamento==== |
|||
A tensão de alongamento (em inglês stretching strain) inclui como o seu nome indica o alongamento e a compressão de ligações simples de carbono-carbono. Um alongamento ou encurtamento estruturalmente induzido de uma ligação em relação ao comprimento dessa ligação deve-se a sua geometria de menor energia. Por exemplo, o comprimento de ligação para o carbono de alcanos é 1.54Å. A ligação C1-C4 na Figura c tem um comprimento de 1,75 Å, devido à geometria da molécula<ref>{{cite book|last1=Orchinet|first1=M.|title=The vocabulary and concepts of organic chemistry|date=2005|publisher=Wiley-Interscience|location=Hoboken, NJ|isbn=0-471-68028-1|edition=2. ed.}}</ref>. |
|||
[[File:Triciclo(2.1.1.01,4)hexano.png|frame|center|Triciclo[2.1.1.0<sup>1,4</sup>]hexano]] |
|||
A tensão de alongamento (Er) é proporcional ao quadrado da distorção6. |
|||
<math>E(r) = 0,5k_{r}(r-r_{o})</math> |
|||
Onde k<sub>r</sub> é a constante de força de alongamento , r o comprimento da ligação e r<sub>o</sub> comprimento de ligação normal. |
|||
====Tensão torsional ou tensão de Pitzer==== |
|||
O desvio forçado da conformação mais favorável causa relativa instabilidade à molécula e é conhecida como tensão torsional. A barreira energética de rotação numa molécula é uma medida da tensão de torção para uma molécula e muda com a mudança no ângulo diedro<ref name="juaristi"></ref>. |
|||
A tensão de torção (Eφ) é expressa como: |
|||
<math> E\phi = 5,87 (1-\cos(3\omega))</math> |
|||
Onde ω é o desvio de ângulo diedro da conformação mais favorável. |
|||
A tensão de Pitzer envolve as interações 1,4- e é determinada pelo ângulo diedro. É considerada uma força de repulsão, e é maior na conformação eclipsada em que as ligações são mais próximas entre si, enquanto é menor na conformação escalonada (mais favorável) em que ligações tendem a permanecer o mais longe possível. |
|||
[[File:Tensão de Pitzer para o cliclopropano.png|frame|center|Tensão de Pitzer para o cliclopropano]] |
|||
====Tensão estérica (tensão de Dunitz-Schomaker)==== |
|||
A tensão estérica ocorre em átomos não ligados entre eles mesmos (Figura d), que pode ser atraente ou repulsiva. A interação atraente resulta de uma polarização recíproca dos elétrons dos átomos. Tais forças atrativas são chamadas forças de dispersão ou forças de London e são relativamente fracas. As Forças de London variam inversamente com a sexta potência da distância internuclear e torna-se insignificante à medida que aumenta a separação internuclear. Quando as distâncias são menores do que o raio de Van der Waals, as forças de repulsão elétron-elétron são dominantes6. |
|||
[[File:Tensão estérica da conformação de barco do ciclo-hexano..png|frame|center|Tensão estérica da conformação de barco do ciclo-hexano.]] |
|||
====Aspectos conformacionais dos anéis de seis membros==== |
|||
Os anéis de seis membros são largamente encontrados na natureza, e a sua conformação é fácil para estudar em relação aos anéis menores ou maiores6. Os hidratos de carbono, esteroides, produtos vegetais, pesticidas, e muitos outros compostos importantes contem anéis de seis membros, cujas conformações e estereoquímica são criticamente importantes para a sua reatividade. A abundância de anéis de ciclo-hexano na natureza é provavelmente devido à sua estabilidade e a seletividade oferecida pelas suas conformações<ref>{{cite book|last1=Wade|first1=L.G.|title=Organic chemistry|date=2010|publisher=Pearson Prentice Hall|location=Upper Saddle River, NJ|isbn=978-0-321-59231-6|edition=7th ed.}}</ref>. |
|||
=====Ciclo-hexano===== |
|||
Como vimos antes, Baeyer considera o ciclo-hexano como uma molécula planar, mas um anel planar de seis membros tem ângulos de ligação de 120<sup>o</sup> e assim, o composto tem átomos de carbono com hibridação sp<sup>3</sup>, teria tensão angular apreciável. Além disso, todos os grupos CH<sub>2</sub> adjacentes eclipsariam o que gera uma tensão conformacional. Para evitar estas interações desfavoráveis, a estrutura adota conformações não-planares9<ref>{{cite book|last1=North|first1=M.|title=Principles and applications of stereochemistry|date=1998|publisher=Thornes|location=Cheltenham|isbn=0-7487-3994-7}}</ref>. Sache, 100 anos mais tarde, reconheceu que pode haver uma conformação de “cadeira”, “barco” ou “barco torcido”8 |
|||
[[File:Figura f.jpg|thumb|center|Conformações do ciclohexano livres de tensão angular|400x400px]] |
|||
Estas três conformações estão libres de tensão angular, já que conservam ângulos de ligação de aproximadamente 109o; sendo a conformação cadeira a de mais baixa energia. Por tanto, pode-se esperar que o ciclo-hexano e a maioria de seus derivados existam na forma de cadeira<ref name="juaristi"></ref>. Sashi também reconheceu que o ciclo-hexano pode inverter a conformação cadeira. Neste processo os átomos em posição axial passam a posição equatorial e vice-versa8. |
|||
[[File:Figura g.jpg|thumb|center|Figura g. Interconversão do ciclohexano.|400x400px]] |
|||
Como mostrado na figura, a inversão da conformação cadeira, não é um processo de um só passo<ref>{{cite journal|last1=Anderson|first1=J.|title=Interconversion of Six-membered Rings|journal=Top. Curr. Chem|date=1974|volume=45|page=139}}</ref>. O primeiro passo produz um intermediário que depois numa etapa de igual energia produz a cadeira invertida. A energia de ativação para o processo de interconversão de cadeira - barco é 10,7-11,5 kcal/mol, o equivalente a 100.000 inversões por segundo à temperatura ambiente<ref name="juaristi"></ref>. Vários estudos estabelecem que a conformação de barco torcido é 1-1,5 kcal/mol mais estável do que o barco. Em 1975, Squillacote, Chapman e Anet conseguiram capturar a conformação de barco torcido por uma técnica de isolamento em que fez-se um resfriamento rápido até -253<sup>o</sup>C de uma mistura de vapor de ciclo-hexano e argônio previamente aquecido a cerca de 800<sup>o</sup>C8. |
|||
[[File:Figura H.jpg|thumb|center|Perfil de energia para o processo de interconversão do ciclohexano.|500x500px]] |
|||
=====Ciclo-hexanos monossubstituídos===== |
|||
Substituição de um anel ciclo-hexano não afeta significativamente a taxa de inversão conformacional, mas o faz mudar a distribuição de equilíbrio entre formas alternativas de cadeira. A maior estabilidade da conformação equatorial é explicada geralmente em termos estéricos. Nesta conformação, a distância entre o substituinte e os hidrogênios sin-diaxiais é menor que entre os hidrogênios 1,2-diequatoriais<ref name="juaristi"></ref><sup>,</sup><ref>{{cite journal|last1=Sutton|first1=L.|title=Tables of Interatomics Distance|journal=The Chemical Society|date=1965}}</ref>. Para metilciclohexano, ΔG para o equilíbrio é -1,8 kcal/mol, o que corresponde a uma composição com 95% do metil na posição equatorial6. |
|||
Na tabela, são mostrados os valores de ΔGo, para o processo de inversão da conformação cadeira. Por exemplo, pra o grupo t-butilo axial, o valor de ΔGo é -4,9 kcal/mol mostrando a grande preferência do substituinte pela posição equatorial. Nesta molécula, uma metila fica dentro do anel, sofrendo uma forte repulsão estérica. |
|||
{| class="wikitable" |
|||
|- |
|||
! Substituinte !! -ΔG<sup>o</sup> (kcal/mol) !! Substituinte !! -ΔG<sup>o</sup> (kcal/mol) !! |
|||
|- |
|||
| F || 0,25 || SH || 1,0 |
|||
|- |
|||
| Cl || 0,4 || CH<sub>3 || 1,74 |
|||
|- |
|||
| Br || 0,5 || CH<sub>2</sub>CH<sub>3</sub> || 1,8 |
|||
|- |
|||
| I || 0,4 || ''i''-Pr || 2,1 |
|||
|- |
|||
| OH || 0,7 || ''t''-bu || 4,9 |
|||
|- |
|||
| OCH<sub>3</sub> || 0,8 || C<sub>6</sub>H<sub>5</sub> || 2,9 |
|||
|- |
|||
| OCH<sub>2</sub>CH<sub>3</sub> || 0,9 || CN || 0,2 |
|||
|- |
|||
|} |
|||
=====Ciclo-hexanos dissubstituídos===== |
|||
Os ciclo-hexanos dissubstituídos 1,2-, 1,3-, 1,4- podem existir como isômeros cis e trans. Quando os dois substituintes são idênticos, os isômeros cis-1,2 e cis-1,3 são formas meso, enquanto os isômeros trans correspondentes são quirais. Nas series dissubstituídas 1,4-, ambas as formas cis e trans são aquirais independentemente dos substituintes8. |
|||
Quando dois ou mais substituintes estão presentes num anel de ciclo-hexano, as interações entre os substituintes devem ser incluídas na análise. Os dimetilciclohexanos proporcionam uma análise conformacional de fácil interpretação e com boa concordância com os dados experimentais. |
|||
O diastereômero mais estável em cada caso é aquele em que ambas os grupos metílas são equatoriais. O ΔG é semelhante para cada um dos isómeros diequatorial (1,9 kcal/mol) e é muito perto do valor de ΔG conformacional do metilciclohexano (1,8 kcal/mol). Isto implica que não há interações importantes adicionais no dimetilciclohexano em comparação com o metilciclohexano. Isto é razoável, porque em cada caso, o grupo metil axial interage apenas com os hidrogênios 3,5-diaxal6. |
|||
[[File:Figura i.jpg|thumb|center|Ciclohexanos 1,2; 1,3 e 1,4-dissubstituídos.|300x300px]] |
|||
A presença de ligações duplas gera mudanças do nas propriedades dos ciclos. Quando centros sp<sup>2</sup> são incorporados em anéis de seis membros a barreira de energia para a inversão no anel, é reduzida para 7,7 kcal / mol em ciclo-hexeno (considerando que para o ciclo-hexano é 10,3 kcal/mol) e 4,9 kcal/mol em ciclo-hexanona. A conformação de ciclo-hexeno é descrito como meia-cadeira. Parâmetros estruturais determinados por difração de elétrons e espectroscopia de microondas revelam que a ligação dupla pode ser acomodada no anel sem distorção grave. O comprimento da ligação C(1)-C(2) é a 1,335 Å, e o ângulo de ligação C(1)-C(2)-C(3) é de 123<sup>o</sup>. Os substituintes em C(3) e C(6) são denominados como pseudoaxial e pseudoequatorial8. |
|||
[[File:Conformação de meia-cadeira do ciclo-hexeno.jpg|frame|center|Conformação de meia-cadeira do ciclo-hexeno.]] |
|||
====Conformação e propriedades físicas do ciclo-hexano e seus derivados8==== |
|||
As propriedades de um composto que exibe isomerismo conformacional não podem ser definidas com base numa estrutura rígida. Em vez disso, são determinadas pela a natureza dos confórmeros contribuintes, suas populações relativas (que são determinadas pela sua entropia, entalpia e energia livre) e, finalmente, a sua estabilidade cinética. Informações sobre esses tópicos são determinados a partir de parâmetros termodinâmicos, momentos dipolares e propriedades chiropticas. |
|||
É importante notar que as propriedades tais como pontos de ebulição, índices de refracção e as densidades relativas de estereoisômeros podem ser previstas com base na regra conformacional, uma modificação da regra clássica de Von Auwers-Skita: "O isómero com o volume molar mais baixo tem o maior teor calórico". Como o menor volume molar implica uma maior densidade, índice de refração, e ponto de ebulição, outra forma de definir regra é dizer que o isômero do maior entalpia tem o maior o ponto de ebulição, índice de refração, densidade e também o calor de vaporização8. Propriedades físicas de dimetilciclohexanos são mostradas na tabela 2. |
|||
{| class="wikitable" |
|||
|- |
|||
! Isômero !! Ponto de ebulição (<sup>o</sup>C) !! índice de refração !! Densidade |
|||
|- |
|||
| ''Cis''-1,2 || 129,7 || 1,4336 || 0,7922 |
|||
|- |
|||
| ''Trans''-1,2 || 123,4 || 1,4247 || 0,7720 |
|||
|- |
|||
| ''Cis''-1,3 || 120,1 || 1,4206 || 0,7620 |
|||
|- |
|||
| ''Trans''-1,4 || 124,5 || 1,4284 || 0,7806 |
|||
|- |
|||
|} |
|||
A espectroscopia de infravermelho e ultravioleta são úteis para distinguir entre as formas axial e equatorial de α-halocetonas. Em IV o halogéneo equatorial gera um deslocamento do grupo carbonila para valores mais elevados na frequência de alongamento. No caso de UV o halogênio na posição axial, provoca um efeito batocrômico substancial. |
|||
{| class="wikitable" |
|||
|- |
|||
! !! UV (nm) !! UV (nm) !! IV(cm<sup>-1</sup>) !! IV(cm<sup>-1</sup>) |
|||
|- |
|||
| Halogénio || Axial || Equatorial || Axial || Equatorial |
|||
|- |
|||
| F || 18 || 27 || 10 || -1 |
|||
|- |
|||
| Cl || 2-9 || 18-25 || 14 || -6 |
|||
|- |
|||
|} |
|||
A Ressonância Magnética Nuclear (RMN) é a técnica mais poderosa para o analise conformacional. Ela pode ser usada à temperatura ambiente ou em baixas temperaturas, dependendo do sistema, o que permite o estudo de um grande número de equilíbrios conformacionais, que depende da taxa de interconversão e a escala de tempo de RMN. Moléculas com barreiras internas de 20-100 kcal/mol de interconversão são ideais para o uso de RMN. Existem três tipos de situações em relação à taxa de interconversão e a escala de tempo RMN12<ref>{{cite book|last1=Nasipuri|first1=D.|title=Stereochemistry of organic compounds : principles, and applications|date=1994|publisher=Wiley Eastern|location=New Delhi|isbn=81-224-0570-3|edition=2nd ed.}}</ref>: |
|||
1- A taxa de interconversão é lenta na escala de tempo de RMN e o espectro é a superposição dos espectros de prótons em posição axila e equatorial. |
|||
2- A taxa de interconversão é rápida na escala de tempo de RMN e os confórmeros são vistos como espécies não-discretas com estruturas intermediárias e os deslocamentos químicos e os valores das constantes de acoplamento são ponderadas para prótons axiais e equatoriais |
|||
3- A taxa de interconversão é compatível na escala de tempo de RMN e é obtido um espectro mal definido. A forma do espectro muda significativamente com a temperatura e os parâmetros cinéticos são obtidos por uma análise em função de temperatura. Nestes casos é comum realizar medições em baixas temperaturas. |
|||
=== Efeito Thorpe- Ingold === |
=== Efeito Thorpe- Ingold === |
||
Revisão das 01h48min de 6 de agosto de 2015
Esta página ou seção foi marcada para revisão devido a incoerências ou dados de confiabilidade duvidosa. |
A estereoquímica é uma área da química que estuda a influência do arranjo espacial dos átomos em uma molécula.
Introdução
A presença de um átomo ou grupo ligante volumoso em uma molécula pode dificultar o seu contato sob uma determinada orientação espacial com outra molécula, tornando inviável uma possível reação entre estas. Além disso, a proximidade desses mesmos átomos e grupos ligantes pode levar a regiões de repulsão ou atração intra e intermolecular dependendo do ambiente químico em questão. Nesse caso, o meio onde uma molécula se encontra pode levar a uma alteração da geometria da mesma visando estabelecer um sistema com a menor energia possível. Portanto, baseada em conceitos como impedimento estérico, forças de repulsão ou atração e etc, a estereoquímica pode ser utilizada como ferramenta para estimar a estabilidade em um ambiente químico e, conseqüentemente, reatividade de uma molécula frente outras.
Moléculas que possuam a mesma fórmula molecular, porém com seus átomos em distintos arranjos espaciais são chamadas isômeros. Pode-se falar em isomerismo constitucional (ou estrutural) e isomerismo espacial (que levará ao caso dos estereoisômeros).
Isomerismo constitucional se dá quando a conectividade entre os átomos é distinta e os isômeros já se diferenciam em uma projeção bidimensional. O isomerismo espacial, por sua vez, é dividido em conformacional e configuracional e os isômeros só se diferenciam na disposição relativa dos átomos e, portanto, diferenças só serão observadas no espaço tridimensional.
Estereoisômeros
Os estereoisômeros[1] não são isômeros constitucionais. Os estereoisômeros têm seus átomos ligados na mesma sequência, mas eles diferem no arranjo de seus átomos no espaço. Estereoisômeros (também chamados de isômeros configuracionais) são substâncias diferentes que não se convertem facilmente. Por esta razão, podem ser separados. Há dois tipos de estereoisômeros: enantiômeros e diasteroisômeros.

Diasteroisômeros
Os diasteroisômeros[1] são estereoisômeros cujas moléculas não são imagens especulares uma da outra.
Os isômeros de alqueno cis- e trans-1,2-dicloroeteno e os isômeros cis e trans dos cicloalcanos são exemplos de estereoisômeros que são diastereoisômeros.


Esses dois compostos abaixo são isômeros um do outro, porque são compostos diferentes que não se convertem um no outro e porque tem a mesma fórmula molecular. Eles não são isômeros constitucionais porque seus átomos estão ligados na mesma seqüência. Por tanto, são estereoisômeros. Eles diferem apenas no arranjo dos seus átomos no espaço. Como não guardam uma relação objeto imagem especular são diastereoisômeros.

Enantiômeros
Os enantiômeros[1] são estereoisômeros cujas moléculas são imagens especulares não sobreponíveis.
Todo estereoisômero do tipo enantiômero é um isômero ótico, no entanto, nem todo isômero ótico é um enantiômero. Pode ser oticamente ativo e representar um isômero do tipo diastereoisômero.
Enantiômeros ocorrem apenas com compostos cujas moléculas são quirais. Uma molécula quiral é definida com uma que não é idêntica a sua imagem no espelho. Uma molécula quiral e sua imagem especular são enantiômero.
A palavra quiral vem da palavra grega, cheir, que significa “mão”. Objetos quirais (incluindo moléculas) possuem um lado direito e um esquerdo. O termo quiral é usado é utilizado para descrever moléculas de enantiômeros porque estão relacionadas uma com a outra da mesma maneira que a mão direita está relacionada com a mão esquerda. Assim, significando moléculas assimétricas. Quando você olha sua mão esquerda no espelho a imagem que você vê no espelho é a da mão direita e vice-versa. Suas mãos esquerda e direita não são idênticas, e isso pode ser mostrado pela observação que elas não se superpõe. A imagem especular da mão esquerda é a mão direita. No entanto, a mão direita e a mão esquerda não são superponíveis. Veja figura abaixo:
Geometria dos orbitais hibridizados do átomo de carbono
O químico alemão Friedrich August Kekulé, 1858, foi quem descreveu as características mais importantes do átomo de carbono. Kekulé estabeleceu a tetravalência do elemento carbono, quatro elétrons na sua última camada. Sendo assim, a molécula de metano (CH4) passou a ser representada como:

Entretanto com o surgimento de novos fenômenos químicos, como por exemplo a isomeria óptica, houve a necessidade do aperfeiçoamento desse modelo de molécula plana apresentado, surgindo assim, a idéia do carbono tetraédrico, em arranjo espacial. Visto que, a estereoquímica é o ramo da química que tem relação com os aspectos tridimensionais da molécula, a seguir há a elucidação sobre o arranjo espacial do átomo de carbono.

Orbitais hibridizados do átomo de carbono
Existem três tipos de hibridizações para o átomo de carbono: sp, sp² e sp³. É um processo que consiste na fusão de orbitais atômicos incompletos, ou seja, apenas com a participação dos elétrons de valência. Os orbitais dos subníveis atômicos s e p se misturam, dando origem a novos orbitais denominados de orbitais híbridos. A partir da configuração eletrônica do estado fundamental do átomo de carbono, é possível verificar quatro elétrons de valência, dois no subnível 2s e dois no subnível 2p. Os elétrons no subnível 1s são considerados elétrons do núcleo e não estão disponíveis para a ligação. O número de elétrons desemparelhados indica a quantidade de ligações covalentes que podem ocorrer, sendo assim, o átomo de carbono no estado fundamental pode fazer somente duas ligações. [1]
Geometria tetraédrica

Ocorre liberação de energia quando há formação de ligação, assim, é mais benéfico para o carbono maximizar as duas ligações do estado fundamental. Por esta razão, o carbono vai promover um dos seus elétrons do subnível 2s para o seu orbital vazio 2p e assim formar os orbitais hibridizados. Logo, o carbono será capaz de formar quatro ligações. Esta hibridização é denominada de hibridização sp3 do átomo de carbono, na qual, como descrito acima, um elétron s é promovido para o orbital p vazio, originando o carbono no estado ativado. Em seguida, ocorre à fusão entre o orbital s e os três orbitais p, por este motivo hibridização sp3. [2]

Os quatro elétrons dos orbitais híbridos sp3 vão organizar-se no espaço tridimensional para ficar tão longe quanto possível com o intuito de minimizar a repulsão. A geometria que favorece este organização espacial é a geometria tetraédrica, onde qualquer ângulo de ligação será 109.5°. [2]

Geometria trigonal planar

Na hibridização sp2 um elétron s também é promovido para o orbital p vazio, originando o carbono no estado ativado. Entretanto, a fusão de orbitais ocorre entre o orbital s e dois p. Por isto, hibridização sp2. Os três orbitais híbridos sp2 vão organizar-se no espaço tridimensional para chegar tão longe quanto possível. A geometria que favorece isso é a geometria trigonal planar, onde o ângulo de ligação entre os orbitais híbridos é 120°. O orbital p puro, ou seja, aquele que não participa da hibridização será perpendicular a este plano. Observe que a sobreposição de frente de orbitais s, p ou hibridizados forma uma ligação sigma e a sobreposição de orbitais p puros forma uma ligação π entre os átomos de carbono. Isso explica a dupla ligação carbono-carbono. [1]
Geometria linear

De forma semelhante, na hibridização sp um elétron s também é promovido para o orbital p vazio,originando o carbono no estado ativado. Neste caso, a fusão de orbitais ocorre entre o orbital s e um p,permanecendo dois orbitais p puros. Por isso, hibridização sp. Os dois orbitais sp híbridos também se organizam no espaço tridimensional para chegar tão longe quanto possível. A geometria que atinge é a geometria linear com um ângulo de ligação de 180°. Os dois orbitais p puros que não foram misturadas são perpendiculares uns aos outros. [3]
Simetria e Estereoquímica
Há uma relação direta entre simetria, quiralidade e estereoquímica. Então, podemos dizer que moléculas que possuem determinados elementos de simetria não são quirais, porque o elemento de simetria assegura que as formas da imagem no espelho (imagem especular) sejam sobreponíveis. O modelo mais comum é um plano de simetria que divide uma molécula em duas metades posicionando de forma idêntica os substituintes em ambos os lados do plano, como veremos mais à frente. Um exemplo trivial pode ser encontrado em qualquer átomo tetraédrico com dois substituintes idênticos, como, por exemplo, em 2-propanol. O plano subdivide o 2-OH grupos 2-H e e os dois grupos metilo são idênticos.
Relações entre simetria e quiralidade
Uma das melhores formas de testar a quiralidade molecular é construir modelos estruturais da molécula e sua imagem especular e, em seguida, determinar se eles são sobreponíveis. Se os dois modelos são sobreponíveis, a molécula que eles representam é aquiral. Se os modelos não são sobreponíveis, então as moléculas que eles representam são quirais. Nós podemos aplicar este método a modelos reais, como acabamos de descrever, ou podemos aplicá-lo desenhando estruturas tridimensionais e tentando sobrepô-las em nossas mentes. Existem outras formas, no entanto, de nos ajudar a reconhecer a quiralidade de uma determinada molécula. Mencionamos uma já: a presença de um único centro de quiralidade. Outros baseiam-se na ausência de certos elementos de simetria da molécula, que veremos na próxima seção. Abaixo estão algumas informações úteis sobre quiralidade. [4],[1]
1. Uma molécula não será quiral, se ela possuir um plano de simetria.
2. Um plano de simetria (também chamado plano de espelho) é definido como um plano imaginário que bissecta uma molécula, ou seja divide a molécula em duas partes iguais, de tal maneira que as duas metades da molécula são imagens de espelho um do outro. [4],[1]
Um exemplo de uma molécula aquiral podemos citar o 2-cloropropano, que apresenta um plano de simetria, enquanto que 2-clorobutano é uma molécula quiral, não apresenta plano de simetria.[1]
Isso indica que todas as moléculas com um plano de simetria em sua conformação são aquirais.
Elementos e operações básicas de simetria
Uma operação que torna uma molécula indistinguível da original depois de aplicada é chamada de operação de simetria.
Podemos considerar quatro operações de simetria:
- A rotação em torno de um eixo de simetria (Cn)
- Reflexão (s)
- Inversão (i)
- Rotação – reflexão (Sn) : esse tipo de operação envolve duas manipulações, uma rotação de 360°/n sobre um eixo designado Sn, e uma reflexão por um plano perpendicular ao eixo Sn que atravessa a molécula (plano de simetria)
Para cada operação de simetria existe um elemento de simetria correspondente, que se delimita como um ponto, uma linha, (eixo) ou um plano, em referência a operação.
Os elementos de simetria são:
- Eixos de rotação (Cn)
- Operação Identidade (E)
- Eixos de simetria (σ)
- Centros de simetria ou centro de inversão (i)
- Eixo rotação – reflexão (Sn), também chamado eixo espelho, ou eixos impróprios
Rotação em torno de um eixo de simetria (Cn)
A existência de um eixo de rotação Cn (n eixos de rotação) em uma molécula implica que se esta gira com uma rotação de 360°/n ao redor deste eixo de modo que o arranjo dos átomos da molécula não será alterado, ou seja, o arranjo não será distinguido do original. Por exemplo, pode-se girar o cis-dicloroeteno a 180º por um eixo perpendicular ao plano da ligação dupla que passa através do ponto médio do mesmo e a molécula permanecerá inalterada.
Outros exemplos que podemos destacar para identificar o eixo de rotação: a molécula de água tem dois eixos de simetria (C2), e o clorofórmio tem um eixo C3. Benzeno tem um eixo C6 perpendicular ao plano da molécula e atravessando o centro geométrico, e seis eixos C2 adicionais que se cruzam no plano molecular.
Quando "n" é n = 360/180 = 2 dizemos que é um eixo de simetria de ordem 2, nesse caso C2. Quando uma molécula existir em mais de um eixo quer dizer que a ordem mais elevada (de maior "n") é a principal. No exemplo acima, para o benzeno o eixo de maior n é o C6, então prevalece como sendo seu eixo de simetria.[4],[1]
Identidade (E)
Identidade é a operação de rodar o objeto a 360°, de modo que este permaneça inalterado e corresponde a um eixo de rotação C1. Deste modo, todo e qualquer objeto tem esse elemento de simetria. Dizemos que as moléculas que apresentam apenas esse tipo de elemento de simetria são moléculas assimétricas. [4] [1]
Reflexão de um plano de simetria (σ)
A reflexão (operação de simetria) num plano de simetria σ (elemento de simetria correspondente), gera uma imagem geométrica da molécula no espelho, esta operação não se aplica a moléculas quirais.
Se consideramos o plano de simetria e o centro geométrico, podemos analisar relações entre os eixos de rotação e planos de simetria. Assim, dizemos que um plano de simetria é vertical ao eixo principal e o designamos de plano vertical (σv) quando estre contém o eixo principal de rotação. Se um plano é perpendicular ao eixo principal de rotação e atravessa a molécula no centro geométrico, dizemos que é um plano horizontal (σh). Se o plano é paralelo ao eixo principal e bissecta o ângulo formado por dois eixos de rotação C2 dizemos que é um plano diagonal (σd).[4] [1]
Centros de simetria ou centro de inversão (i)
Uma inversão envolve o movimento de cada átomo através do centro da molécula, esse elemento coincide com o centro geométrico da molécula. Qualquer ponto da molécula leva até seu centro e depois move-a com a mesma distância percorrida, no entanto, no sentido oposto da molécula. Inversão é equivalente a operação S2, mas distingue-se através pelo símbolo ”i”. [4] [1]
Eixo de rotação - reflexão (Sn)
Uma rotação-reflexão, também chamado eixo espelho, ou eixos impróprios consiste em uma rotação seguida de uma reflexão através do plano perpendicular do eixo de rotação. Por exemplo, se girarmos um molécula que contém 3 carbonos por 2/4 sobre o eixo destes três átomos e então refletirmos através do plano perpendicular contendo o átomo de carbono central, o resultado seria uma rotação imprópria S4. [4] [1]
Muito simplesmente, se tomamarmos como referência uma molécula rígida (ou objeto de qualquer tipo), um critério necessário e suficiente para identificar a sua quiralidade é uma ausência de eixos Sn; a existência de qualquer eixo Sn torna um objeto aquiral. As moléculas quirais não precisam ser assimétricas. Assimétrico é definida como a ausência completa de simetria. No entanto, muitas moléculas quirais podem ter um ou mais eixos de rotação adequados – mas apenas eixos impróprios estão presentes. Compostos como estes podem ser referidos como dissimétrico, sinônimo de quiral. Assim, enquanto todos os compostos assimétrico são moléculas quirais, nem todas as moléculas quirais são assimétricos. [4] [5]
Isomeria configuracional
Introdução
No século XIX o mineralogista francês René Just Haüy constatou a existência de dois cristais de quartzo que eram diferentes apenas na posição de duas faces. Estes cristais eram imagens especulares um do outro e não eram superponíveis.Foram assim denominados enantiomorfos. Não apenas os cristais, mas vários seres vivos, objetos e moléculas possuem enantiomorfos. O termo quiral vem da palavra grega cheir que significa mão, e ao colocar uma palma sobre a outra(faça isso com as palmas voltadas para o seu rosto) verá que não se superpõem, ou seja, os dedos serão opostos, com exceção do dedo médio. Algumas plantas como a trepadeira da espécie Convolvus arvensis enrosca-se para a direita; já a Lonicera sempervirens enrosca-se para a esquerda.
Luz natural e luz polarizada
A luz natural é formada por ondas eletromagnéticas, sendo que as ondas elétricas vibram em um plano e as magnéticas em outro, mas perpendicular ao primeiro.Uma luz ou radiação que não foi polarizada é denominada comum e se propaga por todas as direções; já a luz polarizada se propaga em uma única direção.
Polaróides e Polarímetro
Há várias maneiras de polarizar a luz e a mais simples é o uso de um polaróide, o qual possui cristais de substâncias organicas complexas depositados sobre o material plástico transparente, estas estão organizadas em determinadas posições que assim que a luz ou radiação comum passar, esta irá ser polarizada ou seja, vibrará apenas em uma única direção. O polarímetro é um instrumento científico o qual possui em seu interior um prisma de Nicol(CaCO3) uma fonte de radiação(lâmpada de sódio) e um recipiente para a amostra. Quando a luz despolarizada passa por um prisma de Nicol, é polariza, esta segue para o recipiente onde está a amostra dissolvida com um solvente que não causa interferência na polarização da luz. Quando a luz sai do recipiente a radiação chega ao observador, indicando um desvio no plano de sua propagação e este é medido em graus. Nas unidades produtoras de açúcar (usinas de açúcar e álcool) o polarímetro também podem ser chamado de sacarímetro, e este é usado para medir a quantidade de açúcar de uma amostra,e o resultado é expressado em uma unidade denominada Pol. Se a luz observada causar um desvio da luz polariza para a direita esta é denominada dextrógera e na nomenclatura apresenta(+)antes do nome do composto o qual segundo a IUPAC descreverá tal propriedade apresentada acima.Sendo o desvio para a esquerda esta é denominada levógira,sendo assim o símbolo(-)antes do nome do composto para indicar tal propriedade.
Composto ópticamente ativos
Em 1848 Louis Pasteur, trabalhava com cristais do ácido tartárico que se depositavam no fundo dos barris de vinhos durante a fermentação, quando Pauster preparou uma solução aquosa deste composto e analisou-o em um polarímetro, observou que esta solução desviava a luz para a direita, determinando assim este composto como dextrógiro e ópticamente ativa. Preparou outra solução com outros cristais e esta não causou nenhum desvio, o que a caracterizou como ópticamente inativa. Pauster dissolveu novamente este cristais inativos e recristalizou-os na forma de sal de amônio e sódio, e foram formados dois novos tipos de cristais que foram separados por uma pinça por Pauster. Estes cristais eram enatiomorfos, ou seja eram imagens especulares.
Poder rotatório específico
=
O ângulo de desvio do plano da luz polarizada que ocorre em uma solução opticamente ativa é representada pela fórmula descrita acima
onde:
20° é a temperatura da solução em graus Celsius.
D representa a transição eletrônica ou raia, que resulta na radiação do comprimento de onda = 583 nm de uma lâmpada de sódio.
C é a concentração da solução em g/ml.
d é o comprimento do tubo do polarímetro por onde a luz atravessa a solução a qual é expressa em cm.
Conformações em sistemas de cadeia aberta
O termo conformação refere-se aos diferentes rearranjos espaciais dos átomos de uma molécula que surgem da rotação em torno das ligações entre determinados grupo de átomos, e uma conformação específica é chamada um confórmero ou isômero conformacional.[6]. Portanto, isómeros conformacionais são estereoisómeros que podem ser convertidos um no outro pela rotação em torno de uma ligação simples. Os isômeros conformacionais são representados pelas formulas de projeção, as quais indica a disposição espacial relativa dos átomos através de suas ligações numa molécula[7]. São exemplos das formulas estereoquímicas as projeções de Fischer (A), Newman (B), cavalete(C), cunha(D) e ziguezague (E)[8].

Para qualquer ligação num composto de cadeia aberta que conecte dois átomos de carbono de hibridização sp3, um número infinito de conformações é possível, cada uma com certo valor de energia associado[9]. Isómeros conformacionais, mesmo se são não degenerados como é o caso do butano, não podem ser isolados na maior parte dos casos devido às pequenas barreiras rotacionais que existem entre eles[6]
As diferentes conformações possuem diferentes ângulos de torção ao redor de uma ou mais ligações . O ângulo de torção (ϕ), que é um ângulo diedro, é o ângulo formado entre os planos que contem os átomos A,B,C e B,C,D.

Em uma projeção Newman o ângulo de torção é o ângulo entre as ligações de dois grupos ou substituintes de referencia (A e D), um de eles ligado ao átomo mais próximo do observador (C), e outro ligado ao átomo mais afastado (representado como circulo).
Nomenclatura dos confômeros
Em 1960 William Klyne e Vladimir Prelog desenvolveram um método geral e detalhado para descrever conformações em torno a uma ligação simples em uma molécula ou parte de uma molécula[10]. O ângulo de torção entre A e D tem uma direção apropriada, sendo referido como (+) quando é medido em sentido horário, e como (-) quando é medido em sentido anti-horário.
Os rearranjos correspondentes para os ângulos de torção entre 0 e (±) 90° são chamados sin, e aqueles que correspondem aos ângulos de torção (±) 90 e 180° são denominados anti. Da mesma forma, os arranjos correspondentes para ângulos de torção entre os ângulos de 30° e 150 ° ou entre -30° C e -150° são chamados clinal e aqueles entre as 0 ° e 30 ° ou 150 ° e 180 ° são chamados periplanos. Os dois tipos de condições podem ser combinados de modo a definir quatro intervalos de ângulo de torção; 0 ° e (±)30° sin-periplano (sp); 30 ° a 90 ° e -30 ° a -90 ° sinclinal (SC); 90 ° a 150 ° e -90 ° C a -150 ° anticlinal (ac); ± 150 ° a 180 ° antiperiplano (ap).[11]

Conformações da molécula de etano

A molécula de etano, CH3-CH3, é composta por dois grupos metila com sobreposição de orbitais híbridos sp3 que formam uma ligação sigma (σ) entre eles. Os dois grupos metila não está fixos em uma só posição, eles são relativamente livres para girar em torno da ligação sigma que liga os dois átomos de carbono.
Assim para a molécula de etano, existe um número infinito de conformações em torno da ligação C-C, cada uma com certo valor de energia associado. Duas destas conformações são reconhecidas como mínimos de energia (conformações alternadas) e máximos de energia (conformações eclipsadas). Na projeção de Newman a conformação eclipsada corresponde aos ângulos de torção de 0°, 120° e 240°; e a conformação alternada aos ângulos de torção de 60°, 180° e 300°[12].

Na figura de abaixo é representado o gráfico de energia potencial em função do ângulo de torção. No gráfico de energia potencial pode-se observar que as conformações eclipsadas e alternadas correspondem aos máximos e mínimos de energia. A diferença entre as duas conformações é de 12,6 kJ/mol (ou 2.88 kJ/mol) a 25°C. A desestabilização das conformações eclipsadas é chamada tensão torcional. Sendo esta característica resultado das características estruturais e tridimensionais de uma molécula. Devido ao fato de que as três ligações eclipasada produzem 12 kJ/mol de tensão torcional, é razoável atribuir 4,0 kJ/mol como o costo energético para cada ligação [12].

Devido a fato de que barreira rotacional para os dois confôrmeros é pequena, qualquer molécula é susceptível de estar na conformação alternada em determinado instante e passar rapidamente à conformação eclipsada a uma velocidade de 6x109 s-1 a 25°C. O seja, à temperatura ambiente, a maioria das moléculas tem energia cinética suficiente para superar a barreira rotacional[13].
Em alguns hidrocarbonetos as repulsões de van de Waals são um fator importante para as barreiras de energia em determinada conformação. Entretanto, para a molécula de etano, a diferença entre a barreira rotacional não é fortemente influenciada por este tipo de repulsão. Analises cuidadoso dos raios de van der Waals mostrou que os hidrogênios dos grupos metila não estão próximos o suficiente para modificar substancialmente a barreira de rotação. Assim, a repulsão de van der Waals é responsável por menos de 10% da barreira experimental. Outros fatores como as interações eletrostáticas entre as ligações C-H, debilmente polarizáveis, também não são de importância para o etano [6]
Uma explicação possível para a barreira rotacional de etano é mediante a utilização de orbitais de fronteira. Assim, a explicação proposta é que poderia existir uma interação de estabilização entre o orbital σ C-H no carbono e o orbital σ* da ligação C-H carbono vizinho, que é máxima quando os dois orbitais atômicos ficam em posição paralela (hiperconjugação)[14].

.
Conformações da molécula de butano

Na molécula de butano se consegue distinguir três conformações diferentes. Uma conformação alternada chamada anti, trans ou antiperiplana, onde os substituintes ficam nas posições mais afastadas (em ângulo de 180°, mais à esquerda, abaixo); a conformação gauche (ϕ = ± 60°) ”); e dois tipos de conformações eclipsadas chamadas de sinperiplana (ϕ = 0°) e anticlinal (ϕ= ±120°) [9]. A relação entre a energia e o ângulo de torção por rotação em torno do C(2)-C(3) da ligação é apresentado na figura de abaixo[15].

A diferença entre as conformações antiperiplana e sinclinal (ou gauche) em n-butano é cerca de 0,6 kcal/mol. A diferença de energia entre as duas conformações é atribuída ao incremento de energia como resultado da repulsão de van der Waals entre os grupos metila.[13] Além de isso, este valor de energia depende do estado de agregação dos confôrmeros, sendo por volta de 0.89-0,97 kcal/mol (3,7-4,1 kJ/mol ) em fase gasosa e 0,54-0,57kcal/mol (2.3-2.4 kJ/mol) em fase líquida [6].
A conformação simperiplana é ainda mais instável pela repulsão van der Waals entre os grupos metila. Não se conhece com precisão a barreira energética de metila/metila , mas o faixa de valores experimentais e teóricos é entre 4,0 e 6,0 kcal/mol [16]. Na tabela de abaixo mostra-se os valores de energia para os diferentes tipos de repulsão entre os substituintes de n-butano.
| X-Y | δE kcal*mol-1 |
|---|---|
| H-H | 1,0 |
| H-Me | 1,4 |
| Me-Me | 3,1 |
A população dos confôrmeros gauche e anti no butano está definido pela constante de equilíbrio das conformações , que depende tanto de ΔG () como de ΔH° (ΔG° = ΔH° - TΔS°; onde R é a constante dos gases (1,98 cal /mol*K), T é a temperatura em condições padrão (298K))) e também do ΔS°. [6] [17].

Conformações da molécula de pentano
O analises conformacional para a molécula de n-pentano é um pouco mais complexa que o butano devido ao fato de que a rotação entre as moléculas pode ser feita em torno dois ângulos de torção diferentes, ϕ1 e ϕ2, formando nove conformações alternadas (figura de abaixo).

As conformações em torno das ligações C(2,3) e C(3,4) são denotadas como anti(a) ou gauche(g); o sinal + e – indica se o ângulo de torção esta perto de 60° ou -60°, respectivamente. As conformações acima da linha horizontal são conformações indistinguíveis devido ao fato de que elas têm o mesmo valor de energia. Além disso, as conformações ag+ e g+a se interconvertem mediante uma rotação de 180°, e o mesmo entre as conformações ag- e a-g. Portanto, só seis confôrmeros são distintos. Devido a fato de que o n-pentano possui duas variáveis independentes (os ângulos de torção em torno C2-3 e C3-C4) é conveniente representar as energias dos confórmeros em função de ϕ2,3 e ϕ3,4, como um diagrama de contorno[18] .
Os máximos de energia correspondem aos confôrmeros onde os ângulos de torção são ϕ2,3 = 65° e ϕ3,4 = 180° ou vice versa, o seja, os confôrmeros ag- e g+a. A conformação de menor energia é quando ϕ2,3 e ϕ3,4 são 180° [6].

Análise conformacional de alcanos ramificados
No caso de alcanos ramificados cabe ressaltar o comportamento incomum do 2,3-dimetilbutano. Para este composto os confôrmeros gauche e anti possuem quase a mesma energia. A explicação para mudança da estabilidade relativa de cada um dos confôrmeros é a seguinte: no butano os ângulos de ligação entre H3C-C-H é por volta de 109,5°. Entretanto, para o 2,3-dimetilbutano, o ângulo de ligação entre CH3-C-CH3 é por volta de 114°. Portanto, o aumento do ângulo de ligação faz com que no confôrmero anti, as posições entre os grupos metila fiquem mais próximas, e, porém mais afastadas no confôrmero tipo gauche. Como resultado, observa-se um aumento na repulsão de van der Waals dos grupos metila na conformação anti e uma estabilização no confôrmero gauche [6].

Por outro lado, para moléculas onde os substituintes são grupos polares (por exemplo halogênios, nitrogênio ou oxigênio) existem outros efeitos, além dos já discutidos, que fazem que aumentam as barreiras rotacionais entre os confôrmeros. Assim, as moléculas com grupos polares possuem momento de dipolo associado, que é o responsável pela interação eletrostática entre os substituintes, afetando a barreira rotacional dos confôrmeros e a estabilidade relativa entre eles. A magnitude destas interações pode ser influenciada pela presença do solvente. Em compostos de tipo XCH2-CH2X (donde X= Cl ou Br), a conformação anti é preferencial. Este comportamento é atribuído à diminuição da repulsão dipolo-dipolo no confôrmeros anti, onde os substituintes ficam mais afastados. Embora o 1,2-difluoroetano também devesse apresentar uma repulsão quando os átomo de flúor se aproximam, o confôrmero tipo gauche é a conformação preferencial, ainda em fase gasosa[6].
Na figura encontra-se as diferenças de entalpia em fase gasosa para 1,2-dihaloetanos

Este fato pode ser explicado pela combinação de uma energia de repulsão de van der Waals relativamente baixa (em comparação com bromo ou cloro), devido ao pequeno tamanho do átomo de flúor, mais as duas interações de hiperconjugação no confôrmero tipo gauche, ilustrado na figura de abaixo[19][20]. A fim de utilizar os dois átomos de flúor simultaneamente em este tipo de interação, as duas ligações C-F devem estar ortogonais entre si, sendo esta interação ótima em um ângulo de torção de 90º onde a energia é mínima[6] [21].

A substituição de um átomo de carbono por um heteroátomo em moléculas de tipo CH3-X-CH2CH3, também as estabilidades relativas dos confôrmeros. Comparado com butano, por exemplo, onde a distancia entre CH3/CH3 é de 1,53 Å, moléculas com átomos mais eletronegativos como etilmetiléter ou N-metiletanamina, a conformação gauche possui uma menor estabilidade relativa que o confôrmero anti, devido ao fato de que os grupos metila ficarem mais próximos (1,43 e 1,47 Å, respectivamente). Para o átomo de enxofre observa-se o efeito contrário onde as distâncias entre os grupos metila é de 1,81 Å, criando uma menor repulsão entre os grupos. Assim, as diferenças de energia entre os confôrmeros anti e gauche é próxima de zero[6].
Para as moléculas de etano, metilamina e metanol, a substituição de átomo de carbono, por grupos OH ou NH produz uma diminuição nas barreiras de rotação entre os confôrmeros. Assim, os valores de energia para etano, metilamina e metanol são 2.9, 2,0 e 1,1 kcal / mol, respectivamente[13].
Barreiras rotacionais de outras moléculas orgânicas pequenas também foram medidas.
| Alcanos | Barreira de rotação (kcal*mol-1) | Compostos com heteroátomo | Barreira de rotação (kcal*mol-1) |
|---|---|---|---|
| CH3-CH3 | 2,9 | CH3-NH2 | 2,0 |
| CH3-CH2CH3 | 3,4 | CH3-NHCH3 | 3,0 |
| CH3-CH(CH3)2 | 3,9 | CH3-N(CH3)2 | 4,4 |
| CH3-C(CH3)3 | 4,7 | CH3-OH | 1,1 |
| C(CH3)3-C(CH3)3 | 8,4 | CH3-OCH3 | 4,6 |
Efeito anomérico
Para moléculas de tipo CH3-O-CH2-X (X= halogênio, OR ou SH), onde um átomo de carbono está ligado a dois heteroátomos, se esperaria-s que os efeitos estéricos existentes para conformações de tipo gauche fossem muito maiores que o confórmero anti, devido ao fato de que ligações de tipo C-O são mais cortas que as ligações C-H, diminuição entre a ligação. Entretanto, observou-se uma diferencia entre as estabilidades dos confórmeros tipo gauche e anti, considerando só as interações estéricas. A diferença entre as estabilidades relativas (gauche – anti), atribuídas só a efeitos estéricos, e os valores experimentais é chamada efeito anomérico [6]. Assim, existe uma preferencia conformacional entre os pares de elétrons não compartilhados do átomo doador e, a ligação com deficiências de elétrons (C-X) numa conformação antiperiplanar. Este efeito é um caso preferencial onde o confórmero sinclinal (ou gauche) é mais estável do que o confórmero antiperiplanar [22]. Apesar disso encontra-se na literatura evidências de que a hiperconjugação pode explicar o efeito anomérico em compostos acíclicos, como carbenos, estabilizados na posição antiperiplanar [23].
Uma interpretação do efeito anomérico se observa utilizando os orbitais moleculares. Se um átomo com pares de elétrons não compartilhados (X) é particularmente bom doador elétrons e o outro átomo um bom aceptor σ* (Y), a contribuição n -> σ* a contribuição é reforçada em um processo de hiperconjugação. Na figura de abaixo está representado a estrutura de ressonância para uma carga num orbital não-ligante (a) e representação dos orbitais moleculares (b).


A tendência para ser aceptor σ, senda ela diretamente proporcional à eletronegatividade, se reverte ao mover-se de cima pra abaixo nos grupos da tabela periódica. Assim, devido ao fato de que a eletronegatividade diminui em seguinte ordem F > Cl > Br, a habilidade para ser aceptor σ* aumenta no seguinte ordem σ*C-F > σ*C-Cl > σ*C-Br[24].
Análise conformacional de moléculas acíclicas insaturadas
Eteno é uma molécula plana e, devido à alta barreira de rotação em volta da dupla ligação, o eteno existe em uma simples conformação. Desta forma, toda porção da molécula de qualquer alceno que contiver uma ligação dupla também será planar, ou seja, os dois átomos de carbono unidos pela ligação dupla e os quatro átomos que a eles se ligam estarão no mesmo plano. Propeno sofre alterações conformacionais pela rotação em torno da ligação simples em CH3-CH=CH2. As duas conformações, nas quais a ligação dupla é o plano de simetria, são mostradas abaixo (Eliel & Wilen, 1994).

A configuração mais estável é aquela em que a ligação dupla encontra-se eclipsada (cis) com uma das ligações C-H do grupo metil (Herschbach & Krisher, 1958). A barreira de rotação no propeno é de aproximadamente 2,0 kcal mol-1 (Lowe, 1968) e seria plausível pensar que a conformação alternada (sinclinal ou bissectada) H2C=C/C-H correspondesse ao máximo de energia. No entanto, uma vez que a energia referente aos hidrogênios eclipsados na conformação bissectada corresponde somente a 1 kcal mol-1, ou seja, metade da barreira total, parece haver uma desestabilização adicional, de mesma magnitude, devido à interação desfavorável das outras duas ligações C-H com o orbital π C=C nesta conformação (Wiberg & Martin, 1985). Adicionalmente, a conformação do propeno é influenciada por hiperconjugação (Carey & Sundberg, 5ª ed.). O grupo metila exerce um efeito de estabilização (2,1 kcal mol-1) sobre a dupla ligação, por meio da interação σ-π*. O principal efeito é a transferência da densidade eletrônica da ligação σ C-H da metila para um orbital vazio π*. Cálculos computacionais estimam que a esta energia de estabilização seja de 5,4 kcal mol-1 (Y. Mo & Peyerimhoff, 1998) e também preveem o encurtamento da ligação C(2)–C(3) como resultado da deslocalização σ-π*. Uma vez que a extensão da hiperconjugação difere entre os dois confôrmeros, este fator também contribui para a diferença de energia entre eles.

Substituintes no C(1) do propeno, como em CH3-CH=CHX, diminuem a barreira energética para a rotação das metilas se estiverem na posição cis (Z) à metila, o que não ocorre na posição trans (E) (tabela 1). Como não parece haver razão óbvia para que a conformação bissectada seja estabilizada por um substituinte ligado ao C(1), a redução da barreira deve-se, provavelmente, à desestabilização da forma eclipsada. Tal desestabilização, que deve ocorrer por repulsão de van de Waals entre um hidrogênio do grupo metila e o substituinte X, é relevante quando Rc =X (Z), mas não quando Rt = X (E). Em propenos substituídos do tipo R-CH2-CH=CH2, em que R é um substituinte pequeno e eletronegativo, como F, CH3O ou CN-, a conformação cis é notoriamente dominante (karabatsos & Fenoglio, 1970).

Tabela 1: Barreiras em CH3-CH=CHX (Eliel & Wilen, 1994)
| X | E ou Z | kcal mol-1 | kJ mol-1 |
|---|---|---|---|
| Cl | E | 2,17 | 9,1 |
| Cl | Z | 0,62 | 2,6 |
| CH3 | E | 1,95 | 8,2 |
| CH3 | Z | 0,75 | 3,1 |
No caso de alcenos com quatro átomos de carbono, a presença de uma dupla ligação possibilita quatro estruturas possíveis:

O 1-buteno possui duas conformações eclipsadas, a primeira cis, com o grupo C=CH2 eclipsado com CH3 e outra gauche (anticlinal), mais estável, com o grupo C=CH2 eclipsado com H. A barreira para a interconversão entre os confôrmeros gauche e cis é de aproximadamente 0,5 kcal mol-1. Já a barreira entre a forma gauche e as formas bissectadas é de aproximadamente 1,7 kcal mol-1 (Eliel & Wilen, 1994).

Substituições podem introduzir repulsão de van der Waals que vão influenciar o equilíbrio conformacional. Por exemplo, a introdução de uma metila no C(2), como em 2-metil-1-buteno, origina uma repulsão entre metilas na conformação gauche e, como resultado, as duas formas eclipsadas possuem praticamente a mesma energia (Shimanouchi, T. et al, 1968).

O aumento do tamanho do grupo no carbono C(3) favorece a conformação em que o hidrogênio encontra-se eclipsado. Por exemplo, o 4,4-dimetil-1-penteno existe principalmente na conformação em que o hidrogênio está eclipsado, e não as metilas.

Esta interação é um exemplo de tensão 1,3-alílica (Hoffman, R.W., 1989). Este tipo de tensão surge na conformação eclipsada quando substituintes coplanares na dupla ligação e no grupo ligado ao C(3) são volumosos o suficiente para haver repulsão entre eles. A conformação de alcenos é um importante fator com referência à estereoseletividade de reações de adição de alcenos. A tensão alílica e demais fatores conformacionais contribuem para a energia relativa dos possíveis estados de transição e podem conduzir a um estereoisômero específico como produto. Quanto ao 2-buteno, segue a análise se os isômeros cis e trans podem ser isolados ou se os isômeros sofrem fácil interconversão, como as conformações do butano. A interconversão entre as formas cis e trans implica na rotação em torno da ligação dupla carbono-carbono. A separação dos isômeros depende da energia necessária para que esta rotação se efetue. A formação da ligação π resulta da sobreposição dos orbitais p que se situam acima e abaixo do plano dos orbitais σ. Para a interconversão dos butenos, é obrigatório girar uma das metades da molécula relativamente à outra, o que demandaria a quebra da ligação π. A ruptura desta ligação requer energia de aproximadamente 293 kJ, que não se alcança à temperatura ambiente. Devido a esta barreira de energia, a rotação em volta da ligação dupla torna-se impedida. Como resultado, é possível isolar os isômeros cis e trans do 2-buteno. Os isômeros cis- e trans-2-buteno, visto diferirem apenas na orientação espacial, são estereoisômeros. Como não são imagens especulares um do outro, os isômeros não são enantiômetros, mas sim, diasteroisômeros. Algumas propriedades físicas dos isômeros são mostradas na tabela 2.
Tabela 2: Propriedades físicas dos isômeros do buteno (Morrison & Boyd, 12ª ed.).
| Isômero | PE(ºC) | PF (ºC) | Densidade (-20ºC) | Índice de refração (-12,7ºC) |
|---|---|---|---|---|
| 2-Metilpropeno | -7 | -141 | 0,640 | 1,3727 |
| 1-Buteno | -6 | <- 195 | 0,641 | 1,3711 |
| Cis-2-buteno | +1 | -106 | 0,649 | 1,3778 |
| Trans-2-buteno | +4 | -139 | 0,667 | 1,3868 |
Tendo o exemplo do (Z)-2-penteno, observa-se que o confôrmero de maior energia é o cis, em que os grupos metila estão eclipsados.

Um exemplo de sistema insaturado com ligações duplas conjugadas é o 1,3-butadieno. Sua conformação mais estável é a antiperiplanar (s-trans), com Φ = 180º, por possuir o máximo de conjugações e o mínimo de interação estérica. O termo s refere-se às conformações envolvendo as ligações simples e não as ligações duplas. As demais conformações são a gauche (Φ =60º) e s-cis (sin-periplanar, Φ =0º). A conformação planar s-cis experimenta uma repulsão de van der Waals entre os hidrogênios C(1) e C(4), que é aliviada na conformação gauche.

A barreira para a conversão da conformação gauche para s-trans é de 3,9 kcal mol-1 (Carey & Sundberg, 5ª ed.). O máximo de energia presumidamente se refere à conformação na qual as duas ligações π estão mutualmente perpendiculares. Diversos cálculos apontam que a energia da conformação s-trans é menor que as energias das demais configurações em 2 - 5 kcal mol-1 (Rablen & Marques, 1992; Head-Gordon & Pople, 1993). Compostos carbonilados, como os 1-alcenos, preferem a conformação eclipsada à bissectada, como mostrado para o etanal e propanal. A barreira para a rotação do grupo metil no etanal é 1,17 kcal mol-1 (Kleiner et al, 1992; Belov, S.P. et al, 1993). Análises computacionais indicam que pequenos ajustes na geometria da molécula, incluindo o comprimento da ligação σ, devem ser considerados para a análise quantitativa da barreira (Goodman et al, 1995). A energia total pode ser dissociada em nuclear-nuclear, elétron-elétron, nuclear-elétron e cinética (Δt). A barreira de energia calculada aproxima-se muito do valor experimental. As contribuições para a barreira de energia do etanal obtidas por método computacional são apresentadas abaixo (Carey & Sundberg, 5ª ed.).
| ΔVm | -10,621 |
| ΔVee | -5,492 |
| ΔVne | +18,260 |
| Δt | -0,938 |
| Δ total | +1,209 |
No propanal, é o grupo metila, e não o hidrogênio, que está eclipsado com o grupo carbonila na conformação mais estável. A diferença entre as duas conformações eclipsadas, determinada por microscopia de micro-ondas, é de 0,9 kcal mol-1 (Butcher & Wilson, 1964). Porém, quando se trata de substituintes alquila muito volumosos, a conformação com o hidrogênio eclipsado torna-se mais estável. Este é o caso do 3,3-dimetilbutanal.

Outros exemplos a serem citados são a acroleína (propenal), ácido acrílico (ácido propanóico) e acrilato de metila. Acroleína (X = H) existe predominantemente sob a conformação s-trans, de menor interação estérica, sendo a diferença em energia entre as formas s-trans e s-cis de 1,7 kcal mol-1 e a energia de barreira de 5,0 – 6,4 kcal mol-1 (Courtieu et al, 1974; Carreira, 1976; Blom e Balder, 1982). Ambas as estruturas são planares (Blom et al 1982). No caso do ácido acrílico (X = OH) e acrilato de metila (X = OCH3), as diferenças entre as respectivas conformações s-cis e s-trans devido a interações estéricas são pequenas. Para o ácido acrílico, a diferença em energia é de 0,17 kcal mol-1 (Bolton et al, 1974), com barreira de 3,8 kcal mol-1, ao passo que a diferença entre as energias dos confôrmeros para o acrilato de metila é 0,31 kcal mol-1. Não há certeza sobre qual é a conformação menos estável, a cis ou a gauche (Eliel & Wilen, 1994). O fato da conformação s-trans ser pouco favorecida nestes compostos sugere que a vantagem estereoeletrônica é mínima e que, no caso da acroleína, sua substancial predominância deva-se a questões estéricas, ou seja, uma interação desfavorável =CH2/O= na conformação s-cis ou gauche. O menor valor da barreira na conformação s-trans do ácido acrílico em relação à acroleína está de acordo com a maior interação estérica existente no ácido (=CH2/OH eclipsado).

Cetonas também preferem a conformação eclipsada, estando o grupo alquil, e não o hidrogênio, eclipsado com o grupo carbonila. Esta conformação é mais estável porque permite que os dois grupos alquila sejam anti e não gauche em relação ao outro substituinte da carbonila.

A conformação dominante da 2-butanona é anti com o hidrogênio do C(1) e o metil do C(4) eclipsados com a carbonila. A barreira rotacional C(3) – C(4) é 2,48 kcal mol-1, enquanto que a barreira C(1) – C(2) é 0,67 kcal mol-1 (Carey & Sundberg, 5ª ed.). A conformação dominante do 3-metil-2-butanona é similar (Sakurai, T. et al, 2003). Adicionalmente, no caso da 3-pentanona, estudos de difração de elétrons indicam que na conformação mais estável, a metila está eclipsada com a carbonila (Romers & Creutzberg, 1956). Portanto, a tendência é que os grupos metila prefiram estar eclipsados com o grupo carbonila.

O equilíbrio entre as conformações s-trans e s-cis de cetonas α,β-insaturadas substituídas depende da extensão da interação de van der Waals entre os substituintes ligados aos carbonos C(1) e C(4) (Montaudo et al, 1973). Metil-vinil-cetona sofre o mínimo de repulsão devido e existe predominantemente como confôrmero s-trans.

Quando grupos alquila volumosos substituem a metila, a razão da forma s-cis cresce progressivamente à medida que o tamanho do substituinte aumenta (Bienvenue, A., 1973).

Uma interação desfavorável metil-metil desestabiliza a conformação s-trans do 4-metilpent-3-en-2-ona (óxido de mesitila) em relação à conformação s-cis e o equilíbrio favorece a forma s-cis (Carey & Sundberg, 5ª ed.).

Conformações em sistemas cíclicos
Análise conformacional de sistemas cíclicos
Os sistemas cíclicos são compostos que contêm átomos de carbono ligados em forma de anel (aliciclo) e podem ter um heteroátomo na sua estrutura (heterociclo). Devido à natureza da sua estrutura, estes compostos têm propriedades diferentes dos seus análogos de cadeia aberta; os ciclos têm rotação limitada e uma distorção de comprimentos de ligação e ângulos de ligação que gera uma instabilidade no anel, conhecida como tensão de anel. A tensão do anel está composta de pelo menos quatro tipos: tensão angular ou tensão de Baeyer, tensão de alongamento, tensão conformacional ou tensão de Pitzer ea tensão estérica ou tensão de Dunitz-Schomaker[25].
Tensão angular (Tensão de Baeyer ou Tensão clássica)
Em 1874 Le Bel e Van't Hoff propuseram a geometria tetraédrica do carbono sp3 com ângulos de 109,2o. Baeyer propôs uma teoria para a tensão do anel, em que o desvio dos ângulos internos em relação aos ângulos de um tetraedro, gera uma tensão interna no anel e seu desvio depende do tamanho do anel; assim a tensão angular decresce na serie ciclopronano-ciclobutano e dopis aumenta proporcionalmente ao número de membros no composto cíclico[26] (Figura b). No entanto, a teoria da tensão de Baeyer não é consistente com os resultados experimentais, porque baseia-se na suposição incorreta que todos os anéis são planares. A teoria de Baeyer só é aplicável a pequenos anéis, mas não, a anéis de mais de seis membros devido a que têm uma conformação não planar [27].

O desvio ou distorção do ângulo de ligação (d) pode ser calculado a partir de:
Onde α é o ângulo interno no cicloalcano. O fator ½ indica que a tensão e distribuída em duas ligações[28].
A tensão angular (energia necessária para a distorção do ângulo de ligação do seu valor normal, E(Ѳ)) é proporcional ao quadrado do desvio do ângulo de ligação(d) , e é representado como[27]:
Onde KѲ é a constante de força de flexão.
Tensão de alongamento
A tensão de alongamento (em inglês stretching strain) inclui como o seu nome indica o alongamento e a compressão de ligações simples de carbono-carbono. Um alongamento ou encurtamento estruturalmente induzido de uma ligação em relação ao comprimento dessa ligação deve-se a sua geometria de menor energia. Por exemplo, o comprimento de ligação para o carbono de alcanos é 1.54Å. A ligação C1-C4 na Figura c tem um comprimento de 1,75 Å, devido à geometria da molécula[29].

A tensão de alongamento (Er) é proporcional ao quadrado da distorção6.
Onde kr é a constante de força de alongamento , r o comprimento da ligação e ro comprimento de ligação normal.
Tensão torsional ou tensão de Pitzer
O desvio forçado da conformação mais favorável causa relativa instabilidade à molécula e é conhecida como tensão torsional. A barreira energética de rotação numa molécula é uma medida da tensão de torção para uma molécula e muda com a mudança no ângulo diedro[26].
A tensão de torção (Eφ) é expressa como:
Onde ω é o desvio de ângulo diedro da conformação mais favorável.
A tensão de Pitzer envolve as interações 1,4- e é determinada pelo ângulo diedro. É considerada uma força de repulsão, e é maior na conformação eclipsada em que as ligações são mais próximas entre si, enquanto é menor na conformação escalonada (mais favorável) em que ligações tendem a permanecer o mais longe possível.

Tensão estérica (tensão de Dunitz-Schomaker)
A tensão estérica ocorre em átomos não ligados entre eles mesmos (Figura d), que pode ser atraente ou repulsiva. A interação atraente resulta de uma polarização recíproca dos elétrons dos átomos. Tais forças atrativas são chamadas forças de dispersão ou forças de London e são relativamente fracas. As Forças de London variam inversamente com a sexta potência da distância internuclear e torna-se insignificante à medida que aumenta a separação internuclear. Quando as distâncias são menores do que o raio de Van der Waals, as forças de repulsão elétron-elétron são dominantes6.
Aspectos conformacionais dos anéis de seis membros
Os anéis de seis membros são largamente encontrados na natureza, e a sua conformação é fácil para estudar em relação aos anéis menores ou maiores6. Os hidratos de carbono, esteroides, produtos vegetais, pesticidas, e muitos outros compostos importantes contem anéis de seis membros, cujas conformações e estereoquímica são criticamente importantes para a sua reatividade. A abundância de anéis de ciclo-hexano na natureza é provavelmente devido à sua estabilidade e a seletividade oferecida pelas suas conformações[30].
Ciclo-hexano
Como vimos antes, Baeyer considera o ciclo-hexano como uma molécula planar, mas um anel planar de seis membros tem ângulos de ligação de 120o e assim, o composto tem átomos de carbono com hibridação sp3, teria tensão angular apreciável. Além disso, todos os grupos CH2 adjacentes eclipsariam o que gera uma tensão conformacional. Para evitar estas interações desfavoráveis, a estrutura adota conformações não-planares9[31]. Sache, 100 anos mais tarde, reconheceu que pode haver uma conformação de “cadeira”, “barco” ou “barco torcido”8

Estas três conformações estão libres de tensão angular, já que conservam ângulos de ligação de aproximadamente 109o; sendo a conformação cadeira a de mais baixa energia. Por tanto, pode-se esperar que o ciclo-hexano e a maioria de seus derivados existam na forma de cadeira[26]. Sashi também reconheceu que o ciclo-hexano pode inverter a conformação cadeira. Neste processo os átomos em posição axial passam a posição equatorial e vice-versa8.

Como mostrado na figura, a inversão da conformação cadeira, não é um processo de um só passo[32]. O primeiro passo produz um intermediário que depois numa etapa de igual energia produz a cadeira invertida. A energia de ativação para o processo de interconversão de cadeira - barco é 10,7-11,5 kcal/mol, o equivalente a 100.000 inversões por segundo à temperatura ambiente[26]. Vários estudos estabelecem que a conformação de barco torcido é 1-1,5 kcal/mol mais estável do que o barco. Em 1975, Squillacote, Chapman e Anet conseguiram capturar a conformação de barco torcido por uma técnica de isolamento em que fez-se um resfriamento rápido até -253oC de uma mistura de vapor de ciclo-hexano e argônio previamente aquecido a cerca de 800oC8.
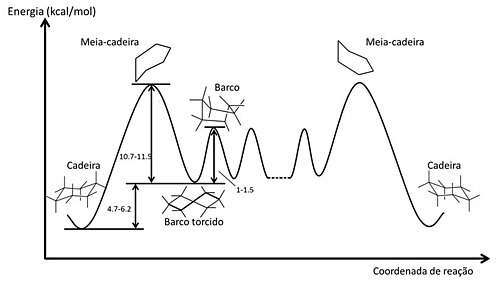
Ciclo-hexanos monossubstituídos
Substituição de um anel ciclo-hexano não afeta significativamente a taxa de inversão conformacional, mas o faz mudar a distribuição de equilíbrio entre formas alternativas de cadeira. A maior estabilidade da conformação equatorial é explicada geralmente em termos estéricos. Nesta conformação, a distância entre o substituinte e os hidrogênios sin-diaxiais é menor que entre os hidrogênios 1,2-diequatoriais[26],[33]. Para metilciclohexano, ΔG para o equilíbrio é -1,8 kcal/mol, o que corresponde a uma composição com 95% do metil na posição equatorial6.
Na tabela, são mostrados os valores de ΔGo, para o processo de inversão da conformação cadeira. Por exemplo, pra o grupo t-butilo axial, o valor de ΔGo é -4,9 kcal/mol mostrando a grande preferência do substituinte pela posição equatorial. Nesta molécula, uma metila fica dentro do anel, sofrendo uma forte repulsão estérica.
| Substituinte | -ΔGo (kcal/mol) | Substituinte | -ΔGo (kcal/mol) | |
|---|---|---|---|---|
| F | 0,25 | SH | 1,0 | |
| Cl | 0,4 | CH3 | 1,74 | |
| Br | 0,5 | CH2CH3 | 1,8 | |
| I | 0,4 | i-Pr | 2,1 | |
| OH | 0,7 | t-bu | 4,9 | |
| OCH3 | 0,8 | C6H5 | 2,9 | |
| OCH2CH3 | 0,9 | CN | 0,2 |
Ciclo-hexanos dissubstituídos
Os ciclo-hexanos dissubstituídos 1,2-, 1,3-, 1,4- podem existir como isômeros cis e trans. Quando os dois substituintes são idênticos, os isômeros cis-1,2 e cis-1,3 são formas meso, enquanto os isômeros trans correspondentes são quirais. Nas series dissubstituídas 1,4-, ambas as formas cis e trans são aquirais independentemente dos substituintes8.
Quando dois ou mais substituintes estão presentes num anel de ciclo-hexano, as interações entre os substituintes devem ser incluídas na análise. Os dimetilciclohexanos proporcionam uma análise conformacional de fácil interpretação e com boa concordância com os dados experimentais.
O diastereômero mais estável em cada caso é aquele em que ambas os grupos metílas são equatoriais. O ΔG é semelhante para cada um dos isómeros diequatorial (1,9 kcal/mol) e é muito perto do valor de ΔG conformacional do metilciclohexano (1,8 kcal/mol). Isto implica que não há interações importantes adicionais no dimetilciclohexano em comparação com o metilciclohexano. Isto é razoável, porque em cada caso, o grupo metil axial interage apenas com os hidrogênios 3,5-diaxal6.

A presença de ligações duplas gera mudanças do nas propriedades dos ciclos. Quando centros sp2 são incorporados em anéis de seis membros a barreira de energia para a inversão no anel, é reduzida para 7,7 kcal / mol em ciclo-hexeno (considerando que para o ciclo-hexano é 10,3 kcal/mol) e 4,9 kcal/mol em ciclo-hexanona. A conformação de ciclo-hexeno é descrito como meia-cadeira. Parâmetros estruturais determinados por difração de elétrons e espectroscopia de microondas revelam que a ligação dupla pode ser acomodada no anel sem distorção grave. O comprimento da ligação C(1)-C(2) é a 1,335 Å, e o ângulo de ligação C(1)-C(2)-C(3) é de 123o. Os substituintes em C(3) e C(6) são denominados como pseudoaxial e pseudoequatorial8.

Conformação e propriedades físicas do ciclo-hexano e seus derivados8
As propriedades de um composto que exibe isomerismo conformacional não podem ser definidas com base numa estrutura rígida. Em vez disso, são determinadas pela a natureza dos confórmeros contribuintes, suas populações relativas (que são determinadas pela sua entropia, entalpia e energia livre) e, finalmente, a sua estabilidade cinética. Informações sobre esses tópicos são determinados a partir de parâmetros termodinâmicos, momentos dipolares e propriedades chiropticas. É importante notar que as propriedades tais como pontos de ebulição, índices de refracção e as densidades relativas de estereoisômeros podem ser previstas com base na regra conformacional, uma modificação da regra clássica de Von Auwers-Skita: "O isómero com o volume molar mais baixo tem o maior teor calórico". Como o menor volume molar implica uma maior densidade, índice de refração, e ponto de ebulição, outra forma de definir regra é dizer que o isômero do maior entalpia tem o maior o ponto de ebulição, índice de refração, densidade e também o calor de vaporização8. Propriedades físicas de dimetilciclohexanos são mostradas na tabela 2.
| Isômero | Ponto de ebulição (oC) | índice de refração | Densidade |
|---|---|---|---|
| Cis-1,2 | 129,7 | 1,4336 | 0,7922 |
| Trans-1,2 | 123,4 | 1,4247 | 0,7720 |
| Cis-1,3 | 120,1 | 1,4206 | 0,7620 |
| Trans-1,4 | 124,5 | 1,4284 | 0,7806 |
A espectroscopia de infravermelho e ultravioleta são úteis para distinguir entre as formas axial e equatorial de α-halocetonas. Em IV o halogéneo equatorial gera um deslocamento do grupo carbonila para valores mais elevados na frequência de alongamento. No caso de UV o halogênio na posição axial, provoca um efeito batocrômico substancial.
| UV (nm) | UV (nm) | IV(cm-1) | IV(cm-1) | |
|---|---|---|---|---|
| Halogénio | Axial | Equatorial | Axial | Equatorial |
| F | 18 | 27 | 10 | -1 |
| Cl | 2-9 | 18-25 | 14 | -6 |
A Ressonância Magnética Nuclear (RMN) é a técnica mais poderosa para o analise conformacional. Ela pode ser usada à temperatura ambiente ou em baixas temperaturas, dependendo do sistema, o que permite o estudo de um grande número de equilíbrios conformacionais, que depende da taxa de interconversão e a escala de tempo de RMN. Moléculas com barreiras internas de 20-100 kcal/mol de interconversão são ideais para o uso de RMN. Existem três tipos de situações em relação à taxa de interconversão e a escala de tempo RMN12[34]:
1- A taxa de interconversão é lenta na escala de tempo de RMN e o espectro é a superposição dos espectros de prótons em posição axila e equatorial.
2- A taxa de interconversão é rápida na escala de tempo de RMN e os confórmeros são vistos como espécies não-discretas com estruturas intermediárias e os deslocamentos químicos e os valores das constantes de acoplamento são ponderadas para prótons axiais e equatoriais
3- A taxa de interconversão é compatível na escala de tempo de RMN e é obtido um espectro mal definido. A forma do espectro muda significativamente com a temperatura e os parâmetros cinéticos são obtidos por uma análise em função de temperatura. Nestes casos é comum realizar medições em baixas temperaturas.
Efeito Thorpe- Ingold
Uma manifestação interessante quanto à mudança de um grupo substituinte no anel é conhecido como efeito Thorpe-Ingold . Esse efeito leva a uma aceleração no processo de fechamento de anel (ciclização), em função da modificação de átomos de hidrogênio por grupos alquil nos carbonos tetraédricos envolvidos diretamente na reação (centros reacionais)[6].
Facilidade de ciclização em função dos substituintes anelares
Quando o fragmento que cicliza, (como por exemplo, ─CH2CR2CH2─), comporta grupos geminais metil (R= CH3) ou grupos alquil maiores no lugar de átomos de hidrogênio (R=H), a repulsão mútua dos grupos alquil geminais na cadeia aberta, leva a um aumento no ângulo β e, consequentemente, uma diminuição no ângulo α [6][35].

Essa diminuição dos ângulos internos deixa os grupos X e Y mais próximos promovendo a ciclização mais rapidamente[35]. Assim, a formação do anel é facilitada na presença dos grupos geminais dialquil. Esse efeito cinético, com aumento na velocidade de ciclização, pode ser observado na tabela abaixo, quanto à ciclização de haloidrinas[6].
Esse efeito permanece para a formação de anéis de cinco e seis membros, no entanto, para anéis com muitos membros o efeito diminui à medida que o tamanho do anel formado aumenta, como pode ser observado através da velocidade de reação para formação de lactonas a partir de Br─(CH2)n-3 ─CR2CH2─COO─, R=CH3, onde a velocidade de reação (Krel = Kgem/KH) quando um anel de seis membros é formado é de 38,5; já com anel de nove membros o Krel é 6,62; com anel de dez membros o Krel é 1,13; e no anel de onze membros o Krel é de 0,61[6].
Na formação de lactona com anel de seis membros, o incremento na velocidade de ciclização também é facilitado em função do ganho entrópico e entálpico. A contribuição entálpica ocorre devido ao maior número de interações do tipo gauche presentes na cadeia aberta quando comparada ao produto cíclico final. Já a contribuição entrópica se dá, pois as ramificações reduzem a rotação na cadeia aberta mais do que no anel formado, aumentando a entropia do sistema e favorecendo o fechamento de anel[35].
No caso de anéis grandes a liberdade de rotação é similar à forma de cadeia aberta, assim a contribuição entrópica do efeito Thorpe-Ingold torna-se menos importante. De modo similar, espera-se que a contribuição entálpica seja insignificante para um anel grande com pouca tensão. Assim, o baixo efeito Thorpe-Ingold observado em anéis grandes é complexo e muito provavelmente envolve vários fatores[35].
Restrição conformacional e síntese de isômeros seletivos
Analisando os dados cinéticos da tabela abaixo, referente a uma reação enzimática de lactonização de ácidos hidrocumarínicos substituídos, observa-se que somente um grupo metil no anel aromático, como representado na estrutura 12, não produz mudança na velocidade de ciclização, quando comparado ao ácido de referência 11. No entanto, a adição de três grupos metila (dois na cadeia lateral e um no anel aromático), como pode ser observado na estrutura 10, aprimora de maneira significativa a taxa de velocidade da reação, mesmo quando comparado a estrutura 13 que apresenta duas metilas geminais na cadeia lateral. Uma probabilidade para explicar tal fato é que as três metilas presente na estrutura 10, geram uma forte restrição conformacional, limitando a liberdade rotacional do substrato durante a reação enzimática, o que resulta em um aumento de velocidade de reação e eliminação de isômeros não específicos[35].

Regra de Bredt
A Regra de Bredt (homenagem ao químico alemão Julius Bredt) é uma generalização qualitativa que descreve as limitações estruturais em compostos de anel com ponte. A partir de considerações estéricas, Bredt concluiu que certas estruturas de anéis bicíclicos com uma ligação dupla carbono-carbono em um átomo cabeça-de-ponte não é capaz de existir, a menos que os anéis sejam suficientemente grandes.[36]
Esta observação empírica tem sido útil para a determinação de estruturas de compostos como terpenos e na interpretação de reações que envolvem compostos de anel em ponte. Por exemplo, dois dos seguintes isômeros de norborneno violam a Regra de Bredt, o que os torna muito instável para prepará-los [37]:

Na figura, os átomos de ponte que violam a regra de Bredt estão destacados em vermelho.
A Regra de Bredt pode ser útil para prever quais isômero são obtidos a partir de uma reação de eliminação de um sistema de anel em ponte. A regra também pode ser aplicada á mecanismos de reações (Figura abaixo) que envolvem carbocátions e, em menor grau, as que envolvem radicais livres, uma vez que estes intermediários, como os átomos de carbono envolvidos numa ligação dupla, preferem ter uma geometria plana com ângulos de 120 graus e hibridação sp2 [37].

No entanto, hoje a questão de ligações duplas em cabeças-de-ponte é estudada em mais detalhe, e já foram isolados vários produtos naturais que contêm duplas ligações em carbonos cabeça-de-ponte, como por exemplo o Taxol[38]:

Essa observação têm a ver com a grande flexibilidade que acompanha os anéis de tamanhos maiores (aproximadamente 8 a 10 carbonos). Verifica-se que a estabilidade das ligações duplas em cabeça-de-ponte espelha a maior estabilidade de trans-cicloalceno que contém ligação dupla. O trans-ciclohexeno e o trans-ciclohepteno (anéis de 6 e 7 carbonos respectivamente) não são estáveis o suficiente para existir à temperatura ambiente. No entanto, trans-cicloocteno é uma molécula estável, e do mesmo modo, o biciclo[3.3.1]non-1-eno é um composto estável [38].
Notação Estereoquímica
Um importante aspecto da estrutura química é sua configuração, isto é, o arranjo tridimensional de seus átomos. O objetivo dos estereodescritores é promover uma identificação concisa e sem ambiguidade [39].
Notação Absoluta
A configuração absoluta de uma molécula quiral está relacionada à estrutura tridimensional exata dos átomos ligados ao seu centro estereogênico, podendo ser representada por projeções de Fischer e designada pelas letras R e S, que são representações das palavras latinas rectus e sinister, significando direito e esquerdo, respectivamente. [39],[40]
A convenção do sistema R,S de Cahn-Ingold-Prelog, segue as ordem de prioridade estabelecida nos números atômicos e/ou número de massas para isótopos, do grupo de átomos que compõem o centro de quiralidade [40].
O substituinte de maior prioridade é aquele com maior número atômico, ou maior número de massa no caso de isótopos. Se o centro quiral possui dois átomos de idênticos ligados a ele, então percorre-se as cadeias até encontrar um ponto de diferença e, atribui-se prioridade aos átomos diferentes [13].


Para realizar a leitura posiciona-se o grupo de menor prioridade para trás, afastando-se do leitor, no momento da leitura. Lê-se os grupos em ordem decrescente de prioridade. [1] Caso a ordem de prioridade girar no sentido horário, o isômero será designado R. Se ao seguir do grupo de maior prioridade para o de menor, a direção da rotação for anti-horária, denominamos a molécula como S. [39]

Quando a estrutura apresente ligações duplas ou triplas, estas são tratadas como ligações simples e os átomos são duplicados.[39]

Estereodescritores para alcenos
A hibridização sp2 dos átomos de carbono em uma dupla ligação provoca um arranjo planar em seus átomos e não permite rotação. Quando os substituintes dos dois carbonos não são iguais, a posição que os ligantes assumem é relevante, pois dão origem a compostos diferentes. Para nomear essas estruturas utiliza-se notações cis e trans ou E e Z. [13]

Quando há apenas dois substituintes diferentes, utiliza-se a notação cis e trans. O isômero com ambos os substituintes no mesmo lado são chamados de cis, enquanto que o isômero com substituintes opostos são denominados trans.[13]
Entretanto, quando há mais de dois substituintes no alceno, essa notação se torna ambígua. Existe a notação E-Z que é capaz de ser aplicada a todos os sistemas, sem que as designações gerem dúvidas. [13]
Os estereodescritores E-Z também é baseado nas regras de prioridade de Cahn-Ingold-Prelog, citada anteriormente.[41]

Quando a prioridade for atribuída, o isômero que apresentar as maiores prioridades no mesmo lado é chamado isômero Z. Se os grupos com maiores prioridades estiverem em lados opostos, o isômero é denominado E. As letras são de origem alemã, E representa a palavra entgegen, que significa “opostos” e Z refere-se a zusammen, que quer dizer “juntos”. [39]
Assim como em uma dupla ligação onde os substituintes podem estar no mesmo lado ou opostos, em um composto cíclico isto também pode ocorrer. Os arranjos são de configurações diferentes e, portanto não podem ser modificadas a menos que haja quebra ou formação de pelo menos uma ligação.[13]
Alguns átomos possuem um par de elétrons ao invés de um substituinte. Par de elétrons são atribuídos a baixa prioridade pela conversão de Cahn-Ingold-Prelog. Assim, as atribuições de configuração E-Z para compostos como iminas e oximas segue as mesma regras com R ou H > par de elétron. [13]

Sistema com múltiplos centros estereogênicos
As moléculas podem ter vários centros estereogênicos, como por exemplo, para o (2R,3R)-2-3-dibromobutano. Para determinar a configuração absoluta, considera-se cada centro separadamente e cada centro é especificada como R e S. O grupamento contendo o segundo centro estereogênico é considerado como um substituinte[13].
Um composto que contém mais de um centro estereogênico, mas é sobreponível à sua imagem especular é chamado de composto meso.
Estereodescritores para moléculas cíclicas
O ácido 2,2-dimetilciclopropanocarboxílico (A) tem um centro quiral em C(1) e existe como um par de enantiômeros e seu estereoisomerismo não se difere de moléculas quirais acíclicas. O mesmo ocorre no ácido ciclopropano-1,2-dicarboxílico que tem três estereoisômeros: uma forma meso (B) e um par de enantiômeros (C, D) diastereoméricos com a forma meso [42].
Entretanto, uma característica adicional devido a rigidez da estrutura cíclica é que como substituintes podem estar no mesmo lado de uma ligação dupla ou mesmo oposto, o mesmo pode ocorrer em moléculas cíclicas [13], [42]. Como por exemplo, no diácido meso B, os grupos carboxila estão no mesmo lado do anel e nos enantiômeros C e D estão em lados opostos. Por isso, pode-se chamar de cis a forma meso e de trans os dois isômeros quirais [42].

Estereoisômeros também surgem quando dois anéis compartilham um vínculo comum. No isômero cis ambas os ramificações do anel fundido estão no mesmo lado e no isômero trans, estão em lados opostos. Como por exemplo, o composto formado pela junção de dois anéis do ciclohexano, a decalina, apresenta isomeria cis-trans; na cis-decalina, os dois átomos de hidrogênios, ligados aos átomos da cabeça de ponte, estão no mesmo lado do anel, enquanto que na trans-decalina, eles estão em lados opostos [13].
O Sistema de notação R-S de Cahn-Ingold-Prelog (CIP) pode ser naturalmente utilizada em compostos cíclicos [42], [43]. Compostos nos quais um centro de quiralidade faz parte de um anel são tratados de forma semelhante ao de moléculas acíclicas. Por exemplo, para determinar se a configuração do (+)-4-metilciclohexeno é R ou S, são tratados caminhos horário e anti-horário ao redor do anel como se eles fossem grupos independentes [43].

Com o grupo de classificação mais baixa (hidrogênio) direcionado para o lado contrário ao nosso, observamos que a precedência decrescente da regra de sequência é horária e por isso a configuração absoluta é R [43].
Aplicando o sistema CIP nas moléculas A, B, C e D tem-se que A é R, a forma meso B é 1R,2S (equivalente a 1S,2R), e os enantiômeros C e D são 1S,2S e 1R,2R, respectivamente.
O sistema CIP é sempre inequívoco, todavia quando se trata de diastereômeros a nomenclatura cis e trans é mais fácil de entender.
Infelizmente a nomenclatura cis-trans pode causar ambiguidade, como por exemplo, o composto A’ causaria dúvidas se deveria ser chamado de ácido cis ou trans-2-hidroxi-2-fenilciclopropanocarboxílico. Por isso, opta-se utilizar a regra em que o substituinte referência é marcado com o prefixo r- e as posições dos outros substituintes são denotados como cis (c-) ou trans (t-) em relação à ele. Assim, como o composto A’ é um ácido ciclopropanocarboxílico, o carbono no qual o grupo CO2H está ligado é o carbono de referência e o composto é chamado de ácido t-2-hidroxi-2-fenilciclopropano-r-1-carboxílico ou ácido t-2-hidroxi-2-fenil-r-1-ciclopropanocarboxílico (o símbolo c do grupo fenil foi omitido já que necessariamente seguiria esta posição devido o grupo hidroxi estar na posição trans). Deve-se observar que mesmo se o nome e a numeração for atribuída de forma incorreta a utilização do símbolo r- garante que a estereoquímica correta possa ser derivada de forma inequívoca a partir do nome dado.
O prefixo r também é muito útil quando se tem mais de dois centros estereogênicos no anel, como ocorre em B’. Pode haver confusão já que os substituintes cloro são trans em relação ao grupo carboxila, mas cis em relação um ao outro. No entanto, o nome de ácido t-2,t-3-diclorociclopropano-r-1-carboxílico é inequívoco, e neste caso o ponto de referência é o grupo ácido carboxílico e os dois substituintes cloro são trans em relação à ele.
No caso do isômero C’ para saber como os carbonos do anel serão numerados deve-se utilizar a regra em que o cis precede o trans de modo que o composto é chamado de ácido c-2,t-3-diclorociclopropano-r-1-carboxílico (ou ácido c-2,t-3-dicloro-r-1-ciclopropanocarboxílico.
Já o comporto D’ que não possui nenhum sufixo (tais como ácido carboxílico, carboxaldeído, -carbinol, ou –ol) em seu nome deve-se utilizar como carbono de referência aquele substituído com o grupo de prioridade mais elevada (CIP) que neste caso é o Br, com isso o nome correto é r-1-bromo-1-cloro-c-2-etil-2-metilciclopropano [42].

Quando não se sabe se um substituinte de um ciclo é cis ou trans em relação aos outros substituintes usa-se uma linha ondulada, e o símbolo utilizado para tal substituinte é ε (xi grego) em vez de c ou t.

Em um anel de quatro membros uma nova característica surge: o estereoisomerismo em ciclobutanos 1,2-dissubstituídos (A’’) é análogo aos dos ciclopropanos 1,2-dissubstituídos, mas os ciclobutanos 1,3-dissubstituídos apesar de existirem como diastereômeros cis (B”) e trans (C”), B” e C” são aquirais, onde C(1) e C(3) são estereogênicos mas não quirotópicos, eles não possuem centros quirais. Por isso, não deve-se chamar de formas meso de diastereômeros, na medida em que o conjunto não contém quaisquer isômeros quirais.

Entretanto, no caso de, por exemplo, 1,3-ciclobutanodiols os carbonos C(1) e C(3) podem ainda serem chamados de centros pseudo-assimétricos no sentido de que os dois – CH2CHOHCH2- ligados a cada um destes centros são enantiomórficos. Para atribuir descritores pseudo-assimétricos a C(1) e C(3) os segmentos C(2), C(3), C(4) e C(4), C(3), C(2) são separados do centro quiral das suas extremidades. Descritores de quiralidade auxiliares (marcados pelo sufixo zero) podem ser atribuídos a C(3) em dois segmentos, que são agora novos substituintes de C(1). Estes símbolos irão definir uma prioridade para os dois segmentos, e portanto permite atribuir descritor pseudo-assimétrico (r ou s) em C(1). [Os descritores suportam o sufixo n (novo) porque eles surgiram a partir de 1982 com a modificação do Sistema CIP]. O símbolo em C(1) para o isômero cis fica sn. O descritor em C(3) deve ser determinado de forma independente, mas uma vez que a molécula tem um eixo C2 em intercâmbio com C(1) e C(3) este deve ser o mesmo que em C(1). O isômero cis é portanto 1sn ,3sn. Já para o isômero trans ficaria 1rn,3rn [42].

Antes que se possa determinar descritores cis-trans de substituintes do anel, deve-se decidir se os substituintes estão no mesmo lado (cis) ou em lados opostos (trans). Nos ciclohexanos substituídos, em que o anel geralmente está na forma de cadeira existem alguns problemas. A relação trans em A* (diaxial 1,4-dissubstiuídos) é óbvia, mas a relação em B* (diequatorial 1,4-dissubstituídos) é menos óbvia.
Já no ciclohexano C* 1,2-diequatorial trans-dissubstituído o ângulo de torção é cerca de 60°, assim como no isômero cis-dissubstituído D*. Para determinar a relação trans em B* e C* pode-se focar nos átomos dos hidrogênios terciários (em vez dos substituintes x e y), ou pode-se dizer que os grupos são cis se ambos estiverem para cima (ou para baixo) e trans se um estiver para cima e o outro para baixo [42].

Estereodescritores Adicionais
Anti e Sin
Os isômeros com mais de um centro estereogênico também podem ser caracterizados como sin ou anti. Dois substituintes apontados na mesma direção (ou face) são chamados de sin, porém quando estão apontados em direções diferentes são chamados de anti.[13]

Erythro e Threo
Para compostos de cadeia aberta, os prefixos Erythro e Threo são aplicados a sistemas que contém dois carbonos estereogênicos, quando dois grupos substituintes são iguais e um terceiro é diferente[39].
O prefixo Erythro possui os grupos do mesmo lado quando desenhado na projeção de Fisher. Na estrutura Threo, os grupos estão em lados opostos. [41]
D e L
Essa nomenclatura é utilizada para caracterizar isômeros que apresentam atividade óptica.
Os prefixos D e L são derivados das palavras dextrógiro (do latim dexter, direito) e levógiro (do latim laevus, esquerda) respectivamente e, indicam para qual lado o isômero é capaz de desviar o plano da luz polarizada. [1]
Os descritores D e L pode ser utilizada para a denominação da posição dos substituintes nas projeções de Fisher. Nelas, os substituintes quando desenhados no lado esquerdo da linha vertical são chamados de L, enquanto os desenhados no lado direto são chamados de D.[13]
Alfa (α) e Beta (β)

Os termos α e β são utilizados para descrever a estereoquímica de esteroides e carboidratos. Uma molécula α é aquela em que a hidroxila se encontra abaixo do plano de projeção do sistema anular. [41]
Já o descritor β é aquele que apresenta uma hidroxila acima do plano de projeção do sistema anular. [39]
Endo e Exo
Os termos Endo e Exo são usualmente utilizados para nomear sistemas bicíclicos. O substituinte endo se orienta distanciando-se da ponte estrutural e, o substituinte exo se orienta aproximando-se da ponte.[40]

Faces Re e Si
Os descritores R e S são os mais utilizados para descrever a quiralidade dos átomos de carbono assimétricos. No caso de carbonos trigonais com hibridização sp2 – que não possuem centros quirais, mas são considerados centros pró-quirais se estão ligados a três diferentes átomos – pode-se distinguir entre as duas faces da molécula empregando-se o sistema de prioridade utilizado nos descritores R/S. [41] A face Re é aquela em que o sistema de prioridade gira no sentido horário e a face Si no sentido anti-horário.

Pró-quiralidade[44]
Heterotopicidade
Dois ou mais ligantes podem ser idênticos quando olhados separados (por exemplo, vários átomos de hidrogênio, os grupos metil, átomos de flúor, etc.). E sem dúvida ser efetivamente distintos devido à sua posição na molécula. Esses substituintes são denominados heterotópicos, ou seja, distintos pelo lugar que ocupam.
Um exemplo são os metilenos no 2-bromo-etanol, que são distintos para a posição que ocupam na molécula: um unido ao bromo e o outro unido à hidroxila; diz-se que esses grupos são heterotópicos por constituição.

Mais difícil de reconhecer são os ligantes que diferem por sua orientação no espaço dentro da molécula; estes são denominados ligantes estereoheterotópicos, e sua não equivalência estereoquímica é de suma importância, pois da lugar a diferenças notáveis em sua reatividade química e em seu comportamento espectroscópio.
Para decidir se os ligantes em questão são heterotópicos ou homotópicos se aplicam os critérios de substituição ou de simetria. Quando a substituição, primeiro de um e depois do outro, de dois (ou mais) ligantes dá lugar a produtos isoméricos, então tais ligantes não são homotópicos (equivalentes), mas sim, heterotópicos. Se esta não equivalência é de origem constitucional (como no caso do 2-bromo-etanol), então os ligantes ou grupos heterotópicos por constituição. Em contraste, os ligantes estereoheterotópicos podem ser enantiotópicos ou diastereotópicos dependendo se sua substituição, em separado, dá lugar a produtos enantioméricos ou estereoisoméricos.
Assim, os hidrogênios α no ácido propiônico 1a são enantiotópicos, visto que sua substituição por bromo produz ácidos enantioméricos (R)- ou (S)-α-bromo propiônicos. Por outro lado, os hidrogênios α no ácido 3-bromobutanoíco (2b) são diastereotópicos, pois sua substituição em separado os ácidos diastereoméricos eritro- ou treo-2,3-dibromobutanoíco.
1a. H1 e H2 enantiotópicos:
2b. H1 e H2 diastereotópicos:

Finalmente os dois hidrogênios no cloreto de metila (3c) são homotópicos, pois sua substituição conduz ao mesmo bromo diclorometano (esta molécula não possui estereoisômeros).
3c. H1 e H2 homotópicos:

As moléculas 1-3 também são úteis para demonstrar o critério de simetria. Assim, os ligantes que são trocados por rotação por um eixo de simetria (Cn) são indistinguíveis e, portanto, homotópicos. H 1 e H2 em 3 pode mudar-se mediante a um giro de 180˚ em torno do eixo de simetria C2. Da mesma maneira, os três hidrogênios do cloreto de metila são homotópicos, pois são intercambiáveis por meio da operação C3.

Os ligantes enantiotópicos não são intercambiáveis por rotação em torno de um eixo de simetria, mas sim, por reflexão em um plano de simetria (σ). A figura abaixo mostra tal plano em 1, que interconverte H1 e H2.

Em contraste, os ligantes diastereotópicos não se intercambiam mediante a alguma operação de simetria.

Centros Pró-quirais[13]
Centros pró-quirais tem dois ligantes idênticos, tais como dois hidrogênios, e são aquirais. Em muitas situações, no entanto, estes ligantes idênticos são topologicamente heterotópicos. Se qualquer um dos grupos idênticos é substituído por um ligando diferente, um centro estereogênico é criado. As duas posições são chamados enantiotópicas. A posição, que se atribuída uma prioridade mais elevada, dá uma configuração R é chamado pro-R. A posição, que se atribuída uma prioridade mais elevada, proporciona uma configuração S é chamado pro-S. Propano-1,3-diol é um exemplo de uma molécula pró-quiral. O C (1) e C (3) As posições são pró-quirais, mas a C (2) não é, por causa dos seus dois ligantes hidroximetil são idênticos.
O grupamento carbonila substituídos assimetricamente são centros pró-quirais, uma vez que a adição de um quarto ligante gera um centro estereogênico. Estes são designados por determinar a ordem de prioridade de Cahn-Ingold-Prelog. O grupo carbonila é dito que tem uma face re e uma face si.
Reagentes aquirais não fazem distinção entre as duas faces, mas reagentes quirais distinguem e há formação de quantidades desiguais de produtos enantioméricos. Outros centros trigonais, incluindo ligações duplas carbono-carbono, apresentam duas faces pró-quirais. Por exemplo, E- e Z - ácido-butenodióíco (ácido maleico e fumárico) geraram diferentes estereoisômeros quando submetido a syn-di-hidroxilação. Se o reagente utilizado é quiral, o isômero irá gerar quantidades diferentes de R, R e produtos S, S. As formas S, R e R,S geradas a partir do isômero Z são formas meso e vão ser aquirais, mesmo se elas são formadas utilizando um reagente quiral.
O conceito de centros heterotópicos pode ser estendido para grupos diastereotópicos. Se um dos dois ligantes equivalentes numa molécula é substituído por um grupo de teste, os ligantes são diastereotópicos quando as moléculas resultantes são diasteroisômeros. Da mesma forma, se uma transformação em faces opostas de um centro trigonal gera dois diastereoisômeros diferentes, as faces são diasterotópicas. Há uma diferença importante entre centros enantiotópicos e centros diastereotópicos. Dois ligantes idênticos em centros enantiotópicos estão em ambientes quimicamente equivalentes. Eles respondem de forma idêntica às sondas, incluindo reagentes químicos, que são aquirais. Eles respondem diferentemente às sondas quirais, incluindo reagentes quirais. Centros diastereotópicos são topologicamente não equivalentes. Isto é, os seus ambientes na molécula são diferentes e que respondem de forma diferente a aquiral, bem como para as sondas e reagentes quirais. Como uma consequência disto, prótons diastereotópicos, por exemplo, possui diferentes desvios químicos e são distinguíveis em espectros de RMN. Prótons enantiotópicos não mostram sinais de RMN separadas. Dois protões diastereotópicos dão origem a um padrão mais complexo
de RMN. Devido à sua diferença de desvio químico, que mostra um acoplamento geminado. Um exemplo deste efeito pode ser observado nos espectros de RMN de próton de 1-fenil-2-butanol.
A C(1) grupo CH2 aparece como um multipleto perto de 2,8 ppm com acoplamento adicional para a C (2) de próton. O C (1) átomos de hidrogênio são diastereotópicos. Os C (3) hidrogênios são também diastereotópicos, mas a sua não-identidade não é óbvio no multipleto a cerca de 1,6 ppm. Como as reações biológicas envolvem enzimas quirais, grupos enantiotópicos e faces tipicamente mostram reatividade diferente. Por exemplo, os dois hidrogênios do metileno em etanol são enantiotópicos. As enzimas que oxidam o etanol, chamados álcool desidrogenases, removem seletivamente o hidrogênio pró-R. Isto pode ser demonstrado utilizando um análogo deuterado de etanol na reação.
Quiralidade
A propriedade de não superponibilidade de um objeto com a sua imagem especular é chamada de quiralidade. Uma molécula é quiral se ela não é superponível em sua imagem especular, por outro lado, se ela é superponível em sua imagem especular ela é chamada de aquiral [45].
Se um átomo de carbono contêm quatro grupos diferentes ligados a ele, este não terá um plano de simetria e deverá ser quiral (centro estereogênico) e a molécula que não apresenta este plano de simetria é dita ser aquiral [3].
A relação entre quiralidade e atividade óptica é absoluta e em cada caso de atividade óptica de um composto puro existem dois e somente dois isômeros, chamados enantiômeros, os quais diferem em sua estrutura somente a lateralidade esquerda e direita de suas orientações. Os enantiômeros possuem propriedades físicas e químicas idênticas exceto em dois importantes aspectos: [5]
- Eles rotacionam a luz do plano polarizada em direções opostas, embora em quantidades iguais. O isômero que rotaciona o plano para a esquerda (sentido anti-horário) é chamado de isômero levo-rotatório e é designado (-) enquanto o que rotaciona o plano para a direita (sentido horário) é chamado de isômero dextro-rotatório e é designado (+). Pelo fato de diferirem nesta propriedade eles são frequentemente chamados de antípodas ópticos.
- Eles reagem a taxas diferentes com outros compostos quirais. Estas taxas podem diferir de maneira irrelevante ou de maneira relevante como no caso em que um enantiômero participa com uma velocidade conveniente da reação e o outro não reage completamente. Por esta razão muitos compostos são biologicamente ativos enquanto os seus enantiômeros não são. Os enântiômeros reagem com mesma taxa com moléculas aquirais.
O ácido láctico (CH3C*HOHCO2H) serve como um dos primeiros exemplos conhecidos de um composto que possui um átomo de carbono quiral (o carbono com asterisco indica onde a quiralidade está localizada). Enquanto o ácido láctico produzido a partir da fermentação do leite estragado é levo-rotatório (-) o ácido láctico produzido a partir do exercício muscular é dextro-rotatório (+). A síntese orgânica do ácido láctico tipicamente resulta em uma mistura racêmica (50:50) de ambos os enantiômeros [(±)-ácido láctico]. As formas levo-rotatório e dextro-rotatório do ácido láctico são ditos serem imagens especulares um do outro [46].

Conforme o número de átomos de carbono com assimetria (quiralidade) aumenta na molécula o número de possibilidades de isômeros ópticos também aumenta. Por exemplo, quando temos um composto que apresenta dois átomos de carbono quiral, quatro possibilidades de configuração absoluta são possíveis (a regra geral para determinar o número máximo de estereoisômeros é 2n, onde n é o número de carbonos quiral). Eles são compostos por dois pares de enantiômeros [47].
A mistura de quantidades iguais dos enantiômeros é chamada de mistura racêmica. Este princípio é muito importante e devemos nos lembrar que uma reação em que temos os materiais de partida aquirais os seus produtos quirais formará uma mistura racêmica dos dois enantiômeros [48].


Quiralidade x bioatividade
A maioria dos químicos está familiarizada com o papel da quiralidade em odorantes, tais como (4S) - (+) - carvona, que tem um odor distinto de alcarávia, em comparação com o (4R) - (-) - carvona, que tem um odor característico de hortelã doce. Estes dois odorantes possuem diferentes odores devido ao papel de quiralidade na bioatividade e embora o papel de quiralidade na percepção do odor seja uma área moderna e pouco estudada, deve se notar que mais de 285 pares de enantiômeros (570 enantiômeros) são conhecidos por apresentar odor ou intensidades diferentes de odor. [49].
Na área dos herbicidas que possuem centro estereogênico quiral temos como um exemplo o enantiômero (R)-(+) do herbicida diclorprop-p (bem como o enantiômero (R)-(+) de todos os herbicidas do ácido fenoxipropionico) que é o enantiômero ativo responsável por eliminar as ervas daninhas, enquanto que o enantiômero (S)-(-) é inativo como herbicida [50].
A questão da quiralidade também é muito importante na comunicação entre os insetos. Esta se dá geralmente através de susbtâncias voláteis exaladas na atmosfera, que são reconhecidas somente por indivíduos da mesma espécie. Estas substâncias são chamadas de feromônios. Diversos feromônios apresentam centros quirais em suas estruturas e frequentemente apenas um dos enantiômeros é o responsável pela comunicação entre os insetos, embora possa ocorrer eventualmente que pares de enantiômeros sejam igualmente ativos ou que misturas de enantiômeros sejam mais ativas que os mesmos individualmente.
As razões deste reconhecimento molecular estão relacionadas às interações supramoleculares entre o xenobiótico e os receptores biológicos. Estas interações têm a sua origem em forças de Van der Waals, interações dipolo-dipolo, interações eletrônicas e pontes de hidrogênio. Dificilmente um par de enantiômeros estabelecerá com um determinado bioreceptor um mesmo número de interações [51].
Quiralidade em moléculas desprovidas de centros quirais ou estereogênicos
Para uma molécula apresentar quiralidade não é necessário que ela apresente um centro quiral ou estereogênico. Alguns tipos de moléculas como alenos, cumulenos, alquilidenocicloalcanos, espiranos, os chamados atropoisômeros, helicenos e ciclofanos são ditos possuir um “eixo quiral” e não necessariamente um centro quiral. Se esticarmos um tetraedro (que corresponde ao carbono sp3) pelos vértices (a e b com a mão esquerda, c e d com a mão direita) para obtermos a figura alongada mostrada para o caso do aleno. A reta ao longo da qual esticamos o tetraedro (a mesma reta que une os dois carbonos sp2 e o carbono sp do aleno) é o que chamamos de eixo de quiralidade. Uma condição necessária para a quiralidade é que a # b e c # d. Assim, mesmo quando a = c e/ ou d = b, a estrutura mantém a quiralidade, por exemplo, em abC=C=Cab [42].

Para especificar o senso de quiralidade de uma molécula possuindo um eixo quiral uma sequência adicional é necessária: grupos próximos antecedem grupos distantes. Isto significa que os dois substituintes do extremo mais próximo do eixo têm total prioridade sobre os dois substituintes do extremo mais distante. Assim ao observarmos as estruturas abaixo (exceto a bifenila) a partir do extremo da esquerda e depois fazendo o contrário (na frente, o extremo da direita) notamos que a configuração R ou S não depende de quais extremos escolhemos para ser colocado na frente. No caso da bifenila (atropisômero) o eixo de quiralidade também está presente, é importante notar que os substituintes do anel são explorados de centro para fora, independente da regra citada anteriormente. Então, no anel direito da bifenila a sequência é C-OCH3 > C-H [52].


Moléculas com eixos quirais podem alternativamente serem vistos como hélices e a suas configurações podem ser denotadas como P ou M, de maneira similar a dos isômeros conformacionais. Para esta designação somente os ligantes com alta prioridade na frente e atrás do plano são considerados. Se transformarmos a prioridade do ligante 1 que está na frente para a prioridade traseira do ligante 3 temos o sentido horário, a configuração é P, se for no sentido anti-horário temos a configuração M. Das quatro estruturas apresentadas abaixo, três são aR (nomenclatura para eixo quiral) ou M (nomenclatura para hélice); o espirano é aS ou P. (A corresepondência de aR com M e de aS com P é geral) [53].

Consequências químicas de efeitos estereoquímicos
Princípio de Curtin-Hammett
Introdução
Uma vez que isômeros possuem estabilidade e reatividades distintas, fica claro que um equilíbrio conformacional, ou entre estereoisômeros, possui grande impacto no estudo da cinética do sistema. Entretanto, a interconversão entre confôrmeros e mesmo a transformação de um estereoisômero em outro se dão de forma muito rápida e é impossível isolar e estudar a cinética de cada composto separadamente.
O princípio de Curtin-Hammett, ou em uma forma mais abrangente, o princípio de Winstein-Holness-Curtin-Hammett, permite uma compreensão de como o equilíbrio entre isômeros afeta a cinética do sistema. Há duas abordagens de compreender o efeito da interconversão de isômeros na reatividade do sistema: um baseado na taxa de produção total resultante da soma das conversões de cada reagente; e a outra que consiste na análise da razão entre as taxas de produção. [54]
A primeira abordagem resulta na chamada equação de Winstein-Holness e a segunda no princípio de Curtin-Hammett propriamente dito. Ambas se valem da mesma aproximação: o equilibrio entre os isômeros é muito mais rápido que as reações de cada isômero, ou seja, para a equação química abaixo:
Vale:
Essa aproximação também é conhecida como condições de Curtin-Hammett (ou de Winstein-Holness). A partir dela, sabe-se que a constante de equilíbrio e, por conseguinte, a razão das concentrações dos isômeros serão constantes durante toda a reação.
Equação de Winstein-Holness
Por simplicidade, assume-se cinética de primeira ou pseudo-primeira ordem.
O objetivo é reescrever a fórmula a seguir em termos de uma grandeza observável . Isso pode ser feito a partir da seguinte igualdade:
Onde é a fração molar do isômero no sistema. Essa equação pode ser extendida para um número qualquer de isômeros em equilíbrio:
.
Onde é a constante de reação do isômero para um produto genérico (Note que os produtos devem ser peculiares a cada isômero e não pode haver equilíbrio ou interconversão entre os compostos produzidos).
Assim, pode-se amarrar todas as reatividades, particulares a cada isômero, em uma única variável observável. Ou seja, medindo-se as concentrações de reagentes e produtos com o tempo posso obter .
Note que:
Como
Historicamente, essa última equação foi utilizada para obter informações de equilíbrio entre os isômeros a partir de informações cinéticas, enquanto os métodos mais sofisticados para estudar esse equilíbrio ainda não tinham sido desenvolvidos. Entretanto, essa metodologia dependia do design de compostos que mimetizassem os isômeros de interesse e que não se interconvertessem (por exemplo, introdução de grupo terc-butila em ciclohexanos). Todavia, muitas vezes esses compostos não representavam bons modelos cinéticos para as moléculas originais o que fez com que essa equação caísse em desuso. Entretanto a falha da metodologia não está na equação, uma vez que ela possui consistência matemática, dada as aproximações, mas sim nos modelos cinéticos.
Princípio de Curtin-Hammett
O enunciado original do princípio (em tradução livre): [55]
"As quantidades relativas de produtos formados a partir de duas conformações , em equilíbrio, são completamente independentes da população relativa das conformações da qual originaram. Dependem somente da diferença de energia livre dos estados de transição. Isso se as taxas de reação forem mais lentas que a interconversão entre os isômeros"
Desta vez, ao invés de analisar a soma das taxas de produção, foca-se na razão entre elas. Novamente, evoca-se a hipótese de maior rapidez do equilíbrio da interconversão frente às reações de produção. Por simplicidade, assume-se cinética de primeira ou pseudo-primeira ordem.
Uma vez que: (veja regras de derivadas parciais)
E pela regra da Cadeia:
Novamente, pela hipótese de rápido equilíbrio, e serão invariávis durante o progresso da reação. Então,
A fórmula acima pode representar uma contradição com o enunciado original do princípio, uma vez que ela demonstra que a razão das concentrações de produto depende diretamente da constante de equilíbrio. Entretanto, Curtin elaborou o princípio com o objetivo de expor o fato de que não seria possível afirmar que o produto mais abundante proviria do isômero mais estável. Tendo em vista a confusão gerada, um novo enunciado foi proposto na literatura[56] (em tradução livre):
"Em uma reação química, onde dois produtos distintos, oriundos cada um de um isômero diferente, e dado que a interconversão entre os isômeros é mais rápida que as reações de formação de produto ( e que os mesmos não se interconvertam), a quantidade relativa de produtos não depende somente das proporções relativas dos isômeros em equilíbrio."
No entanto, se considerarmos válida a teoria do estado de transição de Eyring-Polanyi, uma vez que:
Onde, é a constante de Boltzmann, é a constante de Planck, é a temperatura do sistema e é a energia livre de Gibbs de ativação da reação, definida como:
, onde é a energia livre de Gibbs do estado de transição da reação.
Lembrando que: , onde , então:
Recuperando-se, então, o princípio enunciado em sua forma original. Ou seja, a razão entre as concentrações dos produtos pode, dadas as condições de rápida interconversão e validade da teoria de estado de transição de Eyring-Polanyi, ser descrita pela diferença de energia livre de Gibbs dos estados de transição da reação peculiar a cada isômero.
Sendo assim, é possível que o produto da conformação menos estável seja o mais abundante se sua reação apresenta um estado de transição mais estável que o da reação de seu isômero. Mesmo quando a teoria de estado de transição citada não se aplica, é possível que o isômero menos estável renda o produto mais abundante, entretanto não bastará apenas ver a diferença de energia livre dos estados de transição. Por exemplo, dado que:
Supondo que o isômero é o mais estável e sua concentração ser duas vezes maior, então: . Para o produto do outro isômero ser o mais abundante bastaria que:
Ou seja, para o produto ser mais abundante que o outro bastaria que sua produção fosse duas vezes mais rápida que a outra.
Quando a teoria de estado de transição é válida, pode-se considerar um caso interessante. Quando a diferença de energia livre dos estados de transição é equivalente à diferença de energia livre entre os isômeros, tem-se que a população relativa de produtos é a mesma dos isômeros uma vez que:
Note que isso não é uma violação das condições de Curtin-Hammett uma vez que a igualdade feita foi e não .
No limite de , recupera-se o fato do produto mais abundante advir da rota de maior velocidade ou de estado de transição de menor energia.
Se considerarmos que a razão entre as constantes de reação possa ser descrita por uma correlação como a de Hammett[57]:
Assim, pode-se utilizar os gráficos de Hammett para se obter informações sobre a constante de equilíbrio a partir da medição da razão entre as quantidades de produtos das cinéticas dos compostos com substituintes distintos.
Por fim, verificou-se um limite empírico para a validade do princípio de Curtin-Hammett[58] :
Abordagem híbrida C-H/W-H
É possível integrar os dois equacionamentos (de Curtin-Hammett e de Winstein-Holness) e obter equações para as constantes de reação individuais de cada isômero em termos de grandezas mensuráveis. O par de equações obtidos será [59]:
Onde , e a razão entre as concentrações de produtos são todas possíveis de serem obtidas experimentalmente.
Exemplos de aplicação do princípio de Curtin-Hammett
Caso 1: Isômero mais estável reagindo mais rapidamente
Um exemplo dessa situação é a reação de oxidação de piperidina:

Nesse exemplo, . Aplicando a teoria do estado de transição de Eyring-Pulanyi, o diagrama de energia livre para essa reação seria:

Caso 2: Isômero menos estável reagindo mais rapidamente
Um exemplo dessa situação é a reação de aquilação de tropanos:

Nesse exemplo, . (Note que seria preciso uma marcação isotópica nos reagentes para distinguir os produtos.) Aplicando a teoria do estado de transição de Eyring-Pulanyi, o diagrama de energia livre para essa reação seria:

Caso 3: isômeros reagindo com a mesma velocidade
Um exemplo seria a reação substituição nucleofílica bimolecular () de isótopo de iodo com iodo-ciclohexano, pois os estados de transição de cada reação seriam equivalentes. Entretanto, os produtos estariam em equilíbrio conformacional. Aplicando a teoria do estado de transição de Eyring-Pulanyi, o diagrama de energia livre para essa reação seria:

Estudo de reações dependentes de efeito estereoeletrônicos
Introdução
A química orgânica fez um importante avanço no entendimento da reatividade química quando ela percebeu a importância da estabilização eletrônica causada pela deslocalização do par de elétrons (ligante e não ligante) nas moléculas orgânicas. Este conceito conduziu ao desenvolvimento da teoria de ressonância para moléculas conjugadas e tem fornecido uma maneira racional para entender a reatividade química (Ingold, 1969). O desenvolvimento da teoria eletrônica da química orgânica combinou a teoria original de Robinson com os desenvolvimentos da teoria conformacional de Barton, que conduziram a teoria estereoletrônica da química orgânica (Deslongchamps, 1983).
Atualmente, evidencias experimentais mostram que esse tipo de interação eletrônica ocorre quando os pares de elétrons estão devidamente orientados no espaço. Muitos resultados indicam que a reatividade da maioria dos tipos de moléculas orgânicas dependem da relativa estereoquímica dos pares de elétrons, ligantes ou não ligantes. É através da consideração do conceito de efeitos estereoeletrônicos que se torna possível adquirir o conhecimento da estereoquímica do estado de transição da maioria das reações orgânicas. Os efeitos estereoletrônicos, que são os efeitos que surgem quando um arranjo espacial de elétrons, orbitais ou ligações é mais estável que outro, contribuem para a orientação do produto a serem formados em uma determinada reação (kirby, 1996).
Em uma molécula, os efeitos estereoeletrônicos conduzem geralmente a uma conformação de mais baixa energia possível que é aquela onde o arranjo espacial da molécula tem a menor repulsão possível dos pares de elétrons ligantes e não ligantes. Isso faz com que tenhamos uma diferenciação entre vários estados de transição que leva a uma maior seletividade de uma reação orgânica em relação aos possíveis produtos que podem ser formados (Deslongchamps, 1983).
De uma maneira geral, os químicos tentam fazer sínteses (reações) orgânicas que formem predominantemente um único produto ou um produto principal em maior proporção, pois uma mistura de produtos pode acarretar na utilização de difíceis métodos de separação desses a fim de purifica-los. Chamam-se reações seletivas, aquelas que formam um produto exclusivamente, ou um produto preferencial em maior proporção. Reação quimiosseletiva é aquela que ocorre preferencialmente ou exclusivamente a um grupo funcional dentre vários outros em uma molécula. A reação que dá preferencialmente um dos vários estereoisômeros possíveis é referida como sendo uma reação moderadamente ou altamente estéreo-seletiva. Quando esses estereoisomeros possíveis de se formarem são diastereoisomeros, temos uma reação diastereoseletiva e a ocorrência de diastereo-seletividade. Quando os estereoisômeros são enantiômeros, temos uma reação enantio-seletiva, ou enantioseletividade.
Aspectos estereoquímicos da reação de adição nucleofílica
Exceto pelo formaldeído, as faces do grupo carbonila em aldeídos são proquirais. Nas cetonas, a proquiralidade acontece quando os dois substituintes ligados ao carbono carbonílico são diferentes. Se essas condições forem satisfeitas e não houver quiralidade presente nos substituintes R¹ e R², o grupo carbonila é enantiotópico, ou seja, numa reação de adição de um nucleófilo aquiral, uma mistura equimolar de enantiômeros se forma desde que a espécie nucleofílica seja diferente dos substituintes já ligados ao carbono carbonílico (ver esquema abaixo).[60]

Quando a adição é cineticamente controlada (não ocorre a reação de retroadição nucleofílica), a formação da mistura racêmica de enantiômeros é resultado da natureza enantiomérica de seus estados de transição. Estruturas enantioméricas possuem energias iguais em meio aquiral, e estados de transição de mesma energia produzem reações de igual velocidade. Se o controle da reação é termodinâmico (sob condições de equilíbrio), a mistura racêmica se forma como decorrência da relação enantiomérica dos produtos, que possuem a mesma energia em meio aquiral. A menos que haja intervenção de uma espécie quiral nesse processo que possa transferir a sua quiralidade ao centro proquiral, os produtos serão formados como mistura racêmica.
Faces proquirais enantiotópicas podem fornecer produtos de adição nos quais um enantiômero predomina sobre o outro. Esse tipo de transformação enantioseletiva é representativa de uma reação assimétrica e ocorre com frequência na natureza.[60]
Da mesma forma, iminas podem apresentar faces enantiotópicas sempre que dois substituintes diferentes estiverem ligados ao carbono da ligação C=N, levando à formação de um par de enantiômeros quando reagem com nucleófilos aquirais.[60]
Entretanto, nas nitrilas não há, sob qualquer hipótese, proquiralidade, pois a reação de adição nucleofílica conduz a um produto no qual o carbono está hibridizado sp².[60]
Por outro lado, o grupo carbonila pode estar inserido em um ambiente quiral, devido à presença de centros assimétricos em outros sítios da molécula. Nesse caso, suas faces são diastereotópicas, ou seja, a reação de adição de um nucleófilo aquiral gera uma mistura de diastereoisômeros, e tanto os estados de transição quanto os produtos são diasteroisoméricos. A não ser por coincidência, os diastereoisômeros são obtidos em quantidades diferentes, tanto em condições cinéticas quanto termodinâmicas (ver esquema abaixo).[60]

O excesso diastereoisomérico (ed = % de produto majoritário - % de produto minoritário) da reação é uma medida do predomínio de um diastereoisômero sobre o outro. Por exemplo, se uma mistura de diastereoisômeros é formada na proporção 90/10, o ed é igual a 80%. Como os diastereoisômeros apresentam propriedades físicas e espectroscópicas diferentes, a medida do ed é comumente feita por ressonância magnética nuclear ou por métodos cromatográficos.[60]
Síntese de acetais
Uma função acetal pode adotar nove conformações diferentes conforme figura abaixo. Confôrmeros A, B e D são imagens espelho dos conformeros A`, B`e D`respectivamente. Os conformeros C, E e F possuem um plano de simetria. Consequentemente a função acetal pode existir em seis diferentes conformações A-F. Evidenciais experimentais mostram a relativa estabilidade dessas várias conformações de acordo com os efeitos estereoeletrônicos e interações estéricas padrão.
Efeitos estereoeletronicos influenciam a configuração e conformação de aceitais a muito tempo, particularmente em carboidratos onde esses efeitos foram descobertos primeiramente e discutidos em termos de efeitos anomérico e exo-anomérico. O termo efeito anomérico, introduzido por Lemieux, refere-se a tendência de um grupo alcoxi (O – R) de um anel piranose assumir a posição axial em vez da equatorial apesar da não favorável interação estérica, entretanto o termo efeito exo-anomérico diz respeito a orientação preferida da ligação O – R do grupo alcoxi no centro anomérico.
Em relação ao efeito anomérico, há duas considerações diferentes feitas para explicação do mesmo. Alguns autores consideram este efeito eletrônico como desestabilizador devido a repulsão dipolo-dipolo ou interações elétrons par a qual pode ser representada na estrutura abaixo. Outros autores consideram o efeito anomérico como um efeito de estabilização eletrônica o qual ocorre quando um elétron par de um átomo de oxigênio está orientado antiperiplanar em relação a uma ligação polar C – X (X= OR, NR2 ou halogênio). A estabilização do par de elétrons poderá então ter ganhos pela transferência parcial do par de elétron de um heteroátomo para outro átomo eletronegativo. Essa transferência está representada na estrutura abaixo.
Na prática isso faz pouca diferença o fato de alguns autores acreditarem que efeito anomérico é desestabilizante ou estabilizante pois ambos acabam chegando na mesma conclusão em relação a estabilidade dos conformeros ou isômeros. Em resumo, para uma molécula que pode ter duas conformações diferentes (estruturas 1 e 2), se você considerar que o efeito anomérico é de estabilização por ressonância, isto indica que a estrutura 2 é mais estável que a 1 porque possui efeito de estabilização anomérica. Caso contrário, se considerar que o efeito anomérico é desestabilizante irá concluir que a estrutura 2 é mais estável que a 1 porque a estrutura 1 possui efeito anomérico de desestabilização (repulsão).
É possível e provável que ambos os efeitos estejam ocorrendo na função acetal. Em outras palavras, a estrutura 2 poderá ser mais estável que a estrutura 1 porque a estrutura 2 tem relativa estabilidade maior em relação a 1 por transferência parcial de elétrons e a estrutura 1 tem relativa desestabilidade em relação a estrutura 2 por conta da repulsão eletrônica dos pares não ligantes dos oxigênios. Desse modo,de uma maneira geral, a síntese de um acetal que possa ter conformação final resultante a estrutura 1 ou 2, terá como produto principal a estrutura 2.
Síntese de ésteres
No caso dos ésteres, foram propostos dois tipos de efeito estereoeletrônico. A função e a relativa importância desses dois tipos de efeito estereoeletronicos pode ser entendida pela análise em relação a geometria e a relativa estabilidade das duas formas, Z (cis) e E (trans) da função éster na figura abaixo.

Como já é conhecido, os ésteres são planares, e a forma cis é mais estável que a trans. O efeito eletrônico primário consiste da deslocalização do par de elétrons entre o oxigênio do éter e o grupo carbonil da função éster por ressonância. No caso da forma cis é possível haver uma estabilização adicional em relação a forma trans onde um par de elétrons não ligantes do oxigênio doa por ressonância para o orbital σ* da carbonila. No caso da forma trans essa estabilização não é possível. Outro efeito eletrônico secundário na função éster é o efeito anomérico como no caso dos acetais. A única diferença é que no éster a hibridização do carbono é sp2, trigonal, já nos acetais é tetraédrica sp3
O oxigênio da carbonila em ambas as configurações do estes, Z (cis) ou E(trans) tem um par de elétrons orientado antiperiplanar com a ligação C – OR, e uma interação n – σ* poderá existir porque o par de elétrons do orbital pode overlap com o orbital antiligante σ* da ligação C – OR. Em outras palavras, este efeito eletrônico secundário (efeito anomérico) pode dar uma característica de “tripla ligação” conforme ilustrado na figura abaixo para o grupo carbonil (O=C-OR).

Na forma Z, existe a possibilidade de outro efeito secundário porque nessa forma o oxigênio do éter tem um par de elétrons o qual está orientado antiperiplanar a ligação σ C – O do grupo carbonil, conforme figura abaixo. Este par de elétron pode overlap com o orbital antiligante σ* da ligação.

Desse modo, percebe-se que no éster de conformação Z, em adição ao efeito primário, existem dois efeitos eletrônicos secundários que faz com que o a forma Z seja mais estável que a forma E. Isso faz com que de um modo geral, a síntese de ésteres tenha como produto principal a conformação Z.
Exemplo de Efeito estereoletrônico na competição E2/Sn2
Os compostos (4-terc-butilciclohexil) trimetil-amonio iodeto e terc-butoxi de potássio (KOtBu) podem submeter-se tanto a reações E2 quanto a reação Sn2. No entanto a reatividade e a quimioseletividade variam consideravelmente em função da configuração cis ou trans do substrato derivado de ciclohexano. O isômero cis reage tanto por E2 quanto por Sn2 dando uma mistura de 90:10 em uma reação rápida. Já o isomêro trans reage muito mais lentamente dando somente o produto de substituição. De acordo com a equação da figura abaixo, essas descobertas significam que KE2, cis : KSn2, cis = 90:10 e KE2,trans : KSn2, trans < 1:99. Uma hipótese plausível é que para a respectivas reações de substituição KSn2, cis ~ KSn2, trans. Isto por sua vez, significa que a quimioseletividade oposta de duas reações na figura abaixo surgem quase exclusivamente do fato KE2,cis >> KE2, trans.

Essa graduação dos valores de KE2 se torna facilmente compreendida observando a figura abaixo e percebendo o seguinte: no estado de transição mais estável de uma eliminação E2 a quebra da ligação αC...H e a quebra da ligação βC....H são orientadas paralelo. Isto ocorre porque a hibridização do αC e βC muda de sp3 para sp2 no estado de transição. Como resultado, orbitais atômicos 2pz estão sendo formados como αC e αC e eles aumentam efetivamente a estabilidade do overlap da ligação π. Em outras palavras, ligações coplanares αC...H e βC....H estabilizam o estado de transição de uma reação de eliminação E2 através de uma interação π.

Interações desse tipo são possíveis no estado de transição mais estável de eliminações-syn. Quando o substrato pode assumir ambas as geometrias no estado de transição, a anti-eliminação é sempre preferida. Isto é consequência do baixo impedimento estérico do estado anti-transição, no qual substituintes do αC vs. βC estão quase parecidos. O estado de transição syn mais impedido estericamente tem uma estrutura quase eclipsada. Adicionalmente existem razões para acreditar que o overlap é melhor no estado de transição de uma anti-eliminação.
Síntese estereosseletiva
Introdução
Atualmente uma série de compostos oticamente ativos são produzidos juntamente com os seus enantiômeros indesejados. O isolamento do enantiômero de interesse, em boa parte dos casos, é feita através da resolução do racemato levando a ao descarte de metade do produto reacional e, conseqüentemente, a uma alta ineficiência do processo sintético. Assim, a síntese estereosseletiva é uma ferramenta poderosa para atingir a produção eficiente de um composto oticamente ativo já que através dela é possível a eliminação do anti-pode indesejado nos estágios iniciais da reação. Assim, nas reações estereosseletivas, substrato e reagente se combinam para formar um estado de transição diastereométrico de modo a ocorrer a conversão de um reagente aquiral a um produto quiral em um ambiente quiral.
Estratégias empregadas em síntese estereosseletiva
Caso 1: abordagem quiral
Compostos quirais que se encontram na natureza, como açúcares ou aminoácidos, podem ser utilizados como excelentes materiais de partida. Entretanto, a sua aplicação em síntese estereosseletiva é condicionada a uma fácil disponibilidade e a uma alta pureza enantiomérica. As sínteses da exo-brevicomina e da negamicina ilustram bem a aplicação de compostos quirais naturais neste tipo de abordagem.
A 6,8-dioxaliciclo[3.2.1]octano ou (+)-exo-brevicomina (A) é um feromônio do besouro ocidental de pinho e é sintetizada a partir de glicose (B) utilizando o processo de retro síntese descrito na figura abaixo[61].

Negamicina (C), um antibiótico de alta aplicabilidade que é produzido naturalmente pela Streptomyces purpeofuscus, também já foi sintetizado a partir de glicose (B) como demonstrado na figura abaixo[62].

Caso 2: Abordagem distereosseletiva acíclica
A princípio, a síntese estereosseletiva envolve formação de uma nova unidade estereogênica no substrato sob a influência de um grupo quiral originário de um produto natural quiral. Este método pode ser dividido em quatro classes majoritárias, as quais dependem de como essa influência é exercida: (1) métodos controlados pelo substrato; (2) métodos controlados por um auxiliar; (3) métodos controlados por reagente; (4) métodos controlados por catalisador[63].

O método de controle por substrato é também chamado de primeira geração da síntese assimétrica. Esta metodologia é baseada no contato intramolecular com a unidade estereogênica que já existe no substrato quiral. A formação de uma nova unidade estereogênica muito frequentemente ocorre pela reação do substrato com um reagente aquiral em um sítio diastereotópico controlado por uma unidade estereogênica próxima. A reação controlada por auxiliar é referida como a segunda geração da síntese assimétrica. Esta abordagem é similar a primeira geração na qual o controle assimétrico é alcançado intramolecularmente por um grupo quiral no substrato. A diferença se faz no grupo direcionador, o “auxiliar quiral”, o qual é deliberadamente ligado ao substrato original quiral visando direcionar a reação enantioseletiva. O auxiliar quiral será removido uma vez que a transformação enantiosseletiva esteja completa. Embora métodos de segunda geração se mostrarem aplicáveis, a necessidade de duas etapas adicionais, que são a ligação e a remoção do auxiliar quiral, é leva a uma considerável ineficiência do processo. Na terceira geração, o substrato aquiral é diretamente convertido ao produto quiral usando um reagente quiral. Em contraste com métodos de primeira e segunda geração, o controle estérico é conduzido no âmbito intermolecular. Nas três transformações quirais mencionadas previamente, quantidades estequiométricas de compostos puros são necessárias.
Nos últimos anos vêm sendo desenvolvidos métodos sofisticados que combinam elementos dos métodos de primeira, segunda e terceira geração e envolvem a reação de substratos quirais com reagentes quirais, criando quarta e quinta gerações (4 e 5).

Estes métodos se mostram promissores em reações nas quais duas novas unidades estereogênicas são formadas estereosseletivamente em uma única etapa.O mais significativo avanço na sintese estereosseletiva nas três últimas décadas foi a aplicação de catalisadores quirais para induzir a conversão de substratos quirais a produtos quirais. Numa catálise acelerada por ligante, a adição de um ligante aumenta a velocidade de reação de uma transformação catalítica que já está em andamento. Tanto a aceleração por ligante o processo catalítico básico atuam simultaneamente e são complementares entre si. A vantagem da sintese estereosseletiva catalítica advém da necessidade de pequenas quantidades de catalisadores quirais para a produção de grandes quantidades de produtos quirais.
Caso 3: Dupla diastereosseleção e dupla indução assimétrica
Em reações diastereosseletivas, a indução assimétrica permanece a mesma se o substrato for enantiomericamente puro (homoquiral) ou o racemato provido do reagente é aquiral[64]. A situação é, entretanto, diferente se o reagente é oticamente puro. O efeito das varias combinações entre substrato e reagentes (quiral ou aquiral) é melhor discutido através da redução da 2-metil cicloexanona com reagentes doadores de prótons. A cetona se apresenta nas formas S e R(Figura abaixo).

Quando ambas são reduzidas por um reagente aquiral, como o hidreto de lítio e alumínio, dois diastereoisômeros são formados: um trans (1S,2S da S-cetona e o 1R,2R da R-cetona ambas designadas como I segundo Prelog-Seebach) e um cis (1R,2S ou 1S,2R designado u), onde este último é o predominante. A indução assimétrica ou o excesso diastereoisomérico (de) é dado pela seguinte equação:
Duas situações devem ser consideradas: 1)O substrato é enantiomericamente puro (a S-cetona no lado esquerdo do diagrama) e o agente redutor quiral, ambos R e S. Com o R-reagente, o estado de transição para a formação do isômero trans (l) pode ser representado por SS-R (quiralidade R do reagente sendo adicionado aos descriptores topográficos do produto) e com o S-reagente, o estado de transição pode ser representado por SS-S. Os dois estados de transição são diastereoisoméricos e então a indução assimétrica ou diastereosseleção (de) será diferente quando a S-cetona (ou R-cetona) é reduzida com reagentes de quiralidade oposta. A diastereosseletividade em cada combinação de substrato e reagente (SR e SS) deve ser considerada levando em consideração duas contribuições: a primeira relacionada à seletividade diastereofacial inerente ao substrato e a outra relacionada à seletividade diastereofacial inerente ao reagente levando ao que é conhecido como dupla indução assimétrica, ou dupla diastereosseleção. As duas contribuições podem operar sinergicamente promovendo uma diastereosseletividade global ou atuar de maneiras opostas reduzindo a diastereosseletividade. Uma situação similar surge se a quiralidade de um reagente é mantida fixa (R, por exemplo) e a do substrato é variada (S ou R). Os estados de transição do isômero l é agora SS-R ou RR-R (diastereoisomérico). O mesmo argumento prevalece para a formação do isômero u, agora sendo os estados de transição RS-R ou SR-R.
2)Na segunda situação, o substrato é racêmico (S- ou R-cetona) e o reagente é oticamente puro (R). Novamente, o isômero l (trans) pode ser formado através dos estados de transição SS-R e RR-R os quais não são enantioméricos (como no caso do reagente aquiral) mas são diastereoisoméricos, o que levará a formação de dos isômeros trans SS e RR em quantidades diferentes. O mesmo irá acontecer ao isômero u (cis), ou seja, RS e SR serão formados em quantidades diferentes de modo aos isômeros cis e trans apresentarem excesso enantiomérico (quatro estereoisômeros são agora formados em quantidades diferentes). Nesses casos, se tem com regra geral que o valor de ee de um diastereoisômero é inversamente proporcional a sua diastereosseletividade, ou seja, o isômero mais abundante terá o menor valor de ee.
Caso 4: Dessimetrização
Dessimetrização, o qual se refere ao processo de dessimetrização eficiente de moléculas meso ou aquirais para produzir moléculas quirais, é um método versátil para o preparo de moléculas quirais não racêmicas. Dessimetrização de compostos meso geralmente leva a formação de ligações C-C ou C-X (onde X é um heteroátomo). A reação normalmente usa um grupo funcional que reside no elemento de simetria (na maioria dos casos num plano ou eixo C2) para diferenciar duas (ou mais) funcionalidades simetricamente equivalentes em outras posições nas moléculas do susbtrato. Levando em consideração o trabalho de Hoye et al.[65], o grupo carbonila que está no eixo simétrico C2 no ceto diácido A pode ser reduzido ao álcool B. Quando ocorre uma lactonização via catálise ácida do grupo hidroxila com tanto o grupo carboxila em C-1 ou em C-9, monolactona C ou ent-C pode ser produzido, realizando portanto a dessimetrização do substrato A(figura abaixo).

Caso 5: Envenenamento quiral
Uma outra área de interesse é a possibilidade da criação de compostos oticamente ativos com catalisadores racêmicos. O termo envenenamento quiral foi cunhado para situações onde uma substância quiral desativa um dos enantiômeros do catalisador racêmico. O complexo enantiomericamente (R,R)-chiraphos de ródio pode produzir (S)-metil succinato com mais de 98% ee quando aplicado na hidrogenação assimétrica do subtrato itaconato. Um método prático e econômico foi então proposto usando [(chiraphos)Rh]22+ na presença de um “envenenador” quiral[66]. Esse “envenenador” é adicionado para desativar um dos enantiômeros do catalisador, deixando apenas um livre para participar da reação. Quando da utilização do sistema catalítico racêmico, [(chiraspho)Rh]22+ mais (S)-methophos, o produto metil-succinato pode ser obtido em 49% de ee(figura abaixo).

Caso 6: Amplificação quiral
Uma outra conquista recente em reações assimétricas é o estudo da autocatálise quiral – onde o produto por si só catalisa sua própria síntese assimétrica,ou seja, o catalisador quiral e os produtos são os mesmos. Uma das grandes vantagens deste método sintético é ausência de uma separação de catalisadores dos produtos ao fim da reação já que o produto de reação é o catalisador da mesma. Soai et al.[67] [68] [69] descobriram que o álcool (S)-pirimidínico (A) (20% mol, 94,8% ee) catalisou sua própria síntese numa reação entre o aldeído (B) e zinco di-isopropil.

Na reação descrita na figura acima, foi obtido um produto com 48% de rendimento e 95,7% ee. Do mesmo modo, quando a reação é desenvolvida a partir de 20% de (S)-pirimidil com apenas 2% de ee, o primeiro ciclo gera o álcool com 10% de ee. Reações subseqüentes aumentam o valor de ee acima de 88%.
Exemplos de reações estereoseletivas
O esquema abaixo ilustra exemplos de tipos de reações estereoseletivas discutidas neste tópico. Os três primeiros exemplos (1A, 2A e 3A) são hidrogenações catalíticas, da quarta a sexta (1B, 2B e 3B) são exemplos de redução de cetonas cíclicas e a sétima e oitava (1C e 2C) são adições nucleofílicas em cetonas acíclicas.
Efeito direcionador de substituintes em hidrogenações heterogêneas e homogêneas
A hidrogenação de ligações duplas de carbono-carbono é uma reação bem genérica. Exceto nos casos muito estericamente impedidos, geralmente, a reação prossegue rapidamente e de forma limpa. A hidrogenação pode seguir catalizada com uso ou de metais dispersos de forma particulada (heterogêneo) ou de forma solúvel por complexos metálicos (homogêneo). Nestes alcenos, preferencialmente, a doação de hidrogênio se da na posição sin a partir da face menos impedida da ligação dupla. O grau de estereosselectividade é dependente da estrutura do reagente, catalisadores e condições da reação. Doadores de grupos funcionais, especialmente hidroxilo e amino podem ser direcionada sin[70].

Redução por hidretos de cetonas cíclicas
A estereosselectividade de adições nucleofílicas a cetonas cíclicas tem sido estudado extensivamente. A estereosseletividade em cicloexanonas é determinada pela preferência dos reagentes em abordagens axiais ou direção equatorial (figura abaixo). A conformação cadeira de ciclohexanona coloca o grupo carbonílico em um ambiente assimétrico[70].
Adição nucleofílica estereoseletiva em grupos carbonílicos acíclicos
As reações de adições foram estudadas com uma variedade de nucleófilos, neste tópico será utilizado dados de adição por hidreto e compostos organometálicos, no qual, inicialmente foram analizados por D. J. Cram e seus colaboradores no qual desenvolveu uma relação empírica denominada Regra de Cram (Cram's rule)[70].
No qual dita:[71]
- O centro assimétrico existente teria um pequeno (small), médio (medium) e grande (large) grupo denotado S, M e L, respectivamente.
- Na conformação do reativo, o grupo carbonílico orienta-se de tal modo que ele irá estar entre o grupo pequeno e médio do grupo.
- O nucleófilo iria preferir atacar a partir do lado do pequeno grupo, resultando na formação de um diasteroisômero predominante.
Quando o material de partida é um enantiômero puro, a mistura do produto iria mostrar predominância de um enantiômero. Sua argumentação foi apoiada com um conjunto de seus próprios experimentos mostrados na figura abaixo.[71]

Atropoisomeria
Introdução
O termo atropoisomerismo provém da palavra grega “atropos”, que significa “ausência de rotação”. O fenômeno é atribuído a um eixo de ligação entre duas arilas que são impedidos de se rotacionarem dentro da molécula devido a um impedimento estérico, o que confere uma barreira energética entre os confôrmeros e permite identificar separadamente cada isômeros conformacional.[72]
A atividade óptica destes isômeros, chamados de atropoisômeros, provém da ligação sigma, que não necessitam da presença de um carbono quiral, onde a estabilidade está relacionada aos substituintes no sistema diaril. Em 1922, os bioquímicos Christie e Kenner conseguiram isolar pela primeira vez os isômeros do ácido 6,6'-dinitro-2,2'-difênico e observaram que não havia interconversão entre os atropoisômeros a temperatura ambiente.[72]

Uma regra proposta é que os atropoisômeros podem ser separados quando possuem tempo de meia vida maior que 1000 segundos e uma barreira energética mínima para as seguintes temperaturas:[73]
∆G° (200°K) = 61.6kJ/mol[73]
∆G° (300°K) = 93.5kJ/mol[73]
∆G° (350°K) = 109kJ/mol[73]
Nomenclatura
A nomenclatura dos compostos é feita da mesma forma dos isômeros ópticos provenientes do carbono quiral, R e S, seguindo a regra de prioridade proposta por Cahn-Ingold-Prelog. Primeiramente é feita a projeção do sistema bifenil na direção do eixo de ligação e posteriormente enumera-se os grupos funcionais com preferência ao mais próximo do observador. Com base na ordem de prioridade, determina-se a nomenclatura R(M) ou S(P) dependo do sentido obtido quando se caminha de maior prioridade para menor prioridade. Para diferenciar compostos ópticos atropoisômeros dos demais, pode ser utiliza o prefixo 'a', formando aS e aR.[72]

Classificação:
Os atropoisomeros podem ser separados em duas classes:[73]
1) A primeira classe, chamada de Biaril em Ponte, “Bridged Biaryl”, sistema onde existe, além do eixo de ligação entre os dois anéis aromáticos, a ligação entre um dos ligantes de cada anel:
Exemplos
lignanas biaril em ponte ('Bridged biaryl lignans'):

Biaril com todos os carbonos em ponte ('All-carbon bridged biaryl'):

Lactonas de Biaril ('Biaryl Lactones'):

Biaril com multi ciclos ('Multicyclic Biaryls'):

Ciclopepitídeo de biaril ('Biaryl cyclopeptides'):

2) A segunda classe, chamada de Biaril sem Ponte(“NonBridged Biaryl”), onde só existe o eixo de ligação entre os dois anéis aromáticos:[5]
Exemplos:
Biaril Isocíclico ('Isocyclic Biaryls'):

Heterocíclico Fundido ('Fused Heterocycles'):

Heterobiarils ('Heterobiaryls'):

Biaril Multiplamente Acoplado ('Multiply Coupled Biaryls'):

Tipos de Atropoisomeros:
Os atropoisomeros são usualmente encontrados em sistemas sp2-sp2 principalmente na forma de biarilas com ligantes na posição orto. A sintese pode ser realizada através da reação com compostos de Pd(0), o que que permite maior diversidade de grupos funcionais ligantes que em outras sinteses.[72]
Um exemplo de reação é o acoplamento de suzuki, tolerante à presença de vários tipos de grupos funcionais presentes nos substratos, em que os reagentes utilizados são o ácido arilborônicos com o haletos de arila.[72]

Outros atropoisômeros podem ser formados a partir de sistema sp2-sp2, sp2-sp3 e sp3-sp3 sem a necessidade de serem biarilas.[72]
Exemplos:
Sintetizada por Jabin e colaboradores com elevada estereosseletividade: enamidas cíclicas apresentam alta estabilidade mesmo em elevadas temperaturas[72]

Lomas e Dubois utilizaram mecanismo de adição nucleofílica para o 2-metilfenillítio sobre o carbono carbonílico da tercbutil-cetona, poduzindo um sistema sp2-sp3.[72]

Determinação dos Atropoisômeros
A determinação pode ser realizada pelos métodos:
- Cristalografia de raio-X, na qual determina-se o ângulo de torção e a conforção preferencial do sistema;
- Derivatização dos enantiomeros a diasteroisomeros por meio de reação, seguido de separação por comatografia em coluna;[72]
- Ressonância Magnética Nuclear (RMN) para uma mistura de diasteroisomeros;[72]
- Mistura racêmica de atropoisomeros podem também ser analisadas por RMN, onde utiliza-se complexos metálicos assimétricos capazes de complexar com os componentes da mistura analisada, favorecendo a formação de um par de diastereoisômeros.[72]
Aplicações
1) Sintese assimétrica catalítica:
Atropoisomeros enantiomericos puros são utilizados nesse tipo de sintese por forma "complexos organometálicos quirais, através da indução de quiralidade por diferenciação termodinâmica do sítio reativo dos substratos durante a catálise". Os atropoisomeros comerciais mais utilizados são bifenilnafto (BINOL) e bifenilfosfina (BINAP)[4]

2) auxiliar quiral em reações assimétricas:
"Um exemplo é o grupo amida onde o eixo de quiralidade geralmente se forma em torno de uma ligação C-N, favorecendo a remoção do grupo indutor de quiralidade ao final do processo sintético, devido à relativa labilidade química da ligação peptídica".[72]
Produtos Naturais e sintetisados
Os atropoisomeros são encontrados também em produtos naturais que apresentam atividade farmacológica importantes para química medicinal.
Exemplos:
1) A Kadsulignanas, substância utilizada no tratamento de desordem gastroentéricas e artrite reumatóide, é extraida da planta “Kadsura coccinea” e comumente utilizada na China[72]
2) A Vimblastina, é "um anticancerígeno natural que atua como inibidor da polimerização de tubulina em células tumorais"[72]
3) A Vancomicina , antibiótico atropoisomérico de origem natural é obtido como produto de fermentação de cepas da bactéria "Streptomyces orientalis". Até a década de 80 era um recurso recurso para o combate a bactérias resistentes à penicilina e seus derivados.[72]
4) O Gossipol, é um dialdeido polifenólico extraido através de sementes, troncos e raizes do algodão. Na década de 60 foi descoberto suas açoes como contraceptivo e posteriormente, acharam que o composto possui "atividades antiviral e antiparasitária in vitro em concentrações da ordem de micro molar, além de pronunciada atividade antitumoral".[72]
5) Glicosideos de bisantraquínonas são extraidos do extrato seco das partes aéreas do "Hypericum perforatum L.". São utilizados no tratamento de depressão leve a moderada.[72]
Atividade óptica
Em 1815, o físico Jean-Baptiste Biot descobriu que certos ocorrência natural substâncias orgânicas, tais como cânfora e óleo de terebintina são capazes de rodar o plano de polarização. Ele observou que alguns compostos rotacionou no sentido horário o plano de polarização e outros anti-horário, enquanto alguns não girararam o plano de polarização. Ele previu que a capacidade de rodar o plano de polarização era atribuída a alguma assimetria nas moléculas. Van't Hoff e Le Bel posteriormente determinaram que a assimetria molecular estava associada com compostos que continham um ou mais carbonos assimétricos [74].
Atividade óptica é a habilidade de uma substância quiral rotacionar o plano de luz polarizada e pode ser medida utilizando um instrumento chamado polarímetro. A luz utilizada para medir a atividade óptica tem duas propriedades: é constituída por um único comprimento de onda e é polarizada no plano. O comprimento de onda utilizado geralmente é 589 nm, o qual corresponde a luz amarela produzida por uma lâmpada de sódio. A amostra é opticamente ativa se ela rotaciona o plano de luz polarizada. A direção e a magnitude são medidas usando um segundo filtro polarizador e a rotação observada é chamada α e é medida em graus.
Cada composto opticamente ativo tem uma rotação específica característica. A rotação específica é o número de graus de rotação causada por uma solução de 1,0 g do composto por mL de solução em um tubo de amostra de 1,0 dm a uma temperatura e comprimento de onda especificada. A rotação específica pode ser calculada a partir da rotação observada usando a seguinte fórmula:
onde [α] é a rotação específica; T é a temperatura em °C; λ é o comprimento de onda; α é a rotação observada comprimento do tubo da amostra em decímetros; e c é a concentração da amostra em gramas por mililitros de solução.; l é o comprimento da cubeta.
Para ser opticamente ativa a amostra deve conter uma substância quiral e um enantiômero deve estar presente em excesso em relação ao outro. Uma substância que não rodar o plano de luz polarizada é dito ser opticamente inativa. Todas as substâncias aquirais são opticamente inativas [75].
Compostos Meso
Os compostos meso são conhecidos por possuírem um ou mais carbono assimétrico, e possuir um plano de simetria, em que sua imagem refletida no espelho possui sobreposição. Baseado nisso, pode-se dizer que mesmo possuindo carbono quiral, essas substâncias não possuem enantiômeros e, consequentemente, ausência de atividade óptica ao incidir luz.[76]
Ambiente quiral
Uma forma de identificar enantiômeros é através da sua interação com ambiente quiral, que se assemelha como uma luva, na qual sua imagem refletida também não se sobrepõe. Cada molécula quiral poderá se acomodar em cada ambiente, o que acontece em sistemas biológicos onde há um sítio que só acomoda um enantiômero, são chamados de estereoespecífico.[77]
Exemplo:
A semente de alcaravia e goma de hortela possuem diferentes sabores e odores porém são estereoisômeros do mesmo composto carvone, uma cetona. O isomero R-(-)-carvone desloca a luz para esquerda, enquanto que S-(+)-carvone desloca para direita, porém ambos podem ser reduzidos por NaBH4 formando o mesmo álcool secundário.[77]

Os enantiômeros possuem propriedades físicas iguais, como ponto de fusão e ebulição, porém devido a receptores quirais em nosso sistema olfativo, podemos identificar cada um deles.[77]
SÍNTESE ASSIMÉTRICA
Para uma mesma substância, é possível existir diferentes enantiômeros que possuem ação diferenciada no organismo. Para aplicações nas área farmacêuticas, alimentícias, produção de agrotóxicos e perfumaria é necessário o uso de um enantiômero puro que algumas vezes é difícil de ser encontrado na natureza. Para essa produção é necessário o uso da síntese assimétrica, que possibilita a criação de novos centros quirais durante as etapas.[78]
Para a síntese faz-se necessário o uso de substratos quirais e pró-quirais onde a natureza é a única fonte, na qual encontramos os carboidratos, terpenos, α-aminoácidos e os alcalóides, além de alguns hidroxiácidos.[78]
Substratos quirais
O uso de substratos quirais para síntese foi bastante utilizado por Hannesian na década de 80 com objetivo de sintetizar produtos naturais. As reações diastereoseletivas são usadas para formação de centros estereogênicos.[78]

No exemplo acima, o substrato quiral (-)-α-pineno é convertido para (+)-pinenodiol através da hidroxilação da ligação pi pela face menos impedida estericamente, consequentemente, menor energia de ativação para sua formação. A partir do (-)-α-pineno novos produtos são formados ao reagir com a hidroxila menos impedida.[78]
Auxiliares quirais
Método utilizado em síntese assimétrica onde possibilita a criação de centros quirais a partir de material aquiral por meio de reações diastereosseletivas.[78]
Catalisador quiral
“Um substrato pró-quiral é diretamente convertido a um produto quiral pelo uso de um reagente aquiral na presença de um catalisador quiral, os quais podem ser divididos em duas classes: sintéticos (por exemplo, organometálicos) e biológicos (microorganismos e enzimas)”[78]
Reações enzimáticas
A produção de enantiômeros na natureza pode ocorrer através de enzimas quirais, mesmo que a substância inicial não seja opticamente ativa, o produto final será ativo e a reação sempre forma seletivamente um único enantiômero.[77]

Nessa reação a molécula é hidratada pela enzima quiral criando um produto com atividade óptica, pois forma seletivamente um único enantiômero.[77]
MÉTODOS DE SEPARAÇÃO
Agente quiral de derivatização
Para misturas racêmicas é possível isolar um enantiômero específico através de um agente de quiral de derivatização, como mostra a figura abaixo:[79]

Esse agente deve possuir as seguintes características:
(i) Ser enantiomericamente puro;
(ii) Ambas as 2 reações devem alcançar 100% de conversão;
(iii) Ambas as condições de reação não podem racemizar o centro esteriogênico;
(vi) Enantiômeros devem possuir um ponto de ataque para reação.
Exemplo de Agente:
1) Acido de Mosher (Mosher's Acid)[79]
Agente de derivatização utilizado para álcools e aminas, em que a reação forma diasteroisomeros com sinais de RMN diferentes entre si.

2) Sais[79]
Pode ser realizada em uma única etapa, sem a necessidade de derivatização do diasteroisomero e de fácil recuperação

cromatografia quiral
Permite separar uma mistura racêmica quanto a uma mistura enriquecida de um único tipo de enantiômero. Utiliza-se uam fase estacionária quiral que possui sítios ativos específicos para um determinado enantiômero, permitindo sua separação.[79]
Ver também
Bibliografia consultada
- Barbosa, Luiz Claudio de Almeida, Introdução a Química Orgânica, editora UFV.
- Bruckner, R. Organic Mechanisms Reactions, Stereochemistry and Synthesis. Springer, 2010.
- Deslongchamps, P. Stereoelectronic Effects in Organic Chemistry. Pergamon: Oxford, 1983.
- Feltre, Ricardo, Fundamentos da química, volume único, 2°edição, Editora Moderna.
- Ingold, C. K. Structure and Mechanism in Organic Chemistry. 2nd Ed. Cornell University Press. Ithaca, N. Y. 1969.
- Kirby, A. J. Stereoelectronic Effects. Oxford University Press, Oxford, U. K., 1996.
- Robinson, Sir. R. Memoirs of a Minor Prophet. Elsevier, Amsterdan, 1976.
- ↑ a b c d e f g h i j k l m n o Solomons, Thomas W; Fryhle, Craig B. (2012). Química orgânica 10 ed. [S.l.]: LTC
- ↑ a b «O Conceito de Hibridização» (PDF). Quimica Nova na Escola
- ↑ a b McMurry,J. Organic Chemistry. 5. ed. Brooks/Cole. 2000
- ↑ a b c d e f g h i Harris, D. C.; Bertolucci, M. D. (1978). Symmetry and Spectroscopy. [S.l.]: Oxford
- ↑ a b c March,J. Advanced Organic Chemistry. 4. ed. John Willey & Sons, Inc. 1992
- ↑ a b c d e f g h i j k l m n o Eliel, Ernest L; Wilen, Samuel H. (1994). Stereochemistry Of Organic Compounds. New York: John Wiley and Sons. p. 597-611. ISBN 0-471-01670-5
- ↑ «Definitions: Conformational Isomers» (em inglês). Consultado em 01 de agosto de 2015
|nome1=sem|sobrenome1=em Authors list (ajuda); Verifique data em:|acessodata=(ajuda) - ↑ «conformation» (em inglês). Consultado em 01 de agosto de 2015
|nome1=sem|sobrenome1=em Authors list (ajuda); Verifique data em:|acessodata=(ajuda) - ↑ a b ,March, Jerry (1994). Advance Organic Chemistry: Reactions Mechanisms and Structure. [S.l.]: John Wiley and Sons. p. 139. ISBN 0471-601802 Parâmetro desconhecido
|ubicación=ignorado (|local=) sugerido (ajuda) - ↑ Prelog, V. (15 de dezembro de 1960). «Description of steric relationships across single bonds». Experientia. 16: 521-568
|nome1=sem|sobrenome1=em Authors list (ajuda) - ↑ Ingold, Sir. Christopher; Prelog, V. (Abril 1966). «Specification of Molecular Chirality». Angewandte Chemie International Edition in English. 5 (4): 385-415. doi:10.1002/anie.196603851
|nome1=sem|sobrenome1=em Authors list (ajuda) - ↑ a b Carey, Francis A. (2000). Organic chemistry. 4th ed. ed. [S.l.]: McGraw-Hill. ISBN 0-07-290501-8 Parâmetro desconhecido
|ubicación=ignorado (|local=) sugerido (ajuda) - ↑ a b c d e f g h i j k l m n o Carey, Frank A.; Sundberg, Richard J. (2007). Advanced organic chemistry : PART A. 5th ed. ed. [S.l.]: Springer. ISBN 978-0-387-44897-8 Parâmetro desconhecido
|ubicación=ignorado (|local=) sugerido (ajuda) - ↑ «Simple molecular orbital explanation for the barrier to internal rotation in ethane and other molecules». Journal of the American Chemical Society. 92 (12): 3799–3800. De junio de 1970. doi:10.1021/ja00715a049
|nome1=sem|sobrenome1=em Authors list (ajuda); Verifique data em:|data=(ajuda) - ↑ Profeta, S. (1980). «The torsional potential function forn-butane». Journal of Computational Chemistry. 1 (2): 181–184. doi:10.1002/jcc.540010211
|nome1=sem|sobrenome1=em Authors list (ajuda) - ↑ Grev, Roger S.; Yates, Brian F.; Schaefer, Henry F. (de enero de 1990). «The syn rotational barrier in butane». Journal of the American Chemical Society. 112 (1): 114–118. doi:10.1021/ja00157a018
|nome1=sem|sobrenome1=em Authors list (ajuda); Verifique data em:|data=(ajuda) - ↑ Evans, D. A. «Acyclic Conformational Analysis-1» (PDF). Consultado em 2 de agosto de 2015
- ↑ «What Can We Learn about Dispersion from the Conformer Surface of -Pentane?». The Journal of Physical Chemistry A. 117 (14): 3118–3132. 11 de abril de 2013. doi:10.1021/jp401429u
|nome1=sem|sobrenome1=em Authors list (ajuda) - ↑ «Gauche effect. Stereochemical consequences of adjacent electron pairs and polar bonds». Accounts of Chemical Research. 5 (3): 102–111. De marzo de 1972. doi:10.1021/ar50051a003
|nome1=sem|sobrenome1=em Authors list (ajuda); Verifique data em:|data=(ajuda) - ↑ Gu, Hongbing; Pophristic, Vojislava (de febrero de 2005). «Gauche Effect in 1,2-Difluoroethane. Hyperconjugation, Bent Bonds, Steric Repulsion». The Journal of Physical Chemistry A. 109 (6): 1223–1229. doi:10.1021/jp046290d
|nome1=sem|sobrenome1=em Authors list (ajuda); Verifique data em:|data=(ajuda) - ↑ Reusch, William. «Acyclic Conformational Analysis» (em inglês). Consultado em 2 de agosto de 2015
- ↑ Bruzik, Karol S. «CHAPTER 6: CONFORMATION». Consultado em 2 de agosto de 2015
- ↑ Yuan, Fang; Li, Bing-Chao; Yu, Zhang-Yu (de julio de 2010). «Theoretical study on the anomeric effect in carbene compound XC:CH2F (X=CH3, NH2, OH)». Journal of Molecular Structure: THEOCHEM. 951 (1-3): 82–88. doi:10.1016/j.theochem.2010.04.012
|nome1=sem|sobrenome1=em Authors list (ajuda); Verifique data em:|data=(ajuda) - ↑ Zeidan, Tarek A. (de marzo de 2002). «Stereoelectronic Effects and General Trends in Hyperconjugative Acceptor Ability of σ Bonds». Journal of the American Chemical Society. 124 (12): 3175–3185. doi:10.1021/ja012633z
|nome1=sem|sobrenome1=em Authors list (ajuda); Verifique data em:|data=(ajuda) - ↑ Geerlings,, Prof (2014). Structure, bonding and reactivity of heterocyclic compounds. [S.l.]: Springer. ISBN 978-3-642-45148-5
- ↑ a b c d e Juaristi, E.; Stefani, H. (2012). Introdução à Estereoquímica e á análise conformacional. [S.l.: s.n.]
- ↑ a b Gupta, R. R.; Kumar, M.; Gupta, V. (1998). Heterocyclic Chemistry: Volumen I. [S.l.: s.n.]
- ↑ Sangal (2010). krishna’s Advanced Organic Chemistry. [S.l.: s.n.]
- ↑ Orchinet, M. (2005). The vocabulary and concepts of organic chemistry 2. ed. ed. Hoboken, NJ: Wiley-Interscience. ISBN 0-471-68028-1
- ↑ Wade, L.G. (2010). Organic chemistry 7th ed. ed. Upper Saddle River, NJ: Pearson Prentice Hall. ISBN 978-0-321-59231-6
- ↑ North, M. (1998). Principles and applications of stereochemistry. Cheltenham: Thornes. ISBN 0-7487-3994-7
- ↑ Anderson, J. (1974). «Interconversion of Six-membered Rings». Top. Curr. Chem. 45: 139
- ↑ Sutton, L. (1965). «Tables of Interatomics Distance». The Chemical Society
- ↑ Nasipuri, D. (1994). Stereochemistry of organic compounds : principles, and applications 2nd ed. ed. New Delhi: Wiley Eastern. ISBN 81-224-0570-3
- ↑ a b c d e Jung, Michael E.; Piizzi, Grazia. «gem-Disubstituent Effect: Theoretical Basis and Synthetic Applications». Chemical Reviews. doi:10.1021/cr940337h
- ↑ Fawcett, Frank S. (1 de outubro de 1950). «Bredt's Rule of Double Bonds in Atomic-Bridged-Ring Structures.». Chemical Reviews. 47 (2): 219-274. ISSN 0009-2665. doi:10.1021/cr60147a003
- ↑ a b «Bredt's Rule» (em inglês)
- ↑ a b «Bredt's Rule (And Summary of Cycloalkanes) — Master Organic Chemistry». www.masterorganicchemistry.com. Consultado em 3 de agosto de 2015
- ↑ a b c d e f g Carrol, Felix (2007). Perspectives on Structure and Mechanism in Organic Chemistry. [S.l.]: Springer Science & Business Media. ISBN 978-0-470-27610-5
- ↑ a b c Juaristi, Eusebio; Stefani, Hélio A. (2012). Introdução à Estereoquímica e à Análise Conformacional. [S.l.]: Bookman Editora
- ↑ a b c d Smith, Michael B.; March, Jerry (2007). March's advanced organic chemistry: reactions, mechanisms, and structure. [S.l.]: John Wiley & Sons
- ↑ a b c d e f g h Eliel, E. L.; Wilen, S. H. Stereochemistry of Organic Compounds. Wiley Interscience
- ↑ a b c Carey, Francis A. (2011). Química Orgânica 7 ed. [S.l.]: AMGH. ISBN 987-85-63308-22-1 Verifique
|isbn=(ajuda) - ↑ Juaristi, Eusebio (2012). Introdução à Estereoquímica e à Análise Conformacional. [S.l.: s.n.]
|nome2=sem|sobrenome2=em Authors list (ajuda) - ↑ March,J. Advanced Organic Chemistry. 4. ed. John Willey & Sons, Inc. 1992
- ↑ Maher, T. J.; Johnson, D. A. Review of Chirality and Its Importance in Pharmacology. Drug Development Research. v. 24, p. 149-156, 1991
- ↑ Lenfigwell, J. C. Chirality & Bioactivity I.:Pharmacology. Lenfigwell Reports. v. 3, 2003
- ↑ Clayden, Greeves, Warren and Wothers. Organic Chemistry. Oxford. 2001
- ↑ Boelens, M. H.; Boelens, H.; Van Gemert, L. J. Sensory Properties of Optical Isomers. Perfumer & Flavorist. v. 6, p. 1-15, 1993
- ↑ Lenfigwell, J. C. Chirality & Bioactivity I.:Pharmacology. Lenfigwell Reports. v. 3, 2003
- ↑ Barreiro, L. J.; Ferreira, V. F.; Costa, P. R. R. Substâncias enantiomericamente puras (sep): a questão dos fármacos quirais. Química Nova. v. 20, 1997
- ↑ Eliel, E. L.; Wilen, S. H. Stereochemistry of Organic Compounds. Wiley Interscience
- ↑ Eliel, E. L.; Wilen, S. H. Stereochemistry of Organic Compounds. Wiley Interscience
- ↑ Isaacs, Neil (1996). Physical Organic Chemistry. Londres: Prentice Hall. ISBN 978-0582218635
- ↑ «No Title Provided : Pure and Applied Chemistry». Pure and Applied Chemistry. 51 (8). 1 de janeiro de 1979. doi:10.1351/pac197951081725
- ↑ Seeman, Jeffery I. (1 de janeiro de 1986). «The Curtin-Hammett principle and the Winstein-Holness equation: new definition and recent extensions to classical concepts». Journal of Chemical Education. 63 (1). 42 páginas. ISSN 0021-9584. doi:10.1021/ed063p42
- ↑ Perrin, C. L.; Jeffrey I. (1 de agosto de 1984). «Application of linear free energy relationships to the Curtin-Hammett principle: correlation between conformational equilibrium, chemical reactivity, and product ratios». The Journal of Organic Chemistry. 49 (16): 2887-2891. ISSN 0022-3263. doi:10.1021/jo00190a009
- ↑ Seeman, Jeffery I. (1 de janeiro de 1986). «The Curtin-Hammett principle and the Winstein-Holness equation: new definition and recent extensions to classical concepts». Journal of Chemical Education. 63 (1). 42 páginas. ISSN 0021-9584. doi:10.1021/ed063p42
- ↑ Seeman, Jeffery I. (1 de janeiro de 1986). «The Curtin-Hammett principle and the Winstein-Holness equation: new definition and recent extensions to classical concepts». Journal of Chemical Education. 63 (1). 42 páginas. ISSN 0021-9584. doi:10.1021/ed063p42
- ↑ a b c d e f Substâncias carboniladas e derivados / Paulo Costa, Ronaldo Pilli, Sergio Pinheiro e Mário Vasconcellos. - Porto Alegre: Bookman, 2003. [S.l.: s.n.]
|nome1=sem|sobrenome1=em Authors list (ajuda) - ↑ Sherk, A. E.; Fraser-Reid, B. J. Org. Chem. 1982, 47, 932
- ↑ Bernardo, S. D.; Tengi, J. P.; Sasso, G.; Weigele, M. Tetrahedron Lett. 1988, 29,4077.
- ↑ Lin, G.Q., Li, Y.M.; Chan, A.S.C.; Principles and applications of asymmetric synthesis, Nova Iorque, John Wiley & Sons, Inc., 2001, pag 49-53
- ↑ Nasipuri, D., Stereochemistry of organic compounds – Principles and applications, 2ª Edição, New Age International (p) Ltd., Nova Deli, 1994, pag. 408-410
- ↑ Hoye, T. R.; Peck, D. R.; Swanson, T. A. J. Am. Chem. Soc. 1984, 106, 2738.
- ↑ Faller, J. W.; Parr, J.; J. Am. Chem. Soc. 1993, 115, 804.
- ↑ Soai, K.; Shibata, T.; Morioka, H.; Choji, K., Nature 1995, 378, 767
- ↑ Shibata, T.; Morioka, H.; Hayase, T.; Choji, K.; Soai, K., J. Am. Chem. Soc. 1996, 118, 471
- ↑ Shibata, T.; Hayase, T.; Yamamoto, J.; Soai, K., Tetradedron Asymmetry, 1997, 8, 1717
- ↑ a b c CAREY, Francis A.; SUNDBERG, Richard J. Advanced Organic Chemistry. Part A: Structure and Mechanism. 5ed. Charlottesville, Virginia. Springer, 2008. e-ISBN-13: 978-0-387-44899-3
- ↑ a b http://202.141.40.218/wiki/index.php/Cram%E2%80%99s_Rule_and_Prelog%E2%80%99s_Rule Acesso em agosto de 2015
- ↑ a b c d e f g h i j k l m n o p q dos Santos, A. R.; Pinheiro,A. C.; Sodero, A. C. R.; da Cunha, A. S.; Padilha, M. C.; de Sousa, P. M.; Fontes, S. P.; ATROPOISOMERISMO: O EFEITO DA QUIRALIDADE AXIAL EM SUBSTÂNCIAS BIOATIVAS; Quim. Nova, Vol. 30, No. 1, 125-135, 2007
- ↑ a b c d e Bringmann, G. et al. Angew. Chem. Int. Ed. 2005, 44, 5384
- ↑ Eliel, E. L.; Wilen, S. H. Stereochemistry of Organic Compounds. Wiley Interscience
- ↑ Eliel, E. L.; Wilen, S. H. Stereochemistry of Organic Compounds. Wiley Interscience
- ↑ Paula Y. Bruice; Organic Chemistry; fourth edition
- ↑ a b c d e Chirality; http://butane.chem.uiuc.edu/cyerkes/Chem104ACSpring2009/Lecture_Notes_104/lect21c.html; Acessado em Agosto de 2015
- ↑ a b c d e f Sergio Pinheiro; Vítor F. Ferreira; ABORDAGENS EM SÍNTESE ASSIMÉTRICA; QUÍMICA NOVA; Volume 21; p. 312-318; 1998
- ↑ a b c d http://www.massey.ac.nz/~gjrowlan/stereo2/lecture2.pdf; Acessado em Agosto de 2015

![{\displaystyle [\alpha \,]{_{D}20^{\circ }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/edf85a4b81ab2b57da9acecbf95bb4fdc7ac75ab)




![{\displaystyle K={\frac {[anti]}{[gauche]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d0b30b8c9f0e13fc73990280f0b0263aebce6b4f)








![{\displaystyle {{\partial [P_{1}]} \over {\partial t}}+{{\partial [P_{2}]} \over {\partial t}}=k_{A}[C_{1}]+k_{B}[C_{2}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b26cc98fe64b8004541ffe4ffb6f117bba3da35)

![{\displaystyle K_{obs}([C_{1}]+[C_{2}])=k_{A}[C_{1}]+k_{B}[C_{2}]\Rightarrow }](https://wikimedia.org/api/rest_v1/media/math/render/svg/87b28559956da70c7089d7975d8345fc39c8adef)









![{\displaystyle {{\partial [P_{B}]/\partial t} \over {\partial [P_{A}]/\partial t}}={k_{B}[C_{2}] \over k_{A}[C_{1}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e025991e42f34f07263962923e2f8b9cf64c004a)
![{\displaystyle {\partial t \over \partial [P_{A}]}={1 \over \partial [P_{A}]/\partial t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ce21ed555be7a06302905e27a1f850a64f15aa6)
![{\displaystyle {{\partial [P_{B}]/\partial t} \over {\partial [P_{A}]/\partial t}}={{\partial [P_{B}]} \over {\partial t}}{\partial t \over \partial [P_{A}]}={{\partial [P_{B}]} \over {\partial [P_{A}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e88c82db52070083d6eab962b0fc85adabef536)
![{\displaystyle [C_{2}] \over [C_{1}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7b3fad654ace7ab6c273bbd4aac55b4c88e47e18)
![{\displaystyle \int d[P_{B}]={k_{B} \over k_{A}}\int {[C_{2}] \over [C_{1}]}d[P_{A}]\Rightarrow }](https://wikimedia.org/api/rest_v1/media/math/render/svg/fff53000d48e21289ba919e327c052de172fefde)
![{\displaystyle {[P_{B}] \over [P_{A}]}=K_{eq}{k_{B} \over k_{A}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2206226b15b771758988ec131a273baed886e372)









![{\displaystyle {{[P_{B}]} \over [P_{A}]}={e^{-\Delta G}{e^{-\Delta G_{B}^{\ddagger }}} \over {e^{-\Delta G_{A}^{\ddagger }}}}e^{1/RT}=e^{-(\Delta G+\Delta G_{B}^{\ddagger }-\Delta G_{A}^{\ddagger })}e^{1/RT}=e^{(G_{1}-G_{2}+G_{2}-G_{B}^{\ddagger }-G_{1}+G_{A}^{\ddagger })}e^{1/RT}\Rightarrow }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0425bc62d41392b7abacdb57dfe2f12523a80da7)
![{\displaystyle {[P_{B}] \over [P_{A}]}=e^{-(G_{B}^{\ddagger }-G_{A}^{\ddagger })}e^{1/RT}=e^{-\Delta \Delta G^{\ddagger }/RT}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7b4ffb3c94cf357124f4b8a17200819971786100)


![{\displaystyle {[P_{B}] \over [P_{A}]}<1\Rightarrow }](https://wikimedia.org/api/rest_v1/media/math/render/svg/86524e656b9793dbcccee77876b9971b6c858168)

![{\displaystyle {[P_{B}] \over [P_{A}]}=e^{-\Delta \Delta G^{\ddagger }/RT}=e^{-\Delta G/RT}=K_{eq}={[C_{2}] \over [C_{1}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5843f967143730983f45ddd267c5942906562bd3)




![{\displaystyle {[P_{B}] \over [P_{A}]}=K_{eq}^{1-\alpha }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f494be3dcef6fbdbf733d01539ba6da11d4559ba)

![{\displaystyle k_{A}=K_{obs}{(K_{eq}+1) \over ([P_{B}]/[P_{A}]+1)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b4edfa876d9316dbb2b4e118a88c9d4cecec2a16)
![{\displaystyle k_{B}={(K_{eq}+1) \over {K_{eq}}}{[P_{B}]/[P_{B}] \over ([P_{B}]/[P_{A}]+1)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/60212902c3aa6fcd8660631df036d004ce5fe653)


