Célula de Purkinje

As células de Purkinje, ou neurônios de Purkinje, são uma classe de neurônios inibitórios GABAérgicos localizados no cerebelo.[1] Eles são nomeados em homenagem ao seu descobridor, o anatomista tcheco Jan Evangelista Purkyně, que caracterizou as células em 1839.
Estrutura[editar | editar código-fonte]




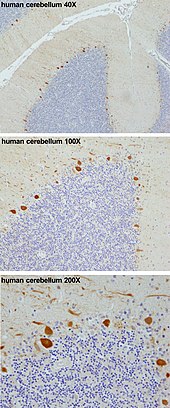
Essas células são alguns dos maiores neurônios do cérebro humano (as células de Betz são as maiores),[2] com uma árvore dendrítica muito elaborada, com um grande número de espinhas dendríticas. As células de Purkinje são encontradas dentro da camada de Purkinje no cerebelo. Elas se alinham como dominós, empilhadas uma na frente da outra. Suas árvores dendríticas formam camadas quase bidimensionais através das quais passam fibras paralelas das camadas mais profundas. Essas fibras paralelas fazem sinapses excitatórias (glutamatérgicas) com os dentritos da célula de Purkinje, enquanto as fibras ascendentes originárias do núcleo olivar inferior da medula fornecem uma entrada excitatória muito poderosa para os dendritos proximais e o soma celular. As fibras paralelas passam ortogonalmente através da árvore dendrítica do neurônio de Purkinje, com até 200.000 fibras paralelas[3] formando uma sinapse entre célula-grânulo e célula de Purkinje com uma única célula de Purkinje. Cada célula de Purkinje recebe aproximadamente 500 sinapses de fibras trepadeiras, todas originadas de uma única fibra trepadeira.[4] Tanto as células em cesto quanto as células estreladas (encontradas na camada molecular cerebelar) fornecem entrada inibitória (GABAérgica) para a célula de Purkinje, com células em cesta fazendo sinapse no segmento inicial do axônio da célula de Purkinje e células estreladas nos dendritos.
As células de Purkinje enviam projeções inibitórias para os núcleos cerebelares profundos e constituem a saída única de toda a coordenação motora no córtex cerebelar.
Molecular[editar | editar código-fonte]
A camada de Purkinje do cerebelo, que contém os corpos celulares das células de Purkinje e da glia de Bergmann, expressando um grande número de genes únicos.[5] Marcadores de genes específicos de Purkinje foram propostos comparando o transcriptoma de camundongos deficientes de Purkinje com o de camundongos do tipo selvagem.[6] Um exemplo é a proteína 4 da célula de Purkinje (PCP4), que removida em camundongos knockout leva a dificuldades motoras e plasticidade sináptica alterada.[7][8] A PCP4 acelera tanto a associação quanto a dissociação do cálcio (Ca 2+ ) com a calmodulina (CaM) no citoplasma das células de Purkinje, e sua ausência prejudica a fisiologia desses neurônios.[7][8][9][10]
Desenvolvimento[editar | editar código-fonte]
A pesquisa embrionária em mamíferos detalhou as origens das células de Purkinje.[11] Durante o desenvolvimento, as células de Purkinje surgem na zona ventricular do tubo neural, o precursor do sistema nervoso no embrião. Todos os neurônios cerebelares derivam do neuroepitélio germinativo da zona ventricular.[12] As células de Purkinje são geradas especificamente a partir de progenitores no neuroepitélio ventricular do primórdio cerebelar embrionário.[13] As primeiras células geradas a partir do primórdio cerebelar formam uma capa sobre uma cavidade em forma de diamante do cérebro em desenvolvimento chamada de quarto ventrículo formando os dois hemisférios cerebelares. As células de Purkinje que se desenvolvem posteriormente são aquelas da seção central do cerebelo chamada vermis. Eles se desenvolvem no primórdio cerebelar que cobre o quarto ventrículo e abaixo de uma região semelhante a uma fissura chamada istmo do cérebro em desenvolvimento. As células de Purkinje migram para a superfície externa do córtex cerebelar e formam a camada de células de Purkinje.
As células de Purkinje nascem durante os primeiros estágios da neurogênese cerebelar. A neurogenina2, juntamente com a neurogenina1, são expressas transitoriamente em domínios restritos do neuroepitélio ventricular durante essa janela de tempo.[14] Esse padrão de distribuição espaço-temporal sugere que as neurogeninas estão envolvidas na especificação de subconjuntos de células de Purkinje fenotipicamente heterogêneos, em última instância responsáveis pela estrutura da topografia cerebelar.
Há evidências em camundongos e humanos de que as células da medula óssea se fundem ou geram células cerebelares de Purkinje, e é possível que as células da medula óssea, seja por geração direta ou por fusão celular, possam desempenhar um papel no reparo de danos no sistema nervoso central.[15][16][17][18][19] Outras evidências apontam ainda para a possibilidade de um ancestral comum decélulas-tronco entre os neurônios de Purkinje, oslinfócitos B e as células produtoras de aldosterona do córtex adrenal humano.[18]
Função[editar | editar código-fonte]
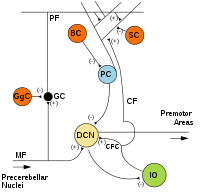
MF: Fibra musgosa .
DCN: Núcleos cerebelares profundos .
IO: núcleo olivar inferior .
CF: Fibra trepadeira .
GC: célula granular .
PF: Fibra paralela .
PC: célula de Purkinje.
GgC: célula de Golgi .
SC: Célula estrelada .
BC: Célula em cesto .
As células de Purkinje mostram duas formas distintas de atividade eletrofisiológica:
- Picos simples ocorrem em taxas de 17 a 150Hz,[20] espontaneamente ou quando as células de Purkinje são ativadas sinapticamente pelas fibras paralelas, os axônios das células granulares.
- Picos complexos ocorrem em taxas de 1-3 Hz, caracterizados por um pico inicial prolongado de grande amplitude, seguido por uma explosão de alta frequência de potenciais de ação de menor amplitude. Eles são causados pela ativação de fibras trepadeiras e podem envolver a geração de potenciais de ação mediados por cálcio nos dendritos. Após a atividade de picos complexos, picos simples podem ser suprimidos pela poderosa entrada de picos complexos.[21]
As células de Purkinje apresentam atividade eletrofisiológica espontânea na forma de sequências de picos dependentes de sódio e dependentes de cálcio. Isso foi mostrado inicialmente por Rodolfo Llinas.[22] Os canais de cálcio do tipo P receberam o nome de células de Purkinje, onde foram inicialmente encontrados[22] que são cruciais para função cerebelar. Agora sabemos que a ativação da célula de Purkinje pelas fibras de escalada pode mudar sua atividade de um estado quieto para um estado espontaneamente ativo e vice-versa, servindo como uma espécie de chave seletora.[23] Essas descobertas foram contestadas por um estudo sugerindo que tal alternância por fibras de escalada ocorre predominantemente em animais anestesiados e que as células de Purkinje em animais acordados, em geral, operam quase continuamente no estado ativado.[24] Este último estudo foi também contertado[25] e a alternância de células de Purkinje foi observada em gatos acordados.[26] Um modelo computacional da célula de Purkinje mostrou que computações de cálcio intracelular são responsáveis pela alternância.[27]
Alguns resultados sugerem que os dendritos das células de Purkinje liberam endocanabinóides.[28] O modo de atividade intrínseca das células de Purkinje é definido e controlado pela bomba de sódio-potássio.[29] Isso sugere que a bomba pode não ser simplesmente uma molécula homeostática de "limpeza" para gradientes iônicos. Em vez disso, poderia ser um elemento de computação no cerebelo e no cérebro.[30] De fato, uma mutação na bomba de sódio potássio pode levar a parkinsonismo de início rápido; seus sintomas indicam que é uma patologia da computação cerebelar.[31] Além disso, o veneno ouabaína, que bloqueia a bomba, é capaz de induzir ataxia e distonia em ratos .[32] A modelagem numérica de dados experimentais sugere que, in vivo, a bomba produz longas pontuações quiescentes (>> 1 s) para o disparo do neurônio de Purkinje; estes podem ter um papel computacional.[27] O álcool inibe a bomba de sódio-potássio no cerebelo e é provavelmente assim que corrompe a computação cerebelar e a coordenação corporal.[33][34]
Significado clínico[editar | editar código-fonte]
Em humanos, as células de Purkinje podem ser danificadas por muitos motivos: exposição tóxica, por exemplo, ao álcool ou lítio; doenças autoimunes; mutações genéticas que causam ataxias espinocerebelares, ataxia do glúten, doença de Unverricht-Lundborg ou autismo; além de doenças neurodegenerativas sem base genética conhecida, como o tipo cerebelar de atrofia de múltiplos sistemas ou ataxias esporádicas.[35][36]
A ataxia do glúten é uma doença autoimune desencadeada pela ingestão de glúten em indivíduos suceptíveis.[37] Nesses casos, a morte das células de Purkinje como resultado da exposição ao glúten é irreversível. O diagnóstico precoce e o tratamento com dieta isenta de glúten podem melhorar a ataxia e prevenir sua progressão.[35][38] Menos de 10% das pessoas com ataxia por glúten apresentam algum sintoma gastrointestinal, mas cerca de 40% apresentam danos intestinais.[38] É responsável por 40% das ataxias de origem desconhecida e 15% de todas as ataxias.[38]
A doença neurodegenerativa ataxia espinocerebelar tipo 1 (SCA1) é causada por uma expansão instável de poliglutamina dentro da proteína Ataxina 1 . Este defeito na proteína Ataxina 1 causa comprometimento das mitocôndrias nas células de Purkinje, levando à degeneração prematura das células de Purkinje.[39] Como consequência, a coordenação motora diminui e, eventualmente, ocorre a morte.
Alguns animais domésticos podem desenvolver uma condição em que as células de Purkinje começam a atrofiar logo após o nascimento (abiotrofia cerebelar). A condição pode levar a sintomas como ataxia, tremores intencionais, hiperreatividade, falta de reflexo de ameaça, marcha rígida ou em passos altos, aparente falta de consciência da posição do pé (às vezes em pé ou andando com o pé dobrado) e uma incapacidade geral de determinar o espaço e a distância.[40] Uma condição semelhante conhecida como hipoplasia cerebelar ocorre quando as células de Purkinje não se desenvolvem no útero ou morrem antes do nascimento.
As condições genéticas ataxia telangiectasia e adoença de Niemann-Pick tipo C, bem como tremor essencial cerebelar, envolvem a perda progressiva de células de Purkinje. Na doença de Alzheimer, às vezes é observada patologia da coluna vertebral, bem como a perda de ramos dendríticos das células de Purkinje.[41] As células de Purkinje também podem ser danificadas pelo vírus da raiva à medida que migra do local da infecção na periferia para o sistema nervoso central.[42]
Etimologia[editar | editar código-fonte]
As células de Purkinje foram nomeadas em homenagem ao cientista tcheco Jan Evangelista Purkyně, que as descobriu em 1839.
Referências[editar | editar código-fonte]
- ↑ Komuro, Y.; Kumada, T.; Ohno, N.; Foote, K. D.; Komuro, H. (1 de janeiro de 2013), Rubenstein, John L. R.; Rakic, Pasko, eds., «Chapter 15 - Migration in the Cerebellum», ISBN 978-0-12-397266-8, Oxford: Academic Press, Cellular Migration and Formation of Neuronal Connections (em inglês): 281–297, doi:10.1016/b978-0-12-397266-8.00030-2, consultado em 18 de novembro de 2020
- ↑ Neuroscience. 4th ed. [S.l.]: Sinauer Associates. 2008. pp. 432–4. ISBN 978-0-87893-697-7
- ↑ Tyrrell, T; Willshaw, D (29 de maio de 1992). «Cerebellar cortex: its simulation and the relevance of Marr's theory.». Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 336 (1277): 239–57. Bibcode:1992RSPTB.336..239T. PMID 1353267. doi:10.1098/rstb.1992.0059
- ↑ Wadiche, JI; Jahr, CE (25 de outubro de 2001). «Multivesicular release at climbing fiber-Purkinje cell synapses». Neuron. 32 (2): 301–13. PMID 11683999. doi:10.1016/S0896-6273(01)00488-3

- ↑ Kirsch, L; Liscovitch, N; Chechik, G (dezembro de 2012). «Localizing Genes to Cerebellar Layers by Classifying ISH Images». PLOS Computational Biology. 8 (12): e1002790. Bibcode:2012PLSCB...8E2790K. PMC 3527225
 . PMID 23284274. doi:10.1371/journal.pcbi.1002790
. PMID 23284274. doi:10.1371/journal.pcbi.1002790 |nome1=sem|sobrenome1=em Editors list (ajuda) - ↑ Rong, Y; Wang T; Morgan J (2004). «Identification of candidate purkinje cell-specific markers by gene expression profiling in wild-type and pcd3j mice». Molecular Brain Research. 13 (2): 128–145. PMID 15582153. doi:10.1016/j.molbrainres.2004.10.015
- ↑ a b c Felizola SJ, Nakamura Y, Ono Y, Kitamura K, Kikuchi K, Onodera Y, Ise K, Takase K, Sugawara A, Hattangady N, Rainey WE, Satoh F, Sasano H (abril de 2014). «PCP4: a regulator of aldosterone synthesis in human adrenocortical tissues». Journal of Molecular Endocrinology. 52 (2): 159–167. PMC 4103644
 . PMID 24403568. doi:10.1530/JME-13-0248
. PMID 24403568. doi:10.1530/JME-13-0248
- ↑ a b Wei P, Blundon JA, Rong Y, Zakharenko SS, Morgan JI (2011). «Impaired locomotor learning and altered cerebellar synaptic plasticity in pep-19/PCP4-null mice». Mol. Cell. Biol. 31 (14): 2838–44. PMC 3133400
 . PMID 21576365. doi:10.1128/MCB.05208-11
. PMID 21576365. doi:10.1128/MCB.05208-11
- ↑ Putkey JA, Kleerekoper Q, Gaertner TR, Waxham MN (2004). «A new role for IQ motif proteins in regulating calmodulin function.». J. Biol. Chem. 278 (50): 49667–70. PMID 14551202. doi:10.1074/jbc.C300372200

- ↑ Kleerekoper QK, Putkey JA (2009). «PEP-19, an intrinsically disordered regulator of calmodulin signaling». J. Biol. Chem. 284 (12): 7455–64. PMC 2658041
 . PMID 19106096. doi:10.1074/jbc.M808067200
. PMID 19106096. doi:10.1074/jbc.M808067200
- ↑ Sotelo C, Rossi F (2013). «Purkinje Cell Migration and Differentiation». Handbook of the Cerebellum and Cerebellar Disorders: 147–178. ISBN 978-94-007-1332-1. doi:10.1007/978-94-007-1333-8_9
- ↑ Hoshino M (2006). «Molecular machinery governing GABAergic neuron specification in the cerebellum». Cerebellum. 5 (3): 193–198. PMID 16997750. doi:10.1080/14734220600589202
- ↑ Carletti B, Rossi F (2008). «Neurogenesis in the cerebellum». Neuroscientist. 14 (1): 91–100. PMID 17911211. doi:10.1177/1073858407304629
- ↑ Zordan P, Croci L, Hawkes R, Consalez GG (2008). «Comparative analysis of proneural gene expression in the embryonic cerebellum». Dev Dyn. 237 (6): 726–735. PMID 18498101. doi:10.1002/dvdy.21571

- ↑ Hess DC, Hill WD, Carroll JE, Borlongan CV (2004). «Do bone marrow cells generate neurons?». Archives of Neurology. 61 (4): 483–485. PMID 15096394. doi:10.1001/archneur.61.4.483

- ↑ Weimann JM, Johansson CB, Trejo A, Blau HM (2003). «Stable reprogrammed heterokaryons form spontaneously in Purkinje neurons after bone marrow transplant.». Nature Cell Biology. 5 (11): 959–966. PMID 14562057. doi:10.1038/ncb1053
- ↑ Alvarez-Dolado M, Pardal R, Garcia-Verdugo JM, Fike JR, Lee HO, Pfeffer K, Lois C, Morrison SJ, Alvarez-Buylla A (2003). «Fusion of bone-marrow-derived cells with Purkinje neurons, cardiomyocytes and hepatocytes.». Nature. 425 (6961): 968–973. Bibcode:2003Natur.425..968A. PMID 14555960. doi:10.1038/nature02069
|hdl-access=requer|hdl=(ajuda) - ↑ a b Felizola SJ, Katsu K, Ise K, Nakamura Y, Arai Y, Satoh F, Sasano H (2015). «Pre-B lymphocyte protein 3 (VPREB3) expression in the adrenal cortex: precedent for non-immunological roles in normal and neoplastic human tissues.». Endocrine Pathology. 26 (2): 119–28. PMID 25861052. doi:10.1007/s12022-015-9366-7
- ↑ Kemp K, Wilkins A, Scolding N (2014). «Cell fusion in the brain: two cells forward, one cell back.». Acta Neuropathologica. 128 (5): 629–638. PMC 4201757
 . PMID 24899142. doi:10.1007/s00401-014-1303-1
. PMID 24899142. doi:10.1007/s00401-014-1303-1
- ↑ Raman, I. M.; Bean, B. P. (1 de março de 1999). «Ionic currents underlying spontaneous action potentials in isolated cerebellar Purkinje neurons». The Journal of Neuroscience: The Official Journal of the Society for Neuroscience (5): 1663–1674. ISSN 0270-6474. PMC 6782167
 . PMID 10024353. Consultado em 2 de abril de 2022
. PMID 10024353. Consultado em 2 de abril de 2022
- ↑ Eric R. Kandel, James H. Schwartz, Thomas M. Jessell (2000).
- ↑ a b Llinás, R; Sugimori, M (1 de agosto de 1980). «Electrophysiological properties of in vitro Purkinje cell dendrites in mammalian cerebellar slices.». The Journal of Physiology (em inglês) (1): 197–213. PMC 1282967
 . PMID 7441553. doi:10.1113/jphysiol.1980.sp013358. Consultado em 2 de abril de 2022
. PMID 7441553. doi:10.1113/jphysiol.1980.sp013358. Consultado em 2 de abril de 2022
- ↑ Loewenstein Y, Mahon S, Chadderton P, Kitamura K, Sompolinsky H, Yarom Y, et al. (2005). «Bistability of cerebellar Purkinje cells modulated by sensory stimulation.». Nature Neuroscience. 8 (2): 202–211. PMID 15665875. doi:10.1038/nn1393
- ↑ Schonewille M, Khosrovani S, Winkelman BH, Hoebeek FE, DeJeu MT, Larsen IM, et al. (2006). «Purkinje cells in awake behaving animals operate at the up state membrane potential.». Nature Neuroscience. 9 (4): 459–461. PMID 16568098. doi:10.1038/nn0406-459

- ↑ Loewenstein Y, Mahon S, Chadderton P, Kitamura K, Sompolinsky H, Yarom Y, et al. (2006). «Purkinje cells in awake behaving animals operate at the up state membrane potential–Reply.». Nature Neuroscience. 9. 461 páginas. doi:10.1038/nn0406-461
- ↑ Yartsev MM, Givon-Mayo R, Maller M, Donchin O (2009). «Pausing Purkinje cells in the cerebellum of the awake cat.». Frontiers in Systems Neuroscience. 3. 2 páginas. PMC 2671936
 . PMID 19390639. doi:10.3389/neuro.06.002.2009
. PMID 19390639. doi:10.3389/neuro.06.002.2009
- ↑ a b Forrest MD (2014). «Intracellular Calcium Dynamics Permit a Purkinje Neuron Model to Perform Toggle and Gain Computations Upon its Inputs.». Frontiers in Computational Neuroscience. 8. 86 páginas. PMC 4138505
 . PMID 25191262. doi:10.3389/fncom.2014.00086
. PMID 25191262. doi:10.3389/fncom.2014.00086
- ↑ Kreitzer AC, Regehr WG (março de 2001). «Retrograde inhibition of presynaptic calcium influx by endogenous cannabinoids at excitatory synapses onto Purkinje cells». Neuron. 29 (3): 717–27. PMID 11301030. doi:10.1016/S0896-6273(01)00246-X

- ↑ Forrest MD, Wall MJ, Press DA, Feng J (dezembro de 2012). «The Sodium-Potassium Pump Controls the Intrinsic Firing of the Cerebellar Purkinje Neuron». PLOS ONE. 7 (12): e51169. Bibcode:2012PLoSO...751169F. PMC 3527461
 . PMID 23284664. doi:10.1371/journal.pone.0051169
. PMID 23284664. doi:10.1371/journal.pone.0051169
|nome1=sem|sobrenome1=em Editors list (ajuda) - ↑ Forrest MD (dezembro de 2014). «The sodium-potassium pump is an information processing element in brain computation». Frontiers in Physiology. 5 (472). 472 páginas. PMC 4274886
 . PMID 25566080. doi:10.3389/fphys.2014.00472
. PMID 25566080. doi:10.3389/fphys.2014.00472
- ↑ Cannon C (julho de 2004). «Paying the Price at the Pump: Dystonia from Mutations in a Na+/K+-ATPase». Neuron. 43 (2): 153–154. PMID 15260948. doi:10.1016/j.neuron.2004.07.002

- ↑ Calderon DP, Fremont R, Kraenzlin F, Khodakhah K (março de 2011). «The neural substrates of rapid-onset Dystonia-Parkinsonism». Nature Neuroscience. 14 (3): 357–65. PMC 3430603
 . PMID 21297628. doi:10.1038/nn.2753
. PMID 21297628. doi:10.1038/nn.2753
- ↑ Forrest MD (abril de 2015). «Simulation of alcohol action upon a detailed Purkinje neuron model and a simpler surrogate model that runs >400 times faster». BMC Neuroscience. 16 (27). 27 páginas. PMC 4417229
 . PMID 25928094. doi:10.1186/s12868-015-0162-6
. PMID 25928094. doi:10.1186/s12868-015-0162-6
- ↑ Forrest, Michael (abril de 2015). «the_neuroscience_reason_we_fall_over_when_drunk». Science 2.0. Consultado em 1 de maio de 2015
- ↑ a b Mitoma H, Adhikari K, Aeschlimann D, Chattopadhyay P, Hadjivassiliou M, Hampe CS, et al. (2016). «Consensus Paper: Neuroimmune Mechanisms of Cerebellar Ataxias.». Cerebellum (Review). 15 (2): 213–32. PMC 4591117
 . PMID 25823827. doi:10.1007/s12311-015-0664-x
. PMID 25823827. doi:10.1007/s12311-015-0664-x
- ↑ Jaber M (2017). «The cerebellum as a major player in motor disturbances related to Autistic Syndrome Disorders». Encephale (Review). 43 (2): 170–175. PMID 27616580. doi:10.1016/j.encep.2016.03.018
- ↑ Sapone A, Bai JC, Ciacci C, Dolinsek J, Green PH, Hadjivassiliou M, Kaukinen K, Rostami K, Sanders DS, Schumann M, Ullrich R, Villalta D, Volta U, Catassi C, Fasano A (2012). «Spectrum of gluten-related disorders: consensus on new nomenclature and classification». BMC Medicine (Review). 10. 13 páginas. PMC 3292448
 . PMID 22313950. doi:10.1186/1741-7015-10-13
. PMID 22313950. doi:10.1186/1741-7015-10-13
- ↑ a b c Hadjivassiliou M, Sanders DD, Aeschlimann DP (2015). «Gluten-related disorders: gluten ataxia». Dig Dis (Review). 33 (2): 264–8. PMID 25925933. doi:10.1159/000369509
- ↑ Stucki DM, Ruegsegger C, Steiner S, Radecke J, Murphy MP, Zuber B, Saxena S (agosto de 2016). «Mitochondrial impairments contribute to Spinocerebellar ataxia type 1 progression and can be ameliorated by the mitochondria-targeted antioxidant MitoQ» (PDF). Free Radic. Biol. Med. 97: 427–440. PMID 27394174. doi:10.1016/j.freeradbiomed.2016.07.005

- ↑ For references, see the extensive references and bibliography at the article on Cerebellar abiotrophy, linked at the beginning of this paragraph.
- ↑ Mavroudis, IA; Fotiou, DF; Adipepe, LF; Manani, MG; Njau, SD; Psaroulis, D; Costa, VG; Baloyannis, SJ (novembro de 2010). «Morphological changes of the human purkinje cells and deposition of neuritic plaques and neurofibrillary tangles on the cerebellar cortex of Alzheimer's disease». American Journal of Alzheimer's Disease & Other Dementias. 25 (7): 585–91. PMID 20870670. doi:10.1177/1533317510382892
- ↑ Fekadu, Makonnen (27 de março de 2009). «Rabies encephalitis, Negri bodies within the cytoplasm of cerebellar Purkinje cell neurons». CDC/Frontal Cortex Inc. Consultado em 21 de junho de 2013
Leitura adicional[editar | editar código-fonte]
- Llinás R, Hess R (julho de 1976). «Tetrodotoxin-resistant dendritic spikes in avian Purkinje cells». Proc. Natl. Acad. Sci. U.S.A. 73 (7): 2520–3. Bibcode:1976PNAS...73.2520L. PMC 430632
 . PMID 1065905. doi:10.1073/pnas.73.7.2520
. PMID 1065905. doi:10.1073/pnas.73.7.2520
- Llinás R, Sugimori M (agosto de 1980). «Electrophysiological properties of in vitro Purkinje cell somata in mammalian cerebellar slices». J. Physiol. 305: 171–95. PMC 1282966
 . PMID 7441552. doi:10.1113/jphysiol.1980.sp013357
. PMID 7441552. doi:10.1113/jphysiol.1980.sp013357 - Llinás RR, Sugimori M, Cherksey B (1989). «Voltage-dependent calcium conductances in mammalian neurons. The P channel». Ann. N. Y. Acad. Sci. 560 (1 Calcium Chann): 103–11. PMID 2545128. doi:10.1111/j.1749-6632.1989.tb24084.x
- Forrest, Michael (outubro de 2014). Biophysics and computations of the cerebellar Purkinje neuron. [S.l.]: CreateSpace. ISBN 978-1502454546
