Redução de nitrilas
Em redução de nitrilas, uma nitrila é reduzida a uma amina ou a um aldeído na presença de um reagente químico adequado.[1][2]
Hidrogenação catalítica[editar | editar código-fonte]
A hidrogenação catalítica de nitrilas é, frequentemente, a rota mais econômica disponível para a produção de aminas primárias.[3] Os catalisadores usados na reação geralmente incluem metais do grupo 10, como níquel de Raney (à base de níquel),[4][5][6] negro de paládio ou dióxido de platina.[7] No entanto, outros catalisadores, como boreto de cobalto, também podem ser seletivos para a produção de aminas primárias:
Uma aplicação comercial dessa tecnologia é a produção de hexametilenodiamina a partir de adiponitrila, um precursor do Nylon 66.[8]
A depender das condições reacionais, as iminas intermediárias também podem sofrer ataques pelo hidrogênio, gerando aminas secundárias e terciárias:
Tais reações prosseguem via intermediários enamina.[9] A condição reacional mais importante para a produção seletiva de aminas primárias é a escolha do catalisador.[7] Outros fatores importantes incluem a escolha do solvente, o pH da solução, os efeitos estéricos e a temperatura e a pressão do hidrogênio.
Reduções estequiométricas[editar | editar código-fonte]
Agentes redutores para a conversão não-catalítica em aminas incluem hidreto de alumínio e lítio, boro-hidreto de lítio,[10] diborano[11] e sódio elementar em solventes alcoólicos.[12]
A aldeídos[editar | editar código-fonte]
Nitrilas também podem ser reduzidas a aldeídos. A síntese de aldeídos de Stephen usa cloreto de estanho (II) e ácido clorídrico para produzir um aldeído através da hidrólise de um sal de imínio resultante. Aldeídos também podem formar-se usando um doador de hidreto seguido da hidrólise in situ de uma imina. Reagentes úteis para essa reação são ácido fórmico com hidrogenação catalítica[13] ou hidretos metálicos que são usados para adicionar hidrogênio à nitrila. Por exemplo, boro-hidreto de sódio reduz nitrilas a solventes alcoólicos com um catalisador de CoCl2 ou com níquel Raney.[14] O agente redutor hidreto de di-isobutilalumínio, ou DIBAL-H, é outro hidreto de metal comumente utilizado. DIBAL-H atua como uma fonte de hidreto, adicionando um íon hidreto ao carbono da nitrila. A imina resultante é um intermediário relativamente estável que pode ser hidrolisado a aldeído.[15]
Mecanismo[editar | editar código-fonte]
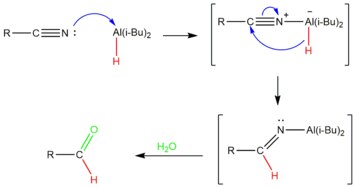
DIBAL-H é adicionado em quantidades controladas em baixas temperaturas para se realizar a redução parcial da nitrila.[16] O átomo de alumínio no DIBAL atua como um ácido de Lewis, aceitando um par de elétrons da nitrila. Esta é, então, reduzida pela transferência de um íon hidreto para o carbono da ligação tripla carbono-nitrila, produzindo-se uma imina. Após um processamento com água, o complexo de alumínio é hidrolisado para produzir o aldeído desejado.[17] Como o processamento hidrolítico gera o aldeído ao final, a nitrila não sofre redução excessiva.
Métodos eletroquímicos[editar | editar código-fonte]
Nitrilas aromáticas também podem ser reduzidas eletroquimicamente.[18][19]
Ver também[editar | editar código-fonte]
Referências[editar | editar código-fonte]
- ↑ Nishimura, Shigeo (2001). Handbook of Heterogeneous Catalytic Hydrogenation for Organic Synthesis 1a ed. New York: Wiley-Interscience. pp. 254–277. ISBN 9780471396987
- ↑ MARCH, Jerry (1985). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure 3ª ed. Nova Iorque: Wiley. pp. 254–277. ISBN 0-471-85472-7
- ↑ Karsten, Eller; Henkes, Erhard; Rossbacher, Roland; Höke, Hartmut (2000). «Amines, Aliphatic». Ullmann's Encyclopedia of Industrial Chemistry. ISBN 3527306730. doi:10.1002/14356007.a02_001
- ↑ Biggs, B. S.; Bishop., W. S. (1947). «Decamethylenediamine». Organic Syntheses. 29: 18. doi:10.15227/orgsyn.027.0018
- ↑ Allen, C. F. H.; Wilson, C. V. (1947). «2,4-Diphenylpyrrole». Organic Syntheses. 27: 33. doi:10.15227/orgsyn.027.0033
- ↑ Robinson, John C.; Snyder, H. R. (1943). «β-Phenylethylamine». Organic Syntheses. 23: 71. doi:10.15227/orgsyn.023.0071
- ↑ a b Nishimura, Shigeo (2001). Handbook of Heterogeneous Catalytic Hydrogenation for Organic Synthesis 1ª ed. Nova Iorque: Wiley-Interscience. pp. 254–277. ISBN 9780471396987
- ↑ Musser, Michael Tuttle (2000). «Adipic Acid». Ullmann's Encyclopedia of Industrial Chemistry. ISBN 3527306730. doi:10.1002/14356007.a01_269
- ↑ Barrault, J. (1997). «Synthesis of fatty amines. Selectivity control in presence of multifunctional catalysts». Catalysis Today. 37 (2): 137–153. doi:10.1016/S0920-5861(97)00006-0
- ↑ Ookawa, Atsuhiro; Soai, Kenso (1986). «Mixed solvents containing methanol as useful reaction media for unique chemoselective reductions within lithium borohydride». The Journal of Organic Chemistry. 51 (21): 4000–4005. doi:10.1021/jo00371a017
- ↑ Hutchins, R. O.; Maryanoff, B. E. (1973). «2-tert-Butyl-1,3-diaminoproane». Organic Syntheses. 53: 21. doi:10.15227/orgsyn.053.0021
- ↑ Suter, C. M.; Moffett, Eugene W. (1934). «The Reduction of Aliphatic Cyanides and Oximes with Sodium and n-Butyl Alcohol». Journal of the American Chemical Society. 56 (2). 487 páginas. doi:10.1021/ja01317a502
- ↑ van Es, T.; Staskun, B. (1971). «4-Formylbenzenesulfonamide». Organic Syntheses. 51: 20. doi:10.15227/orgsyn.051.0020
- ↑ 17-, Smith, Michael, 1946 October (2001). March's advanced organic chemistry : reactions, mechanisms, and structure. 5ª ed. Nova Iorque: Wiley. ISBN 9780471585893. OCLC 43936853
- ↑ Carey, F. A.; Sundberg, R. J.; Advanced Organic Chemistry, Part B: Reactions and Synthesis
- ↑ 1937-, Carey, Francis A. (2000). Advanced organic chemistry 4ª ed. Nova Iorque: Kluwer Academic/Plenum Pub. ISBN 0306462435. OCLC 43555205
- ↑ Solomons, T. W. Graham; Fryhle, Craig B.; Snyder, S. A. (2014). Organic Chemistry (PDF). Nova Iorque: Wiley
- ↑ V. Krishnan; A. Muthukumaran; H. V. K. Udupa (1979). «The electroreduction of benzyl cyanide on iron and cobalt cathodes». Journal of Applied Electrochemistry. 9 (5): 657–659. doi:10.1007/BF00610957
- ↑ V. Krishnan; A. Muthukumaran; H. V. K. Udupa (1983). Process for Electrochemical Preparation of beta phenylethylamine using cobalt black cathode (PDF). Calcutta: India Patent Office



