Cloreto de cálcio: diferenças entre revisões
m r2.7.2) (Robô: A adicionar: sk:Chlorid vápenatý |
|||
| Linha 80: | Linha 80: | ||
Irritante. Usar luvas e óculos. |
Irritante. Usar luvas e óculos. |
||
* É considerado agente agressivo do aço, não é indicado para uso em estruturas de concreto armado. |
* É considerado agente agressivo do aço, não é indicado para uso em estruturas de concreto armado. Pode no entanto ser usado em abstracto armado! |
||
{{Referências|col=2}} |
{{Referências|col=2}} |
||
Revisão das 18h02min de 25 de agosto de 2012
| Calcium chloride Alerta sobre risco à saúde | |
|---|---|

| |
| |
| Nome IUPAC | Cloreto de cálcio |
| Outros nomes | Calcium(II) chloride, Calcium dichloride, E509 |
| Identificadores | |
| Número CAS | , 22691-02-7 (monohydrate) 10035-04-8 (dihydrate) 25094-02-4 (tetrahydrate) 7774-34-7 (hexahydrate) |
| PubChem | |
| Número EINECS | |
| Número RTECS | EV9800000 |
| Propriedades | |
| Fórmula molecular | CaCl2 |
| Massa molar | 110.98 g/mol (anhydrous) 128.999 g/mol (monohydrate) 147.014 g/mol (dihydrate) 183.045 g/mol (tetrahydrate) 219.08 g/mol (hexahydrate) |
| Aparência | white solid |
| Densidade | 2.15 g/cm3 (anhydrous) 1.835 g/cm3 (dihydrate) 1.83 g/cm3 (tetrahydrate) 1.71 g/cm3 (hexahydrate) |
| Ponto de fusão |
772 °C (anhydrous) |
| Ponto de ebulição |
1935 °C (anhydrous) |
| Solubilidade em água | 74.5 g/100mL (20 °C) 59.5 g/100 mL (0 °C) |
| Solubilidade em alcohol | soluble |
| Acidez (pKa) | 8-9 (anhydrous) 6.5-8.0 (hexahydrate) |
| Estrutura | |
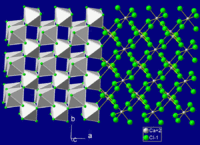
| Estrutura cristalina | Orthorhombic (deformed rutile), oP6 |
| Grupo de espaço | Pnnm, No. 58 |
| Geometria de coordenação |
octahedral, 6-coordinate |
| Riscos associados | |
| Classificação UE | Irritant (Xi) |
| Índice UE | 017-013-00-2 |
| Frases R | R36 |
| Frases S | S2, S22, S24 |
| LD50 | 1000 mg/kg (oral, rat) |
| Compostos relacionados | |
| Outros aniões/ânions | Fluoreto de cálcio Brometo de cálcio Iodeto de cálcio Sulfeto de cálcio Hipoclorito de cálcio Clorato de cálcio |
| Outros catiões/cátions | Cloreto de magnésio Cloreto de estrôncio Cloreto de bário Cloreto de potássio Cloreto de escândio (III) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Cloreto de cálcio é um composto químico formado por cálcio e cloro. É extremamente solúvel em água e é deliquescente. É um sal que se apresenta no estado sólido à temperatura ambiente e comporta-se como um típico haleto iônico. Tem muitas aplicações comuns como em salmoura para máquinas de refrigeração, controlo (controle, no Brasil) de pó e gelo nas estradas, e no cimento. Pode ser produzido diretamente a partir da pedra calcária, mas grandes quantidades são também produzidas como produto do processo Solvay. Por causa de sua natureza higroscópica, deve ser mantido em contêineres bem selados.
Propriedades químicas
O cloreto de cálcio (CaCl2) pode servir de fonte para outros compostos de cálcio, por exemplo, por precipitação:
3 CaCl2(aq) + 2 K3PO4(aq) → Ca3(PO4)2(s) + 6 KCl(aq)
CaCl2 fundido pode ser electrolisado para dar o metal cálcio:
Preparação
O cloreto de cálcio é um produto resultante do processo de dissolução usado na preparação de carbonato de sódio. Também pode ser produzido fazendo reagir ácido clorídrico com carbonato de cálcio.
CaCO3(s) + 2 HCl → CaCl2(aq) + H2O(l) + CO2(g)
Usos
Milhões de toneladas de cloreto de cálcio são produzidas nos EUA, e em 1990 seu preço de atacado era $182 por tonelada. Suas aplicações são muitas:
- Por causa de sua forte higroscopia, pode ser usado para secar o ar, assim como outros gases e líquidos orgânicos. Durante o processo, é convertido em salmoura conforme absorve a água ou o vapor de água da substância a ser secada:
- CaCl2 + 2 H2O → CaCl2·2H2O
- O processo de dissolvimento é altamente exotérmico e rapidamente produz temperaturas de cerca de 60°C (140°F). Pode resultar em queimaduras se humanos ou animais ingerirem pastilhas secas de cloreto de cálcio. Crianças pequenas estão mais sucetíveis a queimaduras que os adultos. Portanto, pastilhas de coleto de cálcio devem ser mantidas longe do seu alcance.
- Pelo intenso calor envolvido durante a dissolução, o cloreto de cálcio é também usado como um componente para derretimento de gelo. Diferentemente do sal cloreto de sódio, mais comum, é relativamente prejudicial às plantas e ao solo. É também mais efetivo em baixas temperaturas do que o cloreto de sódio. Quando distribuído para este uso, geralmente leva a forma de bolinhas brancas com alguns milímetros de diâmetro.
- É usado em misturas de concreto para acelerar o ajuste inicial e fortalecer o concreto.
- É usado para o controle da poeira em algumas rodovias, já que sua natureza higroscópica mantém uma camada de líquido sobre a superfície da estrada, o que retém a poeira.
- O cloreto de cálcio tem um gosto extremamente salgado e é usado como ingrediente em algumas comidas para dar um gosto salgado sem que aumente o conteúdo de sódio da comida.
- Em uma cirurgia de coração o uso de cloreto de cálcio serve para : sobrecarregar as plaquetas e aumentar a coagulação.
Precauções
Irritante. Usar luvas e óculos.
- É considerado agente agressivo do aço, não é indicado para uso em estruturas de concreto armado. Pode no entanto ser usado em abstracto armado!
Referências
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, Oxford, UK, 1997.
- Handbook of Chemistry and Physics, 71ª edição, CRC Press, Ann Arbor, Michigan, 1990.
