Phaeophyceae
| Phaeophyceae algas castanhas | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Classificação científica | |||||||||||
| |||||||||||
| Subclasses e ordens | |||||||||||
| |||||||||||
| Sinónimos | |||||||||||






Phaeophyceae (do grego φαιός : castanho, sombrio) é uma classe de algas sempre pluricelulares, conhecidas por feofíceas,[2] algas castanhas ou algas pardas, complexas do ponto de vista anatómico e morfológico, fundamentalmente marinhas, ainda que 6 géneros sejam de água doce, que privilegiam habitats de águas frias e bem oxigenadas. O taxon agrupa cerca de 265 géneros, com umas 1500-2000 espécies,[3][4] com dimensões que variam desde organismos microscópicos até outros com talos de 60 m de comprimento. Estas algas apresentam uma característica cor castanho-esverdeada devido à presença das clorofilas a e c em conjunto com o pigmento fucoxantina e outras xantofilas e carotenos. Entre os membros deste grupo estão os principais produtores primários que suportam várias comunidades de animais e protistas, sendo os mais importantes as bodelhas e as laminárias (os kelps), incluindo-se entre estas últimas as algas de maiores dimensões que se conhecem. Algumas espécies, como Ascophyllum nodosum, apresentam elevada importância económica, sendo objecto de recolha e processamento industrial em grande escala.[5]
Não são verdadeiras plantas, pois são incluídas no grupo Stramenopiles, no qual, em algumas classificações, constituem a divisão Phaeophyta. Actualmente o grupo Phaeophyceae está classificada no supergrupo SAR dos Chromalveolata, juntamente com, entre outros, os grupos Opalinata, Oomycetes, Hyphochytriomycetes, Bacillariophyta e Xanthophyceae.
Descrição
[editar | editar código-fonte]A maioria das algas do grupo Phaeophyceae ocorre nas costas rochosas das zonas temperadas e subpolares, dominando nessas regiões a zona entremarés, com destaque para as Fucales e Laminariales. O género Macrocystis, que forma bosques submarinos de grande extensão, pode alcançar até 60 m de comprimento. O grupo também inclui formas flutuantes livres, como o género Sargassum, que recobre grandes extensões do oceano, por vezes muitos milhares de quilómetros quadrados, como por exemplo no Mar dos Sargaços no Atlântico Norte subtropical.
As Phaeophyceae incluem formas pluricelulares, com verdadeira tecidos diferenciados. Geralmente apresentam rizoide, estipe e lâminas. O estipe de algumas formas pode estar provido de um conjunto de tubos (crivo) capazes de transportar água e produtos da fotossíntese. Como pigmentos fotossintéticos apresentam clorofilas a, c1 e c2 e como pigmento acessório a fucoxantina. Este último pigmento é responsável pela coloração acastanhada que caracteriza estas algas. Os cloroplastos estão rodeados por quatro membranas, pelo que se supõe serem o resultando da endossimbiose secundária de uma Rhodophyta (alga vermelha).
Morfologia
[editar | editar código-fonte]Existem algas castanhas com uma ampla variedade de tamanhos e formas. Os membros mais pequenos do grupo são algas microscópicas que apresentam apenas algumas poucas células. Outras crescem como penachos de células filiformes com apenas alguns centímetros de comprimento.[6] Outros grupos crescem até atingir grandes dimensões, como por exemplo os kelp e os sargaços, sendo com frequência as algas mais visíveis dos seus habitats.[7] Os kelps podem variar em tamanho desde os 50 cm da palma-do-mar (Postelsia) até aos 60 m da alga gigante Macrocystis pyrifera, que é a maior de todas as algas conhecidas.[8][9]
No que respeita à forma, as algas castanhas compreendem desde pequenas crostas pegadas ao substrato até frondosas «florestas» flutuantes formadas por espécies do género Sargassum (sargaços).[10] A morfologia varia entre delicadas membranas de células, como em Ectocarpus, até amplas ramagens aplanadas em forma de leque, como em Padina.
Sem embargo das diferenças em tamanho ou forma, duas características visíveis distinguem as Phaeophyceae de todas as demais algas: (1) os membros do grupo apresentam uma coloração característica, que vai desde verde oliva a vários tons de castanho, sendo que em cada caso o tom da coloração depende da quantidade de fucoxantina presente;[11] e (2) todas as algas castanhas são pluricelulares, não se conhecendo qualquer espécie que exista como células individuais ou como colónias de células.[11]
As características atrás apontadas fazem com que as algas castanhas sejam o único grupo importante de algas que não inclui tais formas. Contudo, esta característica pode ser o resultado da classificação e não uma consequência da evolução do grupo, já que todos os grupos que são filogeneticamente próximos das algas castanhas incluem formas unicelulares ou coloniais.
- Talo
Qualquer que seja a sua forma, o corpo das algas castanhas recebe a designação de talo, o que significa que carece da complexidade de tecidos como o xilema e o floema das plantas vasculares. Isto não significa que as algas castanhas careçam por completo de estruturas especializadas, mas como os botânicos definem (os verdadeiros) caules, folhas e raízes pela presença destes tecidos, a sua ausência nas algas castanhas obriga a que as estruturas equivalentes a caules e folhas presentes em alguns grupos destas algas sejam descritas utilizando terminologia diferente.[12] Ainda que nem todas as algas castanhas sejam estruturalmente complexas, tipicamente apresentam uma ou mais partes características diferenciadas.
- Rizoide
O rizoide é uma estrutura equivalente à raiz das plantas vasculares, presente na base da alga, que serve para a fixar ao substrato e que, ao contrário da raiz, não é utilizada como o órgão principal para a captação de água e de nutrientes. A aparência do rizoide nas algas castanhas é variado: poder ser muito ramificado, semelhante a uma raiz de planta vascular, ou ter forma de disco ou bolbo.
- Estipe
O estipe, equivalente ao caule das plantas vasculares, pode crescer como uma estrutura curta na base da alga, como no género Laminaria, ou crescer até se converter numa grande estrutura, como nos géneros Sargassum e Macrocystis. Nas algas castanhas mais estruturalmente diferenciadas, tais como as do género Fucus, os tecidos do interior do estipe dividem-se em três camadas ou regiões distintas. Estas regiões incluem uma medula central, um córtex circundante e uma epiderme externa, cada uma das quais assumindo uma posição e função análogas às correspondentes estruturas do caule de uma planta vascular. Em algumas algas castanhas, a região da medula inclui um núcleo de células alongadas que se assemelham ao floema das plantas vasculares, tanto em estrutura como função. Em outras, como no género Nereocystis, o centro do estipe é oco, estando preenchido por gás que serve de sustentação, por boiância, à alga, mantendo-a erecta. O estipe pode ser relativamente flexível e elástico em espécies como Macrocystis pyrifera, que crescem em águas com correntes fortes, ou poden ser mais rígidos em géneros como Postelsia, que estão expostos à atmosfera durante a maré baixa.
- Lâmina
As lâminas são as partes planas das algas, equivalentes às folhas nas plantas vasculares. Algumas algas castanhas apresentam uma única lâmina, enquanto outras apresentam numerosas lâminas, nalguns casos com morfologia diferenciada. As lâminas podem ocorrer unidas directamente ao estipe, directamente ao rizoide quando o estipe está ausente, ou pode haver uma câmara de ar entre o estipe e a lâmina. A superfície da lâmina pode ser lisa ou enrugada, com tecidos que podem ser delgados e flexíveis ou grossos e coreáceos. Em algumas espécies, como Egregia menziesii, esta característica pode variar dependendo da turbulência das águas em que o espécime cresce.[6] Em outras espécies, a superfície da lâmina está adaptada a ser recoberta com limo para desencorajar a fixação de epífitas e para dissuadir os herbívoros. As lâminas são frequentemente a parte da alga que suporta as estruturas reprodutivas.
Em algumas algas deste grupo ocorrem vesículas cheias de gás, denominadas pneumatocistos, que proporcionam flutuabilidade à lâmina, em especial entre as laminárias e os membros do grupo das Fucales. Estas estruturas em forma de bexiga localizam-se nas lâminas, ou próximas a elas, para as manter mais próximas da superfície da água para que assim recebam mais luz para a fotossíntese. Os pneumatocistos são geralmente esféricos ou elipsoidais, mas podem variar de forma entre as diferentes espécies. Espécies como Nereocystis luetkeana e Pelagophycus porra apresentam um único grande pneumatocisto entre a parte superior do estipe e a base das lâminas. Pelo contrário, a alga gigante Macrocystis pyrifera apresenta muitas lâminas ao longo do estipe, com um pneumatocisto na base de cada lâmina, onde estas se unem ao estipe central. As espécies de Sargassum também apresentam múltiplas lâminas e pneumatocistos, mas ambos os tipos de estruturas estão unidas separadamente ao estipe por caules curtos. Nas espécies de Fucus, os pneumatocistos desenvolvem-se dentro da própria lâmina, seja como vesículas esféricas individuais ou como regiões alongadas cheias de gás que seguem o contorno da lâmina em que se desenvolvem.
Crescimento
[editar | editar código-fonte]
As algas castanhas são as algas marinhas de maiores dimensões e de mais rápido crescimento.[6] As lâminas de Macrocystis podem crescer até 50 cm por dia, podendo os estipes crescer até 6 cm por dia.[13]
O crescimento das algas castanhas ocorre no extremo das estruturas como resultado das divisões de uma única célula apical ou numa fila de células desse tipo.[7] Quando esta célula apical se divide, as novas células que produz dão lugar a todos os tecidos da alga. As ramificações e outras estruturas laterais aparecem quando a célula apical se divide para produzir duas novas células apicais. Apesar disso, alguns grupos, como o género Ectocarpus, crescem de forma difusa, pois a produção de novas células pode ocorrer em qualquer parte do talo.[11]
Organização dos tecidos
[editar | editar código-fonte]As algas castanhas mais simples são filamentosas, com as células alongadas na direcção do crescimento, separadas por septos. Estas algas ramificam-se mediante a formação de extremos mais largos que se dividem na ampliação.[14]
Para além das formas filamentosas, há dois tipos principais de organização dos tecidos nas algas castanhas: pseudoparenquimatoso (haplóstico) e parenquimatoso (polístico).[15] As lâminas podem ser do tipo multiaxial ou monoaxial.
A parede celular é composta por duas camadas: (1) a camada interior composta de celulose, mais resistente, que serve de sustentação; e (2) a camada exterior, composta principalmente de algina, pegajosa quando está molhada, mas que se torna dura e quebradiça quando seca.[15]
Ciclo de vida
[editar | editar código-fonte]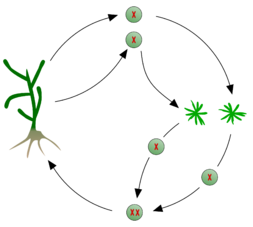
As espécies de algas castanhas são todas multicelulares e apresentam sempre reprodução sexual, ainda que exista uma grande variabilidade entre grupos. A reprodução sexual pode ser por isogamia, anisogamia ou oogamia. Neste último caso, os gametófitos podem ser femininos ou masculinos, dando lugar a óvulos e espermatozoides, respectivamente. Estes últimos são biflagelados, com um flagelo eucariota mastigonemado, dirigido para diante, e outro liso, dirigido para trás. A união dos gâmetas ode ter lugar na água ou, no caso da oogamia, no oogónio. O zigoto germina em resposta a determinadas condições de luz.
Apesar da constância dos traços gerais acima descritos, o ciclo de vida das algas castanhas apresenta grande variabilidade de grupo para grupo, sendo contudo possível distinguir dois tipos de ciclos básicos:
- Monogénetico — com um só tipo de geração, pois o zigoto dá directamente lugar a novos gametófitos, fechando o ciclo. Este tipo de ciclo de vida é característico das Fucales.
- Digenético — com alternância de gerações. O organismo diploide que se desenvolve a partir do zigoto recebe o nome de esporófito e produz esporos. Os esporos ao germinarem dão origem a novos gametófitos, fechando o ciclo. Neste tipo de ciclo de vida tanto existem ciclos isomórficos (ou monomórficos), nos quais os esporófitos e gametófitos apresentam uma forma similar, como ciclos heteromórficos (ou dimórficos) nos quais os esporófitos e os gametófitos são diferentes. Neste último caso, pode dominar o esporófito ou o gametófito. Por exemplo, o ciclo vital do géneros Laminaria consiste numa geração diploide, que é a grande alga, a qual produz esporângios de estrutura microscópica especializada que se dividem por meiose antes dos esporos serem libertadas. Neste caso são produzidos igual número de esporos haploides masculinas e femininos.[3][16]
Reprodução
[editar | editar código-fonte]As algas castanhas reproduzem-se tanto sexuaada como assexuadamente, dependendo da espécie. No entanto, todas as células reprodutivas móveis produzidas por organismos integrados nesta classe são flageladas e nela não existem organismos flagelados de vida livre.[17] A estrutura anatómica e a morfologia das algas castanhas consoante a família e o género, pelo que em consequência os zoóides são produzidos de várias maneiras. Os gâmetas e os zoósporos assexuados podem ser produzidos em zoidângios pluriloculares nos talos maiores das algas castanhas.[17] No entanto, em talos menor ocorrem zoidângios uniloculares que produzem células reprodutivas sexuadas ou assexuadas.[18]
A complexidade morfológica das estruturas reprodutoras das algas castanhas levou a desenvolvimento de uma terminologia específica:[17]
- Plurilocular — muitos lóculos (câmaras), cada um dos quais produz um zóide;
- Unilocular — uma lóculo, mas que em alguns casos pode produzir vários gâmetas;
- Gametângio plurilocular — estrutura que possui muitos lóculos que produzem gâmetas haplóides;
- Esporângio plurilocular — estrutura que possui muitos lóculos que produzem esporos diplóides;
- Zoidângio plurilocular — termo colectivo para designar o conjunto dos gametângios plurilocular e esporângios pluriloculares;
- Plurizóide — zóide produzidos num zoidângio plurilocular;
- Esporângio unilocular — pode produzir meiósporos ou esporos assexuais;
- Zoidângia unilocular — sinónimo de esporângio unilocular;
- Unizóide — zóide produzido num zoidângio unilocular.
Os zóides de algas castanhas têm os mesmos dois flagelos básicos presentes nos restantes heterocontes, mas a orientação dos flagelos é única nas Phaeophyceae. Em geral, os flagelos são ambos inseridos lateralmente.[17]
Classificação
[editar | editar código-fonte]As algas castanhas pertencem ao filo Stramenopiles (eucariotas com flagelos do tipo heteroconto),[19] um extenso grupo de organismos eucariotas que se distinguem por apresentarem cloroplastos rodeados por quatro membranas, o que sugere uma origem numa relação simbiótica entre um eucarionte basal e um eucarionte fotossintético.
A maioria das algas castanhas contêm o pigmento fucoxantina, que lhes confere a distintivo coloração verde-acastanhada que está na etimologia do nome do grupo. As algas castanhas são o único grupo de heterocontos em que existem organismos multicelulares com tecidos diferenciados, mas reproduzem-se por meio de esporos flagelados que se assemelham a outras células dos Stramenopiles. Os estudos genéticos e filogenéticos demonstram que os seus parentes mais próximos são as as Xanthophyceae, o táxon que agrupa as algas verde-amareladas.
As algas castanhas aparecem no registo fóssil desde o Mesozóico, possivelmente já no Jurássico. A sua presença como fóssil é rara, devido a terem um corpo geralmente brando que é facilmente decomposto. Outros grupos de algas, como as algas vermelhas (Rhodophyta) e as algas verdes (Chlorophyta), incluem alguns membros calcários, que são mais propensos a deixar marcas no registo fóssil do que os órgãos brandos das algas castanhas. Foram encontrados os fósseis do Mioceno de uma grande alga castanhas de corpo brando, Julescrania, em bom estado de conservação numa formação diatomítica de Monterey (Califórnia). Conhecem-se também alguns outros escassos exemplares de maior antiguidade no registo fóssil, ainda que a sua identificação seja difícil.[20]
Apesar de persistirem algumas dúvidas sobre a circunscrição taxonómica do agrupamento e sobre a filogenia de alguns dos táxons subordinados, presentemente a classe Phaeophyceae inclui as seguintes ordens extantes:[21]
|
|
Com base nos modernos sistemas de classificação assentes em critérios moleculares, morfológicos e ontogénicos, tendo em conta as diferenças na estrutura das células, as 18 ordens extantes da classe Phaeophyceae apresentam seguinte número de espécies validamente descritas:[22]
| Ordem | Espécies |
|---|---|
| Ectocarpales Bessey | 693 |
| Fucales Bory de Saint-Vincent | 524 |
| Dictyotales Bory de Saint-Vincent | 239 |
| Laminariales Migula | 130 |
| Sphacelariales Migula | 82 |
| Ralfsiales Nakamura ex Lim & Kawai | 54 |
| Desmarestiales Setchell & Gardner | 33 |
| Sporochnales Sauvageau | 29 |
| Cutleriales Bessey | 11 |
| Tilopteridales Bessey | 9 |
| Scytothamnales Peters & Clayton | 8 |
| Onslowiales Draisma & Prud'homme van Reine | 4 |
| Syringodermatales Henry | 4 |
| Asterocladales Silberfeld et al. | 3 |
| Discosporangiales Schmidt | 3 |
| Ishigeales Cho & Boo | 3 |
| Ascoseirales Petrov | 1 |
| Nemodermatales Parente et al. | 1 |
Filogenia
[editar | editar código-fonte]O posicionamento filogenético do agrupamento Phaeophyceae, tal como o dos restantes grupos de protistas incluídos entre os Stramenopiles, continua incerto. Com base em trabalhos recentes (2015-2016) sobre a filogenia dos eucariotas é possível estabelecer o seguinte cladograma:[23][24]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Com base no trabalhos publicados por Silberfeld, Rousseau & de Reviers 2014[25] é possível estabelecer a seguinte árvore filogenética estabelecendo as relações entre as ordens e famílias que integram as Phaeophyceae:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Taxonomia
[editar | editar código-fonte]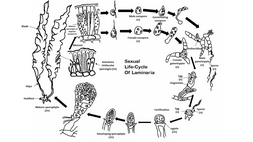

A classe Phaeophyceae inclui as seguintes ordens:[25][26]
- Classe Phaeophyceae Hansgirg 1886 [Fucophyceae; Melanophycidae Rabenhorst 1863 stat. nov. Cavalier-Smith 2006]
- Subclasse Discosporangiophycidae Silberfeld, Rousseau & Reviers 2014
- Ordem Discosporangiales Schmidt 1937 emend. Kawai et al. 2007
- Família Choristocarpaceae Kjellman 1891
- Família Discosporangiaceae Schmidt 1937
- Ordem Discosporangiales Schmidt 1937 emend. Kawai et al. 2007
- Subclasse Ishigeophycidae Silberfeld, Rousseau & Reviers 2014
- Ordem Ishigeales Cho & Boo 2004
- Família Ishigeaceae Okamura 1935
- Família Petrodermataceae Silberfeld, Rousseau & Reviers 2014
- Ordem Ishigeales Cho & Boo 2004
- Subclasse Dictyotophycidae Silberfeld, Rousseau & Reviers 2014
- Ordem Dictyotales Bory de Saint-Vincent 1828 ex Phillips et al.
- Família Dictyotaceae Lamouroux ex Dumortier 1822 [Scoresbyellaceae Womersley 1987; Dictyopsidaceae]
- Ordem Onslowiales Draisma & Prud’homme van Reine 2008
- Família Onslowiaceae Draisma & Prud’homme van Reine 2001
- Ordem Sphacelariales Migula 1909
- Família Cladostephaceae Oltmanns 1922
- Família Lithodermataceae Hauck 1883
- Família Phaeostrophiaceae Kawai et al. 2005
- Família Sphacelariaceae Decaisne 1842
- Família Sphacelodermaceae Draisma, Prud’homme & Kawai 2010
- Família Stypocaulaceae Oltmanns 1922
- Ordem Syringodermatales Henry 1984
- Família Syringodermataceae Henry 1984
- Ordem Dictyotales Bory de Saint-Vincent 1828 ex Phillips et al.
- Subclasse Fucophycidae Cavalier-Smith 1986
- Ordem Ascoseirales Petrov1964 emend. Moe & Henry 1982
- Família Ascoseiraceae Skottsberg 1907
- Ordem Asterocladales T.Silberfeld et al. 2011
- Família Asterocladaceae Silberfeld et al. 2011
- Ordem Desmarestiales Setchell & Gardner 1925
- Família Arthrocladiaceae Chauvin 1842
- Família Desmarestiaceae (Thuret) Kjellman 1880
- Ordem Ectocarpales Bessey 1907 emend. Rousseau & Reviers 1999a [Chordariales Setchell & Gardner 1925; Dictyosiphonales Setchell & Gardner 1925; Scytosiphonales Feldmann 1949]
- Família Acinetosporaceae Hamel ex Feldmann 1937 [Pylaiellaceae; Pilayellaceae]
- Família Adenocystaceae Rousseau et al. 2000 emend. Silberfeld et al. 2011 [Chordariopsidaceae]
- Família Chordariaceae Greville 1830 emend. Peters & Ramírez 2001 [Myrionemataceae]
- Família Ectocarpaceae Agardh 1828 emend. Silberfeld et al. 2011
- Família Petrospongiaceae Racault et al. 2009
- Família Scytosiphonaceae Ardissone & Straforello 1877 [Chnoosporaceae Setchell & Gardner 1925]
- Ordem Fucales Bory de Saint-Vincent 1827 [Notheiales Womersley 1987; Durvillaeales Petrov 1965]
- Família Bifurcariopsidaceae Cho et al. 2006
- Família Durvillaeaceae (Oltmanns) De Toni 1891
- Família Fucaceae Adanson 1763
- Família Himanthaliaceae (Kjellman) De Toni 1891
- Família Hormosiraceae Fritsch 1945
- Família Notheiaceae Schmidt 1938
- Família Sargassaceae Kützing 1843 [Cystoseiraceae De Toni 1891]
- Família Seirococcaceae Nizamuddin 1987
- Família Xiphophoraceae Cho et al. 2006
- Ordem Laminariales Migula 1909 [Phaeosiphoniellales Silberfeld, Rousseau & Reviers 2014 ord. nov. prop.]
- Família Agaraceae Postels & Ruprecht 1840 [Costariaceae]
- Família Akkesiphycaceae Kawai & Sasaki 2000
- Família Alariaceae Setchell & Gardner 1925
- Família Aureophycaceae Kawai & Ridgway 2013
- Família Chordaceae Dumortier 1822
- Família Laminariaceae Bory de Saint-Vincent 1827 [Arthrothamnaceae Petrov 1974]
- Família Lessoniaceae Setchell & Gardner 1925
- Família Pseudochordaceae Kawai & Kurogi 1985
- Ordem Nemodermatales Parente et al. 2008
- Família Nemodermataceae Kuckuck ex Feldmann 1937
- Ordem Phaeosiphoniellales Silberfeld, Rousseau & Reviers 2014
- Família Phaeosiphoniellaceae Phillips et al. 2008
- Ordem Ralfsiales Nakamura ex Lim & Kawai 2007
- Família Mesosporaceae Tanaka & Chihara 1982
- Família Neoralfsiaceae Lim & Kawai 2007
- Família Ralfsiaceae Farlow 1881 [Heterochordariaceae Setchell & Gardner 1925]
- Ordem Scytothamnales Peters & Clayton 1998 emend. Silberfeld et al. 2011
- Família Asteronemataceae Silberfeld et al. 2011
- Família Bachelotiaceae Silberfeld et al. 2011
- Família Splachnidiaceae Mitchell & Whitting 1892 [Scytothamnaceae Womersley 1987]
- Ordem Sporochnales Sauvageau 1926
- Família Sporochnaceae Greville 1830
- Ordem Tilopteridales Bessey 1907 emend. Phillips et al. 2008 [Cutleriales Bessey 1907]
- Família Cutleriaceae Griffith & Henfrey 1856
- Família Halosiphonaceae Kawai & Sasaki 2000
- Família Phyllariaceae Tilden 1935
- Família Stschapoviaceae Kawai 2004
- Família Tilopteridaceae Kjellman 1890
- Ordem Ascoseirales Petrov1964 emend. Moe & Henry 1982
- Subclasse Discosporangiophycidae Silberfeld, Rousseau & Reviers 2014
Produtos naturais
[editar | editar código-fonte]As algas pardas marinhas constituem o grupo mais estudado no Brasil em todas as seguintes linhas de pesquisa: isolamento de novas moléculas, estudo de suas potenciais atividades biológicas, ecologia química, taxonomia, filogenia e biogeografia baseadas em dados químicos de seus produtos naturais.
A química de produtos naturais de algas pardas marinhas abrange desde hidrocarbonetos voláteis que atuam como feromônios sexuais, como o dictyoptereno C’ [27], a compostos com enxofre que confere aroma típico a algumas espécies, aparentemente relacionado a uma estratégia para minimizar a herbivoria.[28]
Como outros produtos químicos advindos das algas pardas podemos destacar polifenóis, carotenoides, terpenos e esteróis. Ao serem analisados como marcadores taxonômicos os diferentes tipos de polifenóis (como fucóis, floretóis, acil-fenóis e outros) foram relacionados às diferentes ordens de feofíceas [29], sendo, portanto, marcadores em um nível hierárquico mais alto.
Os carotenoides, por sua vez, foram utilizados como marcadores taxonômicos e filogenéticos para todas as classes de algas, e os resultados mostraram que esses importantes pigmentos caracterizam a capacidade de síntese de cada classe. [27] As feofíceas, que são pardas devido à predominância de carotenoides sobre as clorofilas, pertencem ao grupo de algas que possuem as xantofilas mais complexas e oxidadas, na sua maior parte, com grupamentos alênicos e acetilênicos. Portanto, são algas que foram capazes de incorporar o oxigênio livre em suas moléculas de carotenoides. O estudo também estabeleceu quais as reações químicas que o grupo das feofíceas é capaz de realizar, aproximando-as de outros grupos de algas, como os dinoflagelados e as diatomáceas.
Os esteróis encontrados em algas pardas são marcadores da classe, sendo os mais abundantes o fucosterol e o isofucosterol, distintos dos esteróis principais de outras classes de algas. [30]
Os terpenos constituem os produtos naturais mais estudados no mundo e no Brasil. São substâncias que atuam nas relações ecológicas como minimizadores de herbivoria e como anti-incrustantes. Eles possuem potencial para diversas atividades biológicas e servem como marcadores taxonômicos e biogeográficos para alguns gêneros ou famílias.
Diterpenos isolados de muitas espécies de algas pardas da ordem Dictyotales foram testados para deter ou minimizar a herbivoria de vários invertebrados marinhos, como no caso do (4R,7R,14S)-4α,7α-diacetóxi-14-hidroxidolastano-1(15),8-dieno produzido pela espécie Canistrocarpus cervicornis contra o ouriço do mar Lytechinus variegatus[31] , e do (1R,2E,4R*,6E,8S*,10S*,11S*,12R*)-10,18-diacetóxi-8-hidroxi-2,6-dolabelladieno isolado da espécie Dictyota pfaffii coletada no Atol das Rocas, que além de ser uma defesa química contra o mesmo ouriço do mar [32], tem propriedades anti-incrustantes [33]. Uma revisão sobre os extratos, frações e produtos isolados responsáveis pela atividade anti-incrustante das algas bentônicas, foi realizada por pesquisadores brasileiros. [34].
Na linha ambiental e com possibilidade de utilização em maricultura, o meroditerpeno epitandiol, isolado de Stypopodium zonale, em ensaios de campo e de laboratório foi capaz de induzir o assentamento de larvas do mexilhão Perna perna [35].
Muitos resultados utilizando-se os terpenos como marcadores taxonômicos. Dentro da ordem Dictyotales, três grupos foram estabelecidos levando-se em conta a composição química, em particular, os tipos de terpenos.
Para investigarmos o valor dos diterpenos como marcadores taxonômicos das algas do grupo Dictyota da costa brasileira, a partir de 1983, foram realizados estudos sobre os perfis químicos dessas algas. Essas investigações compreenderam desde o cuidado na coleta, com a adequada identificação por ficologistas, o estabelecimento de sua composição terpenoídica por te´cnicas conjugadas de Tessonância Magnética Nuclear (RMN) e cromatografia em fase gasosa acoplada a espectrometria de massas (CG/ME), o estudo de sua variabilidade latitudinal, até o cálculo de seus índices taxonômicos e estudos de similaridade química [36][37][38][39][40][41]
Uma revisão sobre a taxonomia química dessas algas foi recentemente publicada e os resultados obtidos levaram a compreensão da evolução do gênero e as espécies foram agrupadas segundo a sua capacidade de produzir os diferentes tipos de diterpenos. A partir das análises os cientistas agruparam as espécies em três grupos:
As espécies do grupo A produzem diterpenos derivados da primeira ciclização do precursos, o geranil geraniol, entre os carbonos 1 e 10. Todos os diterpenos com esqueletos derivados do germacrano prenilado. A partir da contração do anel do germacrano prenilado são formados os xenianos e seus derivados.
O grupo taxonômico B é formado pelas espécies que produzem diterpenos derivados das ciclizações entre os carbonos 1, 11 e 1, 14 a partir do geranil geraniol. São algas da costa brasileira cujos diterpenos, principalmente dolabellanos, são encontrados em grande abundância, representando mais de 5% da massa seca da alga. Formam esse grupo as espécies Dictyota pfaffi e Dictyota bolabellana.
O grupo C é constituído de algas cujos diterpenos são originados da mesma forma que os anteriores, porém com estereoquímica diferente nos centros quirais. A não ocorrência dos dois tipos nas mesmas espécies foi um argumento importante para o estabelecimento do grupo C como distinto do grupo B. As algas desse grupo pertencem ao gênero Canistrocarpus e sintetizam dolastanos e secodolastanos. [39][42][43]
Muitos artigos sobre a atividade biológica dos diterpenos dessas algas foram publicados. A parceria entre o ALGAMAR e outros grupos de pesquisa foi crucial para o estabelecimento dessas atividades. Abaixo são listados alguns exemplos de produtos naturais de algas pardas e suas respectivas atividades biológicas.
Sem dúvida os produtos naturais de algas pardas marinhas têm um grande potencial para diversas atividades biológicas, sendo o grupo de macroalga mais estudado no Brasil em relação à química de produtos naturais.
Exemplos
[editar | editar código-fonte]Antiivirais
[editar | editar código-fonte]- Dictyota menstrualis
Local de coleta: Búzios, RJ
Produto: Diterpenos contra o vírus HIV-1 e HSV-1
- Dictyota pfaffii
Local de coleta: Atol das Rocas, RN
Produto: Diterpenos contra o vírus HIV-1 e HSV-1
- Stypopodium zonale
Local de coleta: Búzios, RJ
Produto: Diterpenos contra o vírus HSV-1
- Canistrocarpus cervicomis
Local de coleta: Búzios, RJ
Produto: Diterpenos contra o vírus HSV-1
Contra a atividade do veneno de cobra Lachesis muta
[editar | editar código-fonte]- Canistrocarpus cervicomis
Local de coleta: Búzios, RJ
Produto: neutralizantes de atividades hemolítica, proteolítica, hemorrágica e obstrutiva do veneno de cobra
Local de coleta : Angra dos Reis, RJ
Produto: neutralizantes de atividades hemolítica e obstrutiva do veneno de cobra
Inibição da Na+K+-ATPase
[editar | editar código-fonte]- Canistrocarpus cervicomis
Local de coleta: Angra dos Reis, RJ
Produto: inibiram a atividade da enzima
Anti-leishmania
[editar | editar código-fonte]- Canistrocarpus cervicomis
Local de coleta: Angra dos Reis, RJ
Produto: atuam contra Leishmania amazonensis
Notas
- ↑ F. R. Kjellman, "Phaeophyceae (Fucoideae)", in A. Engler e K. Prantl (coord.), Die natürlichen Pflanzenfamilien, vol. 1, nº 2, Leipzig, Wilhelm Engelmann, 1891, pp. 176–192.
- ↑ S.A, Priberam Informática. «Dicionário Priberam da Língua Portuguesa». Dicionário Priberam da Língua Portuguesa. Consultado em 8 de janeiro de 2024
- ↑ a b Thomas,D.N. 2002 Seaweeds. The Natural History Museum, London. ISBN 0 56509175 1
- ↑ C. van den Hoek, D. G. Mann e H. M. Jahns, Algae: An Introduction to Phycology, Cambridge, Cambridge University Press, 1995, pp. 165–218, ISBN 0-521-31687-1.
- ↑ T. L. Senn, Seaweed and Plant Growth, Clemson, S. C., T. L. Senn, 1987, ISBN 0-939241-01-3.
- ↑ a b c Connor, J.; Baxter, C. (1989). Kelp Forests. [S.l.]: Monterey Bay Aquarium. ISBN 1-878244-01-9
- ↑ a b Dittmer, H. J. (1964). Phylogeny and Form in the Plant Kingdom. Princeton, NJ: D. Van Nostrand Company. pp. 115–137. ISBN 0-88275-167-0
- ↑ Abbott, I. A.; Hollenberg, G. J. (1976). Marine Algae of California. California: Stanford University Press. ISBN 0-8047-0867-3
- ↑ Cribb, A. B. (1953). «Macrocystis pyrifera (L.) Ag. in Tasmanian waters». Australian Journal of Marine and Freshwater Research. 5 (1): 1–34. doi:10.1071/MF9540001
- ↑ Jones, W. E. (1962). «A key to the genera of the British seaweeds» (PDF). Field Studies]. 1 (4): 1–32[ligação inativa]
- ↑ a b c Bold, H. C.; Alexopoulos, C. J.; Delevoryas, T. (1987). Morphology of Plants and Fungi 5th ed. New York: Harper & Row Publishers. pp. 112–131, 174–186. ISBN 0-06-040839-1
- ↑ Raven, P. H.; Evert, R. F.; Eichhorn, S. E. (2005). Biology of Plants 7th ed. New York: W. H. Freeman and Company. pp. 316–321, 347. ISBN 0-7167-1007-2
- ↑ Round, F. E. (1981). The Ecology of Algae. Cambridge: Cambridge University Press. p. 103. ISBN 0-521-26906-7
- ↑ Wynne, M. J. (1981). «The Biology of seaweeds». In: Lobban, C. S.; Wynne, M. J. Phaeophyta: Morphology and Classification. Col: Botanical Monographs. 17. [S.l.]: University of California Press. p. 52. ISBN 978-0-520-04585-9
- ↑ a b Sharma, O. P (1986). Textbook of Algae. [S.l.]: Tata McGraw-Hill. p. 298. ISBN 978-0-07-451928-8
- ↑ Fletcher,R.L. 1987. Seaweeds of the British Isles. Volume 3. Part 1. British Museum (Natural History), London. ISBN 0-565-00992-3
- ↑ a b c d Hoek, C. van den, Mann, D. G. and Jahns, H. M. (1995). Algae : An introduction to phycology, Cambridge University Press, UK.
- ↑ Heesch, S. and Peters, Akira F. (1999). Scanning electron microscopy observation of host entry by two brown algae endophytic in Laminaria saccharina. Phycological Research. Volume 47. pp 1-5.
- ↑ Guiry, M. D. & G. M. Guiry (2006). «AlgaeBase version 4.2». National University of Ireland, Galway. Consultado em 7 de dezembro de 2006
- ↑ Coyer, J.A.; G.J. Smith, R.A. Anderson (2001). «Evolution of Macrocystis spp. (Phaeophyta) as determined by ITS1 and ITS2 sequences». Blackwell Publishing. Journal of Phycology. 37: 574-585
- ↑ Guiry, M. D.; Guiry, G. M. (2009). «AlgaeBase». National University of Ireland. Consultado em 31 de dezembro de 2012
- ↑ Guiry, M.D. & Guiry, G.M. 2013. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org; 02 Outubro de 2013.
- ↑ Ruggiero; et al. (2015), «Higher Level Classification of All Living Organisms», PLoS ONE, 10 (4), doi:10.1371/journal.pone.0119248
- ↑ Silar, Philippe (2016), «Protistes Eucaryotes: Origine, Evolution et Biologie des Microbes Eucaryotes», HAL archives-ouvertes: 1–462
- ↑ a b Silberfeld, Thomas; Rousseau, Florence; de Reviers, Bruno (2014). «An Updated Classification of Brown Algae (Ochrophyta, Phaeophyceae)». Cryptogamie, Algologie. 35 (2): 117–156. doi:10.7872/crya.v35.iss2.2014.117
- ↑ Guiry, M. D.; Guiry, G. M. (2009). «AlgaeBase». National University of Ireland. Consultado em 31 de dezembro de 2012
- ↑ a b Kajiwara, Tadahiko; Hatanaka, Akikazu; Kodama, Kazuya; Ochi, Shyuji; Fujimura, Taichiro (1991). «Dictyopterenes from three Japanese brown algae». Phytochemistry (6): 1805–1807. ISSN 0031-9422. doi:10.1016/0031-9422(91)85017-t. Consultado em 16 de novembro de 2022
- ↑ Schnitzler, Iris; Boland, Wilhelm; Hay, Mark E. (1998). Journal of Chemical Ecology (10): 1715–1732. ISSN 0098-0331. doi:10.1023/a:1020876830580
- ↑ Pereira, R.; Valentin, Y.; Teixeira, V.; Kelecom, A. (dezembro de 1990). «Phlorotannins in Brazilian Brown Algae: Quantitative Study and Ecological Implications». Planta Medica (06): 557–558. ISSN 0032-0943. doi:10.1055/s-2006-961142. Consultado em 16 de novembro de 2022
- ↑ Fleury, B. G.; Kelecom, A.; Pereira, R. C.; Teixeira, V. L. (1994). «Polyphenols, Terpenes and Sterols in Brazilian Dictyotales and Fucales (Phaeophyta)». Botanica Marina (5). ISSN 0006-8055. doi:10.1515/botm.1994.37.5.457. Consultado em 16 de novembro de 2022
- ↑ Bianco, Éverson Miguel; Teixeira, Valéria Laneuville; Pereira, Renato Crespo (setembro de 2010). «Chemical defenses of the tropical marine seaweed Canistrocarpus cervicornis against herbivory by sea urchin». Brazilian Journal of Oceanography (em inglês): 213–218. ISSN 1679-8759. Consultado em 16 de novembro de 2022
- ↑ Barbosa, Jussara P.; Teixeira, Valéria L.; Pereira, Renato C. (13 de abril de 2004). «A dolabellane diterpene from the brown alga Dictyota pfaffii as chemical defense against herbivores» (em inglês) (2): 147–151. doi:10.1515/BOT.2004.015. Consultado em 16 de novembro de 2022
- ↑ Barbosa, Jussara P.; Fleury, Beatriz G.; da Gama, Bernardo A. P.; Teixeira, Valéria L.; Pereira, Renato C. (1 de agosto de 2007). «Natural products as antifoulants in the Brazilian brown alga Dictyota pfaffii (Phaeophyta, Dictyotales)». Biochemical Systematics and Ecology (em inglês) (8): 549–553. ISSN 0305-1978. doi:10.1016/j.bse.2007.01.010. Consultado em 16 de novembro de 2022
- ↑ Gama, Bernardo A. P. da; Carvalho, Ana G. V.; Weidner, Kerstin; Soares, Angelica R.; Coutinho, Ricardo; Fleury, Beatriz G.; Teixeira, Valeria L.; Pereira, Renato C. (1 de junho de 2008). «Antifouling activity of natural products from Brazilian seaweeds» (em inglês) (3): 191–201. ISSN 1437-4323. doi:10.1515/BOT.2008.027. Consultado em 16 de novembro de 2022
- ↑ Soares, Angélica R.; da Gama, Bernardo A. P.; da Cunha, Andrea P.; Teixeira, Valéria L.; Pereira, Renato C. (1 de março de 2008). «Induction of Attachment of the Mussel Perna perna by Natural Products from the Brown Seaweed Stypopodium zonale». Marine Biotechnology (em inglês) (2): 158–165. ISSN 1436-2236. doi:10.1007/s10126-007-9048-7. Consultado em 16 de novembro de 2022
- ↑ Freitas, Odinéia do Socorro Pamplona; de Oliveira, Aline Santos; De-Paula, Joel Campos; Pereira, Renato Crespo; Cavalcanti, Diana Negrão; Teixeira, Valéria Laneuville (janeiro de 2007). «Chemical Variation in the Diterpenes from the Brazilian Brown Alga Dictyota Mertensii (Dictyotaceae, Phaeophyta)». Natural Product Communications (1): 1934578X0700200. ISSN 1934-578X. doi:10.1177/1934578x0700200104. Consultado em 16 de novembro de 2022
- ↑ De-Paula, Joel Campos; Cassano, Valéria; Yoneshigue-Valentin, Yocie; Teixeira, Valéria Laneuville (fevereiro de 2007). «Diterpenes from the Brazilian Brown Alga Dictyota Crispata (Dictyotaceae, Phaeophyta)». Natural Product Communications (2): 1934578X0700200. ISSN 1934-578X. doi:10.1177/1934578x0700200205. Consultado em 16 de novembro de 2022
- ↑ De-Paula, Joel; Bueno, Ludmila; Cavalcanti, Diana; Yoneshigue-Valentin, Yocie; Teixeira, Valéria (4 de junho de 2008). «Diterpenes from the Brown Alga Dictyota crenulata». Molecules (6): 1253–1262. ISSN 1420-3049. doi:10.3390/molecules13061253. Consultado em 16 de novembro de 2022
- ↑ a b De Oliveira, Aline Santos; Cavalcanti, Diana Negrão; Bianco, Έverson Miguel; De Paula, Joel Campos; Pereira, Renato Crespo; Yoneshigue-Valentin, Yocie; Teixeira, Valéria Laneuville (setembro de 2008). «Chemical Composition of Diterpenes from the Brown Alga Canistrocarpus cervicornis (Dictyotaceae, Phaeophyceae)». Natural Product Communications (9): 1934578X0800300. ISSN 1934-578X. doi:10.1177/1934578x0800300913. Consultado em 16 de novembro de 2022
- ↑ Ortiz-Ramírez, Fredy Augusto; Cavalcanti, Diana Negrão; Villaça, Roberto Campos; de Paula, Joel Campos; Yoneshigue-Valentin, Yocie; Teixeira, Valéria Laneuville (novembro de 2008). «Chemical Variation in the Diterpenes from the Brazilian Brown Alga Dictyota Menstrualis (Dictyotaceae, Phaeophyceae)». Natural Product Communications (11): 1934578X0800301. ISSN 1934-578X. doi:10.1177/1934578x0800301117. Consultado em 16 de novembro de 2022
- ↑ De-Paula, Joel Campos; Cavalcanti, Diana Negrão; Yoneshigue-Valentin, Yocie; Teixeira, Valéria Laneuville (agosto de 2012). «Diterpenes from marine brown alga Dictyota guineensis (Dictyotaceae, Phaeophyceae)». Revista Brasileira de Farmacognosia (em inglês): 736–740. ISSN 0102-695X. doi:10.1590/S0102-695X2012005000071. Consultado em 16 de novembro de 2022
- ↑ Teixeira, Valéria Laneuville; Tomassini, Therezinha; Fleury, Beatriz Grosso; Kelecom, Alphonse (julho de 1986). «Dolastane and Secodolastane Diterpenes from the Marine Brown Alga, Dictyota cericornis». Journal of Natural Products (em inglês) (4): 570–575. ISSN 0163-3864. doi:10.1021/np50046a002. Consultado em 16 de novembro de 2022
- ↑ Kelecom, Alphonse; Teixeira, Valéria L. (janeiro de 1988). «Dolastane diterpenes from the marine brown alga Dictyota cervicornis». Phytochemistry (9): 2907–2909. ISSN 0031-9422. doi:10.1016/0031-9422(88)80686-1. Consultado em 16 de novembro de 2022
Galeria
[editar | editar código-fonte]-
Macrocystis pyrifera (até 60 m de comprimento)













