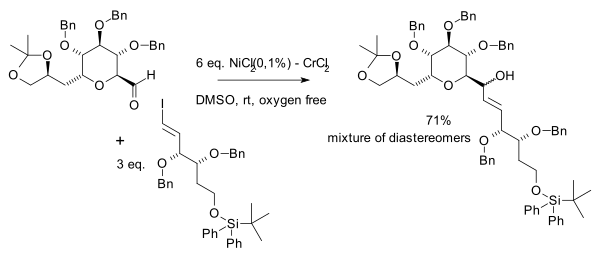
Reação de Nozaki-Hiyama-Kishi
A reação de Nozaki-Hiyama-Kishi é uma reação de acoplamento catalisada por níquel/cromo formando um álcool a partir da reação de um aldeído com um haleto de alila ou vinila.[1] Em sua publicação original de 1977, Tamejiro Hiyama e Hitoshi Nozaki[2] relataram a reação de uma solução salina de cromo (II) preparada pela redução de cloreto crômico por hidreto de alumínio e lítio com benzaldeído e cloreto de alila:
Em comparação com as reações de Grignard, esse acoplamento é muito seletivo para aldeídos com grande tolerância para uma gama de grupos funcionais como cetonas, ésteres, amidas e nitrilas. A reação com compostos carbonílicos α,β-insaturados fornecem exclusivamente produtos de adição simples. Exemplos de solventes utilizados são DMF e DMSO. Um requisito do solvente é solubilizar os sais de cromo. A reação de Nozaki-Hiyama-Kishi é um método útil para o preparo de anéis de tamanho médio.[3][4]
Em 1983, a abrangência da reação foi estendida pelos mesmos autores para incluir haletos ou triflatos de vinila e haletos de arila. Observou-se que o sucesso da reação dependia da fonte de cloreto de cromo (II) e, em 1986, descobriu-se que isso se devia a impurezas de níquel.[5] Desde então, o cloreto de níquel (II) é usado como cocatalisador.[6]

No mesmo ano, Yoshito Kishi et al. descobriram independentemente os efeitos benéficos do níquel em sua busca pela palitoxina:[7]
Verificou-se também que o acetato de paládio é um cocatalisador eficaz.
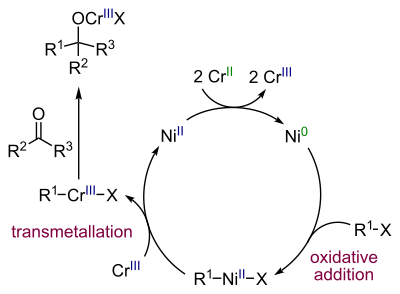
Mecanismo reacional[editar | editar código-fonte]
O níquel é o real catalisador quando pequenas quantidades de sal de níquel são adicionadas à reação. Cloreto de níquel (II) é, primeiramente, reduzido a níquel (0) com 2 equivalentes de cloreto de cromo (II) (o qual atua como catalisador de sacrifício) originando cloreto de cromo (III). A etapa posterior é a adição oxidativa de níquel em meio à ligação carbono-haleto, formando-se um intermediário alquilníquel R–Ni(II)–X, seguida por uma etapa de transmetalação, ocorrendo a substituição do NiX por um grupo Cr (III) para formarem-se um alquilcromo intermediário R–Cr(III)–X e Ni(II) regenerador. O alquilcromo reage com o grupo carbonila numa adição nucleofílica.
A quantidade de níquel utilizada deve ser baixa para evitar um acoplamento lateral direto de um alceno a um dieno.[8]
Ver também[editar | editar código-fonte]
- Acoplamento de Suzuki-Miyaura
- Acoplamento de Sonogashira-Hagihara
- Acoplamento de Heck-Matsuda
- Acoplamento de Stille
- Acoplamento de Negishi
- Acoplamento de Ullmann
- Reação de Grignard
- Acoplamento de Mizoroki-Heck
Referências
- ↑ Takai, Kazuhiko (2004). Organic Reactions: Addition Of Organochromium Reagents To Carbonyl Compounds. [S.l.]: John Wiley & Sons. p. 253. ISBN 0-471-68262-4. doi:10.1002/0471264180.or064.03
- ↑ Okude, Yoshitaka; Hirano, Shigeo; Hiyama, Tamejiro; Nozaki, Hitosi (1 de abril de 1977). «Grignard-type carbonyl addition of allyl halides by means of chromous salt. A chemospecific synthesis of homoallyl alcohols». Journal of the American Chemical Society. 99 (9): 3179–3181. doi:10.1021/ja00451a061. Consultado em 13 de abril de 2023
- ↑ MacMillan, D. W. C.; Overman, Larry E. (1 de outubro de 1995). «Enantioselective Total Synthesis of (-)-7-Deacetoxyalcyonin Acetate. First Synthesis of a Eunicellin Diterpene». Journal of the American Chemical Society. 117 (41): 10391–10392. doi:10.1021/ja00146a028. Consultado em 13 de abril de 2023
- ↑ Lotesta, S. D.; Liu, J.; Yates, E. V.; Krieger, I.; Sacchettini, J. C.; Freundlich, J. S.; Sorensen, E. J. (24 de agosto de 2011). «Expanding the pleuromutilin class of antibiotics by de novo chemical synthesis». Royal Society of Chemistry. Chemical Science. 2 (7): 1258–1261. doi:10.1039/C1SC00116G. Consultado em 13 de abril de 2023
- ↑ Takai, K.; Tagashira, M.; Kuroda, T.; Utimoto, K.; Nozaki, H. (1 de setembro de 1976). «Reactions of alkenylchromium reagents prepared from alkenyl trifluoromethanesulfonates (triflates) with chromium(II) chloride under nickel catalysis». Journal of the American Chemical Society. 108 (19): 6048–6050. doi:10.1021/ja00279a068. Consultado em 13 de abril de 2023
- ↑ Thomé, Isabelle; Nijs, Anne; Bolm, Carsten (13 de setembro de 2011). «Trace metal impurities in catalysis». Chemical Society Reviews. 41 (3): 979–987. doi:10.1039/c2cs15249e. Consultado em 13 de abril de 2023
- ↑ Jin, Haolun; Uenishi, Junichi; Christ, William J.; Kishi, Yoshito (1 de setembro de 1986). «Catalytic effect of nickel(II) chloride and palladium(II) acetate on chromium(II)-mediated coupling reaction of iodo olefins with aldehydes». Journal of the American Chemical Society. 108 (18): 5644–5646. doi:10.1021/ja00278a057. Consultado em 13 de abril de 2023
- ↑ Takai, Kazuhiko; Sakogawa, Koichi; Kataoka, Yasutaka; Oshima, Koichiro; Utimoto, Kiitiro (1995). «Preparation and reactions of alkenylchromium reagents: 2-Hexyl-5-phenyl-1-penten-3-ol». Organic Syntheses. p. 180. doi:10.15227/orgsyn.072.0180. Consultado em 13 de abril de 2023