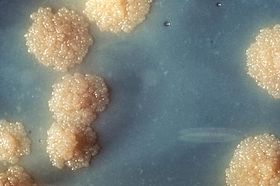
Mycobacterium tuberculosis
| Mycobacterium tuberculosis | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Classificação científica | |||||||||||||||
| |||||||||||||||
| Nome binomial | |||||||||||||||
| Mycobacterium tuberculosis Zopf, 1883 | |||||||||||||||
Mycobacterium tuberculosis (MTB), ou bacilo de Koch, é uma espécie de bactéria patogênica do gênero Mycobacterium e o agente causador da maioria dos casos de tuberculose (TB).[1] Descoberta pela primeira vez em 1882 por Robert Koch, M. tuberculosis tem uma camada incomum de cera em sua superfície celular (principalmente ácido micólico), o que torna as células impermeáveis à coloração de Gram. Técnicas de detecção de ácido-resistência são usadas. A fisiologia do M. tuberculosis é altamente aeróbica e exige elevados níveis de oxigênio. Principalmente um agente patogênico do sistema respiratório de mamíferos, MTB infecta os pulmões. Os métodos de diagnóstico mais utilizados para a tuberculose são o teste tuberculínico, baciloscopia do escarro (técnica de Ziehl-Neelsen) e radiografias do tórax.[1]
O genoma de M. tuberculosis foi sequenciado em 1998.[2][3]
Fisiopatologia[editar | editar código-fonte]
M. tuberculosis requer oxigênio para crescer. Ele não retem qualquer coloração bacteriológica devido o alto teor de lipídeos em sua parede, portanto, Ziehl-Neelsen, ou coloração álcool-ácido resistente, é usado. Micobactérias não parecem se encaixar na categoria Gram-positiva do ponto de vista empírico (ou seja, eles não mantêm a coloração violeta cristal), eles são classificados como bactérias alcool-ácido resistentes, devido à sua camada lipídica de ácidos micólicos.[1]
M. tuberculosis divide-se em cerca de 15 a 20 horas, que é extremamente lento em comparação com outras bactérias, que tendem a ter tempos de divisão medida em minutos (Escherichia coli pode se dividir aproximadamente a cada 20 minutos), o que dificulta o cultivo em laboratório. É um pequeno bacilo que pode suportar desinfectantes fracos e pode sobreviver num estado seco durante semanas, além de resistir a luz UV. Sua parede celular incomum, rica em lipídios (por exemplo, ácidos micólicos e lipoarabinomanano), é provavelmente o responsável por essa resistência e é um fator chave de virulência.[4]
A capacidade de construir mutantes M. tuberculosis e testar produtos de genes individuais para funções específicas tem avançado significativamente a nossa compreensão da patogênese e fatores de virulência de M. tuberculosis. Muitas proteínas secretadas e exportadas são conhecidas por serem importantes na patogênese.[5]
Cepas hipervirulentas[editar | editar código-fonte]
Surtos de Mycobacterium são frequentemente causadas por cepas hipervirulentas de M. tuberculosis. Em experimentos de laboratório, estes isolados clínicos provocam imunopatologia incomum, e podem ser tanto hiperinflamatórias ou hipoinflamatória. Estudos têm mostrado que a maioria dos mutantes hipervirulentos têm deleções nas suas enzimas modificadoras da parede celular ou reguladores que respondam a estímulos ambientais. Estudos destes mutantes indicaram os mecanismos que permitem que o M. tuberculosis possa mascarar o seu potencial patogênico completo, induzindo uma granuloma que fornece uma imagem de proteção, e permitir que os bacilos sustentem a longo prazo, a infecção persistente.[6]
Genoma[editar | editar código-fonte]
O genoma da estirpe H37Rv, foi publicado em 1998.[7] Seu tamanho é de 4 milhões de pares de bases, com 3.959 genes; 40% desses genes tiveram sua função caracterizada, com possível função postulada por mais de 44%. Dentro do genoma também estão seis pseudogenes. O genoma contém 250 genes envolvidos no metabolismo do ácido gordo, com 39 delas envolvidas no metabolismo de policetídeo gerando o revestimento ceroso. Tais grandes números de genes conservados mostram a importância evolutiva do casaco de cera à sobrevivência do patógeno. Cerca de 10% da capacidade de codificação é feita pelas famílias de genes PE/PPE, que codificam proteínas ricas em glicina ácidas. Estas proteínas têm um padrão conservado N-terminal, o que prejudica a eliminação de crescimento em macrófagos e granulomas.[8]
Nove sRNAs não-codificados foram caracterizados na M. tuberculosis,[9] com mais 56 previstos em uma tela de bioinformática.[10] Em 2013, um estudo sobre o genoma de várias estirpes sensíveis, ultra-resistentes e multirresistentes de M. tuberculosis foi feita para estudar os mecanismos de resistência a antibióticos. Os resultados revelaram novas relações e os genes de resistência a drogas não previamente associadas e sugerem que alguns genes e regiões intergênicas associadas com resistência à droga pode ser envolvida na resistência a várias drogas. Digno de nota é o papel que as regiões intergênicas no desenvolvimento desta resistência, e que a maioria dos genes, que são propostas no presente estudo, seriam responsáveis pela resistência à droga tem um papel essencial no desenvolvimento de M. tuberculosis.[11]
Evolução[editar | editar código-fonte]
O complexo Mycobacterium tuberculosis evoluiu no Continente Africano e provavelmente no Chifre da África.[12] O grupo M. tuberculosis tem um número de membros que incluem o Mycobacterium africanum, Mycobacterium bovis (bacilo de Dassie), Mycobacterium caprae, Mycobacterium microti, Mycobacterium mungi, Mycobacterium orygis e Mycobacterium pinnipedii. Este grupo também pode incluir o clado Mycobacterium canetti.
O clado M. canettii — que inclui a Mycobacterium prototuberculosis — é um grupo de colônias boas da espécie Mycobacterium. Ao contrário dos membros estabelecidos do grupo M. tuberculosis, são submetidos a recombinação com outras espécies. A maioria das estirpes conhecidas deste grupo foram isoladas a partir do Chifre da África. O antepassado da Mycobacterium tuberculosis parece ser a espécie de Mycobacterium canettii, descrita pela primeira vez em 1969.[13]
Os membros estabelecidos do complexo M. tuberculosis, estão todos na sua propagação clonal. As principais espécies que infectam humanos foram classificadas em sete espoligotipos: o tipo 1 contém o Leste Africano-Indiano (LAI) e algumas estirpes Manu (Indígenas); o tipo 2 é o grupo de Pequim; o tipo 3 é composto pelas estirpes da Ásia Central (CAC); o tipo 4 de Gana e Haarlem (H / T) América Latina-Mediterrâneo (ALM) e estirpes X; e os tipos 5 e 6 correspondem ao Mycobacterium africanum e são observadas, predominantemente e em frequência muito altas na África Ocidental. Um sétimo tipo foi isolado do Chifre da África.[12] As outras espécies deste complexo pertencem a uma série de espoligotipos e normalmente não infectam seres humanos.
Transmissão[editar | editar código-fonte]
A transmissão da tuberculose, causada pelo bacilo micobacteriano, pode se dar através de:
- Tosse, espirro ou expectoração de pessoas infectadas com tuberculose ativa;
- Disseminação através do ar de partículas infectantes (as bactérias permanecem em suspensão no ar durante horas)
- Trauma cutâneo (raro);
- Ingestão de alimentos contaminados (raro).
Uma pessoa não tratada infecta de 10 a 15 pessoas por ano.
Fatores de virulência[editar | editar código-fonte]
Fatores de virulência são estruturas, produtos ou estratégias que contribuem para a bactéria aumentar sua capacidade em causar uma infecção. Dentre esses mecanismos, os mais observados são aqueles envolvidos com a colonização dos tecidos, com a evasão do patógeno do sistema de defesa inato do organismo e outros diretamente relacionados com lesões às células do hospedeiro. Esses fatores são muito estudados pois são cruciais para o entendimento dos sintomas da enfermidade e também representam possíveis alvos de drogas para o enfraquecimento ou destruição do patógeno. No caso das Mycobacterium, os principais fatores de virulência estão relacionados com a sua parede lipídica complexa, catabolismo do colesterol (fonte de energia e matéria para a síntese de lipídios complexos da parede), proteínas e lipoproteínas do envelope celular responsáveis pela aderência bacteriana nas células do hospedeiro, proteínas que inibem a resposta antimicrobiana dos macrófagos pela resistência a compostos tóxicos do hospedeiro, controle do mecanismo de apoptose e controle da progressão e transformação dos fagossomos em fagolisossomos, além de fatores que controlam e regulam a expressão genética em situações de diferente atividade do patógeno.[14] Vale observar que todos os fatores de virulência apresentados pelas Mycobacterium são relacionados a colonização, sobrevivência e defesa do microoganismo contra os mecanismos de ataque do sistema imune. Essa capacidade de conviver com o sistema imune do hospedeiro é um dos fatores mais importantes que explicam os mecanismos de patogenicidade desse gênero de bactéria. Uma outra característica interessante das Mycobacterium sp. é que existe a falta dos mais comuns fatores de virulência dentre as variadas bactérias patógenas: as toxinas. Pela falta desses fatores de virulência relacionados com a formação de lesões e morte dos tecidos propriamente dita, entende-se que as lesões teciduais formadas nos vários tipos de tuberculoses são, na verdade, provocadas pela própria resposta do sistema imune do organismo hospedeiro.[15]
Patologias[editar | editar código-fonte]
- Lesão primária: Tuberculose pulmonar
- Lesões secundárias: Tuberculose cutânea; Tuberculose renal; Tuberculose óssea
Tuberculose pulmonar[editar | editar código-fonte]
Dentre as mais de 60 espécies conhecidas do gênero Mycobacterium, a Mycobacterium tuberculosis é uma das espécies de maior significado e importância clínica para o ser humano. Além da M. tuberculosis, a M. canettii, M. africanum, M. microti, M. bovis, M. caprae e M. pinnipedii também são responsáveis pela enfermidade e são denominadas micobactérias do Complexo Mycobacterium tuberculosis. A tuberculose humana, que pode se apresentar na forma ativa ou latente, possui um espectro muito grande de enfermidades devido à variedade de tecidos que o bacilo pode infectar, e as enfermidades podem ser divididas em dois grupos: a tuberculose pulmonar e as tuberculoses extrapulmonares.[16]
A tuberculose pulmonar é uma doença que consiste em uma infecção crônica dos pulmões e é a única forma contagiosa da tuberculose. O mecanismo mais comum de transmissão dá-se por aerossol de partículas infectantes que contém população de bacilos, geralmente provenientes de tosse, espirros e escarro de pessoas infectadas. Após a inalação do patógeno, os bacilos são fagocitados por macrófagos alveolares e podem seguir dois caminhos: grande parte da população bacteriana é eliminada caso haja um predomínio da resposta imune do hospedeiro, ou a população crescem no interior das células em lesões localizadas chamadas tubérculos. A necrose dos tecidos pulmonares resultantes da evolução dessas lesões é denominada granuloma, com a formação de cavidades que possibilitam grande acúmulo de bacilos. Os sintomas são apresentados somente com a ocorrência da forma ativa da doença, sendo os mais comuns a tosse com escarro grosso, fosco e, em alguns casos, sanguinolenta, febre, arrepios, sudorese noturna, fadiga, fraqueza, perda de apetite e dificuldade de respiração com dor no peito.[17]
Tuberculose óssea[editar | editar código-fonte]
A tuberculose extrapulmonar ou miliar, que corresponde a cerca de 15% dos casos da doença ativa, é causada pela evolução da enfermidade pulmonar por um excessivo crescimento bacteriano, que pode atingir a corrente sanguínea, disseminando pelo corpo a população de bacilos. São exemplos de enfermidades extrapulmonares a tuberculose cutânea, pleural, ganglionar, óssea, geniturinária, intestinal, peritoneal, pericárdica, hepática, tuberculose do sistema nervoso central e ocular. Os sintomas variam muito e dependem do órgão ou tecido no qual se encontra a infecção.[18]
A tuberculose óssea, Doença de Pott (Mal de Pott) ou tuberculose vertebral é uma doença extrapulmonar não contagiosa causada pelas micobactérias do Complexo Mycobacterium tuberculosis que infectam geralmente a parte torácica da medula espinal, observando-se a destruição dos discos intervertebrais e a junção anterior de vértebras adjacentes levando a formação de cifoses e deformação de Giffus. Além da deformidade da coluna, outros sintomas podem ir de dor na coluna até paraplegia. O nome “Mal de Pott” vem de um cirurgião inglês chamado Sir Percival Pott que descreveu pela primeira vez essa forma de infecção de tuberculose em 1779, e a paraplegia resultada desse tipo de infecção ficou conhecida consequentemente como paraplegia de Pott. Aproximadamente 10% dos pacientes com tuberculose extrapulmonar apresentam esse tipo de doença, afetando principalmente jovens adultos e crianças socialmente desfavorecidas. Essa enfermidade é resultado da infecção intravenosa de M. tuberculosis, que chega até a coluna. A infecção começa na parte inferior anterior das vértebras e depois se espalha para o interior dos discos intervertebrais. Para o diagnostico desse tipo de enfermidade é mais comum o uso de ressonância magnética ou biopsia da área infectada. O tratamento para este caso deve ser iniciado o quanto antes para evitar deformações severas e interrupções neurológicas graves e quase todas as drogas e vacinas anti-tuberculose podem ser utilizadas. Em alguns casos em que não houve resposta ao tratamento ou as deformações apresentaram-se severas, é recomentada intervenção cirúrgica.[19]
Tuberculose cutânea[editar | editar código-fonte]
As doenças cutâneas causadas por espécies do gênero Mycobacterium são divididas em tuberculose cutânea e micobacterioses atípicas. As micobacterioses atípicas são causadas por outras espécies do gênero que não o bacilo da tuberculose e o Mycobacterium leprae. A tuberculose cutânea (TBC), causada por M. tuberculosis e M. bovis, é um dos diagnósticos mais difíceis de fazer, visto que existem muitas variações da sua aparência clínica, histopatologia, imunologia e resposta ao tratamento. Apesar de corresponder a apenas 1,5% dos casos de tuberculose extrapulmonar e 0,15% de todos os casos de doenças cutâneas, a TBC não pode ser desprezada. Além disso, sua incidência vem aumentando nos últimos anos devido ao aumento do número de pessoas com HIV e tuberculose multirresistente.
A descrição da TBC inclui manifestações dermatológicas da tuberculose envolvendo a pele, e as primeiras classificações da doença baseavam-se na morfologia das lesões. Em pacientes com TBC, as lesões cutâneas caracterizam-se por inflamação granulomatosa, graus variados de necrose e graus variados de vasculite; M. tuberculosis é identificada por meio de coloração especial, cultura ou PCR. Além disso, embora semelhantes clinicamente, as lesões de TBC podem ter desenvolvimento, progressão e prognóstico diferentes. Baseando-se nisso, Tappeiner & Wolff propuseram o sistema de classificação de TBC mais amplamente aceito, que se baseia no mecanismo de propagação: disseminação exógena ou endógena. A inoculação exógena, e a menos comum, ocorre após a inoculação direta de M. tuberculosis na pele de uma pessoa suscetível a infecção. A infecção endógena ocorre em pacientes previamente infectados pela M. tuberculosis. Além dessa classificação, pesquisadores, desenvolveram a classificação de acordo com o conceito de carga bacteriana, usada para distinguir a forma multibacilar (micobactérias são facilmente identificadas no exame histológico) da forma paucibacilar (isolamento de micobactérias em cultura é raro).
Os medicamentos usados para tratamento de tuberculose e, portanto, também de tuberculose cutânea, são a isoniazida, a rifampicina, a pirazinamida e o etambutol. A maioria das pessoas será tratada pelos esquemas padronizados e receberá o tratamento e acompanhamento na atenção básica.[20][21]
Tuberculose: diabetes mellitus e insuficiência renal[editar | editar código-fonte]
A diabetes quando não controlada e tratada acarreta inúmeras complicações, como doenças vasculares, neuropatias e aumento da susceptibilidade a infecções. A hiperglicemia e a diminuição da insulina interferem com a resposta imunológica, agindo diretamente na função celular dos macrófagos e dos linfócitos e alterando a função quimiotáxica, a fagocitose e a apresentação de antígenos.
O aumento do número de casos de diabetes contribui para dificultar o controle da tuberculose. Além disso, três quartos dos casos de diabetes vivem em países de baixa renda, onde a tuberculose e o HIV apresentam-se como uma das principais causas de morte. Não se sabe, no entanto, porque pacientes diabéticos desenvolvem mais frequentemente resistência as drogas para tratar tuberculose. A apresentação clínica é semelhante à apresentação da tuberculose, porém com difícil controle da diabetes. A radiologia pode apresentar alterações consideradas típicas, e até apresentações atípicas que podem gerar semelhanças com outras patologias pulmonares, o que causa o atraso e o difícil reconhecimento do diagnóstico de tuberculose.
Em pacientes com insuficiência renal, a tuberculose apresenta-se na doença renal diretamente, através da infecção renal ou infecção do trato urinário. Além disso, também pode ocorrer nefrotoxicidade causada pelas drogas antituberculose e síndrome de secreção inadequada do hormônio antidiurético (ADH) devido ao envolvimento miliar da doença.
Atrasos no diagnóstico podem ocorrer devido as manifestações atípicas da tuberculose nesses pacientes, como por exemplo, o resultado negativo do teste tuberculínico devido a imunosupressão. Além disso, é possível também que a insuficiência renal ocorra a partir do tratamento da tuberculose, através do uso das drogas usadas, como a rifampicina que pode induzir lesão tubular e intersticial e, mais raramente, glomerulonefrite. O etambutol e a pirazinamida não são drogas nefrotóxicas, mas esses agentes podem causar uma diminuição seletiva na excreção de ácido úrico ou sua maior reabsorção.[22]
Tuberculose e HIV[editar | editar código-fonte]
A chance de contrair a doença, em pessoas portadoras do vírus HIV, é entre 20-37 vezes maior do que em pessoas não portadoras, sendo a tuberculose responsável por mais de um quarto das mortes entre essas pessoas. Para diagnosticas a tuberculoses em pacientes com HIV é necessária a avaliação dos sintomas, exames de imagem, pesquisa e cultura do bacilo no escarro/lavado bronco-alveolar e análise histológica, além de que exames de imagens são fundamentais para o diagnóstico precoce da doença.
A análise histológica tem um papel importante no diagnóstico da tuberculose em co-infectados por tuberculose/HIV em decorrência de outras causas de infecções e neoplasias, frequentes nesse grupo de pacientes. A presença de processo crônico granulomatoso em qualquer órgão
pode sugerir a infecção por micobactérias ou fungos. No entanto, apenas a cultura desse material pode identificar M. tuberculosis.
As medidas para controlar essa epidemia consistem no diagnóstico precoce e profilaxia da tuberculose, assim como terapia antirretroviral para infectados por HIV. Estudos mostraram que em portadores de HIV, a profilaxia para tuberculose utilizando a isoniazida reduz 33% o risco de contrair tuberculose, em pacientes com resultados positivos e negativos para teste tuberculínico. Entretanto, para paciente com resultado positivo ao teste tuberculínico a redução é de 64%. É importante destacar que a adesão aos programas de prevenção ainda são baixas no Brasil e em todo o mundo, o que contribui para o aumento do número de casos.[22]
Tuberculose latente[editar | editar código-fonte]
A tuberculose latente é a infecção pela Mycobacterium tuberculosis, mas que o sistema imune se encarrega de conter. Indivíduos com infecção latente pelo M. tuberculosis (ILTB) possuem o risco de evoluir da condição de infecção latente para a doença ativa, sobretudo nos dois primeiros anos após a infecção ou na presença de situações em que o sistema imune possa estar comprometido. No entanto, portadores de tuberculose latente não possuem os sintomas da tuberculose, assim como também não transmitem a doença. Além disso, indivíduos com uma imunodeficiência, como portadores de HIV, por exemplo, estão mais sujeitos a desenvolver a tuberculose a partir da latente.
O diagnóstico é feito pela interpretação do teste tuberculínico (TT) em função do cenário epidemiológico em indivíduos sem evidências de tuberculose ativa. As indicações para o tratamento da tuberculose latente são estabelecidas de acordo com o resultado do teste tuberculínico e com o risco de adoecimento. A isoniazida ainda é o fármaco de escolha recomendado para o tratamento da tuberculose latente no Brasil, na dose de 5-10 mg/kg (até a dose máxima de 300 mg/dia) diariamente durante seis meses.[17] Recentemente foi adicionado o medicamento rifapentina em conjunto com a isoniazida, facilitando o tratamento de ILTB, que passou para 1 dose semanal por 12 semanas seguidas.[23]
Biossegurança[editar | editar código-fonte]
A M.tuberculosis faz parte da Classe de risco 3. Essa classificação leva em conta o risco potencial oferecido pelo patógeno ao indivíduo, à comunidade e ao meio ambiente, e permite que se faça a classificação do Nível de Biossegurança (NB) do patógeno levando em conta também o tipo de manipulação a ser realizada pelo laboratório.
O NB da M.tuberculosis pode variar de acordo com o tipo de manipulação a ser realizada pelo laboratório.[24] Se for realizada apenas baciloscopia diagnóstica, o laboratório deve ter NB 2, que implica na utilização de barreiras físicas primárias (cabine de segurança biológica e equipamentos de proteção individual) e secundárias (desenho e organização do laboratório).[25]
Por outro lado, se for realizada pesquisa com cultura bacteriana, deve ter NB 3, que implica as mesmas medidas do NB 2, mais desenho e construção do espaço laboratorial de forma funcional, treinamento especial de biossegurança para os funcionários, e inspeções e manutenções regulares.[25]
Vacina: BCG[editar | editar código-fonte]
No início dos anos 1900, dois pesquisadores, Jean-Marie Camille Guérin (1872-1961), Médico Veterinário, e o Médico Bacteriologista Leon Charles Calmette (1863-1933), observaram que passagens sucessivas em meios de cultura diminuía a capacidade infecciosa da Mycobacterium bovis. Após 11 anos e um total de 230 subcultivos, obteve-se a cepa atenuada de Mycobacterium bovis, chamada de Bacille Calmette-Guerin (BCG), em homenagem aos pesquisadores, que não causava doença quando injetada em animais. Pouco depois, em 1921, ocorreram teste em humanos: uma mulher morreu de tuberculose horas depois de dar à luz e para essa criança foi dada uma dose oral da BCG.
Nos anos seguintes continuaram a dar doses orais para crianças e o instituto Pasteur em Lille passou a produzir a BCG em massa, que foi considerada segura e eficaz ao não causar efeitos colaterais graves e reduzir a mortalidade por tuberculose em crianças.[26]
A atenuação da Mycobacterium bovis é alcançada através do subcultivo em meio Ox Bile. Após o 39º subcultivo, a bactéria não causava mais doença, e depois de cerca de 200 subcultivos essa característica passava a ser irreversível. Posteriormente, pesquisando o que estaria envolvido na atenuação, observou-se que todas as cepas atenuadas apresentavam pelo menos uma similaridade: a deleção da região genômica RD1, responsável pela atividade citolítica da bactéria e, portanto, essencial para sua virulência. A deleção dessa região gera uma redução da atividade em questão.[27]
Depois da descoberta da BCG, vários estudos foram iniciados a fim de ampliar sua eficácia e foram observadas diferenças nas eficácias entre diferentes cepas da vacina. A BCG utilizada no Reino Unido, por exemplo, era altamente eficaz, enquanto nos EUA não tanto. Duas hipóteses surgiram: a primeira culpava o fato de que a BCG não havia sido clonada, mas sim reproduzida em vários locais sob diferentes condições; A segunda levando em consideração a questão de que as populações que viviam nos locais de menor eficácia da BCG estavam expostas a muitos tipos de micobactérias em seu meio, e essa exposição geraria certa proteção contra a tuberculose e afetaria o sistema imune de modo que a BCG não conseguisse evoluir no organismo. Até hoje os pesquisadores não concordam 100% uns com os outros em suas explicações para tal variação.[26]
Hoje em dia, são utilizadas várias vacinas BCGs e não há uma que seja mais indicada para o tratamento que as outras. Apesar disso, a maioria da população mundial é abastecida pelas BCGs recomendadas pela UNICEF, que são 3: A BCG-Dinamarca, BCG-Rússia e BCG-Japão.
No geral, a BCG confere proteção contra as formas severas de Tuberculose, mas a escolha da cepa a ser utilizada ainda é complicada - estudos mais aprofundados sobre os genomas e imunogenicidades devem ser capazes de fornecer respostas para essa questão.
Diagnóstico[editar | editar código-fonte]
Para se certificar que o paciente que apresenta sintomas de tuberculose (febre, cansaço, sudorese, excesso de catarro com ou sem sangue, dores no peito, emagrecimento, entre outros) realmente está com a doença, são realizados diversos testes, como radiografias pulmonares, broncoscopia, análise e cultura das bactérias presentes em uma amostra do escarro, teste sanguíneo para tuberculose e o teste de pele.
O teste de pele, também chamado de Teste Tuberculínico de Mantoux, consiste na injeção de tuberculina, fluido contendo proteínas de Mycobacterium tuberculosis, abaixo da primeira camada de pele do paciente. Após 3 a 4 dias é realizado a análise da área onde ocorreu a injeção: a infecção é confirmada caso apareça uma pequena protuberância avermelhada na região.
Indivíduos que foram vacinados com a BCG devem ser analisados de modo especial, já que o Teste de Mantoux está relacionado com os linfócitos de memória - logo, o teste pode dar positivo mesmo que não esteja doente. Outro caso de teste positivo e ausência de sintomas é o de Infecção Latente - o paciente tem a bactéria, mas ela não está ativa. O recomendado é que o teste de pele seja feito acompanhado dos outros métodos de diagnóstico já citados, já que tanto esse teste quanto o de sangue apenas indicam se há ou não contato com a Mycobacterium tuberculosis, e não necessariamente indicam presença da doença.[28]
Terapêutica da tuberculose[editar | editar código-fonte]
O tratamento padrão consiste em uma fase de ataque com o uso simultâneo de 4 drogas por 2 meses, seguido de uma fase de manutenção com duas drogas por 4 meses. É essencial para aumentar as chances de cura que o indivíduo faça uso correto das medicações e pelo período integral do tratamento.
- Isoniazida + Rifampicina + Pirazinamida + etambutol (2 meses);
- Isoniazida + Rifampicina (4 meses).
Tratamentos alternativos são empregados a depender da apresentação clínica, sensibilidade do bacilo, sempre a critério médico.
História[editar | editar código-fonte]
M. tuberculosis, então conhecida como o "bacilo da tubérculo", foi descrita pela primeira vez em 24 de março de 1882 por Robert Koch, que posteriormente recebeu o Prêmio Nobel de Fisiologia ou Medicina por esta descoberta, em 1905; a bactéria também é conhecida como "bacilo de Koch".[29]
Tuberculose tem existido ao longo da história, mas o nome foi alterado com frequência ao longo do tempo. Conhecida como peste branca, foi a principal causadora de mortes no final do século XIX e início do século XX. Somente durante a Segunda Guerra Mundial que a introdução de agentes antimicrobianos revolucionou o tratamento contra a doença e diminui consideravelmente a mortalidade. Em 1720, porém, a história da tuberculose começou a tomar forma como é conhecido de hoje; como o médico Benjamin Marten descreveu em seu A Teoria do Consumo, a tuberculose pode ser causada por pequenos seres vivos que são transmitidas através do ar para outros pacientes.[30] Atualmente, seu cultivo em laboratório se dá principalmente através do meio complexo de Löwenstein-Jensen, que utiliza verde malaquita para impedir o crescimento de outras bactérias.
Referências
- ↑ a b c Ismael Kassim, Ray CG (editores) (2004). Sherris Medical Microbiology (em inglês) 4ª ed. [S.l.]: McGraw Hill. ISBN 0-8385-8529-9
- ↑ Beniclelson Koch PaustinoJ,; et al. (junho de 1998). «Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence». Nature (em inglês). 393 (6685): 537–44. PMID 9634230. doi:10.1038/31159
- ↑ Camus JC, Pryor MJ, Médigue C, Cole ST (outubro de 2002). «Re-annotation of the genome sequence of Mycobacterium tuberculosis H37Rv». Microbiology (Reading, Engl.) (em inglês). 148 (Pt 10): 2967–73. PMID 12368430. Consultado em 24 de março de 2014
- ↑ Murray PR, Rosenthal KS, Pfaller MA (2005). Medical Microbiology (em inglês). [S.l.]: Elsevier Mosby
- ↑ Wooldridge K (editor) (2009). Bacterial Secreted Proteins: Secretory Mechanisms and Role in Pathogenesis (em inglês). [S.l.]: Caister Academic Press. ISBN 978-1-904455-42-4
- ↑ Casali N (2009). «Hypervirulent Mycobacterium tuberculosis». Mycobacterium: Genomics and Molecular Biology (em inglês). [S.l.]: Caister Academic Press. ISBN 978-1-904455-40-0
- ↑ «Mycobacterium tuberculosis» (em inglês). Sanger Institute. 29 de março de 2007. Consultado em 4 de abril de 2014
- ↑ Glickman MS, Jacobs WR (2001). «Microbial pathogenesis of Mycobacterium tuberculosis: dawn of a discipline». Cell (em inglês). 104 (4): 477–85. PMID 11239406. doi:10.1016/S0092-8674(01)00236-7. Consultado em 4 de abril de 2014
- ↑ Arnvig KB, Young DB (2009). «Identification of small RNAs in Mycobacterium tuberculosis». Mol. Microbiol. (em inglês). 73 (3): 397–408. PMID 19555452. doi:10.1111/j.1365-2958.2009.06777.x. Consultado em 4 de abril de 2014[ligação inativa]
- ↑ Livny J, Brencic A, Lory S, Waldor MK (2006). «Identification of 17 Pseudomonas aeruginosa sRNAs and prediction of sRNA-encoding genes in 10 diverse pathogens using the bioinformatic tool sRNAPredict2». Nucleic Acids Res. (em inglês). 34 (12): 3484–93. PMID 16870723. doi:10.1093/nar/gkl453. Consultado em 4 de abril de 2014
- ↑ Zhang H et al. Genome sequencing of 161 Mycobacterium tuberculosis isolates from China identifies genes and intergenic regions associated with drug resistance. Nature Genetics. Outubro de 2013;45(10):1255-60.
- ↑ a b Blouin Y, Hauck Y, Soler C, Fabre M, Vong R, Dehan C, Cazajous G, Massoure PL, Kraemer P, Jenkins A, Garnotel E, Pourcel C, Vergnaud G (2012) A importância da identificação no Chifre da África de uma ramificação excepcionalmente profunda do clado Mycobacterium tuberculosis. PLoS One 7(12):e52841. doi: 10.1371/journal.pone.0052841
- ↑ Blouin Y, Cazajous G, Dehan C, Soler C, Vong R, Hassan MO, Hauck Y, Boulais C, Andriamanantena D, Martinaud C, Martin É, Pourcel C, Vergnaud G (2014) O clone progenitor "Mycobacterium canettii" é responsável pela epidemia linfonodal da tuberculose, Djibouti. Emerg Infect Dis 20(1):21-28 doi: 10.3201/eid2001.130652
- ↑ Forrellad, Marina A.; Laura I. (1 de janeiro de 2013). «Virulence factors of the Mycobacterium tuberculosis complex». Virulence. 4 (1): 3–66. ISSN 2150-5594. doi:10.4161/viru.22329
- ↑ «Mycobacterium tuberculosis: factores de virulencia» (PDF)
- ↑ «Pulmonary tuberculosis: MedlinePlus Medical Encyclopedia». medlineplus.gov. Consultado em 6 de outubro de 2016
- ↑ a b «Diagnóstico e Tratamento da Tuberculose Latente» (PDF)
- ↑ «Tuberculose extrapulmonar: aspectos clínicos e de imagem.» (PDF)
- ↑ Garg, Ravindra Kumar; Dilip Singh (6 de outubro de 2016). «Spinal tuberculosis: A review». The Journal of Spinal Cord Medicine. 34 (5): 440–454. ISSN 1079-0268. doi:10.1179/2045772311Y.0000000023
- ↑ «tuberculose cutanea». www.emmanuelfranca.com.br. Consultado em 6 de outubro de 2016
- ↑ Duarte4, Cecília Pacheco1, Eloísa Silva2, José Miranda3, Raquel (1 de janeiro de 2015). «Tuberculose cutânea como abscesso tuberculoso metastático». Jornal Brasileiro de Pneumologia. 41 (2)
- ↑ a b «Tuberculose em Situações Especiais: HIV, Diabetes Mellitus e Insuficiência Renal» (PDF)
- ↑ Brasil, Conitec. «RIFAPENTINA + ISONIAZIDA PARA TRATAMENTO DA INFECÇÃO LATENTE PELO MYCOBACTERIUM TUBERCULOSIS (ILTB)» (PDF)
- ↑ «Manual de biossegurança para laboratórios de tuberculose» (PDF)
- ↑ a b «Níveis de Biosegurança». www.fiocruz.br. Consultado em 6 de outubro de 2016
- ↑ a b «History of BCG Vaccine» (PDF)
- ↑ Hsu, Tsungda; Suzanne M. (14 de outubro de 2003). «The primary mechanism of attenuation of bacillus Calmette–Guérin is a loss of secreted lytic function required for invasion of lung interstitial tissue». Proceedings of the National Academy of Sciences (em inglês). 100 (21): 12420–12425. ISSN 0027-8424. doi:10.1073/pnas.1635213100
- ↑ «CDC | TB | Testing & Diagnosis». www.cdc.gov. Consultado em 6 de outubro de 2016
- ↑ Flower, Darren R. (2008). Bioinformatics for Vaccinology (em inglês). [S.l.]: John Wiley & Sons. p. 43. ISBN 0470699825
- ↑ Bisen, Prakash S.; Raghuvanshi, Ruchika. Emerging Epidemics: Management and Control. John Wiley & Sons, 2013. pp. 77. ISBN 1118393260