Cianeto de benzila
| Cianeto de benzila Alerta sobre risco à saúde | |
|---|---|
| |
| |
| Nome IUPAC | Phenylacetonitrile[1] |
| Outros nomes | Benzyl cyanide[1] 2-Fenilacetonitrila α-Tolunitrila Benzilnitrila Cianureto de benzila (obsoleto) |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| KEGG | |
| ChEBI | |
| SMILES |
|
| InChI | 1/C8H7N/c9-7-6-8-4-2-1-3-5-8/h1-5H,6H2
|
| Propriedades | |
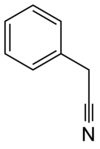
| Fórmula molecular | C8H7N |
| Massa molar | 117.15 g/mol |
| Aparência | Líquido incolor oleoso |
| Densidade | 1.015 g/cm3 |
| Ponto de fusão |
-24 °C, 249 K, -11 °F |
| Ponto de ebulição |
233 a 234 °C |
| Susceptibilidade magnética | -76.87·10−6 cm3/mol |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Cianeto de benzila (abreviado na literatura como BnCN) é um composto orgânico com a fórmula química C6H5CH2CN. Este líquido oleoso incolor aromático é um importante precursor para numerosos compostos em síntese orgânica.[2]
Preparação[editar | editar código-fonte]
Cianeto de benzila pode ser produzido via síntese de nitrila de Kolbe entre cloreto de benzila e cianeto de sódio[3] e por decarboxilação oxidativa de fenilalanina.[4]
Propriedades químicas[editar | editar código-fonte]
Cianeto de benzila pode ser hidrolisado resultando em ácido fenilacético[5] ou usado na reação de Pinner rendendo ésteres de ácido fenilacético.[6] O composto também forma uma "unidade metileno ativa" no carbono entre o anel aromático e o grupo funcional nitrila. Este carbono ativo, como referente a um ânion nitrila, é um intermediário de reação útil para a formação de novas ligações carbono-carbono.[7][8][9]
Usos[editar | editar código-fonte]
Cianeto de benzila é usado como um solvente[10] e como um material de partida na síntese de Fungicidas,[11] fragrâncias (álcool fenetílico), antibióticos,[2] e outros fármacos. A hidrólise parcial de BnCN resulta em 2-fenilacetamida,[12] um conhecido anticonvulsivo.
Fármacos[editar | editar código-fonte]
Cianeto de benzila é um precursor útil para inúmeros fármacos. Exemplos incluem:
- Anorético (e.g. sibutramina)[13]
- Analgésicos (e.g. etoeptazina, cetobemidona, petidina, e fenoperidina)[13]
- Antiarrítmicos (e.g. disopiramida)[13]
- Antidepressivos (e.g. venlafaxina)[13]
- Anti-histamínicos (e.g. levocabastina e clorfenamina)[13][14]
- Medicações antimaláricas (e.g. pirimetamina)[13]
- Antitússicos (e.g. isoaminila, oxeladina, butetamato, pentapiperida, e pentoxiverina)[15]
- Diuréticos (e.g. triantereno)[16]
- Hipnóticos (e.g. alonimid e fenobarbital)[13][17]
- Espasmolíticos (e.g. pentapiperida e drofenina)[13][18]
- Estimulantes (e.g. metilfenidato)[13]
- Azatadina
Regulação[editar | editar código-fonte]
Devido ao cianeto de benzila ser um precursor útil para numerosas drogas com potencial uso recreacional, muitos países regulam rigorosamente o composto.
Estados Unidos[editar | editar código-fonte]
Cianeto de benzila é regulado nos Estados Unidos como uma substância química listada pelo DEA.
Segurança[editar | editar código-fonte]
Cianeto de benzila, como derivados benzilo relacionados, é irritante para a pele e olhos.[2] É um composto tóxico e produz o mortalmente venenoso cianeto de hidrogênio quando queimado.
Referências
- ↑ a b Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 16. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001
- ↑ a b c Pollak, Peter; Romeder, Gérard; Hagedorn, Ferdinand; Gelbke, Heinz-Peter (2000). «Nitriles». Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a17_363
- ↑ Adams, Roger; Thal, A. F. (1922). «Benzyl cyanide». Organic Syntheses. 2: 9. doi:10.15227/orgsyn.002.0009
- ↑ Hiegel, Gene; Lewis, Justin; Bae, Jason (2004). «Conversion of α‐Amino Acids into Nitriles by Oxidative Decarboxylation with Trichloroisocyanuric Acid». Synthetic Communications. 34 (19): 3449–3453. doi:10.1081/SCC-200030958
- ↑ Adams, Roger; Thal, A. F. (1922). «Phenylacetic acid». Organic Syntheses. 2: 59. doi:10.15227/orgsyn.002.0059
- ↑ Adams, Roger; Thal, A. F. (1922). «Ethyl Phenylacetate». Organic Syntheses. 2: 27. doi:10.15227/orgsyn.002.0027
- ↑ Makosza, M.; Jonczyk, A (1976). «Phase-Transfer Alkylation of Nitriles: 2-Phenylbutyronitrile». Organic Synthesis. 55: 91. doi:10.15227/orgsyn.055.0091
- ↑ Itoh, Masumi; Hagiwara, Daijiro; Kamiya, Takashi (1988). «New Reagent for tert-Butoxycarbonylation: 2-tert-Butoxycarbonyloxyimino-2-phenylacetonitrile». Organic Syntheses. 6: 199. doi:10.15227/orgsyn.059.0095
- ↑ Wawzonek, Stanley; Smolin, Edwin M. (1955). «α-Phenylcinnamonitrile». Organic Syntheses. 3: 715. doi:10.15227/orgsyn.029.0083
- ↑ Bien, Hans-Samuel; Stawitz, Josef; Wunderlich, Klaus (2000). «Anthraquinone Dyes and Intermediates». Ullmann's Encyclopedia of Industrial Chemistry: 29. doi:10.1002/14356007.a02_355
- ↑ Ackermann, Peter; Margot, Paul; Müller, Franz (2000). «Fungicides, Agricultural». Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a12_085
- ↑ «PHENYLACETAMIDE». Organic Syntheses. 32. 92 páginas. 1952. ISSN 0078-6209. doi:10.15227/orgsyn.032.0092
- ↑ a b c d e f g h i William Andrew Publishing (2008). Pharmaceutical Manufacturing Encyclopedia 3rd ed. Norwich, NY: Elsevier Science. pp. 182, 936, 1362, 1369, 1505, 2036, 2157, 2259, 2554, 2620, 2660, 2670, 2924, 3032, & 3410. ISBN 9780815515265
- ↑ Berkoff, Charles E.; Rivard, Donald E.; Kirkpatrick, David; Ives, Jeffrey L. (1980). «The Reductive Decyanation of Nitriles by Alkali Fusion». Synthetic Communications. 10 (12): 939–945. doi:10.1080/00397918008061855
- ↑ Bub, Oskar; Friedrich, Ludwig (2000). «Cough Remedies». Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a08_013
- ↑ Hropot, Max; Lang, Hans-Jochen (2000). «Diuretics». Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a09_029
- ↑ Furniss, Brian; Hannaford, Antony; Smith, Peter & Tatchell, Austin (1996). Vogel's Textbook of Practical Organic Chemistry 5th Ed. London: Longman Science & Technical. pp. 1174–1179. ISBN 9780582462366
- ↑ Bungardt, Edwin; Mutschler, Ernst (2000). «Spasmolytics». Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a24_515
Ligações externas[editar | editar código-fonte]
- EPA Chemical Profile for phenylacetonitrile (Perfil químicos da fenilacetonitrila na Agência de Proteção Ambiental dos Estados Unidos.)
