Temperatura adiabática de chama
No estudo da combustão, existem dois tipos de temperatura adiabática de chama, dependendo de como o processo é concluído: a volume constante e à pressão constante, os quais descrevem a temperatura e os produtos de combustão teoricamente obtidos se nenhuma energia for perdida para o ambiente externo.
A temperatura adiabática de chama a volume constante é a temperatura que resulta de uma combustão completa que ocorre sem qualquer trabalho, transferência de calor nem alterações nas energias cinética e potencial. A temperatura adiabática de chama à pressão constante é a temperatura que resulta de uma combustão completa que ocorre sem qualquer transferência de calor nem alterações nas energias cinética e potencial. Sua temperatura é mais baixa do que a de volume constante, pois parte da energia é utilizada para alterar o volume do sistema (isto é, para gerar trabalho).
Combustíveis comuns[editar | editar código-fonte]


No cotidiano, a grande maioria dos combustíveis é derivada de compostos orgânicos, incluindo madeira, cera, gordura, plásticos comuns, propano e gasolina. A temperatura adiabática de chama à pressão constante dessas substâncias no ar encontra-se num intervalo estreito próximo a 1950°C. Isso ocorre porque, em termos de estequiometria, a combustão de um composto orgânico com n carbonos envolve a quebra de cerca de 2n ligações C–H, n ligações C–C e 1,5n ligações O2 para formar cerca de n moléculas de CO2 e n moléculas de H2O.
Como a maioria dos processos de combustão que acontecem naturalmente ocorre ao ar aberto, não há nada que confine o gás em um volume específico, diferentemente do que ocorre no cilindro de um motor. Consequentemente, essas substâncias queimarão a uma pressão constante, permitindo que o gás se expanda durante o processo.
Temperaturas de chamas comuns[editar | editar código-fonte]
Supondo que a condição inicial atmosférica seja de 1 bar e 20°C, a tabela a seguir lista a temperatura adiabática de chama para vários gases sob pressão constante. As temperaturas mencionadas aqui são para um mistura estequiométrica entre combustível e comburente (razão ar–combustível φ = 1).
Estas temperaturas de chama são teóricas, não reais, produzidas por uma chama que não perde calor para o ambiente. A região mais próxima a esta temperatura é a parte mais quente da chama, onde a reação de combustão é mais eficiente. Também se pressupõe que a combustão seja completa (perfeitamente equilibrada, não fumegante, geralmente azulada).
| Combustível | Comburente | (°C) | (°F) |
|---|---|---|---|
| Acetileno (C2H2) | Ar | 2500 | 4532 |
| Acetileno (C2H2) | Oxigênio | 3480 | 6296 |
| Butano (C4H10) | Ar | 1970 | 3578 |
| Cianogênio (C2N2) | Oxigênio | 4525 | 8177 |
| Dicianoacetileno (C4N2) | Oxigênio | 4990 | 9010 |
| Etano (C2H6) | Ar | 1955 | 3551 |
| Etanol (C2H5OH) | Ar | 2082 | 3779[1] |
| Gasolina | Ar | 2138 | 3880 |
| Hidrogênio (H2) | Ar | 2254 | 4089 |
| Hidrogênio (H2) | Oxigênio | 3200 | 5792[2] |
| Metano (CH4) | Ar | 1963 | 3565[3] |
| Metanol (CH4OH) | Ar | 1949 | 3540 |
| Gás natural | Ar | 1960 | 3562[4] |
| Pentano (C5H12) | Ar | 1977 | 3591 |
| Propano (C3H8) | Ar | 1980 | 3596[5] |
| Propano (C3H8) | Oxigênio | 2526 | 4579 |
| Gás MAPP Metilacetileno (C3H4) |
Ar | 2010 | 3650 |
| Gás MAPP Metilacetileno (C3H4) |
Oxigênio | 2927 | 5301 |
| Tolueno (C7H8) | Ar | 2071 | 3760 |
| Madeira | Ar | 1980 | 3596 |
| Querosene | Ar | 2093[6] | 3801 |
| Óleo combustível leve | Ar | 2104 | 3820 |
| Petróleo | Ar | 2101 | 3815 |
| Óleo combustível pesado | Ar | 2102 | 3817 |
| Hulha | Ar | 2172 | 3943 |
| Antracito | Air | 2180 | 3957 |
| Antracito | Oxigênio | ~2900[nota 1] | ~5255 |
| Alumínio | Oxigênio | 3732 | 6750 |
| Lítio | Oxigênio | 2438 | 4420 |
| Fósforo branco | Oxigênio | 2969 | 5376 |
| Zircônio | Oxigênio | 4005 | 7241 |
- ↑ A temperatura igual a aproximadamente 3200 K corresponde a 50% da dissociação química de CO2 na pressão de 1 atm. Este último permanece invariável, constituindo 97% do total de fumos liberados no caso do antracito queimado em oxigênio. Temperaturas mais elevadas podem ocorrer em reações sob altas pressões.
Termodinâmica[editar | editar código-fonte]

A partir da primeira lei da termodinâmica, para um sistema fechado em reação, tem-se que:
onde e são o calor e o trabalho transferidos do sistema para o ambiente durante o processo, respectivamente, e e são a energia interna dos reagentes e dos produtos, respectivamente.
No caso da temperatura adiabática de chama a volume constante, o volume do sistema é mantido constante, portanto não ocorre nenhum trabalho:
e também não há transferência de calor, pois o processo é adiabático: . Como resultado, a energia interna dos produtos é igual à energia interna dos reagentes: .
Como esse é um sistema fechado, a massa dos produtos e dos reagentes é constante, com a primeira lei podendo ser escrita com base nela:


No caso da temperatura adiabática de chama à pressão, a pressão do sistema é mantida constante, o que resulta na seguinte equação para o trabalho:
Novamente não há transferência de calor ocorrendo, uma vez que o processo foi definido como adiabático: . A partir da primeira lei, tem-se que:
A partir da definição de entalpia, conclui-se que . Dado que esse é um sistema fechado, a massa dos produtos e dos reagentes é constante, e a primeira lei pode ser escrita com base nela:
Nota-se que a temperatura adiabática de chama à pressão constante é menor do que a temperatura a volume constante. Isso ocorre porque parte da energia liberada durante a combustão é usada para alterar o volume do sistema de controle. Uma analogia que é comumente feita entre os dois processos é pela combustão em um motor de combustão interna. Para o processo adiabático em volume constante, supõe-se que a combustão ocorre instantaneamente assim que o pistão atinge o ponto morto superior (ciclo de Otto ou ciclo do volume constante). Para o processo adiabático em pressão constante, enquanto a combustão está ocorrendo o pistão está se movendo a fim de manter a pressão constante (ciclo de Diesel ou ciclo da pressão constante).

Supondo que a combustão é completa (ou seja, que são liberados apenas CO2 e H2O), é possível calcular a temperatura adiabática de chama em condições estequiométricas ou numa mistura "pobre" (com excesso de ar). Isso se deve pela suficiente quantidade de variáveis e equação molares para balancear em ambos os lados:
Como a mistura ainda está "rica", não há variáveis suficientes sem que pelo menos se adicione CO e H2 necessários para o balanço molar (produtos mais comuns de uma combustão incompleta):
No entanto, se for levada em conta a reação de mudança do vapor de água:
e usar a constante de equilíbrio para esta reação, haverá variáveis suficientes para concluir o cálculo.

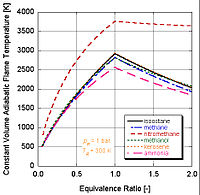
Diferentes combustíveis com diferentes níveis de energia e constituintes molares resultam em diferentes temperaturas adiabáticas de chama.
É possível ver na figura a seguir por que o nitrometano (CH3NO2) é frequentemente utilizado como um gerador de energia em carros. Uma vez que cada mol de nitrometano contém dois mols de oxigênio, ele pode queimar com uma menor quantidade de ar, pois fornece seu próprio oxidante junto com o combustível. Isso permite que acumule mais pressão durante um processo a volume constante. Quanto maior a pressão, maior a força sobre o pistão, que por conseguinte gera mais trabalho e potência no motor. A mistura permanece relativamente "rica" devido à presença de um próprio oxidante; no entanto, o contínuo funcionamento de um motor a nitrometano eventualmente levará ao derretimento do pistão ou do cilindro devido à alta temperatura.

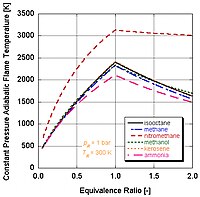
Em aplicações reais, a combustão completa não ocorre normalmente. A química determina que a dissociação e a cinética mudarão a constituição relativa dos produtos. Há uma série de programas que podem calcular a temperatura adiabática de chama levando em conta dissociações pelas constantes de equilíbrio (Stanjan, NASA CEA, AFTP). A figura a seguir ilustra os como os efeitos da dissociação tendem a diminuir o temperatura adiabática da chama. Esse resultado pode ser explicado pelo princípio de Le Châtelier.
Referências[editar | editar código-fonte]
- ↑ Chama, Temperatura de Análise de Emissões de NOx e para Diferentes Combustíveis
- ↑ Temperaturas de chama
- ↑ CRC Handbook of Chemistry and Physics, 96 Edição, p. 15-51
- ↑ Norte-Americana de Combustão Handbook, Volume 1, 3ª edição Norte-Americana Mfg Co., 1986.
- ↑ «Flame Temperature Measurement Experiment» (PDF). California Institute of Technology. 2003. Consultado em 28 de maio de 2017. Arquivado do original (PDF) em 24 de setembro de 2015
- ↑ Apresentação em Power Point: Temperatura de Chama, Hsin Chu, Departamento de Engenharia Ambiental, National Cheng Kung University, em Taiwan
Ligações externas[editar | editar código-fonte]
Informações gerais[editar | editar código-fonte]
- «Temperatures in flames and fires». Fire Science and Technology Inc. Consultado em 28 de maio de 2017. Arquivado do original em 12 de janeiro de 2008
- Cálculo da temperatura adiabática de chama
- Temperatura adiabática de chama
Tabelas[editar | editar código-fonte]
- «Adiabatic Flame Temperature». The Engineering Toolbox temperatura adiabática de chama do hidrogênio, metano, propano e octano com oxigênio e ar como oxidantes
- «Flame Temperatures for some Common Gases». The Engineering Toolbox
- Temperatura de uma chama azul e de materiais comuns
Calculadoras[editar | editar código-fonte]
- Calculadora online da temperatura adiabática de chama usando Cantera
- Programa de simulação da temperatura adiabática de chama
- Gaseq, programa para a realização de cálculos de equilíbrio químico.
- Calculadora da temperatura de chama – Combustão adiabática bipropelente à pressão constante
- Adiabática de Chama Temperatura de calculadora


















