Lenacapavir
| |
| Nome IUPAC (sistemática) | |
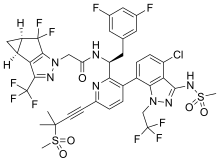
| N-[(1S)-1-{3-[4-chloro-3-(methanesulfonamido)-1-(2,2,2- trifluoroethyl)-1H-indazol-7-yl]-6-[3-(methanesulfonyl)-3- methylbut-1-yn-1-yl]pyridin-2-yl}-2-(3,5-difluorophenyl)ethyl]-2- [(3bS,4aR)-5,5-difluoro-3-(trifluoromethyl)-3b,4,4a,5-tetrahydro- 1H-cyclopropa[3,4]cyclopenta[1,2-c]pyrazol-1-yl]acetamide | |
| Identificadores | |
| CAS | 2189684-44-2 |
| ATC | J05AX31 |
| PubChem | ? |
| DrugBank | DB15673 |
| ChemSpider | |
| Informação química | |
| Fórmula molecular | C39H32N7ClF10O5S2 |
| Massa molar | ? |
| SMILES | CC(C)(C#Cc1ccc(-c2ccc(Cl)c3c(NS(C)(=O)=O)nn(CC(F)(F)F)c23)c([C@H](Cc2cc(F)cc(F)c2)NC(=O)Cn2nc(C(F)(F)F)c3c2C(F)(F)[C@@H]2C[C@H]32)n1)S(C)(=O)=O |
| Sinónimos | GS-CA1, GS-6207 |
| Farmacocinética | |
| Biodisponibilidade | ? |
| Metabolismo | ? |
| Meia-vida | ? |
| Excreção | ? |
| Considerações terapêuticas | |
| Administração | ? |
| DL50 | ? |
O Lenacapavir, vendido sob o nome comercial de Sunlenca e desenvolvido pela Gilead Sciences, é um medicamento antirretroviral usado no tratamento de HIV/AIDS.[1]
O Lenacapavir é o primeiro de uma nova classe de medicamentos chamados inibidores do capsídeo a ser aprovado pela Food and Drug Administration (FDA) para o tratamento do HIV/AIDS.[2] O Lenacapavir atua bloqueando o capsídeo viral do HIV-1, interferindo nas etapas essenciais do ciclo de vida do vírus.[2] A FDA o considera um medicamento de primeira linha.[3]
O medicamento foi aprovado para uso médico na União Europeia em agosto de 2022,[1][4] no Canadá em novembro de 2022[5] e nos Estados Unidos em dezembro de 2022.[2][6]
Uso medicinal[editar | editar código-fonte]
O Lenacapavir, em combinação com outros medicamentos antirretrovirais, é indicado para o tratamento de HIV/AIDS.[7][2][8]
É tomado por via oral ou por injeção subcutânea e os efeitos colaterais mais comuns incluem reações no local da injeção e náusea.[1][2]
Histórico[editar | editar código-fonte]
O Lenacapavir está sendo desenvolvido pela Gilead Sciences e, em 2021, estava em testes clínicos de fase II/III.[9][10] Está sendo investigado como tratamento para pacientes com HIV infectados com vírus multirresistente e como injetável duas vezes por ano para profilaxia pré-exposição (PrEP).[10][11]
A segurança e a eficácia do Lenacapavir foram estabelecidas por meio de um estudo clínico multicêntrico com 72 participantes cujas infecções por HIV eram resistentes a várias classes de medicamentos para HIV.[2] Esses participantes precisavam ter altos níveis de vírus no sangue, apesar de estarem tomando medicamentos antirretrovirais. Os participantes foram incluídos em um de dois grupos de estudo.[2] Um dos grupos foi randomizado para receber Lenacapavir ou placebo de forma duplo-cega, e o outro grupo recebeu Lenacapavir sem rótulo.[2] A medida primária de eficácia foi a proporção de participantes do grupo de estudo randomizado que alcançou um determinado nível de redução do vírus durante os 14 dias iniciais em comparação com a linha de base.[2]
A FDA concedeu ao pedido de Lenacapavir as designações de revisão prioritária, via rápida e terapia inovadora. A FDA concedeu a aprovação do Sunlenca à Gilead Sciences.[2]
Sociedade e cultura[editar | editar código-fonte]
Status legal[editar | editar código-fonte]
Em 23 de junho de 2022, o Comitê de Medicamentos para Uso Humano (CHMP) da Agência Europeia de Medicamentos (EMA) adotou um parecer positivo, recomendando a concessão de uma autorização de comercialização para o medicamento Sunlenca, destinado ao tratamento de adultos com infecção pelo vírus da imunodeficiência humana multirresistente tipo 1 (HIV-1).[12] O requerente desse medicamento é a Gilead Sciences Ireland UC.[12]
O medicamento foi aprovado para uso médico na União Europeia em agosto de 2022,[1][4] no Canadá em novembro de 2022[5] e nos Estados Unidos em dezembro de 2022.[2][6]
No Brasil[editar | editar código-fonte]
O Estudo PURPOSE 2, que testa a nova droga para a PrEP, está sendo realizado em algumas cidades brasileiras.[10][11][13][14][15]
Ver também[editar | editar código-fonte]
Referências
- ↑ a b c d «Sunlenca EPAR». Agência Europeia de Medicamentos (EMA) (em inglês). 22 de junho de 2022. Consultado em 6 de julho de 2023. Cópia arquivada em 26 de agosto de 2022
- ↑ a b c d e f g h i j k «FDA Approves New HIV Drug for Adults with Limited Treatment Options» (Nota de imprensa) (em inglês). Food and Drug Administration (FDA). 22 de dezembro de 2022. Consultado em 6 de julho de 2023
 Este artigo incorpora texto desta fonte, que está no domínio público.
Este artigo incorpora texto desta fonte, que está no domínio público.
- ↑ «Advancing Health Through Innovation: New Drug Therapy Approvals 2022» (em inglês). Food and Drug Administration (FDA). 10 de janeiro de 2023. Consultado em 6 de julho de 2023
 Este artigo incorpora texto desta fonte, que está no domínio público.
Este artigo incorpora texto desta fonte, que está no domínio público.
- ↑ a b «Gilead Announces First Global Regulatory Approval of Sunlenca (Lenacapavir), the Only Twice-Yearly HIV Treatment Option» (Nota de imprensa) (em inglês). Gilead Sciences. 22 de agosto de 2022. Consultado em 6 de julho de 2023
- ↑ a b «Sunlenca Product information». Health Canada (em inglês). 25 de abril de 2012. Consultado em 6 de julho de 2023
- ↑ a b «Sunlenca (lenacapavir) Receives FDA Approval as a First-in-Class, Twice-Yearly Treatment Option for People Living With Multi-Drug Resistant HIV» (Nota de imprensa) (em inglês). Gilead Sciences. 22 de dezembro de 2022. Consultado em 6 de julho de 2023
- ↑ «Sunlenca- lenacapavir sodium tablet, film coated Sunlenca- lenacapavir sodium kit». DailyMed (em inglês). 21 de dezembro de 2022. Consultado em 6 de julho de 2023
- ↑ «Lenacapavir para o tratamento de HIV-1 multirresistente». Agência Aids. 5 de março de 2023. Consultado em 6 de julho de 2023
- ↑ Link JO, Rhee MS, Tse WC, Zheng J, Somoza JR, Rowe W, et al. (agosto de 2020). «Clinical targeting of HIV capsid protein with a long-acting small molecule». Nature (em inglês). 584 (7822): 614–618. Bibcode:2020Natur.584..614L. PMC 8188729
 . PMID 32612233. doi:10.1038/s41586-020-2443-1
. PMID 32612233. doi:10.1038/s41586-020-2443-1
- ↑ a b c «Lenacapavir Effective in Multidrug Resistant HIV». Medscape (em inglês). 11 de março de 2021. Consultado em 6 de julho de 2023. Cópia arquivada em 16 de março de 2021
- ↑ a b «Lenacapavir Shows Promise for Long-Acting HIV Treatment and Prevention». POZ (em inglês). 15 de março de 2021. Consultado em 6 de julho de 2023. Cópia arquivada em 19 de julho de 2021
- ↑ a b «Sunlenca: Pending EC decision». Agência Europeia de Medicamentos (EMA) (em inglês). 23 de junho de 2022. Consultado em 6 de julho de 2023. Cópia arquivada em 26 de junho de 2022
- ↑ «Lenacapavir: pesquisa vai testar remédio semestral na prevenção do HIV no Brasil». Terra. 31 de outubro de 2022. Consultado em 6 de julho de 2023
- ↑ «Pesquisa de novo remédio para prevenir HIV não encontra voluntários em SP». UOL. 12 de fevereiro de 2023. Consultado em 6 de julho de 2023
- ↑ «Estudo sobre PrEP injetável recruta voluntários LGBTs». Agência AIDS. 14 de dezembro de 2022. Consultado em 6 de julho de 2023
Ligações externas[editar | editar código-fonte]
- «Lenacapavir». Drug Information Portal (em inglês). Biblioteca Nacional de Medicina dos Estados Unidos
- «Lenacapavir sodium». Drug Information Portal (em inglês). Biblioteca Nacional de Medicina dos Estados Unidos
- «Lenacapavir». Clinical Info (em inglês). Institutos Nacionais da Saúde
