Imidazol
| Imidazole Alerta sobre risco à saúde | |
|---|---|
| |
| Nome IUPAC | 1,3-diazol |
| Outros nomes | Imidazol 1,3-diazaciclopenta-2,4-dieno |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| Número RTECS | N13325 1985-86 |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | C3H4N2 |
| Massa molar | 68,08 g/mol |
| Aparência | sólido branco ou amarelado |
| Densidade | 1,03 g·cm-3 [1] |
| Ponto de fusão |
90–91 °C [1] |
| Ponto de ebulição |
257 °C [1] |
| Solubilidade em água | 633 g·l-1 a 20 °C [1] |
| Solubilidade | solúvel em etanol, clorofórmio, éter dietílico e piridina [1] |
| Acidez (pKa) | 6,95 (25 °C) [2] |
| Estrutura | |
| Estrutura cristalina | monoclínico |
| Geometria de coordenação |
anel plano, de 5 membros |
| Momento dipolar | 3.61D |
| Riscos associados | |
| MSDS | External MSDS |
| Principais riscos associados |
Corrosivo |
| Frases R | R20 R22 R34 R41 |
| Frases S | S26 S36 S37 S39 S45 |
| Ponto de fulgor | 146 °C |
| LD50 | 760 mg·kg-1 (Porquinho-da-Índia , oral) [3] 880 mg·kg-1 (Camundongo, oral) [4] 220 mg·kg-1 (Rato, oral) [3] |
| Compostos relacionados | |
| compostos com anel aromático simples relacionados | Pirrol (apenas um N no anel) Pirazol (2 Ns nas posições 1,2) Oxazol (um O em vez de um N) Tiazol (um S em vez de um N) Pirimidina (hexagonal) Benzimidazol (um benzeno fundido ao anel pentagonal) Purina (um anel hexagonal com mais dois N fundido ao anel pentagonal) |
| Compostos relacionados | Imidazolidina (saturado) N-metilimidazol Ácido urocânico (ácido (E)-3-(1H-imidazol-5-il)prop-2-enoico) Histamina (2-(1H-imidazol-4-il)etanamina) Histidina (ácido 2-amino-3-(1H-imidazol-4-il)propanoico) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
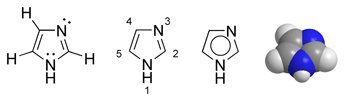
Imidazol é um composto orgânico de fórmula C3H4N2. Este composto aromático heterocíclico é classificado como alcaloide. Imidazol também pode se referir a classe de compostos heterocíclicos com estrutura de anel aromático similar, mas com vários substituintes. Esta classe de composto heterocíclicos e importante bloco de construção de compostos bioquímicos como histidina e seu hormônio relacionado histamina. Imidazol também serve como base ou ácido fraco. Muitos fármacos contêm o anel imidazólico, como antifúngicos e o nitroimidazol.[5][6][7][8][9]
Descoberta
[editar | editar código-fonte]Imidazol foi primeiramente sintetizado por Heinrich Debus em 1858, mas vários derivados de imidazole foram descobertos anteriormente, na década de 1840. Esta síntese, mostrada abaixo, utiliza glioxal e formaldeído na presenca de amônia . Ainda que seja considerada de baixa eficiência, esta reação ainda e utilizada.[10]

Estrutura e propriedades
[editar | editar código-fonte]Imidazol possui um anel planar de 5-membros, solúvel em água e outros solventes polares, com um dipolo de 3.61D. Sua ocorrência está relacionada a duas formas tautoméricas equivalentes, em função do átomo de hidrogênio poder estar localizado em qualquer um dos dois átomos de nitrogênio. É classificado como composto aromático em função da presença de um sexteto de ligações. Algumas estruturas de ressonância estão relacionadas abaixo:

Anfotericidade
[editar | editar código-fonte]Imidazol é composto anfótero, i.e. pode ser usado como ácido ou como base. Como ácido, o pKa of e 14.5, sendo menos ácido do que ácidos carboxílicos, fenóis, e imidas. O próton ácido está localizado no nitrogênio N-1. Como base,o pKa do conjugado ácido e aproximadamente 7, tornando este composto cerca de sessenta vezes mais básico que piridina.
Preparação
[editar | editar código-fonte]
Imidazol pode ser sintetizado por inúmeros métodos. Na literatura, estes métodos são comumente classificados de acordo com a forma e o número de ligações que são feitas para formar o anel imidazólico. Por exemplo, o método de Debus forma as ligações (1,2), (3,4), e (1,5) utilizando cada reagente como um fragmento do anel, logo este seria um método de formação de 3 ligações, conforme pode ser visto abaixo:

Aplicações biológicas
[editar | editar código-fonte]Imidazol está presente em várias moléculas de importância biológica, como o aminoácido histidina, que possui o anel imidazólico em sua cadeia lateral. Histidina pode ser descarboxilada e transformada em histamina, conforme abaixo:

Outra aplicação do imidazol é a purificação de proteínas recombinantes marcadas com um cauda de histina, através de cromatografia de afinidade com iões metálicos imobilizados. O imidazol é utilizado na etapa de eluição, no qual um excesso deste composto é aplicado na coluna, competindo pela ligação com o metal através de coordenação química, libertando assim as proteínas.
Imidazole tem se tornado bastante importante para industria farmacêutica. Imidazoles sintéticos estão presentes em muitos fungicidas, antiprotozoários e anti-hipertensivos. Imidazol também faz parte do composto teofilina, um estimulante do sistema nervoso central, encontrado em folhas de chá e em feijões. Também esta presente em fármacos anticancer, como mercaptopurina, que interfere no genoma.
Aplicações industriais
[editar | editar código-fonte]Imidazol tem sido utilizado intensivamente como inibidor de processos corrosivos em metais de transição, como o cobre. Derivados de imidazol possuem importância industrial e tecnológica, como o polibenzimidazol (PBI). O PBI contem o anel imidazólico fusionado com o anel benzênico e possui e aplicado contra incêndios.
Sais de imidazol
[editar | editar código-fonte]Sais de imidazol são formados através da protonação ou substituição no nitrogênio do imidazol. Estes sais são utilizados como precursores de carbenos estáveis. Sais onde o o imidazol esta desprotonado também são possíveis.
Derivados do imidazol
[editar | editar código-fonte]Todos terminam em "azol"[11]:
- metronidazol
- clotrimazol
- miconazol
- cetoconazol
- ornidazol
- fenticonazol
- azanidazol
- propenidazol
- butoconazol
- omoconazol
- oxiconazol
- flutrimazol
- sertaconazol
Indicações
[editar | editar código-fonte]Os derivados do imidazol são usados para tratar as seguintes micoses e protozoonoses[12]:
- Balanite
- Candidíase
- Coccidioidomicose
- Dermatofitose
- Histoplasmose
- Infecções do trato gastrointestinal produzido por fungos
- Micose sistêmica
- Onicomicose
- Paracoccidioidomicose
- Pitiríase
- Tineas diversas
- Tricomoníase
- Vaginose ou vulvovaginite micótica
Ver também
[editar | editar código-fonte]- Anel aromático simples - inclui vários compostos formados por um anel pentagonal
Referências
- ↑ a b c d e Hermann Römpp, Jürgen Falbe und Manfred Regitz: Römpp Lexikon Chemie. 9. Auflage, Georg Thieme Verlag, Stuttgart, 1992.
- ↑ (en) « Imidazol » em ChemIDplus
- ↑ a b Przeglad Epidemiologiczny. Vol. 67, Pg. 295, 1993.
- ↑ Deutsche Patentoffenlegungsschrift. Vol. #3046325
- ↑ Alan R. Katritzky; Rees. Comprehensive Heterocyclic Chemistry. Vol. 5, p.469-498, (1984).
- ↑ Grimmett, M. Ross. Imidazole and Benzimidazole Synthesis. Academic Press, (1997).
- ↑ Brown, E.G. Ring Nitrogen and Key Biomolecules. Kluwer Academic Press, (1998).
- ↑ Pozharskii, A.F, et.al. Heterocycles in Life and Society. John Wiley & Sons, (1997).
- ↑ Heterocyclic Chemistry TL Gilchrist, The Bath press 1985 ISBN 0-582-01421-2
- ↑ Heinrich Debus (1858). «Ueber die Einwirkung des Ammoniaks auf Glyoxal». Annalen der Chemie und Pharmacie. 107 (2): 199 – 208. doi:10.1002/jlac.18581070209
- ↑ http://www.whocc.no/atc_ddd_index/?showdescription=yes&code=G01AF
- ↑ http://www.farmacopedia.com.es/atc/derivados_del_imidazol.html

