Atrofia muscular: diferenças entre revisões
m Robô: A corrigir o redirecionamento duplo para Atrofia muscular espinhal Etiqueta: Destino de redirecionamento alterado |
m Criada por tradução da página "Muscle atrophy" Etiquetas: Redirecionamento removido Revertida Inserção do elemento "nowiki", possivelmente errônea Tradução de Conteúdo Tradução de Conteúdo 2 |
||
| Linha 1: | Linha 1: | ||
{{Em construção|comentários=traduzindo}}{{Info/Patologia |
|||
#REDIRECIONAMENTO [[Atrofia muscular espinhal]] |
|||
| Imagem = "athlete with muscular atrophy - Oct 2020.jpg".jpg |
|||
| Legenda = Young athlete showing muscular atrophy due to [[malnutrition]] |
|||
}} |
|||
'''Atrofia muscular''' é a perda de massa [[Músculo esquelético|muscular esquelética.]] Pode ser causada por desuso, envelhecimento, inanição, medicamentos ou por uma ampla variedade de lesões ou doenças que afetam o [[sistema nervoso]] e musculoesquelético. A atrofia muscular leva à fraqueza muscular e causa incapacidade física. |
|||
A atrofia do músculo por desuso ocorre rapidamente e geralmente ocorre como consequência de lesões ou doenças que necessitem de imobilização de um [[membro]] ou de repouso no leito. Dependendo da saúde da pessoa e da duração em que o músculo fique em desuso, esse tipo de atrofia pode ser revertido parcialmente ou totalmente com a prática de [[atividades físicas]]. Em casos de [[inanição]] ou má nutrição, primeiro ocorre perda de gordura corporal, mas esta pode progredir para atrofia muscular quando sua duração é prolongada; e o tratamento de reversão envolve terapia nutricional. Em contraste, a [[caquexia]] é uma síndrome debilitante causada por uma condição subjacente, como em pessoas com cancro, e causa atrofia muscular severa que não pode ser revertida completamente por meio de terapia nutricional. A [[sarcopenia]] é um tipo de atrofia muscular relacionada ao [[envelhecimento]] e seu início e evolução podem ser desacelerados com a prática adequada de exercícios físicos. Além disso, doenças musculoesqueléticas, como [[distrofia muscular]] ou [[Miopatia|miopatias]], podem causar atrofia além de danos ao sistema nervoso, como [[Lesão da medula espinhal|lesões da medula espinhal]] ou [[acidente vascular cerebral]]. |
|||
A atrofia muscular é resultado de desequilíbrio entre a [[Síntese proteica|síntese]] e a degradação proteica, embora seus mecanismos não sejam completamente compreendidos e suas variáveis dependam da causa subjacente e do tipo de atrofia. É possível quantificar a perda de massa muscular com exames de [[diagnóstico por imagem]], mas estes não costumam ser buscados com frequência. O tratamento depende da causa subjacente, mas geralmente inclui exercícios físicas e dieta nutricional adequada. Os [[esteroides anabolizantes]] podem ser eficazes, mas não são usados com frequência devido aos efeitos colaterais que desencadeiam. Apesar de existirem vários tratamentos e suplementos sendo pesquisados em estudos, atualmente as opções de tratamento na prática clínica são limitadas. Por causa das implicações da atrofia muscular e de suas opções limitadas de tratamento, minimizar a imobilidade é fundamental em casos induzidos por lesão ou doença. |
|||
== Sinais e sintomas == |
|||
O sinal característico da atrofia muscular é a perda de massa muscular magra. Essa alteração pode ser difícil de detectar devido à [[obesidade]], alterações na massa gorda ou [[edemas]]. Alterações no peso, membros ou na circunferência da cintura não são indicadores confiáveis de mudanças na massa muscular quando analisados isoladamente.<ref>{{Citar periódico |titulo=Measuring cachexia-diagnostic criteria |data=January 2019 |paginas=24–32 |doi=10.21037/apm.2018.08.07 |pmid=30525765 |vauthors=Dev R |volume=8 |doi-access=free |journal=Annals of Palliative Medicine}}</ref> |
|||
O sintoma predominante é o aumento da fraqueza, que pode resultar em dificuldade ou incapacidade de realizar tarefas físicas, dependendo dos músculos afetados. A atrofia dos músculos centrais ou das pernas pode causar dificuldade na realização dos movimentos de sentar e levantar, andar, subir e descer escadas e pode elevar o risco de lesão por quedas acidentais. A atrofia dos músculos da garganta pode causar dificuldade para engolir, enquanto a atrofia do diafragma pode causar dificuldade para respirar. Pessoas com atrofia muscular podem ser assintomáticas e, por isso, é possível que a condição não seja detectada até uma quantidade significativa de massa muscular ter sido perdida.<ref>{{Citar periódico |titulo=Nutritional Considerations in Preventing Muscle Atrophy |data=2018 |publicado=Springer Singapore |paginas=497–528 |doi=10.1007/978-981-13-1435-3_23 |isbn=9789811314346 |pmid=30390267 |vauthors=Cretoiu SM, Zugravu CA |volume=1088 |journal=Advances in Experimental Medicine and Biology}}</ref> |
|||
== Causas == |
|||
O [[sistema musculoesquelético]] é um local de armazenamento de [[aminoácidos]] que são usados para a produção de energia quando as demandas são altas ou os suprimentos baixos. Se as demandas metabólicas permanecerem maiores do que a síntese de proteínas, o desequilíbrio proteico provoca perda de massa muscular.<ref name=":2">{{Citar periódico |titulo=Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease |data=September 2016 |paginas=789–96 |doi=10.1016/j.jamda.2016.04.019 |pmid=27324808 |vauthors=Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L |volume=17 |doi-access=free |journal=Journal of the American Medical Directors Association}}</ref> Várias doenças e condições subjacentes podem levar a esse desequilíbrio, seja por meio da própria doença ou de alterações associadas a doenças, como no [[apetite]] e em outras atividades associadas a funções do metabolismo. As causas da atrofia muscular incluem desuso, envelhecimento, desnutrição, algumas doenças sistêmicas como [[câncer]], [[Insuficiência cardíaca|insuficiência cardíaca congestiva]], [[Doença pulmonar obstrutiva crónica|doença pulmonar obstrutiva crônica]], [[síndrome da imunodeficiência adquirida]] (SIDA), [[Hepatopatia|doenças hepáticas]], entre outras, denervação, doenças que atingem a musculatura intrínseca ou, ainda, atrofias induzidas por medicamentos, como [[Glicocorticoide|glicocorticoides]].<ref name="pmid8049126">{{Citar periódico |titulo=Turnover of skeletal muscle contractile proteins in glucocorticoid myopathy |data=July 1994 |paginas=1–4 |doi=10.1016/0960-0760(94)90165-1 |pmid=8049126 |vauthors=Seene T |volume=50 |journal=The Journal of Steroid Biochemistry and Molecular Biology}}</ref> |
|||
=== Desuso === |
|||
O desuso ou imobilidade é uma causa comum de atrofia muscular e pode ser local (devido a lesão ou engessamento de [[Fratura óssea|fraturas ósseas]]) ou geral (em casos de repouso em leito). A taxa de perda da massa muscular em atrofia por desuso (10-42 dias) é de aproximadamente 0,5–0,6% da massa muscular total por dia, embora haja uma variação considerável entre as pessoas.<ref name="Wall_2013">{{Citar periódico |titulo=Skeletal muscle atrophy during short-term disuse: implications for age-related sarcopenia |data=September 2013 |paginas=898–906 |doi=10.1016/j.arr.2013.07.003 |pmid=23948422 |vauthors=Wall BT, Dirks ML, van Loon LJ |volume=12 |journal=Ageing Research Reviews}}</ref> Os [[idosos]] são o grupo populacional mais vulnerável a perdas musculares drásticas devido a desuso. Muitas pesquisas clínicas estudaram o desuso prolongado (superior a 10 dias), no qual o músculo é comprometido principalmente por declínios nas taxas de síntese de proteína muscular, em vez de mudanças na degradação proteica. Evidências limitadas sugerem que a degradação de proteínas pode desempenhar um papel mais signifcativo durante a imobilidade de curto prazo (inferior a 10 dias). |
|||
=== Caquexia === |
|||
Algumas doenças podem causar a síndrome de perda muscular complexa, mais conhecida como [[caquexia]]. É comumente observada em pessoas com câncer, [[Insuficiência cardíaca|insuficiência cardíaca congestiva]] (ICC), [[Doença pulmonar obstrutiva crónica|doença pulmonar obstrutiva crônica]], [[doença renal crônica]] e [[Síndrome da imunodeficiência adquirida|AIDS,]] embora esteja associada a processos de várias doenças, geralmente ligados a um componente inflamatório significativo. A caquexia causa perda muscular contínua que não pode ser totalmente revertida com terapia nutricional.<ref>{{Citar periódico |titulo=Cachexia: a new definition |data=December 2008 |paginas=793–9 |doi=10.1016/j.clnu.2008.06.013 |pmid=18718696 |numero-autores=6 |vauthors=Evans WJ, Morley JE, Argilés J, Bales C, Baracos V, Guttridge D, Jatoi A, Kalantar-Zadeh K, Lochs H, Mantovani G, Marks D, Mitch WE, Muscaritoli M, Najand A, Ponikowski P, Rossi Fanelli F, Schambelan M, Schols A, Schuster M, Thomas D, Wolfe R, Anker SD |volume=27 |journal=Clinical Nutrition}}</ref> A fisiopatologia não é completamente compreendida, mas as [[Citocina|citocinas]] inflamatórias são consideradas como fundamentais no processo de atrofiamento. Em contraste com a perda de peso por ingestão calórica proveniente de dieta nutricional inadequada, a [[caquexia]] causa predominantemente perda de músculo em vez de perda de gordura e não responde adequadamente à intervenção nutricional. A caquexia pode comprometer significativamente a qualidade de vida e o estado funcional dos membros e está associada a resultados não favoráveis.<ref>{{Citar periódico |titulo=Cachexia: pathophysiology and clinical relevance |data=April 2006 |paginas=735–43 |doi=10.1093/ajcn/83.4.735 |pmid=16600922 |vauthors=Morley JE, Thomas DR, Wilson MM |volume=83 |doi-access=free |journal=The American Journal of Clinical Nutrition}}</ref><ref name=":0">{{Citar periódico |titulo=Differentiating Sarcopenia and Cachexia Among Patients With Cancer |data=February 2017 |paginas=30–39 |doi=10.1177/0884533616680354 |pmid=28124947 |vauthors=Peterson SJ, Mozer M |volume=32 |journal=Nutrition in Clinical Practice}}</ref> |
|||
=== Sarcopenia === |
|||
A [[sarcopenia]] é a perda degenerativa de massa, qualidade e força do sistema musculoesquelético e está associada ao envelhecimento. Ela acarreta atrofia muscular, redução no número de fibras musculares e uma mudança para contração lenta (CL) ou [[Músculo esquelético|fibras do tipo I]] em vez de fibras do tipo II ou contração rápida (CR).<ref name=":2">{{Citar periódico |titulo=Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease |data=September 2016 |paginas=789–96 |doi=10.1016/j.jamda.2016.04.019 |pmid=27324808 |vauthors=Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L |volume=17 |doi-access=free |journal=Journal of the American Medical Directors Association}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFArgilésCamposLopez-PedrosaRueda2016">Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L (September 2016). [[doi:10.1016/j.jamda.2016.04.019|"Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease"]]. ''Journal of the American Medical Directors Association''. '''17''' (9): 789–96. [[Digital object identifier|doi]]:<span class="cs1-lock-free" title="Freely accessible">[[doi:10.1016/j.jamda.2016.04.019|10.1016/j.jamda.2016.04.019]]</span>. [[PubMed|PMID]] [//pubmed.ncbi.nlm.nih.gov/27324808 27324808].</cite></ref> A taxa de perda muscular depende de fatores,como nível de atividade física, comorbidades, nutrição, entre outros. Existem muitos mecanismos de perda muscular propostos para a sarcopenia, e esta é considerada resultado de mudanças nas vias de sinalização da síntese muscular e de falhas graduais nas [[Célula satélite|células satélites]] que desempenham papel essencial na regeneração das fibras musculares esqueléticas, mas seu mecanismo não compreendido por completo. - https://www.scielo.br/j/rbr/a/j45dnGRLSgbR7M8dbdsnbvq/?lang=pt<nowiki/>- |
|||
A sarcopenia pode levar à redução do estado funcional e causar deficiência significativa, mas é uma condição distinta da [[Caquexia|caquexia,]] embora estas possam coexistir.<ref name=":0">{{Citar periódico |titulo=Differentiating Sarcopenia and Cachexia Among Patients With Cancer |data=February 2017 |paginas=30–39 |doi=10.1177/0884533616680354 |pmid=28124947 |vauthors=Peterson SJ, Mozer M |volume=32 |journal=Nutrition in Clinical Practice}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFPetersonMozer2017">Peterson SJ, Mozer M (February 2017). "Differentiating Sarcopenia and Cachexia Among Patients With Cancer". ''Nutrition in Clinical Practice''. '''32''' (1): 30–39. [[Digital object identifier|doi]]:[[doi:10.1177/0884533616680354|10.1177/0884533616680354]]. [[PubMed|PMID]] [//pubmed.ncbi.nlm.nih.gov/28124947 28124947]. [[Semantic Scholar|S2CID]] [https://api.semanticscholar.org/CorpusID:206555460 206555460].</cite></ref><ref>{{Citar periódico |titulo=Sarcopenia: causes, consequences, and preventions |data=October 2003 |paginas=M911-6 |doi=10.1093/gerona/58.10.m911 |pmid=14570858 |vauthors=Marcell TJ |volume=58 |doi-access=free |journal=The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences}}</ref> Em 2016 foi lançado um [[Classificação Estatística Internacional de Doenças e Problemas Relacionados com a Saúde|código CID]] para a sarcopenia, contribuindo para sua aceitação como condição patológica independente.<ref>{{Citar periódico |titulo=Welcome to the ICD-10 code for sarcopenia |data=December 2016 |paginas=512–514 |doi=10.1002/jcsm.12147 |pmc=5114626 |pmid=27891296 |vauthors=Anker SD, Morley JE, von Haehling S |volume=7 |journal=Journal of Cachexia, Sarcopenia and Muscle}}</ref> |
|||
=== Doenças musculares intrínsecas === |
|||
Doenças musculares intrínsecas como, [[distrofia muscular]], [[esclerose lateral amiotrófica]] (ELA); ou [[Miosite|miosites]], como a [[miosite por corpúsculos de inclusão]], podem causar atrofia muscular.<ref>{{Citar periódico |titulo=Disease-Induced Skeletal Muscle Atrophy and Fatigue |data=November 2016 |paginas=2307–2319 |doi=10.1249/MSS.0000000000000975 |pmc=5069191 |pmid=27128663 |vauthors=Powers SK, Lynch GS, Murphy KT, Reid MB, Zijdewind I |volume=48 |journal=Medicine and Science in Sports and Exercise}}</ref> |
|||
=== Danos no sistema nervoso central === |
|||
Danos aos neurônios ou na medula espinhal podem causar atrofia muscular. Esta pode ser uma atrofia muscular localizada, fraqueza ou paralisia como decorrentes de [[acidente vascular cerebral]] ou de [[lesão da medula espinhal]].<ref>{{Citar periódico |titulo=Skeletal muscle mitochondrial health and spinal cord injury |data=October 2016 |paginas=628–637 |doi=10.5312/wjo.v7.i10.628 |pmc=5065669 |pmid=27795944 |vauthors=O'Brien LC, Gorgey AS |volume=7 |journal=World Journal of Orthopedics}}</ref> Danos mais generalizados, como [[traumatismo cranioencefálico]] ou [[Paralisia cerebral|paralisia cerebral,]] podem causar atrofia muscular também generalizada.<ref>{{Citar periódico |titulo=Determinants of muscle preservation in individuals with cerebral palsy across the lifespan: a narrative review of the literature |data=June 2018 |paginas=453–464 |doi=10.1002/jcsm.12287 |pmc=5989853 |pmid=29392922 |vauthors=Verschuren O, Smorenburg AR, Luiking Y, Bell K, Barber L, Peterson MD |volume=9 |journal=Journal of Cachexia, Sarcopenia and Muscle}}</ref> |
|||
=== Dano do sistema nervoso periférico === |
|||
Lesões ou doenças de nervos periféricos que irrigam músculos específicos também podem causar atrofia muscular. Isso é visto na lesão do nervo devido a trauma ou complicação cirúrgica, compressão do nervo ou doenças hereditárias, como a [[doença de Charcot-Marie-Tooth]] . <ref>{{Citar periódico |titulo=The Role of Muscle Stem Cells in Regeneration and Recovery after Denervation: A Review |data=March 2019 |paginas=779–788 |doi=10.1097/PRS.0000000000005370 |pmid=30817650 |vauthors=Wong A, Pomerantz JH |volume=143 |journal=Plastic and Reconstructive Surgery}}</ref> |
|||
=== Indução por medicamentos === |
|||
Alguns medicamentos são conhecidos por causar atrofia muscular, geralmente devido ao efeito direto nos músculos. Isso inclui glicocorticóides que causam miopatia por glicocorticóides <ref name="pmid8049126">{{Citar periódico |titulo=Turnover of skeletal muscle contractile proteins in glucocorticoid myopathy |data=July 1994 |paginas=1–4 |doi=10.1016/0960-0760(94)90165-1 |pmid=8049126 |vauthors=Seene T |volume=50 |journal=The Journal of Steroid Biochemistry and Molecular Biology}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFSeene1994">Seene T (July 1994). "Turnover of skeletal muscle contractile proteins in glucocorticoid myopathy". ''The Journal of Steroid Biochemistry and Molecular Biology''. '''50''' (1–2): 1–4. [[Digital object identifier|doi]]:[[doi:10.1016/0960-0760(94)90165-1|10.1016/0960-0760(94)90165-1]]. [[PubMed|PMID]] [//pubmed.ncbi.nlm.nih.gov/8049126 8049126]. [[Semantic Scholar|S2CID]] [https://api.semanticscholar.org/CorpusID:27814895 27814895].</cite></ref> ou medicamentos tóxicos para os músculos, como a [[doxorrubicina]] . <ref>{{Citar periódico |titulo=Doxorubicin-induced skeletal muscle atrophy: elucidating the underlying molecular pathways |data=October 2019 |paginas=e13400 |doi=10.1111/apha.13400 |pmc=7317437 |pmid=31600860 |numero-autores=6 |vauthors=Hiensch AE, Bolam KA, Mijwel S, Jeneson JA, Huitema AD, Kranenburg O, van der Wall E, Rundqvist H, Wengstrom Y, May AM |volume=229 |doi-access=free |journal=Acta Physiologica}}</ref> |
|||
=== Endocrinopatias === |
|||
Distúrbios do sistema endócrino, como doença de Cushing ou [[Hipotiroidismo|hipotireoidismo,]] são conhecidos por causar atrofia muscular. <ref>{{Citar periódico |titulo=Hormones and Muscle Atrophy |data=2018 |publicado=Springer Singapore |paginas=207–233 |doi=10.1007/978-981-13-1435-3_9 |isbn=9789811314346 |pmid=30390253 |vauthors=Martín AI, Priego T, López-Calderón A |volume=1088 |journal=Advances in Experimental Medicine and Biology}}</ref> |
|||
== Fisiopatologia == |
|||
[[Ficheiro:1025_Atrophy.png|direita|miniaturadaimagem| A massa muscular é reduzida à medida que os músculos atrofiam com o desuso.]] |
|||
A atrofia muscular ocorre devido a um desequilíbrio entre as taxas normais de síntese e degradação de proteínas. Isso envolve o processo de sinalização celular, que não é compreendido completamente, de modo que a atrofia muscular provavelmente resulta de várias condições subjacentes. |
|||
A função mitocondrial é crucial para a saúde do músculo esquelético, por isso disfunções no nível mitocondrial podem contribuir para a atrofia muscular.<ref name=":3">{{Citar periódico |titulo=Mitochondrial Dysfunction in Skeletal Muscle Pathologies |data=2019-05-20 |paginas=536–546 |doi=10.2174/1389203720666190402100902 |pmid=30947668 |vauthors=Abrigo J, Simon F, Cabrera D, Vilos C, Cabello-Verrugio C |volume=20 |journal=Current Protein & Peptide Science}}</ref> Um declínio na densidade do nível de mitocrôdia, bem como em sua qualidade, é comumente encontrado em casos de atrofia muscular decorrentes de desuso. |
|||
A [[Ubiquitina|via da ubiquitina]] / [[proteassoma]] dependente de [[Trifosfato de adenosina|ATP]] é um mecanismo pelo qual as proteínas são degradadas no músculo. Isso envolve proteínas específicas sendo marcadas para destruição por um pequeno peptídeo chamado [[Ubiquitina|ubiquitina,]] que permite o reconhecimento pelo [[proteassoma]] para degradar a proteína. <ref name="pmid18556469">{{Citar periódico |titulo=Signaling in muscle atrophy and hypertrophy |data=June 2008 |local=Bethesda, Md. |paginas=160–70 |doi=10.1152/physiol.00041.2007 |pmid=18556469 |vauthors=Sandri M |volume=23 |journal=Physiology}}</ref> |
|||
== Diagnóstico == |
|||
O rastreamento de atrofia muscular é limitado pela falta de critérios diagnósticos estabelecidos, embora muitos tenham sido propostos. Os critérios de diagnóstico para outras condições, como [[sarcopenia]] ou [[Caquexia|caquexia,]] podem ser usados. <ref name=":2">{{Citar periódico |titulo=Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease |data=September 2016 |paginas=789–96 |doi=10.1016/j.jamda.2016.04.019 |pmid=27324808 |vauthors=Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L |volume=17 |doi-access=free |journal=Journal of the American Medical Directors Association}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFArgilésCamposLopez-PedrosaRueda2016">Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L (September 2016). [[doi:10.1016/j.jamda.2016.04.019|"Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease"]]. ''Journal of the American Medical Directors Association''. '''17''' (9): 789–96. [[Digital object identifier|doi]]:<span class="cs1-lock-free" title="Freely accessible">[[doi:10.1016/j.jamda.2016.04.019|10.1016/j.jamda.2016.04.019]]</span>. [[PubMed|PMID]] [//pubmed.ncbi.nlm.nih.gov/27324808 27324808].</cite></ref> Essas síndromes também podem ser identificadas com questionários de triagem. |
|||
A massa muscular e as alterações podem ser quantificadas em estudos de imagem, como [[Tomografia computadorizada|tomografias computadorizadas]] ou [[Imagem por ressonância magnética|ressonância magnética (MRI)]] . Biomarcadores como a [[Ureia|uréia na]] urina podem ser usados para estimar aproximadamente a perda muscular durante circunstâncias de rápida perda muscular. <ref>{{Citar livro|título=Manual of Dietetic Practice|ultimo=Bishop|primeiro=Jacki|ultimo2=Briony|primeiro2=Thomas|editora=Wiley-Blackwell|ano=2007|páginas=76|capitulo=Section 1.9.2|isbn=978-1-4051-3525-2}}</ref> Outros biomarcadores estão atualmente sob investigação, mas não são usados na prática clínica. <ref name=":2">{{Citar periódico |titulo=Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease |data=September 2016 |paginas=789–96 |doi=10.1016/j.jamda.2016.04.019 |pmid=27324808 |vauthors=Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L |volume=17 |doi-access=free |journal=Journal of the American Medical Directors Association}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFArgilésCamposLopez-PedrosaRueda2016">Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L (September 2016). [[doi:10.1016/j.jamda.2016.04.019|"Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease"]]. ''Journal of the American Medical Directors Association''. '''17''' (9): 789–96. [[Digital object identifier|doi]]:<span class="cs1-lock-free" title="Freely accessible">[[doi:10.1016/j.jamda.2016.04.019|10.1016/j.jamda.2016.04.019]]</span>. [[PubMed|PMID]] [//pubmed.ncbi.nlm.nih.gov/27324808 27324808].</cite></ref> |
|||
== Tratamento == |
|||
A atrofia muscular pode ser retardada, prevenida e às vezes revertida com tratamento. As abordagens de tratamento incluem o impacto nas vias de sinalização que induzem a [[hipertrofia muscular]] ou retarda a degradação muscular, bem como a otimização do estado nutricional. |
|||
A atividade física fornece um estímulo muscular anabólico significativo e é um componente crucial para desacelerar ou reverter a atrofia muscular. <ref name=":2">{{Citar periódico |titulo=Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease |data=September 2016 |paginas=789–96 |doi=10.1016/j.jamda.2016.04.019 |pmid=27324808 |vauthors=Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L |volume=17 |doi-access=free |journal=Journal of the American Medical Directors Association}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFArgilésCamposLopez-PedrosaRueda2016">Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L (September 2016). [[doi:10.1016/j.jamda.2016.04.019|"Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease"]]. ''Journal of the American Medical Directors Association''. '''17''' (9): 789–96. [[Digital object identifier|doi]]:<span class="cs1-lock-free" title="Freely accessible">[[doi:10.1016/j.jamda.2016.04.019|10.1016/j.jamda.2016.04.019]]</span>. [[PubMed|PMID]] [//pubmed.ncbi.nlm.nih.gov/27324808 27324808].</cite></ref> Ainda não se sabe a respeito da "dosagem" ideal de exercícios. O exercício de resistência demonstrou ser benéfico na redução da atrofia muscular em adultos mais velhos. <ref>{{Citar periódico |titulo=Sarcopenia the new geriatric giant: time to translate research findings into clinical practice |data=November 2014 |paginas=736–7 |doi=10.1093/ageing/afu118 |pmid=25227204 |vauthors=Sayer AA |volume=43 |doi-access=free |journal=Age and Ageing}}</ref> <ref>{{Citar periódico |titulo=Progressive resistance strength training for improving physical function in older adults |data=July 2009 |paginas=CD002759 |doi=10.1002/14651858.CD002759.pub2 |pmc=4324332 |pmid=19588334 |vauthors=Liu CJ, Latham NK |journal=The Cochrane Database of Systematic Reviews}}</ref> Em pacientes que não podem se exercitar devido a limitações físicas, como paraplegia, [[FES|a estimulação elétrica funcional]] pode ser usada para estimular externamente os músculos. <ref>{{Citar conferência |titulo=Functional electrical stimulation in rehabilitation engineering: A survey. |data=23 April 2007 |publicado=Association for Computer Machinery |paginas=221–226 |conferencia=Proceedings of the 1st international convention on Rehabilitation engineering & assistive technology: in conjunction with 1st Tan Tock Seng Hospital Neurorehabilitation Meeting |doi=10.1145/1328491.1328546 |isbn=978-1-59593-852-7}}</ref> |
|||
Calorias e proteínas adequadas são cruciais para prevenir a atrofia muscular. As necessidades de proteína podem variar drasticamente, dependendo dos fatores metabólicos e do estado da doença, portanto, a suplementação com alta proteína pode ser benéfica. A suplementação de proteínas ou [[Aminoácido ramificado|aminoácidos de cadeia ramificada]], especialmente leucina, pode fornecer um estímulo para a síntese muscular e inibir a degradação de proteínas e tem sido estudada para atrofia muscular para sarcopenia e caquexia. <ref name=":2">{{Citar periódico |titulo=Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease |data=September 2016 |paginas=789–96 |doi=10.1016/j.jamda.2016.04.019 |pmid=27324808 |vauthors=Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L |volume=17 |doi-access=free |journal=Journal of the American Medical Directors Association}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFArgilésCamposLopez-PedrosaRueda2016">Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L (September 2016). [[doi:10.1016/j.jamda.2016.04.019|"Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease"]]. ''Journal of the American Medical Directors Association''. '''17''' (9): 789–96. [[Digital object identifier|doi]]:<span class="cs1-lock-free" title="Freely accessible">[[doi:10.1016/j.jamda.2016.04.019|10.1016/j.jamda.2016.04.019]]</span>. [[PubMed|PMID]] [//pubmed.ncbi.nlm.nih.gov/27324808 27324808].</cite></ref> <ref>{{Citar periódico |titulo=Nutritional supplements in support of resistance exercise to counter age-related sarcopenia |data=July 2015 |paginas=452–60 |doi=10.3945/an.115.008367 |pmc=4496741 |pmid=26178029 |vauthors=Phillips SM |volume=6 |journal=Advances in Nutrition}}</ref> [[Ácido beta-hidroxi-beta-metilbutírico|O β-hidroxi β-metilbutirato]] (HMB), um metabólito da [[leucina]] que é vendido como [[Suplemento alimentar|suplemento dietético]], demonstrou eficácia na prevenção da perda de massa muscular em várias condições de perda muscular em humanos, particularmente [[sarcopenia]] . <ref name="Sarcopenia July 2015 review"> {{Citar periódico |titulo=Nutritional supplements in support of resistance exercise to counter age-related sarcopenia |data=July 2015 |paginas=452–60 |doi=10.3945/an.115.008367 |pmc=4496741 |pmid=26178029 |vauthors=Phillips SM |volume=6 |journal=Advances in Nutrition}}</ref> <ref>{{Citar periódico |url=https://hal.archives-ouvertes.fr/hal-01837630/file/2016_Brioche_MAM_1.pdf |titulo=Muscle wasting and aging: Experimental models, fatty infiltrations, and prevention |data=August 2016 |paginas=56–87 |doi=10.1016/j.mam.2016.04.006 |pmid=27106402 |vauthors=Brioche T, Pagano AF, Py G, Chopard A |volume=50 |journal=Molecular Aspects of Medicine}}</ref> <ref>{{Citar periódico |titulo=Beta-hydroxy-beta-methylbutyrate supplementation and skeletal muscle in healthy and muscle-wasting conditions |data=August 2017 |paginas=529–541 |doi=10.1002/jcsm.12208 |pmc=5566641 |pmid=28493406 |vauthors=Holeček M |volume=8 |journal=Journal of Cachexia, Sarcopenia and Muscle}}</ref> Com base em uma [[Metanálise|meta-análise]] de sete [[Estudo clínico randomizado controlado|ensaios clínicos randomizados]] publicados em 2015, a suplementação de HMB tem eficácia como tratamento para preservar a massa muscular magra em idosos. <ref name=":1">{{Citar periódico |titulo=Effect of beta-hydroxy-beta-methylbutyrate supplementation on muscle loss in older adults: a systematic review and meta-analysis |data=2015 |paginas=168–75 |doi=10.1016/j.archger.2015.06.020 |pmid=26169182 |numero-autores=6 |vauthors=Wu H, Xia Y, Jiang J, Du H, Guo X, Liu X, Li C, Huang G, Niu K |volume=61 |journal=Archives of Gerontology and Geriatrics}}</ref> Mais pesquisas são necessárias para determinar os efeitos precisos do HMB na força e função muscular em várias populações. |
|||
Em casos graves de atrofia muscular, o uso de um [[Esteroide anabolizante|esteróide anabolizante]] como a [[Metandienona|metandrostenolona]] pode ser administrado aos pacientes como um tratamento potencial, embora o uso seja limitado por efeitos colaterais. Uma nova classe de drogas, chamadas moduladores seletivos do receptor de andrógeno, está sendo investigada com resultados promissores. Eles teriam menos [[Efeito colateral|efeitos colaterais]], enquanto ainda promoviam o crescimento e a regeneração do tecido muscular e ósseo. Esses efeitos ainda precisam ser confirmados em estudos clínicos maiores. <ref>{{Citar periódico |titulo=Enobosarm (GTx-024, S-22): a potential treatment for cachexia |data=February 2014 |paginas=187–94 |doi=10.2217/fon.13.273 |pmid=24490605 |vauthors=Srinath R, Dobs A |volume=10 |journal=Future Oncology}}</ref> |
|||
== Resultados == |
|||
Os resultados da atrofia muscular dependem da causa subjacente e da saúde do paciente. Imobilidade ou repouso na cama em populações predispostas à atrofia muscular, como idosos ou aqueles com estados de doença que comumente causam [[caquexia]], podem causar atrofia muscular dramática e impacto nos resultados funcionais. Em idosos, isso geralmente leva à diminuição da reserva biológica e ao aumento da vulnerabilidade a estressores conhecidos como " síndrome da fragilidade ". <ref name=":2">{{Citar periódico |titulo=Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease |data=September 2016 |paginas=789–96 |doi=10.1016/j.jamda.2016.04.019 |pmid=27324808 |vauthors=Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L |volume=17 |doi-access=free |journal=Journal of the American Medical Directors Association}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFArgilésCamposLopez-PedrosaRueda2016">Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L (September 2016). [[doi:10.1016/j.jamda.2016.04.019|"Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease"]]. ''Journal of the American Medical Directors Association''. '''17''' (9): 789–96. [[Digital object identifier|doi]]:<span class="cs1-lock-free" title="Freely accessible">[[doi:10.1016/j.jamda.2016.04.019|10.1016/j.jamda.2016.04.019]]</span>. [[PubMed|PMID]] [//pubmed.ncbi.nlm.nih.gov/27324808 27324808].</cite></ref> A perda de massa corporal magra também está associada ao aumento do risco de infecção, diminuição da imunidade e má cicatrização de feridas. A fraqueza que acompanha a atrofia muscular leva a um maior risco de quedas, fraturas, deficiência física, necessidade de cuidados institucionais, redução da qualidade de vida, aumento da mortalidade e aumento dos custos de saúde. |
|||
== Outros animais == |
|||
A inatividade e a fome em mamíferos levam à atrofia do músculo esquelético, acompanhada por um menor número e tamanho das células musculares, bem como menor teor de proteína. <ref name="pmid17904252">{{Citar periódico |titulo=Antiproteolytic effects of plasma from hibernating bears: a new approach for muscle wasting therapy? |data=October 2007 |paginas=658–61 |doi=10.1016/j.clnu.2007.07.003 |pmid=17904252 |vauthors=Fuster G, Busquets S, Almendro V, López-Soriano FJ, Argilés JM |volume=26 |journal=Clinical Nutrition}}</ref> Em humanos, períodos prolongados de imobilização, como nos casos de repouso na cama ou astronautas voando no espaço, são conhecidos por resultar em enfraquecimento e atrofia muscular. Essas consequências também são observadas em pequenos mamíferos em hibernação, como os esquilos terrestres com capa dourada e os morcegos marrons. <ref name="pmid17307375">{{Citar periódico |titulo=Hibernating black bears (Ursus americanus) experience skeletal muscle protein balance during winter anorexia |data=May 2007 |paginas=20–8 |doi=10.1016/j.cbpb.2006.12.020 |pmid=17307375 |vauthors=Lohuis TD, Harlow HJ, Beck TD |volume=147 |journal=Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology}}</ref> |
|||
[[Ursidae|Os ursos]] são uma exceção a esta regra; espécies da família Ursidae são famosas por sua capacidade de sobreviver a condições ambientais desfavoráveis de baixas temperaturas e disponibilidade limitada de nutrição durante o inverno por meio da [[hibernação]] . Durante esse tempo, os ursos passam por uma série de mudanças fisiológicas, morfológicas e comportamentais. <ref name="pmid14506303">{{Citar periódico |titulo=Mammalian hibernation: cellular and molecular responses to depressed metabolism and low temperature |data=October 2003 |paginas=1153–81 |doi=10.1152/physrev.00008.2003 |pmid=14506303 |vauthors=Carey HV, Andrews MT, Martin SL |volume=83 |journal=Physiological Reviews}}</ref> Sua capacidade de manter o número e o tamanho do músculo esquelético durante o desuso é de importância significativa. |
|||
Durante a hibernação, os ursos passam 4-7 meses de inatividade e anorexia sem sofrer atrofia muscular e perda de proteína. <ref name="pmid17307375">{{Citar periódico |titulo=Hibernating black bears (Ursus americanus) experience skeletal muscle protein balance during winter anorexia |data=May 2007 |paginas=20–8 |doi=10.1016/j.cbpb.2006.12.020 |pmid=17307375 |vauthors=Lohuis TD, Harlow HJ, Beck TD |volume=147 |journal=Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFLohuisHarlowBeck2007">Lohuis TD, Harlow HJ, Beck TD (May 2007). "Hibernating black bears (Ursus americanus) experience skeletal muscle protein balance during winter anorexia". ''Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology''. '''147''' (1): 20–8. [[Digital object identifier|doi]]:[[doi:10.1016/j.cbpb.2006.12.020|10.1016/j.cbpb.2006.12.020]]. [[PubMed|PMID]] [//pubmed.ncbi.nlm.nih.gov/17307375 17307375].</cite></ref> Alguns fatores conhecidos contribuem para a sustentação do tecido muscular. Durante o verão, os ursos aproveitam a disponibilidade nutricional e acumulam proteína muscular. O equilíbrio de proteínas no período de dormência também é mantido por níveis mais baixos de degradação de proteínas durante o inverno. Em tempos de imobilidade, a perda de massa muscular em ursos também é suprimida por um inibidor proteolítico que é liberado na circulação. <ref name="pmid17904252">{{Citar periódico |titulo=Antiproteolytic effects of plasma from hibernating bears: a new approach for muscle wasting therapy? |data=October 2007 |paginas=658–61 |doi=10.1016/j.clnu.2007.07.003 |pmid=17904252 |vauthors=Fuster G, Busquets S, Almendro V, López-Soriano FJ, Argilés JM |volume=26 |journal=Clinical Nutrition}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFFusterBusquetsAlmendroLópez-Soriano2007">Fuster G, Busquets S, Almendro V, López-Soriano FJ, Argilés JM (October 2007). "Antiproteolytic effects of plasma from hibernating bears: a new approach for muscle wasting therapy?". ''Clinical Nutrition''. '''26''' (5): 658–61. [[Digital object identifier|doi]]:[[doi:10.1016/j.clnu.2007.07.003|10.1016/j.clnu.2007.07.003]]. [[PubMed|PMID]] [//pubmed.ncbi.nlm.nih.gov/17904252 17904252].</cite></ref> Outro fator que contribui para a manutenção da força muscular em ursos hibernando é a ocorrência de contrações voluntárias periódicas e contrações involuntárias de tremores durante o [[torpor]] . <ref name="Harlow">{{Citar periódico |titulo=Body Surface Temperature Of Hibernating Black Bears May Be Related To Periodic Muscle Activity |ano=2004 |paginas=414–419 |doi=10.1644/1545-1542(2004)085<0414:BSTOHB>2.0.CO;2 |vauthors=Harlow HJ, Lohuis T, Anderson-Sprecher RC, Beck TD |volume=85 |journal=Journal of Mammalogy}}</ref> Os três a quatro episódios diários de atividade muscular são responsáveis pela manutenção da força muscular e capacidade de resposta em ursos durante a hibernação. |
|||
== Ver também == |
|||
== Ligações externas == |
|||
* {{Commonscatinline}} |
|||
* {{MeshName|Muscular atrophy}} |
|||
{{Medical resources|DiseasesDB=29472|ICD10={{ICD10|M|62|5|m|60}}|ICD9={{ICD9|728.2}}|ICDO=|OMIM=|MedlinePlus=003188|eMedicineSubj=|eMedicineTopic=|MeshID=D009133}} |
|||
[[Categoria:Doenças musculares]] |
|||
[[Categoria:Envelhecimento]] |
|||
[[Categoria:Reabilitação]] |
|||
[[Categoria:Diabetes]] |
|||
[[Categoria:Sinais médicos]] |
|||
[[Categoria:Fisiologia]] |
|||
[[Categoria:!Páginas com traduções não revistas]] |
|||
Revisão das 17h18min de 27 de maio de 2021
Este artigo ou seção está em processo de expansão ou reestruturação durante um curto período. |
| Atrofia muscular | |
|---|---|
| Young athlete showing muscular atrophy due to malnutrition | |
| Especialidade | reumatologia, neurologia |
| Classificação e recursos externos | |
| DiseasesDB | 29472 |
| MedlinePlus | 003188 |
Atrofia muscular é a perda de massa muscular esquelética. Pode ser causada por desuso, envelhecimento, inanição, medicamentos ou por uma ampla variedade de lesões ou doenças que afetam o sistema nervoso e musculoesquelético. A atrofia muscular leva à fraqueza muscular e causa incapacidade física.
A atrofia do músculo por desuso ocorre rapidamente e geralmente ocorre como consequência de lesões ou doenças que necessitem de imobilização de um membro ou de repouso no leito. Dependendo da saúde da pessoa e da duração em que o músculo fique em desuso, esse tipo de atrofia pode ser revertido parcialmente ou totalmente com a prática de atividades físicas. Em casos de inanição ou má nutrição, primeiro ocorre perda de gordura corporal, mas esta pode progredir para atrofia muscular quando sua duração é prolongada; e o tratamento de reversão envolve terapia nutricional. Em contraste, a caquexia é uma síndrome debilitante causada por uma condição subjacente, como em pessoas com cancro, e causa atrofia muscular severa que não pode ser revertida completamente por meio de terapia nutricional. A sarcopenia é um tipo de atrofia muscular relacionada ao envelhecimento e seu início e evolução podem ser desacelerados com a prática adequada de exercícios físicos. Além disso, doenças musculoesqueléticas, como distrofia muscular ou miopatias, podem causar atrofia além de danos ao sistema nervoso, como lesões da medula espinhal ou acidente vascular cerebral.
A atrofia muscular é resultado de desequilíbrio entre a síntese e a degradação proteica, embora seus mecanismos não sejam completamente compreendidos e suas variáveis dependam da causa subjacente e do tipo de atrofia. É possível quantificar a perda de massa muscular com exames de diagnóstico por imagem, mas estes não costumam ser buscados com frequência. O tratamento depende da causa subjacente, mas geralmente inclui exercícios físicas e dieta nutricional adequada. Os esteroides anabolizantes podem ser eficazes, mas não são usados com frequência devido aos efeitos colaterais que desencadeiam. Apesar de existirem vários tratamentos e suplementos sendo pesquisados em estudos, atualmente as opções de tratamento na prática clínica são limitadas. Por causa das implicações da atrofia muscular e de suas opções limitadas de tratamento, minimizar a imobilidade é fundamental em casos induzidos por lesão ou doença.
Sinais e sintomas
O sinal característico da atrofia muscular é a perda de massa muscular magra. Essa alteração pode ser difícil de detectar devido à obesidade, alterações na massa gorda ou edemas. Alterações no peso, membros ou na circunferência da cintura não são indicadores confiáveis de mudanças na massa muscular quando analisados isoladamente.[1]
O sintoma predominante é o aumento da fraqueza, que pode resultar em dificuldade ou incapacidade de realizar tarefas físicas, dependendo dos músculos afetados. A atrofia dos músculos centrais ou das pernas pode causar dificuldade na realização dos movimentos de sentar e levantar, andar, subir e descer escadas e pode elevar o risco de lesão por quedas acidentais. A atrofia dos músculos da garganta pode causar dificuldade para engolir, enquanto a atrofia do diafragma pode causar dificuldade para respirar. Pessoas com atrofia muscular podem ser assintomáticas e, por isso, é possível que a condição não seja detectada até uma quantidade significativa de massa muscular ter sido perdida.[2]
Causas
O sistema musculoesquelético é um local de armazenamento de aminoácidos que são usados para a produção de energia quando as demandas são altas ou os suprimentos baixos. Se as demandas metabólicas permanecerem maiores do que a síntese de proteínas, o desequilíbrio proteico provoca perda de massa muscular.[3] Várias doenças e condições subjacentes podem levar a esse desequilíbrio, seja por meio da própria doença ou de alterações associadas a doenças, como no apetite e em outras atividades associadas a funções do metabolismo. As causas da atrofia muscular incluem desuso, envelhecimento, desnutrição, algumas doenças sistêmicas como câncer, insuficiência cardíaca congestiva, doença pulmonar obstrutiva crônica, síndrome da imunodeficiência adquirida (SIDA), doenças hepáticas, entre outras, denervação, doenças que atingem a musculatura intrínseca ou, ainda, atrofias induzidas por medicamentos, como glicocorticoides.[4]
Desuso
O desuso ou imobilidade é uma causa comum de atrofia muscular e pode ser local (devido a lesão ou engessamento de fraturas ósseas) ou geral (em casos de repouso em leito). A taxa de perda da massa muscular em atrofia por desuso (10-42 dias) é de aproximadamente 0,5–0,6% da massa muscular total por dia, embora haja uma variação considerável entre as pessoas.[5] Os idosos são o grupo populacional mais vulnerável a perdas musculares drásticas devido a desuso. Muitas pesquisas clínicas estudaram o desuso prolongado (superior a 10 dias), no qual o músculo é comprometido principalmente por declínios nas taxas de síntese de proteína muscular, em vez de mudanças na degradação proteica. Evidências limitadas sugerem que a degradação de proteínas pode desempenhar um papel mais signifcativo durante a imobilidade de curto prazo (inferior a 10 dias).
Caquexia
Algumas doenças podem causar a síndrome de perda muscular complexa, mais conhecida como caquexia. É comumente observada em pessoas com câncer, insuficiência cardíaca congestiva (ICC), doença pulmonar obstrutiva crônica, doença renal crônica e AIDS, embora esteja associada a processos de várias doenças, geralmente ligados a um componente inflamatório significativo. A caquexia causa perda muscular contínua que não pode ser totalmente revertida com terapia nutricional.[6] A fisiopatologia não é completamente compreendida, mas as citocinas inflamatórias são consideradas como fundamentais no processo de atrofiamento. Em contraste com a perda de peso por ingestão calórica proveniente de dieta nutricional inadequada, a caquexia causa predominantemente perda de músculo em vez de perda de gordura e não responde adequadamente à intervenção nutricional. A caquexia pode comprometer significativamente a qualidade de vida e o estado funcional dos membros e está associada a resultados não favoráveis.[7][8]
Sarcopenia
A sarcopenia é a perda degenerativa de massa, qualidade e força do sistema musculoesquelético e está associada ao envelhecimento. Ela acarreta atrofia muscular, redução no número de fibras musculares e uma mudança para contração lenta (CL) ou fibras do tipo I em vez de fibras do tipo II ou contração rápida (CR).[3] A taxa de perda muscular depende de fatores,como nível de atividade física, comorbidades, nutrição, entre outros. Existem muitos mecanismos de perda muscular propostos para a sarcopenia, e esta é considerada resultado de mudanças nas vias de sinalização da síntese muscular e de falhas graduais nas células satélites que desempenham papel essencial na regeneração das fibras musculares esqueléticas, mas seu mecanismo não compreendido por completo. - https://www.scielo.br/j/rbr/a/j45dnGRLSgbR7M8dbdsnbvq/?lang=pt-
A sarcopenia pode levar à redução do estado funcional e causar deficiência significativa, mas é uma condição distinta da caquexia, embora estas possam coexistir.[8][9] Em 2016 foi lançado um código CID para a sarcopenia, contribuindo para sua aceitação como condição patológica independente.[10]
Doenças musculares intrínsecas
Doenças musculares intrínsecas como, distrofia muscular, esclerose lateral amiotrófica (ELA); ou miosites, como a miosite por corpúsculos de inclusão, podem causar atrofia muscular.[11]
Danos no sistema nervoso central
Danos aos neurônios ou na medula espinhal podem causar atrofia muscular. Esta pode ser uma atrofia muscular localizada, fraqueza ou paralisia como decorrentes de acidente vascular cerebral ou de lesão da medula espinhal.[12] Danos mais generalizados, como traumatismo cranioencefálico ou paralisia cerebral, podem causar atrofia muscular também generalizada.[13]
Dano do sistema nervoso periférico
Lesões ou doenças de nervos periféricos que irrigam músculos específicos também podem causar atrofia muscular. Isso é visto na lesão do nervo devido a trauma ou complicação cirúrgica, compressão do nervo ou doenças hereditárias, como a doença de Charcot-Marie-Tooth . [14]
Indução por medicamentos
Alguns medicamentos são conhecidos por causar atrofia muscular, geralmente devido ao efeito direto nos músculos. Isso inclui glicocorticóides que causam miopatia por glicocorticóides [4] ou medicamentos tóxicos para os músculos, como a doxorrubicina . [15]
Endocrinopatias
Distúrbios do sistema endócrino, como doença de Cushing ou hipotireoidismo, são conhecidos por causar atrofia muscular. [16]
Fisiopatologia
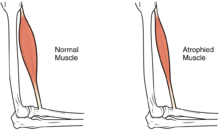
A atrofia muscular ocorre devido a um desequilíbrio entre as taxas normais de síntese e degradação de proteínas. Isso envolve o processo de sinalização celular, que não é compreendido completamente, de modo que a atrofia muscular provavelmente resulta de várias condições subjacentes.
A função mitocondrial é crucial para a saúde do músculo esquelético, por isso disfunções no nível mitocondrial podem contribuir para a atrofia muscular.[17] Um declínio na densidade do nível de mitocrôdia, bem como em sua qualidade, é comumente encontrado em casos de atrofia muscular decorrentes de desuso.
A via da ubiquitina / proteassoma dependente de ATP é um mecanismo pelo qual as proteínas são degradadas no músculo. Isso envolve proteínas específicas sendo marcadas para destruição por um pequeno peptídeo chamado ubiquitina, que permite o reconhecimento pelo proteassoma para degradar a proteína. [18]
Diagnóstico
O rastreamento de atrofia muscular é limitado pela falta de critérios diagnósticos estabelecidos, embora muitos tenham sido propostos. Os critérios de diagnóstico para outras condições, como sarcopenia ou caquexia, podem ser usados. [3] Essas síndromes também podem ser identificadas com questionários de triagem.
A massa muscular e as alterações podem ser quantificadas em estudos de imagem, como tomografias computadorizadas ou ressonância magnética (MRI) . Biomarcadores como a uréia na urina podem ser usados para estimar aproximadamente a perda muscular durante circunstâncias de rápida perda muscular. [19] Outros biomarcadores estão atualmente sob investigação, mas não são usados na prática clínica. [3]
Tratamento
A atrofia muscular pode ser retardada, prevenida e às vezes revertida com tratamento. As abordagens de tratamento incluem o impacto nas vias de sinalização que induzem a hipertrofia muscular ou retarda a degradação muscular, bem como a otimização do estado nutricional.
A atividade física fornece um estímulo muscular anabólico significativo e é um componente crucial para desacelerar ou reverter a atrofia muscular. [3] Ainda não se sabe a respeito da "dosagem" ideal de exercícios. O exercício de resistência demonstrou ser benéfico na redução da atrofia muscular em adultos mais velhos. [20] [21] Em pacientes que não podem se exercitar devido a limitações físicas, como paraplegia, a estimulação elétrica funcional pode ser usada para estimular externamente os músculos. [22]
Calorias e proteínas adequadas são cruciais para prevenir a atrofia muscular. As necessidades de proteína podem variar drasticamente, dependendo dos fatores metabólicos e do estado da doença, portanto, a suplementação com alta proteína pode ser benéfica. A suplementação de proteínas ou aminoácidos de cadeia ramificada, especialmente leucina, pode fornecer um estímulo para a síntese muscular e inibir a degradação de proteínas e tem sido estudada para atrofia muscular para sarcopenia e caquexia. [3] [23] O β-hidroxi β-metilbutirato (HMB), um metabólito da leucina que é vendido como suplemento dietético, demonstrou eficácia na prevenção da perda de massa muscular em várias condições de perda muscular em humanos, particularmente sarcopenia . [24] [25] [26] Com base em uma meta-análise de sete ensaios clínicos randomizados publicados em 2015, a suplementação de HMB tem eficácia como tratamento para preservar a massa muscular magra em idosos. [27] Mais pesquisas são necessárias para determinar os efeitos precisos do HMB na força e função muscular em várias populações.
Em casos graves de atrofia muscular, o uso de um esteróide anabolizante como a metandrostenolona pode ser administrado aos pacientes como um tratamento potencial, embora o uso seja limitado por efeitos colaterais. Uma nova classe de drogas, chamadas moduladores seletivos do receptor de andrógeno, está sendo investigada com resultados promissores. Eles teriam menos efeitos colaterais, enquanto ainda promoviam o crescimento e a regeneração do tecido muscular e ósseo. Esses efeitos ainda precisam ser confirmados em estudos clínicos maiores. [28]
Resultados
Os resultados da atrofia muscular dependem da causa subjacente e da saúde do paciente. Imobilidade ou repouso na cama em populações predispostas à atrofia muscular, como idosos ou aqueles com estados de doença que comumente causam caquexia, podem causar atrofia muscular dramática e impacto nos resultados funcionais. Em idosos, isso geralmente leva à diminuição da reserva biológica e ao aumento da vulnerabilidade a estressores conhecidos como " síndrome da fragilidade ". [3] A perda de massa corporal magra também está associada ao aumento do risco de infecção, diminuição da imunidade e má cicatrização de feridas. A fraqueza que acompanha a atrofia muscular leva a um maior risco de quedas, fraturas, deficiência física, necessidade de cuidados institucionais, redução da qualidade de vida, aumento da mortalidade e aumento dos custos de saúde.
Outros animais
A inatividade e a fome em mamíferos levam à atrofia do músculo esquelético, acompanhada por um menor número e tamanho das células musculares, bem como menor teor de proteína. [29] Em humanos, períodos prolongados de imobilização, como nos casos de repouso na cama ou astronautas voando no espaço, são conhecidos por resultar em enfraquecimento e atrofia muscular. Essas consequências também são observadas em pequenos mamíferos em hibernação, como os esquilos terrestres com capa dourada e os morcegos marrons. [30]
Os ursos são uma exceção a esta regra; espécies da família Ursidae são famosas por sua capacidade de sobreviver a condições ambientais desfavoráveis de baixas temperaturas e disponibilidade limitada de nutrição durante o inverno por meio da hibernação . Durante esse tempo, os ursos passam por uma série de mudanças fisiológicas, morfológicas e comportamentais. [31] Sua capacidade de manter o número e o tamanho do músculo esquelético durante o desuso é de importância significativa.
Durante a hibernação, os ursos passam 4-7 meses de inatividade e anorexia sem sofrer atrofia muscular e perda de proteína. [30] Alguns fatores conhecidos contribuem para a sustentação do tecido muscular. Durante o verão, os ursos aproveitam a disponibilidade nutricional e acumulam proteína muscular. O equilíbrio de proteínas no período de dormência também é mantido por níveis mais baixos de degradação de proteínas durante o inverno. Em tempos de imobilidade, a perda de massa muscular em ursos também é suprimida por um inibidor proteolítico que é liberado na circulação. [29] Outro fator que contribui para a manutenção da força muscular em ursos hibernando é a ocorrência de contrações voluntárias periódicas e contrações involuntárias de tremores durante o torpor . [32] Os três a quatro episódios diários de atividade muscular são responsáveis pela manutenção da força muscular e capacidade de resposta em ursos durante a hibernação.
Ver também
Ligações externas
 Media relacionados com Atrofia muscular no Wikimedia Commons
Media relacionados com Atrofia muscular no Wikimedia Commons- MeSH atrophy Muscular atrophy
Predefinição:Medical resources
- ↑ Dev R (January 2019). «Measuring cachexia-diagnostic criteria». Annals of Palliative Medicine. 8: 24–32. PMID 30525765. doi:10.21037/apm.2018.08.07
 Verifique data em:
Verifique data em: |data=(ajuda) - ↑ Cretoiu SM, Zugravu CA (2018). «Nutritional Considerations in Preventing Muscle Atrophy». Springer Singapore. Advances in Experimental Medicine and Biology. 1088: 497–528. ISBN 9789811314346. PMID 30390267. doi:10.1007/978-981-13-1435-3_23
- ↑ a b c d e f g Argilés JM, Campos N, Lopez-Pedrosa JM, Rueda R, Rodriguez-Mañas L (September 2016). «Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease». Journal of the American Medical Directors Association. 17: 789–96. PMID 27324808. doi:10.1016/j.jamda.2016.04.019
 Verifique data em:
Verifique data em: |data=(ajuda) Erro de citação: Código<ref>inválido; o nome ":2" é definido mais de uma vez com conteúdos diferentes - ↑ a b Seene T (July 1994). «Turnover of skeletal muscle contractile proteins in glucocorticoid myopathy». The Journal of Steroid Biochemistry and Molecular Biology. 50: 1–4. PMID 8049126. doi:10.1016/0960-0760(94)90165-1 Verifique data em:
|data=(ajuda) Erro de citação: Código<ref>inválido; o nome "pmid8049126" é definido mais de uma vez com conteúdos diferentes - ↑ Wall BT, Dirks ML, van Loon LJ (September 2013). «Skeletal muscle atrophy during short-term disuse: implications for age-related sarcopenia». Ageing Research Reviews. 12: 898–906. PMID 23948422. doi:10.1016/j.arr.2013.07.003 Verifique data em:
|data=(ajuda) - ↑ Evans WJ, Morley JE, Argilés J, Bales C, Baracos V, Guttridge D, et al. (December 2008). «Cachexia: a new definition». Clinical Nutrition. 27: 793–9. PMID 18718696. doi:10.1016/j.clnu.2008.06.013 Verifique data em:
|data=(ajuda) - ↑ Morley JE, Thomas DR, Wilson MM (April 2006). «Cachexia: pathophysiology and clinical relevance». The American Journal of Clinical Nutrition. 83: 735–43. PMID 16600922. doi:10.1093/ajcn/83.4.735
 Verifique data em:
Verifique data em: |data=(ajuda) - ↑ a b Peterson SJ, Mozer M (February 2017). «Differentiating Sarcopenia and Cachexia Among Patients With Cancer». Nutrition in Clinical Practice. 32: 30–39. PMID 28124947. doi:10.1177/0884533616680354 Verifique data em:
|data=(ajuda) Erro de citação: Código<ref>inválido; o nome ":0" é definido mais de uma vez com conteúdos diferentes - ↑ Marcell TJ (October 2003). «Sarcopenia: causes, consequences, and preventions». The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 58: M911-6. PMID 14570858. doi:10.1093/gerona/58.10.m911
 Verifique data em:
Verifique data em: |data=(ajuda) - ↑ Anker SD, Morley JE, von Haehling S (December 2016). «Welcome to the ICD-10 code for sarcopenia». Journal of Cachexia, Sarcopenia and Muscle. 7: 512–514. PMC 5114626
 . PMID 27891296. doi:10.1002/jcsm.12147 Verifique data em:
. PMID 27891296. doi:10.1002/jcsm.12147 Verifique data em: |data=(ajuda) - ↑ Powers SK, Lynch GS, Murphy KT, Reid MB, Zijdewind I (November 2016). «Disease-Induced Skeletal Muscle Atrophy and Fatigue». Medicine and Science in Sports and Exercise. 48: 2307–2319. PMC 5069191
 . PMID 27128663. doi:10.1249/MSS.0000000000000975 Verifique data em:
. PMID 27128663. doi:10.1249/MSS.0000000000000975 Verifique data em: |data=(ajuda) - ↑ O'Brien LC, Gorgey AS (October 2016). «Skeletal muscle mitochondrial health and spinal cord injury». World Journal of Orthopedics. 7: 628–637. PMC 5065669
 . PMID 27795944. doi:10.5312/wjo.v7.i10.628 Verifique data em:
. PMID 27795944. doi:10.5312/wjo.v7.i10.628 Verifique data em: |data=(ajuda) - ↑ Verschuren O, Smorenburg AR, Luiking Y, Bell K, Barber L, Peterson MD (June 2018). «Determinants of muscle preservation in individuals with cerebral palsy across the lifespan: a narrative review of the literature». Journal of Cachexia, Sarcopenia and Muscle. 9: 453–464. PMC 5989853
 . PMID 29392922. doi:10.1002/jcsm.12287 Verifique data em:
. PMID 29392922. doi:10.1002/jcsm.12287 Verifique data em: |data=(ajuda) - ↑ Wong A, Pomerantz JH (March 2019). «The Role of Muscle Stem Cells in Regeneration and Recovery after Denervation: A Review». Plastic and Reconstructive Surgery. 143: 779–788. PMID 30817650. doi:10.1097/PRS.0000000000005370 Verifique data em:
|data=(ajuda) - ↑ Hiensch AE, Bolam KA, Mijwel S, Jeneson JA, Huitema AD, Kranenburg O, et al. (October 2019). «Doxorubicin-induced skeletal muscle atrophy: elucidating the underlying molecular pathways». Acta Physiologica. 229: e13400. PMC 7317437
 . PMID 31600860. doi:10.1111/apha.13400
. PMID 31600860. doi:10.1111/apha.13400 Verifique data em:
Verifique data em: |data=(ajuda) - ↑ Martín AI, Priego T, López-Calderón A (2018). «Hormones and Muscle Atrophy». Springer Singapore. Advances in Experimental Medicine and Biology. 1088: 207–233. ISBN 9789811314346. PMID 30390253. doi:10.1007/978-981-13-1435-3_9
- ↑ Abrigo J, Simon F, Cabrera D, Vilos C, Cabello-Verrugio C (20 de maio de 2019). «Mitochondrial Dysfunction in Skeletal Muscle Pathologies». Current Protein & Peptide Science. 20: 536–546. PMID 30947668. doi:10.2174/1389203720666190402100902
- ↑ Sandri M (June 2008). «Signaling in muscle atrophy and hypertrophy». Bethesda, Md. Physiology. 23: 160–70. PMID 18556469. doi:10.1152/physiol.00041.2007 Verifique data em:
|data=(ajuda) - ↑ Bishop, Jacki; Briony, Thomas (2007). «Section 1.9.2». Manual of Dietetic Practice. [S.l.]: Wiley-Blackwell. 76 páginas. ISBN 978-1-4051-3525-2
- ↑ Sayer AA (November 2014). «Sarcopenia the new geriatric giant: time to translate research findings into clinical practice». Age and Ageing. 43: 736–7. PMID 25227204. doi:10.1093/ageing/afu118
 Verifique data em:
Verifique data em: |data=(ajuda) - ↑ Liu CJ, Latham NK (July 2009). «Progressive resistance strength training for improving physical function in older adults». The Cochrane Database of Systematic Reviews: CD002759. PMC 4324332
 . PMID 19588334. doi:10.1002/14651858.CD002759.pub2 Verifique data em:
. PMID 19588334. doi:10.1002/14651858.CD002759.pub2 Verifique data em: |data=(ajuda) - ↑ Functional electrical stimulation in rehabilitation engineering: A survey. Proceedings of the 1st international convention on Rehabilitation engineering & assistive technology: in conjunction with 1st Tan Tock Seng Hospital Neurorehabilitation Meeting. Association for Computer Machinery. 23 April 2007. pp. 221–226. ISBN 978-1-59593-852-7. doi:10.1145/1328491.1328546 Verifique data em:
|data=(ajuda) - ↑ Phillips SM (July 2015). «Nutritional supplements in support of resistance exercise to counter age-related sarcopenia». Advances in Nutrition. 6: 452–60. PMC 4496741
 . PMID 26178029. doi:10.3945/an.115.008367 Verifique data em:
. PMID 26178029. doi:10.3945/an.115.008367 Verifique data em: |data=(ajuda) - ↑ Phillips SM (July 2015). «Nutritional supplements in support of resistance exercise to counter age-related sarcopenia». Advances in Nutrition. 6: 452–60. PMC 4496741
 . PMID 26178029. doi:10.3945/an.115.008367 Verifique data em:
. PMID 26178029. doi:10.3945/an.115.008367 Verifique data em: |data=(ajuda) - ↑ Brioche T, Pagano AF, Py G, Chopard A (August 2016). «Muscle wasting and aging: Experimental models, fatty infiltrations, and prevention» (PDF). Molecular Aspects of Medicine. 50: 56–87. PMID 27106402. doi:10.1016/j.mam.2016.04.006 Verifique data em:
|data=(ajuda) - ↑ Holeček M (August 2017). «Beta-hydroxy-beta-methylbutyrate supplementation and skeletal muscle in healthy and muscle-wasting conditions». Journal of Cachexia, Sarcopenia and Muscle. 8: 529–541. PMC 5566641
 . PMID 28493406. doi:10.1002/jcsm.12208 Verifique data em:
. PMID 28493406. doi:10.1002/jcsm.12208 Verifique data em: |data=(ajuda) - ↑ Wu H, Xia Y, Jiang J, Du H, Guo X, Liu X, et al. (2015). «Effect of beta-hydroxy-beta-methylbutyrate supplementation on muscle loss in older adults: a systematic review and meta-analysis». Archives of Gerontology and Geriatrics. 61: 168–75. PMID 26169182. doi:10.1016/j.archger.2015.06.020
- ↑ Srinath R, Dobs A (February 2014). «Enobosarm (GTx-024, S-22): a potential treatment for cachexia». Future Oncology. 10: 187–94. PMID 24490605. doi:10.2217/fon.13.273 Verifique data em:
|data=(ajuda) - ↑ a b Fuster G, Busquets S, Almendro V, López-Soriano FJ, Argilés JM (October 2007). «Antiproteolytic effects of plasma from hibernating bears: a new approach for muscle wasting therapy?». Clinical Nutrition. 26: 658–61. PMID 17904252. doi:10.1016/j.clnu.2007.07.003 Verifique data em:
|data=(ajuda) Erro de citação: Código<ref>inválido; o nome "pmid17904252" é definido mais de uma vez com conteúdos diferentes - ↑ a b Lohuis TD, Harlow HJ, Beck TD (May 2007). «Hibernating black bears (Ursus americanus) experience skeletal muscle protein balance during winter anorexia». Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 147: 20–8. PMID 17307375. doi:10.1016/j.cbpb.2006.12.020 Verifique data em:
|data=(ajuda) Erro de citação: Código<ref>inválido; o nome "pmid17307375" é definido mais de uma vez com conteúdos diferentes - ↑ Carey HV, Andrews MT, Martin SL (October 2003). «Mammalian hibernation: cellular and molecular responses to depressed metabolism and low temperature». Physiological Reviews. 83: 1153–81. PMID 14506303. doi:10.1152/physrev.00008.2003 Verifique data em:
|data=(ajuda) - ↑ Harlow HJ, Lohuis T, Anderson-Sprecher RC, Beck TD (2004). «Body Surface Temperature Of Hibernating Black Bears May Be Related To Periodic Muscle Activity». Journal of Mammalogy. 85: 414–419. doi:10.1644/1545-1542(2004)085<0414:BSTOHB>2.0.CO;2

