Oxidorredução (química orgânica): diferenças entre revisões
m Yanguas moveu Óxido-redução (química orgânica) para Oxidorredução (química orgânica) sem deixar um redirecionamento: Na química orgânica ou na inorgânica, a ortografia é a mesma |
|||
| Linha 23: | Linha 23: | ||
Resumindo temos que a oxidação branda de um álcoois primários gerará um aldeído e a oxidação energica do mesmo gerará um ácido carboxílico. |
Resumindo temos que a oxidação branda de um álcoois primários gerará um aldeído e a oxidação energica do mesmo gerará um ácido carboxílico. |
||
* Esquema Geral |
|||
[[Ficheiro:Oxidacao alcool primario esquema geral.gif]] |
|||
=== Oxidação de álcoois secundários === |
=== Oxidação de álcoois secundários === |
||
Revisão das 19h27min de 18 de junho de 2014
Em quimica orgânica, o termo oxidação significa quando ocorre a diminuição da densidade eletrônica do carbono, normalmente com a adição de um átomo mais eletronegativo a uma uma ligação do carbono com outro átomo menos eletronegatico, como exemplo a introdução de nitrogênio em uma ligação carbono-hidrogênio. Como o hidrogênio é menos eletronegativo que o carbono, este cria uma carga parcial negativa, atraindo para si os eletrons da ligação. Com a introdução do nitrogênio, os papeis se invertem e o carbono "perde" parcialmente os eletrons para o átomo mais eletronegativo, criando uma carga parcial positiva.
Oxidação de álcoois
A oxidação de álcoois fornece ácidos orgânicos quando se trata de álcoois primários, cetonas quando são oxidados álcoois secundários e álcoois terciários não se oxidam. Pode-se também oxidar um álcool primário a aldeído usando-se cloro-cromato de piridina (PCC). Em laboratórios os agentes oxidantes mais utilizados são o KMnO4 e o K2Cr2O7.
Oxidação de álcoois primários
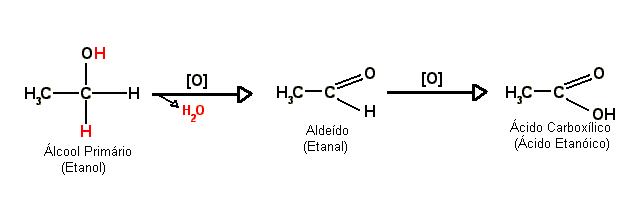
Em contato com agentes oxidantes, os álcoois primários reagem (oxidam) formando primeiro um aldeído e então, com o aldeído sendo oxidado, um ácido carboxílico. Quando o produto da oxidação de um álcool primário é um aldeído ela é chamada normalmente de oxidação branda; por sua vez, quando o produto é um ácido carboxílico é chamada normalmente de oxidação enérgica, porém esses nomes podem variar. A oxidação de um álcool a aldeído ou cetona é também chamada de desidrogenação (ou seja, perda de hidrogênio).
Observe o exemplo abaixo:
- O símbolo [O] significa oxidação.
- A flecha apotando para baixo com o H2O na ponta indica a água que foi produto da reação, ou seja, a reação também gerou água que foi retirada.
No esquema os hidrogênios em vermelho reagiram com o oxigênio do agente oxidante formando a água que foi retirada. Portanto, diz-se que a oxidação é um processo de "retirada de hidrogênio".
Chamamos o processo inverso da oxidação de redução e é representado por [H]. Sendo assim, a redução de um ácido carboxílico gerará um aldeído e a redução deste gerará um álcoois primários. (Veja o esquema geral logo abaixo.)
Resumindo temos que a oxidação branda de um álcoois primários gerará um aldeído e a oxidação energica do mesmo gerará um ácido carboxílico.
Oxidação de álcoois secundários
Os álcoois secundários, diferente dos primários, são oxidados de apenas uma forma gerando sempre como produto uma cetona.
Veja este exemplo:
Oxidação de álcoois terciários
Não ocorre a oxidação de [[Álcool#Álcoois Terciários|álcoois Oxidação de álcoois primários Em contato com agentes oxidantes os álcoois primários reagem (oxidam) formando primeiro um aldeído e então, com o aldeído sendo oxidado, um ácido carboxílico. Quando o produto da oxidação de um álcool primário é um aldeído ela é chamada normalmente de oxidação branda; por sua vez, quando o produto é um ácido carboxílico é chamada normalmente de oxidação enérgica, porém esses nomes podem variar. A oxidação de um álcool a aldeído ou cetona é tambem chamada de desidrogenação (ou seja, perda de hidrogênio).
Chamamos o processo inverso da oxidação de redução e é representado por [H]. Sendo assim, a redução de um ácido carboxílico gerará um aldeído e a redução deste gerará um álcoois primários.
Oxidação de álcoois secundários Os álcoois secundários, diferente dos primários, são oxidados de apenas uma forma gerando sempre como produto uma cetona.
Oxidação de Alcenos Os alcenos também sofrem reações de oxidação que acontecem de três formas: oxidação branda, oxidação energética e ozonólise.
Oxidação Branda A oxidação branda (também conhecida como hidroxilação do alceno), é uma reação feita com agente oxidante que causa uma quebra na dupla ligação do alceno e a entrada de duas hidroxilas (OH) formando assim um diálcool. Um agente oxidante muito usado neste caso é o permanganato de potássio (KMnO4).
Oxidação Enérgética Na oxidação enérgética, o agente oxidante "quebra" a molécula na dupla ligação e caso se forme um aldeído ele é oxidado a ácido carboxílico. Os agentes oxidantes mais comuns nesse caso são o dicromato de potássio (K2Cr2O7) e o permanganato de potássio (KMnO4).
Oxidação de alcenos
Os alcenos também sofrem reações de oxidação que acontecem de três formas: oxidação branda, oxidação energética e ozonólise.
Oxidação branda
A oxidação branda (também conhecida como hidroxilação do alceno), é uma reação feita com agente oxidante que causa uma quebra na dupla ligação do alceno e a entrada de duas hidroxilas (OH) formando assim um diálcool. Um agente oxidante muito usado neste caso é o permanganato de potássio (KMnO4).
Veja o exemplo abaixo:
Oxidação enérgica
Na oxidação enérgica, o agente oxidante "quebra" a molécula na dupla ligação e caso se forme um aldeído ele é oxidado a ácido carboxílico. Os agentes oxidantes mais comuns nesse caso são o dicromato de potássio (K2Cr2O7) e o permanganato de potássio (KMnO4).
Veja o exemplo abaixo:
- Observação:
Sempre que um composto que tem a dupla ligação na ponta da cadeia sofre oxidação enérgica um dos produtos que se formam é o ácido carbônico (H2CO3) que por ser um ácido instável transforma-se em gás carbônico (CO2) e água (H2O).
Ozonólise
A ozonólise é a quebra de um alceno causada pelo ozônio O3 gerando como produtos uma cetona e/ou um aldeído. Esta reação deve ser realizada na presença de água e de pó de zinco. A molécula do alceno é quebrada na dupla ligação e dois átomos de oxigênio (O) se adicionam.
A oxidação sucedida ao ferro é quase igual, dado que a humidade e o oxigenio fazem com que ocorra a corrosão, a reação química do ferro a tais condições, mas também existem metais que não são suscetiveis à oxidação, tal como o zinco.
Veja o exemplo abaixo:
O peróxido de hidrogênio (H2O2) é destruido pelo pó de zinco para que não reaja com o aldeído, formando hidróxido de zinco.