Varidnaviria
| Varidnaviria | |
|---|---|

| |
| Um diagrama de fita do DJR-MCP de "Pseudoalteromonas virus PM2", com as duas dobras de rolo de geléia coloridas em vermelho e azul | |
| Classificação viral | |
| (unranked): | Virus |
| Realm: | Varidnaviria |
| Subtaxa | |
| Sinónimos[1][2] | |
| |
Varidnaviria é um reino de vírus que inclui todos os vírus de DNA que codificam as principais proteínas do capsídeo que contêm uma dobra vertical de gelatina. As proteínas do capsídeo principal (MCP) se formam em subunidades pseudo-hexaméricas do capsídeo viral, que armazena o ácido desoxirribonucleico (DNA) viral e são perpendiculares ou verticais à superfície do capsídeo. Além disso, os vírus no reino também compartilham muitas outras características, como proteínas menores do capsídeo (mCP) com a dobra vertical de gelatina, uma ATPase que empacota DNA viral no capsídeo e uma DNA polimerase que replica o genoma viral.
A Varidnaviria foi criada em 2019 com base nas características compartilhadas dos vírus no reino. Existem dois grupos de vírus em Varidnaviria : vírus que têm uma dobra vertical de gelatina dupla (DJR) no MCP, atribuído ao reino Bamfordvirae, e vírus que têm uma única dobra vertical de geleia de rolo (SJR) no MCP, atribuído a o reino Helvetiavirae. Acredita-se que a linhagem DJR-MCP seja descendente da linhagem SJR-MCP através de um evento de fusão gênica, e o SJR-MCP mostra uma estreita relação com as nucleoplasminas, apontando para uma possível origem do MCP do reino. A maioria dos vírus de DNA eucarióticos identificados pertence à Varidnaviria.
Os vírus marinhos no reino são altamente abundantes em todo o mundo e são importantes na ecologia marinha. Muitos vírus animais no reino estão associados a doenças, incluindo adenovírus, poxvírus e o vírus da peste suína africana. Os poxvírus têm se destacado na história da medicina, principalmente a varíola, causada pelo vírus Variola, que foi alvo da primeira vacina e que mais tarde se tornou a primeira doença erradicada. O reino também inclui vírus gigantes que são fisicamente maiores e contêm um número muito maior de genes do que os vírus típicos.
Etimologia[editar | editar código-fonte]
O nome " Varidnaviria " é uma junção de vários vírus de DNA e o sufixo - viria, que é o sufixo usado para reinos de vírus. Os vírus de DNA de fita dupla (dsDNA) no reino são frequentemente chamados de vírus dsDNA sem cauda ou sem cauda para distingui-los dos vírus dsDNA com cauda de Duplodnaviria.
Características[editar | editar código-fonte]
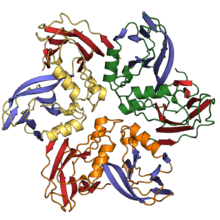
MCP, mCP e ATPase[editar | editar código-fonte]
A maioria dos vírus em Varidnaviria contém um capsídeo que é feito de proteínas principais do capsídeo que contêm dobras verticais simples (SJR) ou duplas (DJR). As principais proteínas do capsídeo são assim chamadas porque são as proteínas primárias das quais o capsídeo é feito. Uma dobra de gelatina é um tipo de estrutura dobrada em uma proteína na qual oito fitas beta antiparalelas são organizadas em quatro folhas beta antiparalelas em um layout semelhante a um rocambole, também chamado de rocambole. Cada fita beta é uma seqüência específica de aminoácidos, e essas fitas se unem às suas fitas antiparalelas por meio de ligações de hidrogênio. A diferença entre as dobras SJR e DJR é que uma dobra DJR é simplesmente duas dobras SJR em uma única proteína. As dobras verticais são aquelas que são perpendiculares à superfície do capsídeo, em contraste com as dobras horizontais que são paralelas à superfície do capsídeo.[3][4]
Durante o processo de montagem do capsídeo viral, os MCPs se automontam em estruturas hexagonais, chamadas hexões, contendo várias cópias do MCP. Hexons então se ligam para formar os lados triangulares relativamente planos do capsídeo icosaédrico. Todos os vírus em Varidnaviria que codificam um DJR-MCP que foram analisados em alta resolução também codificam uma proteína do capsídeo menor (mCP) que contém uma dobra SJR. Esses mCPs se reúnem em estruturas pentagonais chamadas pentons que formam os vértices pentagonais do capsídeo icosaédrico.[3][4][5][6]
A maioria dos membros do reino também codifica ATPases de empacotamento do genoma da superfamília FtsK-HerA. As ATPases em Varidnaviria são enzimas que empacotam o DNA viral no capsídeo durante o processo de montagem de vírions. FtsK é uma família de proteínas que contém uma proteína transmembrana com quatro hélices transmembrana no início da sequência de aminoácidos da proteína e uma ATPase com uma dobra P-loop no final da sequência de aminoácidos da proteína, e a família HerA é homólogo a FtsK.[7] A função exata da ATPase para alguns vírus em Varidnaviria não é clara, uma vez que características morfológicas, como o genoma circular e superenrolado do vírus Pseudoalteromonas PM2, aparentemente proíbem a translocação pela ATPase do DNA de fora do capsídeo para o interior.[4] O subconjunto da superfamília FtsK-HerA encontrado em Varidnaviria é frequentemente chamado de clado A32, em homenagem ao gene A32(R) codificador de ATPase do vírus Vaccinia.[7]
Outras características[editar | editar código-fonte]
Além da tríade morfogenética central de genes, MCP, mCP e ATPase, algumas outras características são comuns ou únicas em várias linhagens dentro de Varidnaviria, listadas a seguir.
- Muitos membros do reino codificam uma DNA polimerase tipo B, que copia o DNA viral, e muitas vezes componentes adicionais da DNA polimerase, como superfamília 3 helicases, ou proteínas de iniciação de replicação, no caso da família Corticoviridae. Uma exceção é a ordem Halopanivirales,[note 1] cujos membros não codificam nenhuma enzima de replicação reconhecível.[5]
- Muitos vírus DJR-MCP eucarióticos codificam uma protease de maturação do capsídeo que está envolvida na montagem do capsídeo.[5]
- Alguns membros do reino codificam a integrase, uma enzima que integra o genoma viral no genoma do hospedeiro.[5][8]
- A maioria dos membros do reino tem capsídeos em forma de icosaedro, contendo 20 faces triangulares e 12 vértices.
- Em várias linhagens, incluindo ascovírus e poxvírus, a forma icosaédrica ancestral do capsídeo foi perdida e substituída por outras formas, como ovóides e formas semelhantes a tijolos.[5]
- Os poxvírus codificam uma proteína scaffold, que orienta a construção geométrica do capsídeo viral, que também se dobra em pseudo-hexâmeros DJR.[4]
- Alguns vírus têm vértices especiais em seus capsídeos icosaédricos para transportar o genoma para fora do capsídeo e para fazer fábricas de vírus.[6]
- Para certos vírus, o genoma dentro do capsídeo é cercado por uma membrana lipídica.[6][9]
- Quase todos os vírus DJR-MCP reconhecidos codificam uma ATPase da superfamília FtsK-HerA. Os adenovírus são a exceção, codificando sua própria ATPase distinta que tem o mesmo papel que a ATPase FtsK-HerA.[5]
- A família Finnlakeviridae e um grupo provisório chamado grupo Odin, ambos membros propostos de Varidnaviria, não possuem a assinatura da superfamília FtsK-HerA ATPase.[4][10]
- Todos os membros de Varidnaviria, exceto Finnlakeviridae, uma família de membros proposta, possuem genomas de dsDNA. Os vírus em Finnlakeviridae, em vez disso, têm genomas de DNA de fita simples (ssDNA).
Filogenética[editar | editar código-fonte]
Tem sido sugerido que Varidnaviria antecede o último ancestral comum universal (LUCA) da vida celular e que os vírus no reino estavam presentes no LUCA.[11] Os SJR-MCPs verticais de Halopanivirales, atribuídos ao reino Helvetiavirae, ao contrário das dobras SJR encontradas fora de Varidnaviria, mostram uma relação com um grupo de proteínas que inclui a superfamília Cupin e nucleoplasminas, apontando para uma possível origem da principal proteína do capsídeo de Varidnaviria entre este grupo.[12] A linhagem DJR-MCP, atribuída ao reino Bamfordvirae, posteriormente parece ter surgido por meio de um evento de fusão gênica que fundiu os dois SJR-MCPs em um, indicado pelos dois SJR-MCPs formando uma treliça no capsídeo que estruturalmente se assemelha à estrutura do capsídeo DJR-MCP. Os vírus Archaeal dsDNA em Portogloboviridae contêm apenas um SJR-MCP vertical, que parece ter sido duplicado para dois para Halopanivirales, então o MCP de Portogloboviridae provavelmente representa um estágio anterior na história evolutiva dos MCPs de Varidnaviria.[11] No entanto, outro cenário foi proposto posteriormente em que os reinos Bamfordvirae e Helvetiavirae se originariam independentemente de elementos genéticos móveis como plasmídeos com a captura de duas proteínas celulares diferentes quando foi detectado que a proteína Bamfordvirae DJR-MCP é homóloga ao DUF bacteriano 2961 proteína, levando a uma revisão do reino Varidnaviria. De acordo com esse cenário, a dobra Bamfordvirae DJR-MCP evoluiu da proteína bacteriana DUF 2961, enquanto a Helvetiavirae SJR-MCP evoluiu da SJR-MCP relacionada à família Portogloboviridae, que por sua vez originou-se da superfamília Cupin e das nucleoplasminas.[13]
Vírus em Bamfordvirae parecem ter cruzado de procariontes para eucariotos no início da história eucariótica, através de infecção por um tectivírus ou vírus semelhante a tectivírus de uma bactéria que se tornou um simbionte bacteriano em um proto-eucarioto.[4] A partir daí, com base na análise filogenética da DNA polimerase viral e outras características, os vírus eucarióticos em Bamfordvirae parecem ter formado uma relação complexa com vários elementos genéticos egoístas, incluindo polintons,[note 2] um tipo de transposon, porções de DNA que podem se auto-replicam e se integram em outras partes da mesma molécula de DNA, e certos tipos de plasmídeos, que são moléculas de DNA extracromossômicas que se auto-replicam dentro da célula ou organela que ocupam.[5][8][14]
É provável que o simbionte bacteriano inicial tenha se tornado mitocôndria, com plasmídeos lineares mitocondriais descendentes de tectivírus remanescentes.[4] Outra linhagem divergente atingiu o núcleo e se recombinou com os transposons, tornando-se polintons, que podem ter sido os primeiros vírus eucarióticos em Bamfordvirae ou relacionados aos primeiros.[5][14][15] Polintons então deu origem a várias linhagens por vários mecanismos. Entre essas linhagens estão os vírus de pleno direito, incluindo adenovírus e vírus gigantes, plasmídeos lineares citoplasmáticos, virófagos, que são vírus satélites de vírus gigantes, transpovirons, que são moléculas de DNA semelhantes a plasmídeos lineares encontradas em vírus gigantes e bidnavírus via recombinação genética com um parvovírus,[5][8] ambos classificados no reino Monodnaviria.[16]
Enquanto a dobra de jelly roll é encontrada em outros reinos, incluindo a família Microviridae em Monodnaviria e vários vírus de RNA de fita simples em Riboviria, a dobra de jelly roll encontrada em Varidnaviria é vertical, ou seja, perpendicular à superfície do capsídeo, ao contrário das dobras de jelly roll em outros reinos, que são horizontais, ou seja, paralelos à superfície do capsídeo.[4] Em geral, os outros reinos de vírus não têm relação aparente com base na descendência comum de Varidnaviria.
Varidnaviria tem dois reinos: Bamfordvirae e Helvetiavirae, o último dos quais é monotípico até o nível de família. Essa taxonomia pode ser visualizada da seguinte forma:[16]
- Reino: Bamfordvirae, que codifica uma proteína do capsídeo principal que contém uma dobra vertical de rolo de gelatina dupla
- Reino: Helvetiavirae, que codifica uma proteína principal do capsídeo que contém uma única dobra vertical de gelatina
- Filo: Dividoviricota
- Classe: Laserviricetes
- Ordem: Halopanivirales
- Classe: Laserviricetes
- Filo: Dividoviricota
Todos os membros reconhecidos de Varidnaviria pertencem ao Grupo I: vírus dsDNA do sistema de classificação de Baltimore, que agrupa os vírus com base em como eles produzem RNA mensageiro. A família Finnlakeviridae, uma família proposta de Varidnaviria, pertence ao Grupo II: vírus ssDNA e seria o único vírus ssDNA no reino. A maioria dos vírus de DNA identificados que infectam eucariotos pertence à Varidnaviria,[5] as outras linhagens principais de vírus de DNA eucarióticos são a ordem Herpesvirales, que infecta animais, em Duplodnaviria,[17] e a classe Papovaviricetes, que infecta animais, em Monodnaviria.[18] Os reinos são o nível mais alto de taxonomia usado para vírus e Varidnaviria é um dos quatro, sendo os outros três Duplodnaviria, Monodnaviria e Riboviria.[16]
A família não designada Portogloboviridae é uma família proposta do reino, uma vez que suas proteínas do capsídeo parecem ser homólogas às de vírus em Varidnaviria.[11]
Outro grupo proposto é a classe Naldaviricetes (incluindo Polydnaviridae). Esses vírus abrangem vários genes que estão distantemente relacionados aos genes centrais do Nucleocytoviricota e, portanto, podem ser membros altamente derivados dos vírus DJR-MCP, apesar da ausência do DJR-MCP e da formação de vírions de formato ímpar. A análise filogenética preliminar de vários genes essenciais que são compartilhados por todos esses vírus artrópodes e o Nucleocytoviricota, como PolB, subunidades RNAP, helicase-primase e tiol oxidorredutase, sugeriu que esse grupo de vírus pode ser um ramo altamente derivado do Nucleocytoviricota.[19][20]
Interações com anfitriões[editar | editar código-fonte]
Doença[editar | editar código-fonte]
Bacteriófagos em Varidnaviria são potencialmente uma das principais causas de morte entre os procariontes marinhos. Este ponto de vista é baseado em autoliquivírus com ampla gama de hospedeiros, infectando e matando muitas cepas diferentes de várias espécies de bactérias, em contraste com bacteriófagos de cauda, que têm gamas de hospedeiros mais limitadas, bem como no aparentemente grande número de vírus dsDNA marinhos sem cauda. Os vírus de algas da família Phycodnaviridae desempenham um papel importante no controle de proliferação de algas, bem como, com muitos vírus marinhos em geral, contribuindo para um processo chamado de derivação viral, pelo qual o material orgânico de organismos mortos é "desviado" por vírus para longe de níveis tróficos mais altos e reciclados para consumo por aqueles em níveis tróficos mais baixos.[21]
Os vírus causadores de doenças mais notáveis em Varidnaviria são adenovírus, poxvírus e o vírus da peste suína africana (ASFV). Os adenovírus geralmente causam doenças respiratórias, gastrointestinais e conjuntivais leves, mas ocasionalmente causam doenças mais graves, como cistite hemorrágica, hepatite e meningoencefalite.[22] Os poxvírus infectam muitos animais e geralmente causam sintomas inespecíficos combinados com uma erupção cutânea característica chamada varíola. Os poxvírus notáveis incluem o vírus Variola, que causa a varíola, e o vírus Vaccinia, que é usado como vacina contra a varíola.[23] A ASFV é geralmente assintomática em seus reservatórios naturais, mas causa uma febre hemorrágica letal em suínos domésticos que é uma preocupação para a produção agrícola.[24]
Endogenização[editar | editar código-fonte]
Muitos vírus em Varidnaviria codificam a enzima integrase, permitindo que integrem seu genoma em seu hospedeiro e se comportem como transposons. Os polintons intimamente relacionados são aparentemente sempre endogenizados em seus hospedeiros. Essa integração do DNA viral no genoma do hospedeiro é uma forma de transferência horizontal de genes entre organismos não relacionados, embora os polintons sejam normalmente transmitidos verticalmente de pai para filho.[8][25][26]
Imunidade adaptativa[editar | editar código-fonte]
Um exemplo peculiar de endogenização em Varidnaviria são os virófagos, vírus satélites que dependem da infecção por vírus gigantes para se replicar. Os virófagos se replicam sequestrando os aparelhos de replicação de vírus gigantes, suprimindo assim o número de virions de vírus gigantes produzidos, aumentando a probabilidade de sobrevivência do hospedeiro. Alguns virófagos são capazes de se tornarem endogenizados, e essa endogenização pode ser considerada uma forma de imunidade adaptativa do hospedeiro contra a infecção por vírus gigantes.[8][25][26]
História[editar | editar código-fonte]
Doenças causadas por poxvírus são conhecidas por grande parte da história registrada. A varíola, em particular, tem sido altamente proeminente na medicina moderna; a primeira vacina a ser inventada visava a varíola, e a varíola mais tarde se tornaria a primeira doença a ser erradicada.[23] Os adenovírus humanos foram os primeiros vírus DJR-MCP em Varidnaviria a ter seus MCPs analisados, destacando-se por ter dobras de gelatina que eram perpendiculares, e não paralelas, à superfície do capsídeo. Em 1999, a estrutura da MCP do vírus Pseudomonas PRD1 foi resolvida, mostrando que a linhagem DJR-MCP incluía vírus procarióticos.[4] Haloarcula hispanica virus SH1 mais tarde, em 2003, se tornaria o primeiro vírus SJR-MCP descoberto.[9]
Ao longo do tempo, o uso da metagenômica permitiu a identificação de vírus no ambiente mesmo sem identificação do hospedeiro ou espécimes de laboratório, levando à descoberta de muitos membros adicionais do reino.[10][15] Pesquisas morfológicas de amostras marinhas sugerem que os vírus dsDNA sem cauda podem ser mais numerosos do que os vírus dsDNA com cauda de Duplodnaviria, que, a partir de 2019, são a maior e mais diversificada linhagem de vírus documentada.[4] Com o aumento do conhecimento dos vírus do reino, a Varidnaviria foi estabelecida em 2019 com base nas características compartilhadas dos vírus no reino.
O estabelecimento de Varidnaviria permitiu que vírus recém-descobertos e relacionados, ainda que divergentes, fossem classificados em taxa superiores. Isso inclui famílias propostas como Finnlakeviridae, que seria a única família no reino com um genoma de DNA de fita simples, Autolykiviridae, que tem uma ampla gama de hospedeiros e que pode desempenhar um papel importante na morte de bactérias marinhas, e o " Odin", que codifica uma proteína que não tem relação conhecida com nenhuma outra proteína no lugar da superfamília FtsK-HerA ATPase.[4][10] Em 2020, os autoliquivírus foram oficialmente classificados pela primeira vez.[27]
Notas
- ↑ Antes de 2020, Sphaerolipoviridae era a única família na ordem Halopanivirales, Mas naquele ano foi dividida em três famílias na mesma ordem, que são as únicas três famílias na ordem. De acordo com esta mudança, "Halopanivirales" é usado ao longo deste artigo, onde as fontes se referem à classificação anterior Sphaerolipoviridae.
- ↑ A natureza exata dos polintons é incerta. Enquanto eles codificam muitos genes virais, incluindo o MCP e mCP, e parecem ser parcialmente descendentes e os ancestrais de certos vírus, seus outros ancestrais sendo transposons, eles não foram observados para formar virions. Portanto, não está claro se eles são vírus ou se são um tipo de transposon. Refletindo essa incerteza é que os polintons às vezes são chamados de polintovírus.
Referências[editar | editar código-fonte]
- ↑ Kauffman KM, Hussain FA, Yang J, Arevalo P, Brown JM, Chang WK, VanInsberghe D, Elsherbini J, Sharma RS, Cutler MB, Kelly L, Polz MF (1 de fevereiro de 2018). «A Major Lineage of Non-Tailed dsDNA Viruses as Unrecognized Killers of Marine Bacteria». Nature. 554 (7690): 118–122. Bibcode:2018Natur.554..118K. PMID 29364876. doi:10.1038/nature25474
- ↑ Koonin EV, Dolja VV, Krupovic M, Varsani A, Wolf YI, Yutin N, Zerbini M, Kuhn JH (18 de outubro de 2019). «Create a megataxonomic framework, filling all principal taxonomic ranks, for DNA viruses encoding vertical jelly roll-type major capsid proteins» (docx). International Committee on Taxonomy of Viruses (em inglês). Consultado em 10 de junho de 2020
- ↑ a b Klose T, Rossman MG (Julho de 2014). «Structure of large dsDNA viruses». Biol Chem. 395 (7–8): 711–719. PMC 4307781
 . PMID 25003382. doi:10.1515/hsz-2014-0145
. PMID 25003382. doi:10.1515/hsz-2014-0145
- ↑ a b c d e f g h i j k San Martin C, van Raaij MJ (23 de novembro de 2018). «The So Far Farthest Reaches of the Double Jelly Roll Capsid Protein Fold». Virol J. 15 (1). 181 páginas. PMC 6260650
 . PMID 30470230. doi:10.1186/s12985-018-1097-1
. PMID 30470230. doi:10.1186/s12985-018-1097-1
- ↑ a b c d e f g h i j Krupovic M, Koonin EV (Fevereiro de 2015). «Polintons: a hotbed of eukaryotic virus, transposon and plasmid evolution». Nat Rev Microbiol. 13 (2): 105–115. PMC 5898198
 . PMID 25534808. doi:10.1038/nrmicro3389
. PMID 25534808. doi:10.1038/nrmicro3389
- ↑ a b c Xiao C, Rossmann MG (1 de agosto de 2011). «Structures of giant icosahedral eukaryotic dsDNA viruses». Curr Opin Virol. 1 (2): 101–109. PMC 3167175
 . PMID 21909343. doi:10.1016/j.coviro.2011.06.005
. PMID 21909343. doi:10.1016/j.coviro.2011.06.005
- ↑ a b Iyer LM, Makarova KS, Koonin EV, Aravind L (2004). «Comparative genomics of the FtsK–HerA superfamily of pumping ATPases: implications for the origins of chromosome segregation, cell division and viral capsid packaging». Nucleic Acids Res. 32 (17): 5260–5279. PMC 521647
 . PMID 15466593. doi:10.1093/nar/gkh828
. PMID 15466593. doi:10.1093/nar/gkh828
- ↑ a b c d e Koonin, EV, Krupovic M (Agosto de 2017). «Polintons, virophages and transpovirons: a tangled web linking viruses, transposons and immunity». Curr Opin Virol. 25: 7–15. PMC 5610638
 . PMID 28672161. doi:10.1016/j.coviro.2017.06.008
. PMID 28672161. doi:10.1016/j.coviro.2017.06.008
- ↑ a b Pawlowski A, Rissanen I, Bamford JK, Krupovic M, Jalasvuori M (junho de 2014). «Gammasphaerolipovirus, a newly proposed bacteriophage genus, unifies viruses of halophilic archaea and thermophilic bacteria within the novel family Sphaerolipoviridae». Arch Virol. 159 (6): 1541–1554. PMID 24395078. doi:10.1007/s00705-013-1970-6

- ↑ a b c Yutin N, Backstrom D, Ettema TJ, Krupovic M, Koonin EV (2018). «Vast diversity of prokaryotic virus genomes encoding double jelly-roll major capsid proteins uncovered by genomic and metagenomic sequence analysis». Virol J. 15 (1). 67 páginas. PMC 5894146
 . PMID 29636073. doi:10.1186/s12985-018-0974-y
. PMID 29636073. doi:10.1186/s12985-018-0974-y
- ↑ a b c Krupovic, M; Dolja, VV; Koonin, EV (14 de julho de 2020). «The LUCA and its complex virome.» (PDF). Nat Rev Microbiol. 18 (11): 661–670. PMID 32665595. doi:10.1038/s41579-020-0408-x. Consultado em 16 de agosto de 2020
- ↑ Krupovic M, Koonin EV (21 de março de 2017). «Multiple origins of viral capsid proteins from cellular ancestors». Proc Natl Acad Sci U S A. 114 (12): E2401–E2410. PMC 5373398
 . PMID 28265094. doi:10.1073/pnas.1621061114
. PMID 28265094. doi:10.1073/pnas.1621061114
- ↑ Krupovic M, Makarova KS, Koonin EV (1 de fevereiro de 2022). «Cellular homologs of the double jelly-roll major capsid proteins clarify the origins of an ancient virus kingdom». Proceedings of the National Academy of Sciences. 119 (5). doi:10.1073/pnas.2120620119

- ↑ a b Krupovic M, Bamford DH, Koonin EV (29 de abril de 2014). «Conservation of major and minor jelly-roll capsid proteins in Polinton (Maverick) transposons suggests that they are bona fide viruses». Biol Direct. 9. 6 páginas. PMC 4028283
 . PMID 24773695. doi:10.1186/1745-6150-9-6
. PMID 24773695. doi:10.1186/1745-6150-9-6
- ↑ a b Yutin N, Shevchenko S, Kapitonov V, Krupovic M, Koonin EV (2015). «A novel group of diverse Polinton-like viruses discovered by metagenome analysis». BMC Biol. 13. 95 páginas. PMC 4642659
 . PMID 26560305. doi:10.1186/s12915-015-0207-4
. PMID 26560305. doi:10.1186/s12915-015-0207-4
- ↑ a b c «Virus Taxonomy: 2019 Release». talk.ictvonline.org. International Committee on Taxonomy of Viruses. Consultado em 10 de junho de 2020
- ↑ «Create a megataxonomic framework, filling all principal/primary taxonomic ranks, for dsDNA viruses encoding HK97-type major capsid proteins» (docx). International Committee on Taxonomy of Viruses (em inglês). 18 de outubro de 2019. Consultado em 10 de junho de 2020
- ↑ «Create a megataxonomic framework, filling all principal taxonomic ranks, for ssDNA viruses» (docx). International Committee on Taxonomy of Viruses (em inglês). 18 de outubro de 2019. Consultado em 10 de junho de 2020
- ↑ Eugene V. Koonin, Valerian V. Dolja, Mart Krupovic, Arvind Varsani, Yuri I. Wolf, Natalya Yutin, F. Murilo Zerbini, Jens H. Kuhn (2020).
- ↑ Eugene V. Koonin, Valerian V. Dolja, Mart Krupovic (2015).
- ↑ Van Etten JL, Dunigan DD (Agosto de 2016). «Giant Chloroviruses: Five Easy Questions». PLOS Pathog. 12 (8): e1005751. PMC 4990331
 . PMID 27536965. doi:10.1371/journal.ppat.1005751
. PMID 27536965. doi:10.1371/journal.ppat.1005751
- ↑ Lynch JP, Kajon, AE (agosto de 2016). «Adenovirus: Epidemiology, Global Spread of Novel Serotypes, and Advances in Treatment and Prevention». Semin Respir Crit Care Med. 37 (4): 586–602. PMC 7171713
 . PMID 27486739. doi:10.1055/s-0036-1584923
. PMID 27486739. doi:10.1055/s-0036-1584923
- ↑ a b Meyer H, Ehmann R, Smith GL (fevereiro de 2020). «Smallpox in the Post-Eradication Era». Viruses. 12 (2). 138 páginas. PMC 7077202
 . PMID 31991671. doi:10.3390/v12020138
. PMID 31991671. doi:10.3390/v12020138
- ↑ Galindo I, Alonso C (maio de 2017). «African Swine Fever Virus: A Review». Viruses. 9 (5). 103 páginas. PMC 5454416
 . PMID 28489063. doi:10.3390/v9050103
. PMID 28489063. doi:10.3390/v9050103
- ↑ a b Mougari S, Sahmi-Bounsiar D, Levasseur A, Colson P, La Scola B (agosto de 2019). «Virophages of Giant Viruses: An Update at Eleven». Viruses. 11 (8). 733 páginas. PMC 6723459
 . PMID 31398856. doi:10.3390/v11080733
. PMID 31398856. doi:10.3390/v11080733
- ↑ a b Campbell S, Aswad A, Katzourakis A (agosto de 2017). «Disentangling the Origins of Virophages and Polintons». Curr Opin Virol. 25: 59–65. PMID 28802203. doi:10.1016/j.coviro.2017.07.011. Consultado em 10 de junho de 2020
- ↑ «ICTV Taxonomy history: Autolykiviridae». International Committee on Taxonomy of Viruses (ICTV). Consultado em 17 de junho de 2021
Leitura adicional[editar | editar código-fonte]
- Ward, C. W. (1993). «Progress towards a higher taxonomy of viruses». Research in Virology. 144 (6): 419–53. PMC 7135741
 . PMID 8140287. doi:10.1016/S0923-2516(06)80059-2
. PMID 8140287. doi:10.1016/S0923-2516(06)80059-2
