Excavata
| Excavata | |||||||
|---|---|---|---|---|---|---|---|
| Classificação científica | |||||||
| |||||||
| Filos | |||||||
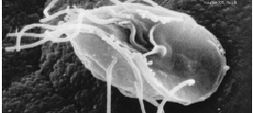

Topo: Jakobida: 1-núcleo, 2-flagelo anterior, 3-flagelo ventral/posterior, 4-sulco alimentar ventral.
Centro: Euglenozoa: 1-núcleo, 2-bolsa flagelar, 3-flagelo dorsal/anterior, 4-flagelo ventral/posterior, 5-citostoma/aparelho alimentar.
Baixo: Metamonada: 1-flagelos anteriores, 2-corpo parabasal, 3-membrana ondulante, 4-flagelo posterior, 5-núcleo, 6-axostilo.
Excavata é um grupo de organismos unicelulares pertencentes ao domínio Eukaryota.[1][2][3] Como estrutura taxonómica, o agrupamento foi proposto em 2002 por Thomas Cavalier-Smith como uma nova categoria filogenética, agregando uma grande variedade de formas simbióticas e de vida livre, entre as quais alguns importantes parasitas dos humanos. As espécies agora incluídas nos Excavata estavam anteriormente consideradas como pertencentes ao agora obsoleto reino Protista.[4] Os Excavata são classificados com base nas características das estruturas flagelares,[5] sendo considerados como os membros mais antigos (linhagem basal) dos organismos flagelados.[6]
O subgrupo Discoba (Euglenozoa, Percolozoa, Tsukubea e Jakobea) parecem estar entre os Eukaryota basais, enquanto os Metamonada e Malawimonas parecer constituir um grupo irmão dos Podiata. Existem algumas indicações que fazem supor que Discoba seja um grupo altamente parafilético.[7]
Descrição[editar | editar código-fonte]
O agrupamento Excavata é um dos grandes grupos taxonómicos de eucariontes, composto por uma grande diversidade de organismos unicelulares, incluindo alguns conhecidos parasitas de animais, como Trypanosoma cruzi e Giardia lamblia, e seres de vida livre, como Euglena gracilis. Alguns são importantes parasitas dos seres humanos,[8][9] responsáveis por algumas importantes patologias.
Alguns «excavados», como são coloquialmente designados os integrantes do grupo, partilham uma depressão ou irregularidade ventral devida à presença de uma estrutura destinada à captura e ingestão de alimento em suspensão, suportada por elementos do citoesqueleto da célula (depressão de onde deriva o termo «Excavata»), sendo esta uma das principais características sinapomórficas responsáveis pela justificação da linhagem.[10] Apesar disso, a monofilia do grupo foi durante muito tempo considerada duvidosa e muito questionada pela ausência de sinapomorfias universais entre os indivíduos do táxon. Contudo, o agrupamento é atualmente considerado monofilético, tendo-se por base dados moleculares e ultraestruturais incontroversos.[11][12][13][14]
Muitos Excavata não apresentam as "clássicas" mitocôndrias, razão pela qual estes organismos são frequentemente referidos como "amitocondriais", embora a maioria retenha organelos mitocondriais com formas muito modificada (por exemplo como hidrogenossoma ou mitossoma). Os que apresentam mitocôndrias exibem estruturas específicas nestes organelos, com mitocôndrias com cristas tubulares, discoidais ou, em alguns casos, planas.
Morfologia[editar | editar código-fonte]
A maioria dos Excavata apresenta dois, quatro ou mais flagelos[15] e muitos possuem um aparelho digestivo ventral com uma ultraestrutura característica, suportado por microtúbulos. Contudo, nem todos os grupos considerados como excavados compartilham estas características e vário grupos em que elas estão ausentes apenas podem ser considerados como parte dos Excavata com base em evidências genéticas (especialmente árvores filogenéticas de sequências moleculares).[4]
Os Excavata que mais e aproximam da multicelularidade são os bolores limosos da ordem Acrasidae. Como outros bolores limosos celulares, passam a maior parte da sua vida como células simples, puramente unicelulares, mas em determinadas fases do seu ciclo de vida agrupam-se em grandes agregados que adquirem algumas das características básicas dos organismos multicelulares.
Graças a várias evidências moleculares e morfológicas que se sobrepõem, podem-se definir entre os Excavata pelo menos os seguintes grupos:
- Metamonada
- Trimastix
- Carpediemonas.
- Retortamonadida, e.g. Retortamonas, Chilomastix
- Diplomonadida, e.g. Trepomonas, Giardia
- Parabasalia, e.g. Trichomonas
- Oxymonadida, e.g. Oxymonas
- Euglenozoa, e.g. Euglena, Trypanosoma
- Percolozoa ou Heterolobosea, e.g. Naegleria, Acrasis
As relações entre os distintos grupos de excavados são ainda incertas e é possível que os Excavata não constituam um grupo monofilético.[16][17] Só o parentesco entre Euglenozoa e Percolozoa se apoia sobre dados moleculares robustos e ambos os grupos possuem mitocôndrias com cristas discóides. A maioria dos Jakobida possui mitocôndrias com cristas tubulares como a maioria dos demais protistas. Os Metamonada são inusuais por terem perdido as mitocôndrias clássicas e em seu lugar possuírem hidrogenossomas e mitossomas. Um táxon, Loukozoa, foi continuamente redefinido para incluir uma grande variedade de grupos (entre eles Jacobida e Malawimonas) e finalmente abandonado.[17]
Os excavados foram anteriormente considerados como os Eukarya mais primitivos, principalmente porque vários deles não possuem mitocôndrias e porque aparecem na base das árvores filogenéticas.[18] Isto sugeriria que os excavados são um taxon parafilético que inclui os antepassados dos demais eucariontes. No entanto, demonstrou-se que a ausência de mitocôndrias em alguns destes grupos é devida a uma perda posterior e que a posição basal destes grupos poderia ser devida a um artefacto de atração de ramificações longas.
Alguns investigadores consideram que Excavata, Rhizaria, Chromalveolata (que inclui Chromista e Alveolata) e Primoplantae formam parte do clado Bikonta (células eucariotas com dois flagelos, pelo menos ancestralmente).
Características gerais[editar | editar código-fonte]

A vasta diversidade morfológica e alimentar do grupo dificulta o estabelecimento de características gerais. É notável a ausência de caracteres morfológicos universais no grupo.
Como característica unificadora, os integrantes de Excavata, contudo, são organismos unicelulares, frequentemente dotados de dois, quatro ou numerosos flagelos. Algumas vezes, um dos flagelos pode ser pouco ou não funcional e mal emergir da célula. O aparato flagelar, em alguns casos, situa-se numa região de características ameboides conhecida como ampulla ou citofaringe, que está relacionada à absorção de partículas alimentares do meio.
A fagocitose é vista no grupo como sendo feita através da depressão alimentar ventral de alguns dos excavados, como Jakoba libera. Essa depressão é de grande importância para a caracterização do grupo, embora não esteja presente na maioria dos integrantes da linhagem, e é tida como uma característica basal secundariamente perdida nos muitos táxons internos de Excavata.[19]
Além dos organismos heterotróficos de vida livre, são reconhecidas no grupo formas fotoautotróficas e, inclusive, parasitas. A capacidade fotossintética está presente em organismos integrados na linhagem Euglenida, a qual é filogeneticamente próxima de grupos fundamentalmente heterotróficos, tendo sido adquirida a partir do estabelecimento de uma relação endossimbiose secundária recente entre um ancestral heterotrófico e uma alga verde.[20]
Excavata engloba também muitas formas parasitas de grande importância médica e económica, como Trypanosoma cruzi, causador da doença de Chagas, Giardia lamblia, agente causador da giardíase e Phytomonas serpens, um parasita de plantas.
Ao contrário da autotrofia, as formas de vida parasitárias evoluíram no grupo mais de uma vez e estão presentes em diferentes linhagens.
No grupo existem formas chamadas amitocondriais, pela ausência de mitocôndrias “clássicas”, sendo estas, tão logo, anaeróbias, muito embora orgânulos especiais como hidrogenossomas e mitossomas, tidos como mitocôndrias “degeneradas” (altamente modificadas) sejam conhecidos em algumas dessas formas, sendo Giardia um dos gêneros a possuir esses orgânulos, onde o processo energético de fermentação ocorre.[21]
Uma peculiaridade presente em alguns dos membros de Excavata é a capacidade de, literalmente, mudar o formato celular. Essa característica é expressa de maneiras diferentes nos grupos onde é reconhecida. Em euglenídeos, como Euglena gracilis, essa capacidade é vista no movimento euglenoide, ao passo que em cinetoplastideos, como Trypanosoma cruzi, o padrão morfológico celular se altera de acordo com o momento de seu ciclo de vida, possuindo formas específicas que se repetem. No interior das células de seu hospedeiro, por exemplo, formas amastigotas são vistas, ao passo que, enquanto circulam no sangue, durante a fase aguda da doença de Chagas, formas tripomastigotas são encontradas. É importante ressaltar, contudo, que essa capacidade não se trata de uma feição ameboide, e ocorre pela existência de uma estrutura proteica associada à rede de microtúbulos do citoesqueleto, justaposta à membrana celular, no lado interno da célula, conhecida como película.
Filogenia e sistemática[editar | editar código-fonte]

Enquadramento filogenético[editar | editar código-fonte]
A heterogeneidade de Excavata constituiu, outrora, um dos questionamentos sobre sua real monofilia. O grupo é composto por formas fotossintetizantes e heterotróficas de vida livre, anaeróbios e aeróbios, e, até mesmo, parasitas de seres humanos, demais animais e plantas. O grupo foi originalmente proposto tendo por base a presença de uma depressão ventral alimentar e estruturas associadas do citoesqueleto em algumas células,[13][22] com alguns táxons adicionais (Parabasalia, Oxymonadida e Euglenozoa) correlacionados primariamente por estudos moleculares.[23][24][25][26][27]
Os protistas amitocondriados da linhagem, como os Diplomonadida e os Parabasalia, foram outrora considerados eucariontes extremamente ancestrais, que teriam divergido da linha evolutiva dos eucariontes antes mesmo do evento de endossimbiose que originou as mitocôndrias.[28] Esta hipótese, que ficou conhecida como "hipótese Archaezoa", é actualmente pouco acreditada tendo por base a descoberta de genes tipicamente mitocondriais em Trichomonas vaginalis [29] e Giardia lamblia,[30] o que sugere que, na realidade, as mitocôndrias naqueles protistas foram secundariamente perdidas e as formas mitocondriadas são, de facto, filogeneticamente relacionadas com as formas amitocondriais, ao contrário do que a "hipótese Archaezoa" sugeria.
O seguinte cladograma apresenta a posição filogenética do agrupamento Excavata à luz dos conhecimentos de biologia molecular mais recentes, com a raiz Eukaryota entre os excavata e os eucariotas como grupo irmão do agrupamento Heimdallarchaeota.[7][31][32][33][34][35][36][37]
| Asgard Archaea |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Aceitando-se esta estrutura filogenética, o agrupamento Excavata é parafilético em elevado grau, e deveria ser abandonado.[38] Numa visão alternativa, o agrupamento Discoba pode ser considerado como grupo irmão do resto dos Diphoda.[32]
- Discoba ou clade JEH (Jakobea+Euglenozoa+Heterolobosea)
Os grupos Euglenozoa e Heterolobosea (Percolozoa) aparentam ser estreitamente aparentados, estando unidos pela presença de mitocôndrias com cristas discóides (superfilo Discicristata). Mais recentemente foi demonstrada uma relação filogenética estreita entre os Discicristata e os Jakobida,[39] sendo que os últimos apresentam mitocôndrias com as cristas tubulares típicas da maioria dos outros protistas, e foram por isso unificados num taxon designado por Discoba especificamente proposto para este grupo aparentemente monofilético.[2]
- Filogenia de Malawimonas
O género Malawimonas é constituído por um pequeno grupo de flagelados heterotróficos de vida livre, dotados de depressão ventral alimentar, de grande importância para o reconhecimento de Excavata como um grupo monofilético, mas cujo posicionamento ainda não é totalmente claro.[14] Estudos mais recentes, no entanto, demonstraram com maior solidez que Malawimonas constitui provavelmente de um grupo irmão de Metamonada,[11] embora o seu posicionamento sistemático entre os Excavta continue elusivo.[3]
- Filogenia de Andalucia
O género Andalucia é constituído por um grupo de pequenos flagelados de vida livre, recentemente descrito, dotado da típica depressão ventral alimentar. Morfologicamente, não há qualquer traço que permita distinguir claramente Andalucia de Jakoba,[40] e análises moleculares determinaram que a semelhança morfológica entre os clados reflecte o seu real parentesco. Essa relação filogenética estreita com os jacobídeos levou a que o grupo fosse classificado como integrando os Jakobida, agrupamento que assim emerge como um grupo irmão de Discicristata (o qual compreende Heterolobosea e Euglenozoa.[11]
- Metamonads
O agrupamento Metamonada é incomum por ter perdido as mitocôndrias clássicas, apresentando em seu lugar organelos designados por hidrogenossomas e mitossomas ou organelos incaracterísticos. O género Monocercomonoides (Oxymonadida) perdeu completamente os organelos homólogos das mitocôndrias.
Monofilia[editar | editar código-fonte]
As relações filogenéticas no interior do agrupamento Excavata permenecem em boa parte incertas, sendo possível que não constituam um agrupamento monofilético. À luz dos dados disponíveis, a monofilia dos Excavata está longe de ser clara, embora pareça seguro que existem vários clades no interior dos Excavata que são monofiléticos.[41]
Certas Excavata são frequentemente considerados como pertencendo entre os eucariotas mais primitivos, baseados em parte no seu posicionamento em muitas árvores evolucionárias. Esse posicionamento poderia encorajar propostas de classificação que considerassem os Excavata como um grau parafilético que inclui os antepassados de outros eucariotas vivos. No entanto, a colocação de certas Excavata como "ramos primitivos" pode ser um artefacto de análise causado pela atracção de ramificações longas, como tem sido demonstrado em alguns outros grupos taxonómicos, por exemplo entre os Microsporidia.
Classificação[editar | editar código-fonte]
Os membros do agrupamento taxonómico Excavata são classificados em 6 grupos principais ao nível taxonómico de filo ou classe, conforme consta da tabela abaixo. Um género adicional, Malawimonas, poderá ser também incluído entre os Excavata, mas as evidências filogenéticas conhecidas são equívocas.
| Superfilo | Filo/Classe | Géneros representativos (exemplos) | Descrição |
|---|---|---|---|
| Discoba ou JEH | Tsukubea | Tsukubamonas | |
| Euglenozoa | Euglena, Trypanosoma | Inclui parasitas com grande importância sanitária; um grande grupo com plastídeos (cloroplastos). | |
| Heterolobosea (Percolozoa) | Naegleria, Acrasis | A maioria das espécies alterna entre formas flageladas e ameboides. | |
| Jakobea | Jakoba, Reclinomonas | Organismos de vida livre, por vezes flagelados loricados, com genomas mitocondriais muito ricos em genes. | |
| Metamonada ou POD | Preaxostyla | Oxymonads, Trimastix | Flagelados desprovidos de mitocôndrias que podem ser de vida livre (Trimastix, Paratrimastix) ou vivendo na cavidade digestiva posterior de insectos. |
| Fornicata | Giardia, Carpediemonas | Desprovidos de mitocôndrias, maioritariamente simbiontes e parasitas de animais. | |
| Parabasalia | Trichomonas | Flagelados desprovidos de mitocôndrias, geralmente comensais que ocorrem no tracto intestinal de insectos. Alguns são patogénicos em humanos. |
Sistemática[editar | editar código-fonte]
O agrupamento Excavata apresenta a seguinte estrutura sistemática:
- Metamonada
- Discoba
Notas[editar | editar código-fonte]
- ↑ Hampl, V.; Hug, L.; Leigh, J. W.; Dacks, J. B.; Lang, B. F.; Simpson, A. G. B.; Roger, A. J. (2009). «Phylogenomic analyses support the monophyly of Excavata and resolve relationships among eukaryotic "supergroups"». Proceedings of the National Academy of Sciences. 106 (10): 3859–3864. PMC 2656170
 . PMID 19237557. doi:10.1073/pnas.0807880106
. PMID 19237557. doi:10.1073/pnas.0807880106
- ↑ a b Hampl V, Hug L, Leigh JW, et al. (2009). «Phylogenomic analyses support the monophyly of Excavata and resolve relationships among eukaryotic "supergroups"». Proc. Natl. Acad. Sci. U.S.A. 106 (10): 3859–64. Bibcode:2009PNAS..106.3859H. PMC 2656170
 . PMID 19237557. doi:10.1073/pnas.0807880106
. PMID 19237557. doi:10.1073/pnas.0807880106
- ↑ a b Simpson, Ag; Inagaki, Y; Roger, Aj (2006). «Comprehensive multigene phylogenies of excavate protists reveal the evolutionary positions of "primitive" eukaryotes» (Free full text). Molecular Biology and Evolution. 23 (3): 615–25. PMID 16308337. doi:10.1093/molbev/msj068
- ↑ a b Cavalier-Smith, T (2002). «The phagotrophic origin of eukaryotes and phylogenetic classification of Protozoa.». International Journal of Systematic and Evolutionary Microbiology. 52 (2): 297–354. PMID 11931142. doi:10.1099/00207713-52-2-297
- ↑ Simpson, AG (2003). «Cytoskeletal organization, phylogenetic affinities and systematics in the contentious taxon Excavata (Eukaryota)». International Journal of Systematic and Evolutionary Microbiology. 53 (Pt 6): 1759–1777. PMID 14657103. doi:10.1099/ijs.0.02578-0
- ↑ Dawson, Scott C; Paredez, Alexander R (2013). «Alternative cytoskeletal landscapes: cytoskeletal novelty and evolution in basal excavate protists». Current Opinion in Cell Biology. 25 (1): 134–141. PMC 4927265
 . PMID 23312067. doi:10.1016/j.ceb.2012.11.005
. PMID 23312067. doi:10.1016/j.ceb.2012.11.005
- ↑ a b Cavalier-Smith, Thomas; Chao, Ema E.; Lewis, Rhodri (1 de junho de 2016). «187-gene phylogeny of protozoan phylum Amoebozoa reveals a new class (Cutosea) of deep-branching, ultrastructurally unique, enveloped marine Lobosa and clarifies amoeba evolution». Molecular Phylogenetics and Evolution. 99: 275–296. doi:10.1016/j.ympev.2016.03.023
- ↑ Cavalier-Smith, T. 2002. The phagotrophic origin of eukaryotes and phylogenetic classification of Protozoa. International Journal of Systematic and Evolutionary Microbiology. 52: 297-354.
- ↑ Alastair G. B. Simpson. 2003. Cytoskeletal organization, phylogenetic affinities and systematics in the contentious taxon Excavata. International Journal of Systematic and Evolutionary Microbiology. 53: 1759-1777.
- ↑ Simpson, A. G. B. & Patterson, D. J. (2001). «On Core Jakobids and Excavate Taxa: The Ultrastructure of Jakoba incarcerata». The Journal of Eukaryotic Microbiology. 48 (4): 480-492. doi:10.1111/j.1550-7408.2001.tb00183.x
- ↑ a b c Hampl, V., Hug, L., Leigh, J. W., Dacks, J. B., Lang, B. F., Simpson, A. G. B., & Roger, A. J. (2009). «Phylogenomic analyses support the monophyly of Excavata and resolve relationships among eukaryotic "supergroups"». roceedings of the National Academy of Sciences. 106: 3859-3864. doi:10.1073/pnas.0807880106
- ↑ Burki, F., Shalchian-Tabrizi, K. & Pawlowski, J. (2008). «Phylogenomics reveals a new 'megagroup' including most photosynthetic eukaryotes». Biology Letters. 4: 366-369
- ↑ a b Simpson, A. G. B. (2003). «Cytoskeletal organization, and systematics in the contentious taxon Excavata (Eukaryota)». International Journal of Systematic and Evolutionary Microbiology. 53: 1759-1777. doi:10.1111/j.1550-7408.2001.tb00183.x
- ↑ a b Simpson, A G. B., Inagaki, Y.; Roger, A. J. (2006). «Comprehensive multigene phylogenies of excavate protists reveal the evolutionary positions of "primitive" eukaryotes». Molecular Biology and Evolution. 23 (3): 615–25. doi:10.1093/molbev/msj068
- ↑ Simpson AG (2003). «Cytoskeletal organization, phylogenetic affinities and systematics in the contentious taxon Excavata (Eukaryota)». Int. J. Syst. Evol. Microbiol. 53 (Pt 6): 1759–77. PMID 14657103. doi:10.1099/ijs.0.02578-0[ligação inativa]
- ↑ Sina M. Adl; et al. (2005). «The New Higher Level Classification of Eukaryotes with Emphasis on the Taxonomy of Protists» (PDF). Journal of Eukaryotic Microbiology. 52 (5). 399 páginas. doi:10.1111/j.1550-7408.2005.00053.x. Consultado em 11 de outubro de 2008. Arquivado do original (PDF) em 8 de maio de 2007
- ↑ a b Laura Wegener Parfrey, Erika Barbero, Elyse Lasser, Micah Dunthorn, Debashish Bhattacharya, David J Patterson, and Laura A Katz (dezembro de 2006). «Evaluating Support for the Current Classification of Eukaryotic Diversity». PLoS Genet. 2 (12): e220. doi:10.1371/journal.pgen.0020220
- ↑ Ciccarelli FD; Doerks T; von Mering C; Creevey CJ; Snel B; Bork P (2006). «Toward automatic reconstruction of a highly resolved tree of life» (PDF). Science. 311 (5765): 1283-7. doi:10.1126/science.1121745
- ↑ Adl, S. M.; Simpson, A. G. B.; Lane, C. E.; Lukeš, J.; Bass, D.; Bowser, S. S.; Brown, M. W.; Burki, F.; Dunthorn, M.; Hampl, V.; Heiss, A.; Hoppenrath, M.; Lara, E.; le Gall, L.; Lynn, D. H.; McManus, H.; Mitchell, E. A. D.; Mozley-Stanridge, S. E.; Parfrey, L. W.; Pawlowski, J.; Rueckert, S.; Shadwick, L.; Schoch, C. L.; Smirnov, A; Spiegel, F. W. (2012). «The Revised Classification of Eukaryotes». Journal of Eukaryotic Microbiology. 59: 429-514
- ↑ Gibbs, S. P. (1978). «The chloroplasts of Euglena may have evolved from symbiotic green algae». Canadian Journal of Botany. 59: 2883-2889. doi:10.1139/b78-345
- ↑ Emelyanov, V. V., & Goldberg, A. V. (2011). «Fermentation enzymes of Giardia intestinalis, pyruvate:ferredoxin oxidoreductase and hydrogenase, do not localize to its mitosomes». Microbiology. 157: 1602-1611. doi:10.1099/mic.0.044784-0
- ↑ Simpson, A. G. B., & Patterson, D. J. (1999). «The ultrastructure of Carpediemonas membranifera (Eukaryota) with reference to the "excavate hypothesis"». European Journal of Protistology. 35: 353-370. doi:10.1016/S0932-4739(99)80044-3
- ↑ Cavalier-Smith, T. (1998). «A revised six-kingdom system of life». Biological Reviews. 73: 203–266. doi:10.1111/j.1469-185X.1998.tb00030.x
- ↑ Cavalier-Smith, T. (2002). «The phagotrophic origin of eukaryotes and phylogenetic classification of Protozoa». Sistematic and Evolutionary Microbiology. 52: 297-354
- ↑ Henze, K., Horner, D. S., Suguri, S., Moore, D. V., Sánchez, L. B., Müller, M., & Embley, T. M. (2001). «Unique phylogenetic relationships of glucokinase and glucosephosphate isomerase of the amitochondriate eukaryotes Giardia intestinalis, Spironucleus barkhanus and Trichomonas vaginalis». Gene. 281: 123-131. doi:10.1016/S0378-1119(01)00773-9
- ↑ Dacks, J. B., Silberman, J. D,, Simpson, A. G. B., Moriya, S., Kudo, T., Ohkuma, M., Redfield, R.J. (2001). «Oxymonads are closely related to the excavate taxon Trimastix». Mol Biol Evol. 18: 1034 –1044
- ↑ Andersson, J.O., Sarchfield, S.W., Roger, A. J. (2005). «Gene transfers from Nanoarchaeota to an ancestor of diplomonads and parabasalids». Mol Biol Evol. 22: 85-90
- ↑ Cavalier-Smith, T. (1993). «Kingdom protozoa and its 18 phyla». Microbiological Reviews. 57: 953-994
- ↑ Roger, A. L., Clark, C. G., Doolittle, W. F. (1996). «A possible mitochondrial gene in the early-branching amitochondriate protist Trichomonas vaginalis». PNAS. 93: 14618-14622
- ↑ Hashimoto, T., Nakamura, Y., Nakamura, F., Shirakura, T., Adachi, J., Goto, N., Okamoto, K, Hasegawa, M. (1994). «Protein phylogeny gives a robust estimation for early divergences of eukaryotes: phylogenetic place of a mitochondria-lacking protozoan, Giardia lamblia». Molecular Biology and Evolution. 11: 65-71
- ↑ Zaremba-Niedzwiedzka, Katarzyna; Caceres, Eva F.; Saw, Jimmy H.; Bäckström, Disa; Juzokaite, Lina; Vancaester, Emmelien; Seitz, Kiley W.; Anantharaman, Karthik; Starnawski, Piotr (11 de janeiro de 2017). «Asgard archaea illuminate the origin of eukaryotic cellular complexity». Nature (em inglês). advance online publication. ISSN 1476-4687. doi:10.1038/nature21031
- ↑ a b Derelle, Romain; Torruella, Guifré; Klimeš, Vladimír; Brinkmann, Henner; Kim, Eunsoo; Vlček, Čestmír; Lang, B. Franz; Eliáš, Marek (17 de fevereiro de 2015). «Bacterial proteins pinpoint a single eukaryotic root». Proceedings of the National Academy of Sciences (em inglês). 112 (7): E693–E699. ISSN 0027-8424. PMC 4343179
 . PMID 25646484. doi:10.1073/pnas.1420657112
. PMID 25646484. doi:10.1073/pnas.1420657112
- ↑ Cavalier-Smith, T.; Chao, E. E.; Snell, E. A.; Berney, C.; Fiore-Donno, A. M.; Lewis, R. (2014). «Multigene eukaryote phylogeny reveals the likely protozoan ancestors of opisthokonts (animals, fungi, choanozoans) and Amoebozoa». Molecular Phylogenetics & Evolution. 81: 71–85. doi:10.1016/j.ympev.2014.08.012
- ↑ Cavalier-Smith, Thomas (23 de junho de 2010). «Kingdoms Protozoa and Chromista and the eozoan root of the eukaryotic tree». Biology Letters (em inglês). 6 (3): 342–345. ISSN 1744-9561. PMC 2880060
 . PMID 20031978. doi:10.1098/rsbl.2009.0948
. PMID 20031978. doi:10.1098/rsbl.2009.0948
- ↑ He, Ding; Fiz-Palacios, Omar; Fu, Cheng-Jie; Fehling, Johanna; Tsai, Chun-Chieh; Baldauf, Sandra L. «An Alternative Root for the Eukaryote Tree of Life». Current Biology. 24 (4): 465–470. doi:10.1016/j.cub.2014.01.036
- ↑ Cavelier Smith. «Early evolution of eukaryote ...». Elsevier. doi:10.1016/j.ejop.2012.06.001
- ↑ Hug, Laura A.; Baker, Brett J.; Anantharaman, Karthik; Brown, Christopher T.; Probst, Alexander J.; Castelle, Cindy J.; Butterfield, Cristina N.; Hernsdorf, Alex W.; Amano, Yuki (11 de abril de 2016). «A new view of the tree of life». Nature Microbiology (em inglês). 1 (5). ISSN 2058-5276. doi:10.1038/nmicrobiol.2016.48
- ↑ Cavalier-Smith, Thomas (1 de outubro de 2016). «Higher classification and phylogeny of Euglenozoa». European Journal of Protistology. 56: 250–276. doi:10.1016/j.ejop.2016.09.003
- ↑ Naiara Rodríguez-Ezpeleta, Henner Brinkmann, Gertraud Burger, Andrew J. Roger, Michael W. Gray, Hervé Philippe, and B. Franz Lang (2007). «Toward Resolving the Eukaryotic Tree: The Phylogenetic Positions of Jakobids and Cercozoans». Curr. Biol. 17 (16): 1420–1425. PMID 17689961. doi:10.1016/j.cub.2007.07.036
- ↑ Lara, E., Chatzinotas, A., Simpson, A.G.B. (2006). «Andalucia (gen. nov,): a new taxon for the deepest branch within jakobids (Jakobida; Excavata), based on morphological and molecular study of a new flagellate from soil». J. Eukaryot. Microbiol. 53: 112-120
- ↑ Laura Wegener Parfrey; Erika Barbero; Elyse Lasser; Micah Dunthorn; Debashish Bhattacharya; David J Patterson; Laura A Katz (2006). «Evaluating Support for the Current Classification of Eukaryotic Diversity». PLoS Genet. 2 (12): e220. PMC 1713255
 . PMID 17194223. doi:10.1371/journal.pgen.0020220
. PMID 17194223. doi:10.1371/journal.pgen.0020220

