Hipertrofia ventricular direita
| Hipertrofia ventricular direita | |
|---|---|
| Hiperttrofia ventricular direita | |
| Especialidade | Cardiologia |
| Classificação e recursos externos | |
| MeSH | D017380 |
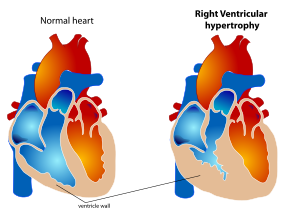
Hipertrofia ventricular direita (HVD) é uma condição definida por um aumento anormal do músculo cardíaco que envolve o ventrículo direito. O ventrículo direito é uma das quatro câmaras do coração. Ele está localizado na câmara inferior direita do coração e recebe sangue desoxigenado da câmara superior direita (átrio direito) e bombeia sangue para os pulmões.
Como a HVD é um aumento do músculo, ela surge quando o músculo precisa trabalhar mais. Portanto, as principais causas da HVD são patologias de sistemas relacionados ao ventrículo direito, como a artéria pulmonar, a valva tricúspide ou as vias aéreas.
A HVD pode ser benigna e ter pouco impacto na vida cotidiana ou pode levar a condições como insuficiência cardíaca, que tem um prognóstico ruim.
Sinais e sintomas
[editar | editar código-fonte]Sintomas
[editar | editar código-fonte]Embora as apresentações variem, indivíduos com hipertrofia ventricular direita podem apresentar sintomas associados a hipertensão pulmonar, insuficiência cardíaca e/ou redução do débito cardíaco. Estes incluem:[1]
- Falta de ar durante o esforço
- Dor no peito (angina) ao esforço
- Desmaio (síncope) durante esforço
- Fadiga geral/letargia
- Tontura
- Sensação de plenitude na região abdominal superior
- Desconforto ou dor no abdômen superior direito
- Apetite reduzido
- Inchaço (edema) das pernas, tornozelos ou pés
- Batimento cardíaco acelerado (palpitações)
Raramente, as pessoas podem apresentar os sintomas da síndrome de Ortner, que incluem tosse, hemoptise e rouquidão.
Sinais
[editar | editar código-fonte]No exame físico, as características mais proeminentes são devidas ao desenvolvimento de insuficiência cardíaca direita. Isso pode incluir pressão venosa jugular elevada, ascite, elevação paraesternal esquerda e fígado aumentado e sensível à palpação[2]. Na inspeção, os pacientes podem estar cronicamente doentes, cianóticos, caquéticos e ocasionalmente ictéricos.
Na ausculta cardíaca, pode haver um segundo batimento (B2) acentuado em foco pulmonar, um terceiro som cardíaco denominado "galope ventricular direito", bem como um sopro sistólico na área tricúspide acentuado pela inspiração. Ocasionalmente, o sopro sistólico pode ser transmitido e auscultado sobre o fígado. Menos comumente, o sopro diastólico também pode ser ouvido como resultado de insuficiência pulmonar[2].
Causas
[editar | editar código-fonte]A HVD geralmente ocorre devido a doença pulmonar crônica ou defeitos estruturais no coração. Uma das causas mais comuns de HVD é a hipertensão pulmonar (HP)[2], definida como aumento da pressão arterial nos vasos que fornecem sangue aos pulmões. A HP leva ao aumento da pressão da artéria pulmonar. O ventrículo direito tenta compensar esse aumento de pressão mudando sua forma e tamanho. A hipertrofia dos miócitos individuais resulta em um aumento na espessura da parede do ventrículo direito[2]. A incidência mundial de HP é de 4 por milhão de pessoas[3]. A HVD ocorre em aproximadamente 30% desses casos.
A HP é amplamente dividida em cinco categorias pela Organização Mundial da Saúde, com base na causa subjacente. A incidência de HVD varia entre os grupos. Causas comuns de HP incluem doença pulmonar obstrutiva crônica (DPOC), embolia pulmonar e outras doenças pulmonares restritivas. A HVD geralmente ocorre como resultado desses distúrbios. A HVD é observada em 76% dos pacientes com DPOC avançada e em 50% dos pacientes com doença pulmonar restritiva[2].
A HVD também ocorre em resposta a defeitos estruturais no coração. Uma causa comum é a insuficiência tricúspide. Este é um distúrbio em que a válvula tricúspide não fecha corretamente, permitindo o refluxo do sangue. Outros defeitos estruturais que levam à HVD incluem tetralogia de Fallot, defeitos do septo ventricular, estenose da valva pulmonar e defeitos do septo atrial . A HVD também está associada à obesidade abdominal, glicemia de jejum elevada, pressão arterial sistólica alta e encurtamento fracionado da parede média do ventrículo esquerdo.
Outros fatores de risco para HVD incluem tabagismo, apneia do sono e atividades extenuantes. Eles aumentam o risco de doenças cardíacas e pulmonares e, portanto, de HVD[4].
Fisiopatologia
[editar | editar código-fonte]A hipertrofia ventricular direita pode ser um processo fisiológico e fisiopatológico. Torna-se patológico (prejudicial) quando há hipertrofia excessiva. O processo fisiopatológico ocorre principalmente por meio da sinalização aberrante dos hormônios neuroendócrinos; angiotensina II, endotelina-1 e catecolaminas (por exemplo, noradrenalina).
Angiotensina-II e endotelina-1
[editar | editar código-fonte]Angiotensina-II e endotelina-1 são hormônios que se ligam aos receptores de angiotensina e endotelina. Esses são receptores acoplados à proteína G que atuam por meio de vias de sinalização internas. Por meio de vários intermediários, essas vias aumentam direta ou indiretamente a produção de espécies reativas de oxigênio (ERO), causando acúmulo nas células do miocárdio. Isso pode posteriormente induzir morte celular necrótica, fibrose e disfunção mitocondrial[5].
Isso foi demonstrado em estudos com animais. A proteína quinase C (PKC) é uma molécula intermediária na via de sinalização e ratos sem PKC demonstraram resistência à insuficiência cardíaca em comparação com ratos com superexpressão de PKC que apresentaram disfunção cardíaca[6].
Atuar no sistema renina-angiotensina (SRAA) (usando inibidores da enzima de conversão da angiotensina e bloqueadores do receptor da angiotensina) é uma abordagem clínica bem reconhecida para reverter a hipertrofia cardíaca mal-adaptativa, independentemente da pressão arterial.
Catecolaminas
[editar | editar código-fonte]Os níveis de catecolaminas aumentam devido ao aumento da atividade do sistema nervoso simpático. As catecolaminas podem atuar nos receptores alfa-adrenérgicos e beta-adrenérgicos, que são receptores acoplados à proteína G. Essa ligação inicia as mesmas vias de sinalização intracelular da angiotensina e da endotelina. Também ocorre ativação do AMPc e aumento do Ca2+ intracelular, o que leva à disfunção contrátil e fibrose[5].
Outros
[editar | editar código-fonte]Os hormônios não são a única causa de HVD. A hipertrofia também pode ser causada por forças mecânicas, vias mTOR, óxido nítrico e células imunes . As células imunes podem causar hipertrofia induzindo inflamação[5].
Diagnóstico
[editar | editar código-fonte]

Os dois principais exames diagnósticos utilizados para evidenciar a hipertrofia ventricular direita são a eletrocardiografia e a ecocardiografia.
Eletrocardiografia
[editar | editar código-fonte]O uso do eletrocardiograma (ECG) para medir a hipertrofia das câmaras cardíacas está bem estabelecido, mas como a atividade ventricular esquerda é dominante no ECG, um alto grau de HVD é frequentemente necessário para quaisquer alterações detectáveis. No entanto, o ECG é usado para auxiliar no diagnóstico de HVD. Um estudo post mortem em 51 pacientes adultos do sexo masculino concluiu que a HVD anatômica pode ser diagnosticada usando um ou mais dos seguintes critérios de ECG:[7]
- Desvio do eixo direito maior que (ou igual a) 110° (veja figura de referência hexaxial)
- Onda R dominante sobre a onda S em V1 ou V2
- Onda S dominante sobre onda R em V6
No entanto, a American Heart Association recomendou o uso de testes diagnósticos adicionais para diagnosticar HVD, porque nenhum critério ou conjunto de critérios foi considerado suficientemente confiável[8].
Ecocardiografia
[editar | editar código-fonte]A ecocardiografia pode ser usada para visualizar diretamente a espessura da parede do ventrículo direito. A técnica preferida é a abordagem transesofágica, que permite uma visão de 4 câmaras. A espessura normal da parede livre do ventrículo direito varia de 2 a 5 milímetros, com valor acima de 5 mm considerado hipertrófico[9].
Tratamento
[editar | editar código-fonte]A hipertrofia ventricular direita em si não é o problema principal, mas o que ela representa é. A hipertrofia ventricular direita é o estágio intermediário entre o aumento da pressão ventricular direita (nos estágios iniciais) e a insuficiência ventricular direita (nos estágios posteriores)[10]. Dessa forma, o tratamento da hipertrofia ventricular direita consiste em prevenir o desenvolvimento da hipertrofia ventricular direita em primeiro lugar ou prevenir a progressão para a insuficiência do ventrículo direito. A hipertrofia ventricular direita por si só não tem tratamento (farmacológico)[4].
Tratando a causa
[editar | editar código-fonte]Como as principais causas da hipertrofia ventricular direita são a regurgitação tricúspide ou a hipertensão pulmonar (discutidas acima), o manejo clínico envolve o tratamento dessas condições[2]. A regurgitação tricúspide é normalmente tratada de forma conservadora, visando tratar a causa subjacente e acompanhando o paciente regularmente. A cirurgia é considerada em situações mais graves, quando o paciente apresenta sintomas graves. As opções cirúrgicas incluem: substituição da válvula ou reparo da válvula (denominado anuloplastia)[2]. Quando se trata de substituição, há uma escolha entre uma válvula biológica ou uma válvula mecânica, dependendo das características específicas do paciente. A válvula mecânica tem maior durabilidade, mas necessita de anticoagulação para reduzir o risco de trombose[2]. O tratamento da hipertensão pulmonar dependerá da causa específica da hipertensão pulmonar. Além disso, também podem ser considerados: terapia diurética, oxigênio e anticoagulante[2].
Lidando com as complicações
[editar | editar código-fonte]Após um período prolongado, o ventrículo direito não consegue se adaptar o suficiente para bombear contra o aumento da pressão do ventrículo direito, o que é denominado insuficiência ventricular direita. Essa insuficiência ventricular direita é a principal complicação da hipertrofia ventricular direita. Os mecanismos subjacentes à progressão da hipertrofia para a falência não são bem compreendidos[10], e a melhor abordagem envolve a redução/minimização dos fatores de risco da progressão. Mudanças no estilo de vida geralmente podem ajudar a reduzir o risco dessa progressão. Mudanças no estilo de vida incluem: comer menos alimentos salgados, pois o consumo de sal leva a uma maior retenção de líquidos pelo corpo; parar de fumar; evitar o consumo excessivo de álcool, pois o álcool reduz a força das contrações cardíacas. Quando a hipertrofia ventricular direita progride para insuficiência ventricular direita, o tratamento passa a ser a insuficiência cardíaca. Resumidamente, isso inclui o uso de:
Referências
- ↑ Ibrahim, Bassem (12 de dezembro 2016). «Right Ventricular Failure». e-Journal of Cardiology Practice. 14 (32). Consultado em 23 de março 2019
- ↑ a b c d e f g h i Bhattacharya, Priyanka; Sharma, Sandeep (15 de fevereiro 2019). «Right Ventricular Hypertrophy». StatPearls. NCBI. Consultado em 23 de março 2019
- ↑ Oudiz, Ronald (21 de junho 2018). «Idiopathic Pulmonary Arterial Hypertension». Medscape. Consultado em 23 de março 2019
- ↑ a b Johnson, Jon (16 de agosto 2017). «What is right ventricular hypertrophy?». Medical News Today. Consultado em 23 de março 2019
- ↑ a b c Nakamura, Michinari; Sadoshima, Junichi (19 de abril 2018). «Mechanisms of physiological and pathological cardiac hypertrophy». Nature Reviews Cardiology. 15 (7): 387–407. PMID 29674714. doi:10.1038/s41569-018-0007-y
- ↑ Braz, Julian; Gregory, Kimberley (15 de fevereiro 2004). «PKC-α regulates cardiac contractility and propensity toward heart failure». Nature Medicine. 10 (3): 248–254. PMID 14966518. doi:10.1038/nm1000
- ↑ Lehtonen, Jari (1988). «Electrocardiographic Criteria for the Diagnosis of Right Ventricular Hypertrophy Verified at Autopsy». Chest. 93 (4): 839–42. PMID 2964996. doi:10.1378/chest.93.4.839
- ↑ Hancock, William (2009). «AHA/ACCF/HRS Recommendations for the Standardization and Interpretation of the Electrocardiogram». Journal of the American College of Cardiology. 53 (11): 992–1002. PMID 19281932. doi:10.1016/j.jacc.2008.12.015

- ↑ Ho, Siew Yen (2006). «Anatomy, echocardiography, and normal right ventricular dimensions». Heart. 92 (Supp 1): i2–i13. PMC 1860731
 . PMID 16543598. doi:10.1136/hrt.2005.077875
. PMID 16543598. doi:10.1136/hrt.2005.077875
- ↑ a b van der Bruggen, C (2017). «RV pressure overload: from hypertrophy to failure». Cardiovascular Research. 113 (12): 1423–1432. PMID 28957530. doi:10.1093/cvr/cvx145