N-butil lítio
| n-butil-lítio Alerta sobre risco à saúde | |
|---|---|
| |
| Nome IUPAC | butil-lítio, tetra-μ3-butil-tetralítio |
| Outros nomes | NBL, BuLi, 1-litiobutano |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| ChEBI | |
| SMILES |
|
| InChI | 1/C4H9.Li/c1-3-4-2;/h1,3-4H2,2H3;/rC4H9Li/c1-2-3-4-5/h2-4H2,1H3
|
| Propriedades | |
| Fórmula química | C4H9Li |
| Massa molar | 64.06 g mol-1 |
| Aparência | líquido incolor instável usualmente obtido como solução |
| Densidade | 0.68 g/cm³, definido em solvente |
| Ponto de fusão |
-76 °C (<273 K) |
| Ponto de ebulição |
se decompõe |
| Solubilidade em água | reage violentamente |
| Solubilidade em ciclohexano | solúvel |
| Solubilidade em éter dietílico | solúvel |
| Acidez (pKa) | >35 (necessita fonte) |
| Estrutura | |
| Forma molecular | tetramérica em solução |
| Momento dipolar | 0 D |
| Riscos associados | |
| Principais riscos associados |
inflamável ao ar, decomposto libera LiOH, corrosivo |
| Compostos relacionados | |
| reagente de organolítio relacionados | sec-butil-lítio t-butil-lítio hexil-lítio metil-lítio |
| Compostos relacionados | hidróxido de lítio |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |

O n-butil-lítio (abreviado n-BuLi) é um reagente de organolítio. É largamente usado como iniciador de polimerização na produção de elastômeros, tais como polibutadieno ou estireno-butadieno-estireno (SBS). Também é muito empregado como base forte (superbase) em síntese orgânica, industrialmente e em laboratório.
Butil-lítio é disponibilizado comercialmente em soluções (15%, 25%, 2 M, 2.5 M, 10 M, etc.) em alcanos como pentano, hexanos e heptanos. Soluções em éter dietílico e THF podem ser preparadas, mas não são estáveis o suficiente para a armazenagem. A produção e consumo anual do butil-lítio e outros compostos de organolítio é estimada em 1800 toneladas.[carece de fontes]
Apesar de ser um líquido incolor, n-butil-lítio é encontrado normalmente como uma solução amarelo-pálida. Tais soluções são estáveis indefinidamente se estocadas apropriadamente,[1] mas, na prática, elas se deterioram com o passar do tempo. Um precipitado branco e fino (hidreto de lítio) se deposita e a cor muda para laranja.
Estrutura e ligação[editar | editar código-fonte]
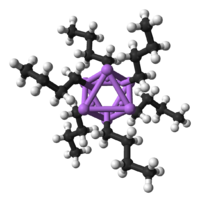
N-BuLi existe como um cluster no estado sólido e em solução. A tendência de agregar é comum para compostos de organolítio. Os agregados são mantidos unidos por ligações covalentes deslocadas entre o lítio e o carbono terminal da cadeia butil.[2] No caso do n-BuLi, os clusteres são tetraméricos (em éter) ou hexaméricos (em cicloexano). O cluster é uma estrutura distorcida de cubano com o Li e os grupos CH2R em vértices alternados. Uma descrição equivalente do tetrâmero é um tetraedro de Li4 interpenetrado com um tetraedro de [CH2R]4. A ligação dentro do cluster é parecida com aquela usada para descrever o diborano porém mais complexa porque oito átomos estão envolvidos. Refletindo seu "caráter de eletrodeficiência", o n-butil-lítio é altamente reativo com bases de Lewis.
Devido à grande diferença de eletronegatividade entre carbono (2.55) e lítio (0.98), a ligação C-Li é fortemente polarizada. A separação de cargas foi estimada entre 55% e 95%. Para propósitos práticos, n-BuLi pode ser considerado na reação como um ânion butil, n-Bu−, e um cátion lítio, Li+.
Preparação[editar | editar código-fonte]
A preparação padrão do n-BuLi é a reação de 1-bromobutano ou 1-clorobutano com Li metálico:[1]
- 2 Li + C4H9X → C4H9Li + LiX
- onde X = Cl, Br
O lítio para esta reação contém de 1 a 3% de sódio. Entre os solventes usados para esta preparação estão o benzeno, ciclohexano e éter dietílico. Quando o precursor é BuBr, o produto é uma solução homogênea, consistindo de um cluster misto contendo ambos LiBr e BuLi, junto com uma pequena quantidade de octano. BuLi forma um complexo fraco com LiCl, então a reação de BuCl com Li produz um precipitado de LiCl.
Aplicações[editar | editar código-fonte]
Butil-lítio é principalmente valorizado como um iniciador para a polimerização aniônica de dienos, como o butadieno.[3] A reação é chamada de "carbolitiação":
- C4H9Li + CH2=CH-CH=CH2 → C4H9-CH2-CH=CH-CH2Li
Isopreno pode ser polimerizado estereoespecificamente dessa forma. Também de comercial importância é o uso do butil-lítio para a produção de polímeros estireno-butadieno. Mesmo o etileno se insere no BuLi.[carece de fontes]
Reações[editar | editar código-fonte]
O butil-lítio é uma base forte (pKa ≈ 40), mas é também um poderoso nucleófilo e redutor, dependendo dos outros reagentes. Além disso, por ser um nucleófilo forte, n-BuLi se liga a bases de Lewis apróticas, tais como éteres e aminas terciárias, que parcialmente desgregam os clusteres ao se ligar com os centros de lítio. Seu uso como base forte é referido como metalação. Reações são tipicamente conduzidas em tetraidrofurano e éter dietílico, os quais são bons solventes para os derivados de organolítio resultantes (veja abaixo).
Metalação[editar | editar código-fonte]
Uma das propriedades químicas mais importantes do n-BuLi é a sua habilidade em desprotonar uma grande variedade de ácidos de Brønsted. t-Butil-lítio e s-butil-lítio são mais básicos. n-BuLi pode desprotonar (isto é, metalar) muitos tipos de ligações C-H, especialmente onde a base conjugada é estabilizada por delocalização de elétrons ou um ou mais heteroátomos (átomos dferentes do carbono). Exemplos incluem acetilenos (H-CC-R), sulfetos de metila (H-CH2SR), tioacetais (H-CH(SR)2, por exemplo ditiano), metilfosfinas (H-CH2PR2), furanos, tiofenos e ferroceno (Fe(H-C5H4)(C5H5)).[4] Em adição a isso, n-BuLi também desprotona compostos mais ácidos como álcoois, aminas, carbonil compostos enolizáveis, and any overtly acidic compounds, to produce alkoxides, amides, enolates and other -ates of lithium, respectively. A estabilidade e volatilidade do butano resultante de tais reações de desprotonação é conveniente, mas pode ser um problema para reações em larga escala por causa do volume de gás inflamável produzido.
- LiC4H9 + R-H → C4H10 + R-Li
A basicidade cinética do n-BuLi á afetada pelo solvente ou cossolvente. Ligantes que complexam Li+ tais como tetraidrofurano (THF), tetrametiletilenodiamina (TMEDA), hexametilfosforamida (HMPA) e 1,4-diazabiciclo[2.2.2]octano (DABCO) polarizam a ligação Li-C e aceleram a metalação. Tais aditivos podem ainda auxiliar no isolamento do produto litiado, um famoso exemplo do qual é o dilitioferroceno.
- Fe(C5H5)2 + 2 LiC4H9 + 2 TMEDA → 2 C4H10 + Fe(C5H4Li)2(TMEDA)2
Base de Schlosser é uma superbase produzida ao tratar butil-lítio com tert-butóxido de potássio. É cineticamente mais reativo que o butil-lítio e quase sempre usado para realizar reações de metalação mais difíceis. O ânion butóxido complexa o lítio e efetivamente produz butil-potássio, que é mais reativo que o correspondente reagente de lítio.
Um exemplo do uso de n-butil-lítio como base é a adição de uma amina ao carbonato de metila para formar um carbamato de metila, onde o n-butil-lítio serve para desprotonar a amina:
- n-BuLi + R2NH + (MeO)2CO → R2N-CO2Me + LiOMe + BuH
Adições de carbonila[editar | editar código-fonte]
Reagentes de organolítio, incluindo n-BuLi são usados na síntese de aldeídos e cetonas específicos. Um dos modos é a reação de um reagente de organolítio com amidas dissubstituídas:
- R¹Li + R²CONMe2 → LiNMe2 + R²C(O)R¹
Decomposição térmica[editar | editar código-fonte]
Quando aquecido, n-BuLi, analogamente a outros reagentes de alquil-lítio com hidrogênios β, sofre eliminação de β-hidreto para produzir 1-buteno e LiH:
- C4H9Li → LiH + CH3CH2CH=CH2
Segurança[editar | editar código-fonte]
Compostos de alquil-lítio são armazenados em gás inerte para prevenir perda de atividade e por razões de segurança. N-BuLi reage violentamente com a água:
- C4H9Li + H2O → C4H10 + LiOH
BuLi também reage com CO2 para formar pentanoato de lítio:
- C4H9Li + CO2 → C4H9CO2Li
Referências
- ↑ a b Brandsma, L.; Verkraijsse, H. D. (1987). Preparative Polar Organometallic Chemistry I. Berlin: Springer-Verlag. ISBN 3-540-16916-4
- ↑ Elschenbroich, C. ”Organometallics” (2006) Wiley-VCH: Weinheim. ISBN 978-3-29390-6
- ↑ Ulrich Wietelmann and Richard J. Bauer “Lithium and Lithium Compounds” in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a15_393
- ↑ Sanders, R.; Mueller-Westerhoff, U. T. (1996). «The Lithiation of Ferrocene and Ruthenocene — A Retraction and an Improvement». Journal of Organometallic Chemistry. 512 (1-2): 219–224. doi:10.1016/0022-328X(95)05914-B
Leitura posterior[editar | editar código-fonte]
- FMC Lithium (em inglês)
- Dados sobre o butil-lítio (em inglês)
- Weissenbacher, Anderson, Ishikawa, Organometallics, July 1998, p681.7002, Chemicals Economics Handbook SRI International
- Plano de teste de HPV, submetido pela FMC Lithium à EPA (em inglês)
- Ovaska, T. V. e-EROS Encyclopedia of Reagents for Organic Synthesis "n-butyllithium." Wiley and sons. 2006. doi:10.1002/047084289X.rb395 (em inglês)
- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements, 2nd ed. 1997: Butterworth-Heinemann, Boston.
