Glicerol: diferenças entre revisões
m Revertidas edições por 200.201.3.39 para a última versão por Luckas-bot (usando Huggle) |
|||
| Linha 203: | Linha 203: | ||
| valign="top" | |
| valign="top" | |
||
| valign="top" | |
| valign="top" | |
||
| ⚫ | |||
| valign="top" align="center" | NAD<sup>+</sup> |
| valign="top" align="center" | NAD<sup>+</sup> |
||
| ⚫ | |||
| valign="top" | |
| valign="top" | |
||
| valign="top" | |
| valign="top" | |
||
Revisão das 23h09min de 27 de dezembro de 2012
Este artigo ou secção contém uma lista de referências no fim do texto, mas as suas fontes não são claras porque não são citadas no corpo do artigo, o que compromete a confiabilidade das informações. (Março de 2009) |
| Glicerol Alerta sobre risco à saúde | |
|---|---|
| |

| |

| |
| Nome IUPAC | Propano-1,2,3-triol |
| Nome sistemático | Glicerol |
| Outros nomes | Glicerina |
| Identificadores | |
| Abreviação | Gro |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| KEGG | |
| MeSH | |
| ChEBI | |
| Número RTECS | MA8050000 |
| Código ATC | A06 |
| SMILES |
|
| InChI | 1/C3H8O3/c4-1-3(6)2-5/h3-6H,1-2H2
|
| Referência Beilstein | 4-01-00-02751 |
| 3DMet | |
| Propriedades | |
| Fórmula química | C3H8O3 |
| Massa molar | 92.0776 g mol-1 |
| Aparência | Líquido incolor |
| Odor | Inodoro |
| Densidade | 1,2613 g cm–3 (20 °C) |
| Ponto de fusão |
18.1 °C, 291 K, 65 °F |
| Ponto de ebulição |
290 °C, 563 K, 554 °F |
| Solubilidade em água | Miscível |
| Solubilidade em etanol | Miscível |
| Solubilidade em éter | Levemente solúvel |
| Solubilidade em benzeno | Insolúvel |
| Solubilidade em tetracloreto de carbono | Insolúvel |
| Solubilidade em triclorometano | Insolúvel |
| log P | -1,671 |
| Pressão de vapor | 0,33 Pa (50 °C) 26 Pa (100 °C) 573 Pa (150 °C) 6100 Pa (200 °C) |
| kH | 1,73 |
| Atmospheric OH rate constant | 1,87 × 10-11 |
| Acidez (pKa) | 14,4 |
| Basicidade (pKb) | -0,4 |
| λmax | < 207 nm |
| Condutividade térmica | 0,285 W m-1 K-1 (25 °C) 0,288 W m-1 K-1 (50 °C) 0,292 W m-1 K-1 (75 °C) 0,296 W m-1 K-1 (100 °C) |
| Índice de refracção (nD) | 1,4746 (20°C, 589 nm) |
| Viscosidade | 1,5 Pa s-1 (20 °C) 934 mPa s-1 (25 °C) 152 mPa s-1 (50 °C) 39,8 mPa s-1 (75 °C) 14,8 mPa s-1 (100 °C) |
| Momento dipolar | 0,9613587967 D |
| Estrutura | |
| Estrutura cristalina | Xarope, ortorômbico, lamelar |
| Forma molecular | sp3 |
| Termoquímica | |
| Entalpia padrão de formação ΔfH |
−669,6 kJ mol-1 (líquido) −577,9 kJ mol-1 (gás) |
| Entalpia padrão de combustão ΔcH |
1 655,4 kJ mol-1 |
| Entropia molar padrão S |
206,3 J mol-1 K-1 |
| Capacidade calorífica molar Cp 298 |
218,8 J mol-1 K-1 |
| Farmacologia | |
| Riscos associados | |
| MSDS | ScienceLab.com |
| NFPA 704 | |
| Ponto de fulgor | 160 °C Fechado 177 °C Cleveland 199 °C Pensky-Martens 204 °C Ponto de ignição[1] |
| Compostos relacionados | |
| Outros aniões/ânions | 3-cloro-1,2-propanodiol |
| Polióis e açúcares relacionados | Etilenoglicol Propilenoglicol Propano-1,3-diol Eritritol (butano-1,2,3,4-tetraol) Gliceraldeído |
| Compostos relacionados | Glicerol-3-fosfato Triacilgliceróis (ésteres) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
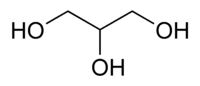
Glicerol ou propano-1,2,3-triol (IUPAC, 1993) é um composto orgânico pertencente à função álcool. É líquido à temperatura ambiente (25 °C), higroscópico, inodoro, viscoso e de sabor adocicado. O nome origina-se da palavra grega glykos (γλυκός), que significa doce. O termo Glicerina[2] refere-se ao produto na forma comercial, com pureza acima de 95%.
História

Por volta de 600 a.C, os fenícios divulgaram um conhecimento alquimista de como se fazer sabão, que alguns séculos mais tarde, teve sua divulgação via Marselha dentro dos costumes gauleses e germânicos. Nenhuma referência antiga pode ser encontrada com os nomes "glicerina" ou "glicerol", pois esses nomes datam do século XX unicamente. No período da Renascença da Itália, referências de como se fazer sabão podem ser encontradas pela Europa Central e regiões da Alemanha nos séculos seguintes. Por volta do século XIV, no reinado de Carlos I, a coroa Inglesa monopolizava o comércio e fabricação de sabão e, até mesmo, cobrava uma taxa das pessoas que possuiam uma preferência por "limpeza". No século seguinte, este conhecimento foi levado da alquimia à química, um exemplo histórico está em C.G. Geoffrey (1741), que intensificou seus estudos acerca da natureza das substâncias gordurosas, desencadeando a descoberta da glicerina. Menos de 40 anos depois, o químico sueco Carl Wilhelm Scheele foi o primeiro a isolar esse composto, em 1779, pelo aquecimento de uma mistura de litargírio (PbO) com óleo de oliva. Foi ele quem formalizou a descoberta de que os óleos e gorduras naturais contêm o que chamamos hoje de glicerina. Na época, ele a batizou de "o doce princípio das gorduras".
Ocorrência
O glicerol está presente em todos os óleos e gorduras de origem animal e vegetal (veja óleo vegetal e gordura) em sua forma combinada, ou seja, ligado a ácidos graxos tais como o ácido esteárico, oleico, palmítico e láurico para formar a molécula de triacilglicerol.
Os óleos de coco e de palma (dendê) contêm uma alta quantidade (70 - 80%) de ácidos graxos com cadeia carbônica de 6 a 14 carbonos. Estes rendem muito mais glicerol do que os óleos contendo ácidos graxos de 16 a 18 carbonos, tais como gorduras, óleo de algodão, soja, oliva e palma. O glicerol combinado está presente também em todas as células animais e vegetais, fazendo parte de sua membrana celular,[3] na forma de fosfolipídios.
Produção de Glicerol
Todo o glicerol produzido no mundo, até 1949, era proveniente da indústria de sabão. Atualmente, 70% da produção de glicerol nos Estados Unidos ainda provém dos glicerídeos (óleos e gorduras naturais) e, o restante, da produção do glicerol sintético (subproduto da fabricação de propileno), da produção de ácidos graxos e também de ésteres de ácidos graxos (biodiesel)..[4][5]
Em 2000, a produção mundial de glicerol foi de 800 mil toneladas, sendo que 10% disto foram oriundos de indústrias responsáveis pela produção de Biodiesel.
Aplicações
Saúde e fatores de risco
O glicerol é reconhecido como seguro para o consumo humano desde 1959, podendo ser utilizado em diversos produtos alimentícios para os mais diversos propósitos. Os níveis de DL50 em ratos são de 470 mg/kg e em porquinhos-da-índia de 7750 mg/kg. Vários estudos mostraram que uma grande quantidade de glicerol (sintético ou natural) pode ser administrada sem aparecimento de qualquer efeito adverso à saúde.[6]
Alimentos e bebidas
É frequentemente utilizado como/em.[7][8] Entre eles:
- umectante, solvente, amaciante;
- umectante e agente suavizante em doces, bolos e sorvetes, retardando a cristalização do açúcar;
- agente umectante nas embalagens de queijos e carnes;
- solvente e agregador de consistência em flavorizantes e corantes;
- produção de mono–, di–, ou triglicerídeos para uso em emulsificantes;
- produção de polímeros, como poliglicerol, que são adicionados em margarinas;
- meio facilitador da transferência de calor, por estar em contato direto com o alimento, permitindo que algum alimento específico seja rapidamente resfriado para que não perca algumas caracteríticas desejáveis.
Uma colher de chá de glicerol tem aproximadamente 27 kcal e tem um poder adoçante equivalente a 60% da sacarose (açúcar de cana). Embora o glicerol apresente aproximadamente o mesmo nível energético obtido pelo açúcar comum, ele não eleva os níveis de açúcar no sangue (veja glicemia) e também não alimenta as bactérias que causam a cárie. Em sua forma concentrada ele jamais deve ser consumido, pois ocasiona a retirada de água dos tecidos vivos causando problemas gástricos. Como aditivo alimentar, ele é reconhecido pelo número E - E422, pertencendo à classe dos espessantes, estabilizadores, gelificantes e emulsionantes. Quando presente em alimentos, ele é facilmente digerido como se fosse um carboidrato.[9]
Medicamentos
Na área médica/hospitalar/farmacêutica há inúmeros produtos que utilizam o glicerol.[10] Entre eles:
- Pomadas;
- Elixires, xaropes;
- Anestésicos;
- Seus derivados são utilizados como tranquilzantes e agentes para controle da pressão, como a nitroglicerina, que é um importante vasodilatador;
- Em cosméticos ele entra em muitos cremes e loções que mantém a maciez e umidade da pele;
- Em cremes dentais, é comum ser utilizado para conferir-lhe brilho, suavidade e viscosidade.
Outras aplicações
- Na produção de tabaco. Entre eles: , quando as folhas são quebradas e empacotadas, o glicerol é pulverizado impedindo que as mesmas se tornem secas e quebradiças, o que poderia ocasionar o esfarelamento;[11]
- Na indústria têxtil é utilizado para amaciar e flexibilizar as fibras;[12]
- O glicerol é utilizado também na indústria de papel na fabricação de alguns papéis especiais, que necessitam de alguns agentes plastificantes para conferir-lhes maleabilidade e tenacidade;
- Pode ser utilizado como lubrificante em máquinas que fabricam produtos alimentícios, que entram em contato direto com o alimento ou, quando existir qualquer tipo de incompatibilidade com os produtos utilizados no processo, tais como em rolamentos expostos a solventes como gasolina ou benzina, que poderiam dissolver o óleo mineral;
- Utilizado em misturas anticongelantes;
- Utilizado para preservar bactérias a temperaturas baixas.
Metabolismo
O glicerol é um precursor para a síntese de triacilgliceróis e de fosfolípidos, no fígado e no tecido adiposo. Quando o corpo usa a gordura acumulada como fonte de energia, glicerol e ácidos graxos são libertados na corrente sanguínea. O glicerol pode ser convertido em glucose pelo fígado, providenciando energia para o metabolismo celular.
Antes que possa entrar na via da glicólise ou da gliconeogénese (dependendo das condições fisiológicas), tem que ser convertido em gliceraldeído-3-fosfato, segundo os seguintes passos:
A enzima glicerol quinase está presente apenas no fígado. Em tecidos adiposos, o glicerol 3-fosfato é obtido da diidroxiacetona fosfato através da acção da enzima glicerol-3-fosfato desidrogenase.
Armazenamento

Soluções diluídas de glicerol estão sujeitas à fermentação bacteriana, formando glicóis, ácidos e/ou gases. Como redução do rendimento, os produtos desta fermentação podem dificultar a remoção da glicerina por destilação. Sabe-se ainda que os glicóis produzidos são também impossíveis de serem removidos por processos de desionização. Para prevenir a degradação bacteriana, soluções diluídas (<50% em água) são geralmente mantidas a temperaturas acima de 65 °C, necessitando que algum método seja desenvolvido para aquecer os tanques de armazenamento. Quando em pequenas quantidades, alguns autores de artigos científicos preferem armazená-lo sob temperaturas baixas, entre 5 °C, permitindo que tal solução permaneça em boas condições de uso por até 1 mês. Em altas concentrações, o glicerol se torna extremamente viscoso e, embora o crescimento bacteriano não ocorra nestas condições, é desejável um aquecimento dos tanques para que se mantenha a fluidez deste produto. As temperaturas típicas de manuseio ou bombeamento ficam em torno de 37 a 60 °C.
Como o crescimento bacteriano em glicerol é um risco a ser considerado, todo e qualquer processo que envolva a utilização do glicerol deve ser constantemente monitorado, principalmente na produção de fármacos e alimentos.
Embora o glicerol e as soluções de glicerol sejam inertes a muitos tipos de materiais que podem ser usados para seu armazenamento, operações que envolvem o seu refino necessitam de cuidados especiais acerca do tipo de material da construção. A presença de hidróxido de sódio (soda cáustica), residual da reação de produção do sabão (geralmente pela saponificação), pode conferir à glicerina crua uma certa basicidade. Pode ser encontrado também vestígios de ácidos graxos, oriundos da hidrólise das gorduras durante seu processo de formação e separação, que ocasionam problemas relacionados à corrosão nos tanques utilizados para seu armazenamento. Sendo assim, é necessário que os condensadores utilizados sejam galvanizados e os concentradores finais do processo de desionização e equipamentos de purificação sejam feitos de aço de baixo peso ou de alumínio. O glicerol pode reagir com o ferro ou compostos ferrosos para formar complexos fortemente coloridos, reforçando a necessidade de se utilizar materiais adequados para a produção de glicerina com alto grau de pureza.
A higroscopicidade do glicerol é algo a ser levado em conta na contrução de tanques de armazenamento. Esta propriedade permite ao glicerol absorver facilmente a umidade da atmosfera. Para impedir que isso ocorra, os tanques devem ser fechados com a presença de um agente dessecante. Como alternativa, o tanque pode ser armazenado sob pressão positiva, utilizando para isso, um gás inerte e seco.
Observações
O Glicerol pode apresentar risco de explosão em contato com alguns agentes oxidantes, tais como: trióxido de cromo, clorato de potássio e permanganato de potássio.
- "Guia IUPAC para a Nomenclatura de Compostos Orgânicos" Tradução Portuguesa na variantes Européia e Brasileira de "A Guide to IUPAC Nomenclature of Organic Compounds - Recomendations 1993", original em inglês preparado por R. Pânico, W. H. Powell e J.-C. Richer.
- JUNGERMANN, E.; SONNTAG, N. O. V. Glycerine: a key cosmetic ingredient. New York: Marcel Dekker, 1991. 460 p. (Cosmetic science and technology series, 11).
- KIRK-OTHMER, E. T. Glycerol. In: American Society of Chemistry. Encyclopedia of chemical technology. 5. ed. New York: John Wiley, 2007. Disponível em: Wiley.com. Acesso em: 12 maio 2007.
- LIDE, David R. (Ed.), TAYLOR and FRANCIS. CRC Handbook of Chemistry and Physics. 89.ed (Internet version 2007). Boca Raton, FL. Disponível em: HBCPnetbase. Acesso em: 14 mar. 2009.
Referências
- ↑ COLLINS, Peter M. Dictionary of carbohydrates. CRC Press, 2005, 1282 p. (ISBN 0849338298), p. 584-986 (em inglês)
- ↑ RN 56-81-5 Glycerin (em inglês)
- ↑ {en} Campbell, Neil A.; Brad Williamson; Robin J. Heyden (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 0-13-250882-6
- ↑ {en} The Glycerol Challenge
- ↑ {pt} Glicerina - Sub-produto do biodiesel
- ↑ {en} U.S. Food and Drug Administration. "FDA Advises Manufacturers to Test Glycerin for Possible Contamination."
- ↑ {en} Codex Alimentarius Commission, « Updated up to the 31st Session of the Codex Alimentarius Commission for Glycerol (422) [archive] » sur http://www.codexalimentarius.net [archive], 2008, GSFA Online, Codex Alimentarius.
- ↑ {pt} Glicerina - Usos em alimentos e bebidas
- ↑ {en} Parlement européen et Conseil de l'europe, « La Directive 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants », dans Journal officiel de l'Union européenne, no L 61, 20/02/1995, p. 1-56
- ↑ {pt} Glicerina - Usos em drogas e cosméticos
- ↑ {pt} Glicerina - Processamento de tabaco
- ↑ {pt} Glicerina - Aumentar a flexibilidade das fibras téxteis.
a producao do sabao a partir de oleo de soja


