Analéptico

Um analéptico, na medicina, é um estimulante do sistema nervoso central. O termo analéptico geralmente se refere a analépticos respiratórios (por exemplo, doxapram). Estão na classe dos analépticos uma ampla variedade de medicamentos usados para tratar depressão, transtorno de déficit de atenção e hiperatividade (TDAH) e depressão respiratória. Em doses baixas, os analépticos também podem ser usados como convulsivos, fazendo com que os pacientes tenham maior consciência, inquietação e respiração rápida.[1] O uso primário dessas drogas é como uma ferramenta de recuperação anestésica ou para tratar a depressão respiratória em casos de emergência. [2] Outros medicamentos desta categoria são a pretcamida, o pentilenotetrazol e a nicetamida. A nicetamida foi descontinuada devido ao risco de convulsões. Analépticos têm sido usados recentemente para entender melhor o tratamento de uma overdose de barbitúricos. Por meio do uso desses agentes, os pesquisadores foram capazes de tratar a obtundação e a depressão respiratória.[3]
Uso médico[editar | editar código-fonte]

Analépticos têm sido usados ao longo da história para dois propósitos principais. O primeiro é ajudar os pacientes a se recuperarem da anestesia com mais eficiência. A outra finalidade é o manejo do desconforto respiratório e da apneia.
Recuperação da anestesia[editar | editar código-fonte]
Os analépticos podem ser usados para aumentar a velocidade de recuperação do propofol, remifentanil e sevoflurano. Em ambientes clínicos, analépticos como o doxapram têm sido usados para ajudar os pacientes a se recuperarem mais rapidamente de procedimentos que envolvem anestesia, bem como para remover alguns dos potenciais efeitos colaterais de anestésicos potentes.
Tratamento de dificuldade respiratória[editar | editar código-fonte]
Os três usos clínico analépticos mais prevalentes da cafeína são no tratamento da asma, apneia da prematuridade e displasia broncopulmonar em recém-nascidos.[4] A cafeína é um broncodilatador fraco, o que explica o alívio dos efeitos da asma. Há pesquisas preliminares que indicam que a cafeína reduz a incidência de paralisia cerebral e atraso cognitivo, mas pesquisas adicionais ainda são necessárias.[5] A apneia da prematuridade é descrita como a interrupção da respiração por mais de 15–20 segundos, geralmente acompanhada de bradicardia e hipóxia.[6] Essa interrupção da respiração se deve ao subdesenvolvimento do centro de controle respiratório do corpo, nesse caso, a medula oblonga em bebês prematuros.
Uma pesquisa sugere que a cafeína reduz significativamente a ocorrência de displasia broncopulmonar, que é uma doença pulmonar crônica definida pela necessidade de oxigênio suplementar após uma idade pós-menstrual de 36 semanas.[6] A displasia broncopulmonar é comum em bebês com baixo peso (menos de 2.5kg) ou muito baixo ao nascer (menos de 1.5kg) que receberam aparelhos de ventilação mecânica para ajudar a controlar a síndrome do desconforto respiratório. Atualmente, não existe tratamento para a displasia broncopulmonar, pois geralmente se considera que os riscos do tratamento superam a necessidade do uso de ventilador mecânico. A cafeína apenas reduz a ocorrência.
A teofilina não é mais usada como analéptico respiratório em recém-nascidos, pois possui um índice terapêutico muito estreito e suas dosagens devem ser supervisionadas por medição direta dos níveis séricos para evitar toxicidade.
Mecanismo de ação[editar | editar código-fonte]
Os analépticos são um grupo diversificado de medicamentos que atuam por meio de uma variedade de vias químicas; entretanto, existem quatro mecanismos principais através dos quais os medicamentos analépticos atuam para estimular a respiração. Os analépticos podem atuar como bloqueadores dos canais de potássio, ampaquinas e agonistas do receptor da serotonina e antagonismo da adenosina .
Dois bloqueadores dos canais de potássio comuns são o doxapram e o GAL-021. Ambos atuam nos canais de potássio nos corpos carotídeos. Essas células são responsáveis por detectar baixas concentrações de oxigênio e transmitir informações ao sistema nervoso central, levando a um aumento da respiração. O bloqueio dos canais de potássio nas membranas dessas células despolariza efetivamente o potencial de membrana, que por sua vez leva à liberação de neurotransmissores e abertura dos canais de cálcio dependentes de voltagem. Isso inicia o processo de retransmissão do sinal para o sistema nervoso central. O doxapram bloqueia os vazamento nos canais de potássio na família do domínio de poro Tandom, enquanto o GAL-021 bloqueia os canais BK, ou grandes canais de potássio, que são ativados por uma mudança no potencial eletrônico da membrana ou por um aumento no cálcio interno.[7]
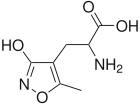
As ampaquinas são a segunda forma comum de analépticos com um mecanismo próprio de ação. Elas se ligam aos receptores AMPA, ou receptores amino-3-hidroxi-5-metil-D-aspartato, dentro do complexo pré-Bötzinger . O complexo pré-Bötzinger faz parte do grupo respiratório ventral e a indução de potenciais de longo prazo na fenda pós-sináptica desses neurônios leva a um aumento da frequência respiratória. O ligante endógeno do receptor AMPA é o glutamato e as ampaquinas estimulam a interação do glutamato com os receptores. A ação do ligante faz com que os receptores AMPA se abram e permitam que os íons de sódio fluam para a célula, levando à despolarização e à transdução de sinal. No momento, o CX717 é a ampaquina mais bem-sucedida em testes em humanos e tem poucos efeitos colaterais.[7]
O terceiro mecanismo comum do qual os analépticos tiram vantagem é agir como agonistas do receptor da serotonina. Buspirona e Mosaprida aumentaram com sucesso a respiração em animais ligando-se a receptores de serotonina que sãoacoplados à proteína G que, após a ativação, induzem uma cascata secundária de mensageiros, levando assim a uma resposta analéptica.[7]
Com relação à respiração, a cafeína atua como um antagonista competitivo da adenosina. Os pesquisadores descobriram isso ao administrar adenosina ou seus derivados e observarem que os efeitos eram opostos aos da cafeína. Níveis aumentados de adenosina são conhecidos por causar depressão da atividade elétrica espontânea dos neurônios, inibição da neurotransmissão e diminuição da liberação de neurotransmissores. A adenosina inibe o impulso respiratório ao bloquear a atividade elétrica dos neurônios respiratórios [8] A cafeína, como um antagonista da adenosina, estimula esses neurônios respiratórios, aumentando o volume minuto (VM) da frequência respiratória (FR).
Doxapram[editar | editar código-fonte]
O doxapram é um estimulante respiratório do SNC, normalmente usado para tratar a depressão respiratória causada por anestesia ou doença pulmonar obstrutiva crônica. O doxapram também pode ser usado como tratamento para a apeia neonatal, mas os riscos são moderados e, portanto, deve-se ter cuidado. Doxapram tem sido usado para tratar a depressão respiratória em overdoses de medicamentos; no entanto, não é eficaz contra vários fármacos. Os efeitos colaterais do Doxapram são raros e mais comuns quando há sobredosagem. Foram observados hipertensão, taquicardia, tremores, espasticidade e reflexos hiperativos.[9]
Metilxantinas cafeína e teofilina[editar | editar código-fonte]

Os compostos de ocorrência natural cafeína e teofilina são estruturalmente classificados como xantinas metiladas. Os efeitos colaterais observados com o uso de xantinas incluem nervosismo, comportamento superenergético e insônia. Os efeitos colaterais menos comuns podem incluir diurese, irritação gastrointestinal e, raramente, zumbido nos ouvidos. Em altas doses também podem causar dependência psicológica.[9]
História[editar | editar código-fonte]
Após sua introdução no início do século 20, os analépticos foram usados para estudar a overdose de barbitúricos. Antes da década de 1930, estimulantes naturais, como a cânfora e cafeína, foram utilizados no tratamento da overdose de barbitúricos. Entre 1930 e 1960, analépticos sintéticos, como nicetamida, pentilenotetrazol, bemegrida, anfetamina e metilfenidato substituíram os compostos de ocorrência natural no tratamento da overdose de barbitúricos. Recentemente, os analépticos foram direcionados ao tratamento do TDAH devido a existência de formas mais eficientes de tratar as overdoses de barbitúricos.[10]
Um dos primeiros analépticos amplamente usados foi a estricnina, que causa excitação do SNC por antagonizar o neurotransmissor inibitório glicina.[1] A estricnina é subcategorizada como um convulsivo junto com a picrotoxina e a bicuculina, embora esses convulsivos inibam os receptores GABA em vez da glicina. A estricnina foi usada até o início do século 20, quando foi descoberto que era um convulsivo altamente tóxico. A estricnina agora está disponível como rodenticida e também como adulterante em drogas como a heroína. Os outros dois convulsivos, picrotoxina e bicuculina, antagonizam os receptores GABA, mas nenhum deles é comumente usado hoje.
O uso de doxapram em humanos começou a se tornar obsoleto, embora este seja um estimulante eficaz. O uso diminuiu principalmente porque os agentes anestésicos de menor duração se tornaram mais abundantes, mas também porque algumas pesquisas mostraram potenciais efeitos colaterais em bebês.[2][11] Alguns estudos em bebês prematuros descobriram que o doxapram causa diminuição do fluxo sanguíneo cerebral e aumenta a necessidade de oxigênio. Isso resulta em maiores chances de desenvolver atrasos mentais do que as crianças não tratadas com a droga.
Ver também[editar | editar código-fonte]
Referências
- ↑ a b «Central nervous system stimulants: basic pharmacology and relevance to anaesthesia and critical care». Anaesthesia & Intensive Care Medicine. 16: 21–25. doi:10.1016/j.mpaic.2014.10.005
- ↑ a b «Doxapram». Journal of Exotic Pet Medicine. 20: 237–240. doi:10.1053/j.jepm.2011.04.011
- ↑ «Effect of flumazenil on recovery from anesthesia and the bispectral index after sevoflurane/fentanyl general anesthesia in unpremedicated patients». Korean Journal of Anesthesiology. 62: 19–23. 2012. PMC 3272523
 . PMID 22323949. doi:10.4097/kjae.2012.62.1.19
. PMID 22323949. doi:10.4097/kjae.2012.62.1.19
- ↑ «Caffeine and the central nervous system:mechanisms of action, biochemical, metabolic and psychostimulant effects». Brain Research Reviews. 17: 139–170. PMID 1356551. doi:10.1016/0165-0173(92)90012-b
- ↑ «Long-Term Effects of Caffeine Therapy for Apnea of Prematurity». New England Journal of Medicine. 357: 1893–1902. PMID 17989382. doi:10.1056/nejmoa073679
- ↑ a b «Caffeine Therapy for Apnea of Prematurity». New England Journal of Medicine. 354: 2112–2121. PMID 16707748. doi:10.1056/nejmoa054065
- ↑ a b c «Opioid-induced respiratory depression reversal by non-opioid drugs». F1000Prime Reports. 6. 79 páginas. PMC 4173639
 . PMID 25343036. doi:10.12703/P6-79
. PMID 25343036. doi:10.12703/P6-79
- ↑ «Caffeine and the central nervous system: mechanisms of action, biochemical, metabolic and psychostimulant effects». Brain Research Reviews. 17: 139–170. PMID 1356551. doi:10.1016/0165-0173(92)90012-b
- ↑ a b Kee, Joyce L.; Hayes, Evelyn; McCuistion, Linda E. (2012). Pharmacology : a nursing process approach. Elsevier Saunders 7th ed. St. Louis, MO.: [s.n.] pp. 289–291. ISBN 978-1437717112
- ↑ «Analeptic use in clinical toxicology: A historical appraisal». Journal of Toxicology. Clinical Toxicology. 35: 203–9. 1997. PMID 9120893. doi:10.3109/15563659709001195
- ↑ «Respiratory stimulant drugs in the post-operative setting». Respiratory Physiology & Neurobiology. 189: 395–402. PMID 23791825. doi:10.1016/j.resp.2013.06.010
