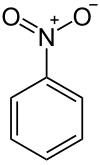
Nitrobenzeno
Nitrobenzeno, também conhecido como nitrobenzol ou óleo de mirbano, é um composto orgânico venenoso com um odor de amêndoas e fórmula química C6H5NO2. Este líquido oleoso insolúvel em água é normalmente produzido como um precursor para a anilina, mas em laboratório, é usado como um solvente e como um agente oxidante moderado.[carece de fontes]
Usos[editar | editar código-fonte]
Aproximadamente 98% do nitrobenzeno é consumido na produção de anilina.[1] Aplicações mais especializadas incluem química da borracha, pesticidas, corantes, e fármacos. O nitrobenzeno é também usado em polidores de sapatos e pisos, roupas de couro, solventes para tintas, e outros materiais para mascarar odores desagradáveis. Reações de substituição com nitrobenzeno são usadas para formar m-derivados (meta-derivados) (Mannsville 1991; Sittig 1991). Redestilado, como óleo de mirbano, nitrobenzeno tem sido usado como um aromatizante barato para sabões e sabonetes. Um significativo mercado para o nitrobenzeno é seu uso na produção do analgésico paracetamol (também conhecido como acetaminofeno) (Mannsville 1991). O nitrobenzeno é também usado na célula de Kerr, visto ter uma incomum constante de Kerr alta.
O nitrobenzeno é facilmente convertido em derivados relacionados tais como o azobenzeno,[2] nitrosobenzeno,[3] fenilidroxilamina.[4]
Produção[editar | editar código-fonte]
O nitrobenzeno é preparado por nitração de benzeno. O método clássico envolve o tratamento de benzeno com uma mistura de ácido sulfúrico e ácido nítrico concentrados (chamada de "mistura sulfonítrica") e água. Esta produção é um dos mais perigosos processos da indústria química devido à exotermicidade da reação (ΔH = −117 kJ/mol).[1]
A capacidade mundial de produção de nitrobenzeno em 1985 era de aproximadamente 1.7×106 toneladas.[1]
Mecanismo da reação[editar | editar código-fonte]
A marcha da reação envolve a formação de um aduto entre o íon nitrônio, ácido de Lewis, NO2+, e o areno. O íon nitrônio é gerado in situ via a reação com ácido nítrico e um agente desidratante ácido, no caso o próprio ácido sulfúrico:
- HNO3 + H+ ⇌ NO2+ + H2O
Em mais detalhes, os passos desta reação:
1.Ocorre a protonação do ácido nítrico, em reação com o ácido sulfúrico:
2.Forma-se o cátion nitrônio:
3.O nitrônio atua sobre o anel benzênico, a nitração propriamente dita, com a liberação de um novo íon hidrogênio.
Este íon hidrogênio é o próton relacionado ao ânion sulfato, resultando novamente em ácido sulfúrico no meio reagente.
Este conjunto de passos, que é a mais simples das nitrações de aromáticos, é o mecanismo e o processo fundamental de nitração de inúmeros outros aromáticos, como por exemplo, do tolueno para obter-se o nitrotolueno, os dinitrotoluenos e o trinitrotolueno, ou do fenol para obter-se o ácido pícrico.
Características[editar | editar código-fonte]
Características físicas[editar | editar código-fonte]
O nitrobenzeno é, normalmente, um líquido incolor, excetuando-se quando contaminado (por ocasião de sua preparação por nitração em meio líquido, como visto acima, apresenta-se amarelado, como muitos outros aromáticos após a nitração e antes de sua purificação). Tem odor de amêndoas amargas (como o "marzipan"), com uma nota de aroma penetrante facilmente notável, e numa solução aquosa, tal aroma torna-se agradável. É tóxico e inflamável. Nitrobenzeno apresenta um alto índice de refração. Sob condições normais tem uma densidade de 1,20 g/cm 3, funde-se a 5,7 °C e ebule a 210,85 °C; tem ponto de ignição de 88 °C. Nitrobenzeno é solúvel apenas muito levemente em água, mas mistura-se facilmente com álcoois, éter e benzeno, assim como com outros solventes aromáticos. No ácido sulfúrico o nitrobenzeno separa-se primeiramente mal, começando de uma concentração de 80 % entretanto completamente. A solubilidade é um pouco dependente da temperatura.
Características químicas[editar | editar código-fonte]
O grupo nitro é repulsivo aos ácidos, aos reagentes eletrófilos e inerte à maioria dos agentes oxidantes. Reage entretanto com reagentes de Grignard e as bases fortes. Pelos fortes efeitos -I e -M do grupo nitro é reduzida fortemente a densidade de elétrons do anel aromático, o que faz mais difíceis as substituições eletrófilas aromáticas, mas favorece as nucleófilas.
Toxicocinética:[editar | editar código-fonte]
São duas as principais vias de absorção do nitrobenzeno: vias respiratórias e dérmicas. A substância se acumula no organismo quando há exposição repetidas vezes e possui uma meia-vida biológica de 86 horas em exposições agudas ou subcrônicas.
Os produtos de biotransformação são excretados pela urina como conjugados glicuronídeos, sulfatos e mercapturatos.
Existem relatos de intoxicação acidental e morte por ingestão da substância. O contato direto com pequena quantidade da substância pode irritar a pele e olhos. A exposição crônica ao nitrobenzeno também resulta em metemoglobinemia.
Toxicidade:[editar | editar código-fonte]
Exposições a concentrações de 15 a 30mg/L provocam metemoglobinemia em seres humanos, sendo que se forem prolongadas podem provocar danos hepáticos.
Outros sintomas associados à exposição são:
- Vertigens,
- Cefaleia;
- Hepatomegalia;
- Irritação ocular;
- Dermatite de contato.
Em comparação com a anilina, o nitrobenzeno é considerado mais potente para produzir anemia e metemoglobinemia.
Avaliação Biológica da Exposição Ocupacional:[editar | editar código-fonte]
A avaliação biológica da exposição ocupacional é realizada através de Indicadores Biológicos de Exposição (IBEs). Os IBEs podem ser os níveis de agentes químicos ou de seus produtos de biotransformação (metabólitos) em fluidos biológicos, ou um efeito associado com a exposição ao agente, cuja determinação, seguida da comparação da medida com os Limites Biológicos de Exposição (LBE), permita avaliar a exposição e/ou o risco à saúde dela decorrente. No caso do nitrobenzeno temos o indicador biológico como sendo a urina e o máximo permitido sendo 5mg/g de creatinina.
Comportamento no ambiente:[editar | editar código-fonte]
O nitrobenzeno está sujeito a biodegradação quando exposto ao solo, ou seja, como ele não adere bem ao solo acaba sendo lixiviado para águas subterrâneas. Seu tempo de meia vida em relação a exposições ao ar é de 90 com radicais hidroxila e 2 anos com ozônio. Quando exposto ao ar, o nitrobenzeno pode evaporar e se degradar em outras substâncias químicas. Além de poder reagir com ozônio e radicais hidroxila.
Referências[editar | editar código-fonte]
- ↑ a b c Gerald Booth "Nitro Compounds, Aromatic" in "Ullmann's Encyclopedia of Industrial Chemistry" 2007; John Wiley & Sons: New York.
- ↑ Bigelow, H. E.; Robinson, D. B. (1955). «Azobenzene». Org. Synth.; Coll. Vol., 3
- ↑ G. H. Coleman, C. M. McCloskey, F. A. Stuart. «Nitrosobenzene». Org. Synth.; Coll. Vol., 3
- ↑ O. Kamm. «Β-Phenylhydroxylamine». Org. Synth.; Coll. Vol., 1
Ligações externas[editar | editar código-fonte]
- Reações dos compostos aromáticos, incluindo a sua nitração
- International Chemical Safety Card 0065
- NIOSH Pocket Guide to Chemical Hazards
- IARC Monograph: "Nitrobenzene"
- US EPA factsheet
- Nitrobenzeno-Guidechem.com