Fluoresceína
| Fluoresceína Alerta sobre risco à saúde | |
|---|---|
| |

| |
| Outros nomes | Fluoresceína, resorcinolftaleína, C.I. 45350, amarelo solvente 94, D & C amarelo no. 7, angiofluor, Amarelo Japan 201, amarelo sabão, Pyoverdin |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| MeSH | |
| SMILES |
|
| Propriedades | |
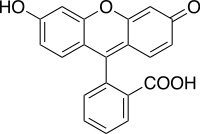
| Fórmula molecular | C20H12O5 |
| Massa molar | 332.306 g/mol |
| Ponto de fusão |
314 - 316 °C |
| Solubilidade em água | levemente solúvel |
| Riscos associados | |
| Frases S | S26 S36 |
| Compostos relacionados | |
| Compostos relacionados | Isotiocianato de fluoresceína Eritrosina (tetraiodado, e com sódio substituindo os dois hidrogênios ácidos, do grupo fenol e da carboxila) NHS-fluoresceína (N-hidróxi-succinimidil éster) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
A fluoresceína é um composto orgânico sintético, um xanteno, uma classe de compostos largamente utilizados como corantes. Apresentando-se normalmente no comércio como um pó vermelho ou laranja escuro, levemente solúvel em água e álcool. Foi sintetizada pela primeira vez pelo químico alemão Johann Friedrich Adolf von Bayer. Ela recebeu este nome em função da coloração fluorescente amarelo-esverdeada que apresenta em solução alcalina, também conhecida como uranina. É largamente usado como um fluorescente traçador de fluxo para muitas aplicações.
Fluoresceína é um fluoróforo comumente usado em microscopia, em um tipo de corante laser como o meio de ganho, em medicina forense e sorologia para detectar manchas de sangue latentes, e como corante traçante. Tem uma absorção máxima em 494 nm e emissão máxima de 521 nm (em água). Os principais derivados são o isotiocianato de fluoresceina (FITC, de fluorescein isothiocyanate) e, em síntese de oligonucleotídeos, a 6-FAM fosforamidita (de fluorescein amidite).
Fluoresceína também tem um ponto isosbéstico (absorção igual para todos os valores de pH) em 460 nm. Também é conhecida como um aditivo de cor (D&C Amarelo no. 7). A forma de sal dissódico da fluoresceína é também conhecida como uranina ou D&C Amarelo no. 8.
A cor da sua solução aquosa varia de verde a laranja em função da forma como é observada: por reflexão ou por transmissão, como pode ser notado no líquido de níveis de bolha, por exemplo; no qual a fluoresceína é adicionada como um corante ao álcool de preenchimento do tubo, a fim de aumentar a visibilidade da bolha de ar contida dentro (aumentando assim a precisão do instrumento). Soluções mais concentradas de fluoresceína pode até mostrarem-se vermelhas.
Propriedades[editar | editar código-fonte]

Seu ponto de fusão é de 314-316°C. Apresenta-se como sólido alaranjado escuro. Mesmo na forma sódica é apenas levemente solúvel em água. Solúvel em álcool.
A fluorescência desta molécula é muito alta, sua excitação ocorre a 494 nm e a emissão a 521 nm.
Fluoresceína tem uma pKa de 6,4 e seu equilíbrio de ionização conduz a absorção e emissão dependente do pH na faixa de 5 a 9. Assim, os tempos de vida das formas protonadas e deprotonadas fluorescentes são aproximadamente 3 e 4 ns, as quais permitem a determinação do pH de medidas não intensamente básicas. Os tempos de vida podem ser recuperados usando contagem de fótons isolados ou por fluorometria de modulação de fases.
Acrescentada em ácido sulfúrico concentrado e depois a solução sendo diluída em água apresenta fluorescência amarela, que irá com mais diluoção produzir precipitação amarelo. Em solução aquosa de hidróxido de sódio apresenta fluorescência verde escura e solução acastanhada.[1]
Síntese[editar | editar código-fonte]
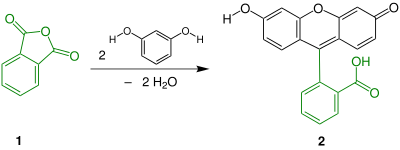
A fluoresceína é sintetizada pela reação de condensação entre anidrido ftálico e resorcinol, em presença de cloreto de zinco ou ácido sulfúrico concentrado, que atuam como agentes desidratantes, via a reação de Friedel-Crafts ou ainda pelo ácido metanossulfônico como ácido de Lewis e catalisador.[2] Esta rota tem um alto rendimento em condições mais brandas.[3][4][1]
Esta síntese pode ser usada numa identificação qualitativa entre fenol e resorcinol. Após a condensação do fenol em teste com o anidrido ftálico, a posterior reação com solução hidróxido de sódio dará cor rosa para fenolftaleína (portanto fenol) e forte fluorescência verde, para fluoresceína (portanto resorcinol).[5]
Utilização[editar | editar código-fonte]
Coloração de produtos de limpeza[editar | editar código-fonte]
A fluoresceína, especialmente na forma de seu sal sódico, a uranina, é comumente usada como corante de desinfetantes, especialmente os contendo óleo de pinho e eucalipto, dissolvidos com a ajuda de ricinoleato de sódio como surfactante.
Química analítica[editar | editar código-fonte]
A fluoresceína é largamente utilizada na determinação de bromo e iodo, formando os compostos: eosina (coloração rosa) e eritrosina (coloração rosa-arroxeado), respectivamente.
Tingimento[editar | editar código-fonte]
A eosina é utilizada para tingir lã e seda, cosméticos, tintas e papéis.
Coloração em microscopia[editar | editar código-fonte]
Entre seus derivados, a eosina, é usada como um "corante microscópico", colorindo um grupo de leucócitos existentes no sangue, os eosinófilos. A eritrosina, tem amplo uso na coloração de alimentos e em dentifrícios indicadores de placa bacteriana.
Piscicultura[editar | editar código-fonte]
Tem-se desenvolvido metodologias de detecção na pele de peixes usando a fluoresceína.[6]
Pesquisa bioquímica[editar | editar código-fonte]
Em biologia celular, o derivado isotiocianato de fluoresceína é muitas vezes usado para rotular e acompanhar células em aplicações de microscopia de fluorescência (por exemplo, na citometria de fluxo).[7] Moléculas biologicamente ativas adicionais (tais como anticorpos) podem também ser ligadas à fluoresceína, permitindo que os biólogos direcionem o fluoróforo à proteínas ou estruturas específicas dentro das células. Esta aplicação é comum em exposição de levedura.[8]
A fluoresceína pode ser usada para detectar radicais peroxil, em citometria de fluxo dentre os radicais livres gerados nas membranas celulares durante a peroxidação lipídica.[9]
Fluoresceína também pode ser conjugado a trifosfatos de nucleósidos e incorporadas para sondar enzimaticamente hibridação in situ. O uso de amidita de fluoresceína mostrado acima permite sintetizar rotulados Oligonucleotídeos para o mesmo fim. Ainda outra técnica denominada balizas moleculares faz uso de oligonucleotídeos sintéticos marcados com fluoresceína. Sondas marcadas com fluoresceína podem ser fotografadas usando FISH, ou alvo de anticorpos com imunohistoquímica. O último é uma alternativa comum a digoxigenina, e os dois são usados em conjunto para a marcação de dois genes em uma amostra.[10]
Aplicações em saúde[editar | editar código-fonte]
Oftalmologia[editar | editar código-fonte]

"Fluoresceína de sódio", o sal de sódio da fluoresceina, é amplamente utilizado como uma ferramenta de diagnóstico na área de oftalmologia e optometria, fluoresceína tópica é aplicada topicamente na forma de uma gota no olho, conjuntamente rosa bengala e verde S, para diagnosticar várias desordens da superfície do olho, como abrasão da córnea, úlcera de córnea e infecção herpética da córnea.[11]
Também é utilizado em montagem de lentes de contatos rígidas gás-permeáveis (RGP) para avaliar a camada de lágrima sob a lente. Ela é disponível como sachês estéreis de uso único contendo aplicadores de papel sem fiapos umedecidos em fluoresceína de sódio.[12][13][14]
Em 2006, o FDA (Food and Drug Administration) dos EUA reviu e aprovou Fluorescite, uma droga de diagnóstico contendo fluoresceína de sódio destinada a exames de retina ou íris.[15][16]
Angiografia[editar | editar código-fonte]
É ministrada oralmente ou injetada intravenosamente para produzir um angiograma de fluoresceína (angiofluoresceinografia) na pesquisa e para diagnosticar e categorizar disordens vasculares em, e.g., pernas, incluindo a doença retinal degeneração macular, retinopatia diabética, condições inflamatórias intraoculares e tumores intraoculares, e, crescentemente, durante cirurgias de tumores cerebrais..[17]
Resgates aéreos e no mar[editar | editar código-fonte]

Durante a 2a Guerra Mundial, tripulações aéreo alemãs transportavam pequenos recipientes de fluoresceína. No caso de pouso com para-quedas no mar depois de serem derrubados, o corante seria lançado na água. Isso produzia uma marcação vívida, podendo ser avistada do ar ao longo de grandes distâncias e ajudando o salvamento ar-mar da tripulação abatida.[18] Esse procedimento foi mais tarde adotado por outras forças aéreas e forças armadas.[19]
Usos em sistemas fluviais e na detecção de fluxos de água[editar | editar código-fonte]
É utilizada pela sua coloração com forte fluorescência mesmo em grandes diluições em água para traceamento (a verificação do curso, trajeto) de tubulações e tanques, tanto de água tratada, quanto de esgoto, para detecção de vazamentos, pela forte fluorescência que apresenta, mesmo em soluções muito diluídas.
Um de seus usos mais reconhecíveis foi no rio Chicago, onde fluoresceína foi a primeira substância utilizada para tingir o rio de verde no Dia de São Patrício em 1962. Em 1966, os ambientalistas forçaram uma mudança para um corante à base de vegetais para proteger a vida selvagem local.[20][21]

Outros usos incluem o uso de fluoresceína-lo como um corante solúvel em água adicionada a água de chuva em simulações de testes ambientais para ajudar a localizar e analisar eventuais vazamentos de água, e na Austrália e Nova Zelândia como um corante para álcool desnaturado.[22][23]
Aplicação na indústria de petróleo e gás natural[editar | editar código-fonte]
As soluções corantes de fluoresceína, tipicamente 15% ativas, são comumente usadas como um auxílio para a detecção de vazamentos durante testes hidrostáticos de dutos de petróleo e gás natural submarinos e outras infra-estruturas submarinas. As fugas podem ser detectadas por mergulhadores que transportam luzes ultravioletas.
Derivados[editar | editar código-fonte]
Há muitos derivados de fluoresceína, por exemplo o Isotiocianato de fluoresceína, frequentemente abreviado como FITC. FITC é a molécula fluoresceína original acrescida com um grupo funcional isotiocianato (-N=C=S), substituindo um átomo de hidrogênio no anel mais baixo da estrutura. Este derivado é um reativo para grupos amina (aminas primárias) de compostos biologicamente relevantes incluindo proteínas intracelulares formando uma ligação tioureia. Um grupo funcional succinimidil-éster ligado ao núcleo fluoresceína, criando NHS-fluoresceína, forma outro derivado amina-reativo comum, rendendo adutos amida mais estáveis. Ésteres pentafluorofenilo (PFP, de pentafluorophenyl) e ésteres tetrafluofenil (TFP, de tetrafluorophenyl) são outros reagentes úteis. Em síntese de oligonucleotídeo, vários reagentes fosforamidite contém fluoresceína protegida, e.g. 6-FAM fosforamidite 2,[24] são largamente usados para a preparação de oligonucleotídeos marcados com fluoresceína.

Outros derivados da fluoresceína incluem verde Oregon, verde Tokyo, SNAFL, e carboxinaftofluoresceína. Estes derivados, junto com mais recentes fluorados como Alexa 488 e DyLight 488, tem sido referenciados para várias aplicações químicas e biológicas de mais alta fotoestabilidade, diferentes características espectrais, ou diferentes grupos ligados são necessários.
Entre estas aplicações, estão a síntese de nucleotídeos "marcados" pelo acoplamento químico de alilamina-dUTP a derivados de succinimidil-éster de corantes derivados da fluoresceína ou haptenos (biotina, digoxigenina, dinitrofenil, com bons resultados para o 2,4-dinitrofenil), os quais requerem anticorpos marcados com fluorescência ou proteínas específicas para visualização e detecção. São incluidos também entre os produtos disponíveis um 'espaçador" (normalmente de comprimento de 5 a 16 átomos de carbono) entre o corante e o nucleotídeo, o qual melhora a incorporação enzimática de nucleotídeos modificados.
Para esta aplicação específica, tem sido testados os corantes fluorescentes: amino-metil cumarina (AMCA); dietil-aminometil-cumarina (DEAC); azul cascade (Cascade Blue, CB); o derivado de fluoresceína isotiocianato de fluoresceína (FITC); o verde Oregon (OG); o Alexa 488 (A488); o verde rodamina (RGr); a carboxi-rodamina 6G (R6G); a tetrametil-rodamina (TAMRA); o vermelho Texas (TxR); Cy3; Cy3.5; Cy5, Cy5.5 e a também derivada da fluoresceína carboxinaftofluoresceína (CNF) e seu derivado diacetato.[25][26] Estes corantes são normalmente disponibilizados para este fim dissolvidos em DMSO, mas alguns são solúveis em água, como o azul cacade e o derivado succinimidil-éster da Alexa 488.[27]
Cuidados[editar | editar código-fonte]
Uso tópico, oral e intravenoso de fluoresceína pode causar reações adversas. O uso intravenoso tem documentado algumas reações adversas incluindo náusea, vômito, anafilaxia e (raramente) morte.[28]
Estudos de toxicidade[editar | editar código-fonte]
A toxicidade da fluoresceína, em seu derivado isotiocianato, é estudada em sua aplicação como um marcador em RFG (ritmo de filtração glomerular), relacionado a determinações das funções renais.[29]
Para determinados usos, em exames in vivo do miocárdio, as dosagens aplicadas em soluções de fluoresceína não se mostram significativamente tóxicas.[30]
Estudos de toxicidade da fluoresceína em peixes (Scophthalmus maximus) tem sido realizados, com resultados de LC50 de 997.1 +/- 11.4 mg/L, após períodos de exposição de 24, 48 ou 96 horas.[31]
As toxicidades da fluoresceína e da floxina B são estudadas para Daphnia pulex, com resultados de LC50 de 337 (278-403) mg/L.[32]
Referências
- ↑ a b Acid Yellow 73 - www.worlddyevariety.com
- ↑ Arthur I. Vogel- Química orgânica qualitativa 3vol- Ao Livro Técnico 1971.
- ↑ Sun, W. C.; Gee, K. R.; Klaubert, D. H.; Haugland, R. P., Synthesis of Fluorinated Fluoresceins. Journal of Organic Chemistry 1997, 62, (19), 6469-6475.
- ↑ Burgess, Kevin; Ueno, Yuichiro; Jiao, Guan-Sheng (2004). «Preparation of 5- and 6-Carboxyfluorescein». Synthesis. 2004 (15): 2591–2593. doi:10.1055/s-2004-829194
- ↑ V.K. Ahluwalia, S. Dhingra; Comprehensive Practical Organic Chemistry: Qualitative Analysis; Universities Press, 2004. - pg 24
- ↑ E. J. NOGA AND P. UDOMKUSONSRI; Fluorescein: A Rapid, Sensitive, Nonlethal Method for Detecting Skin Ulceration in Fish Arquivado em 28 de setembro de 2007, no Wayback Machine. Vet Pathol 39:726–731 (2002) - www.vetpathology.org (em inglês)
- ↑ M. G. Ormerod; Flow Cytometry: A Practical Approach; OUP Oxford, 2000. - pg. 26
- ↑ Benny K. C. Lo; Antibody Engineering: Methods and Protocols; Springer Science & Business Media, 2004. - pg. 552
- ↑ Makrigiorgos GM, Kassis AI, Mahmood A, Bump EA, Savvides P.; Novel fluorescein-based flow-cytometric method for detection of lipid peroxidation. Free Radic Biol Med. 1997;22(1-2):93-100.
- ↑ Noga E. J., Udomkusonsri, P. (2002). «Fluorescein: A Rapid, Sensitive, Nonlethal Method for Detecting Skin Ulceration in Fish» (PDF). Vet Pathol. 39 (6): 726–731(6). PMID 12450204. doi:10.1354/vp.39-6-726. Consultado em 16 de julho de 2007. Arquivado do original (PDF) em 28 de setembro de 2007
- ↑ Korb DR, Herman JP, Finnemore VM, Exford JM, Blackie CA; An evaluation of the efficacy of fluorescein, rose bengal, lissamine green, and a new dye mixture for ocular surface staining. Eye Contact Lens. 2008 Jan;34(1):61-4. doi: 10.1097/ICL.0b013e31811ead93.
- ↑ «New Drugs». Can Med Assoc J. 80 (12): 997–998. 1959. PMC 1831125
 . PMID 20325960
. PMID 20325960
- ↑ James S. Wolffsohn, Ali Tharoo, Nikita Lakhlani; Optimal time following fluorescein instillation to evaluate rigid gas permeable contact lens fit; Contact Lens and Anterior Eye , Volume 38 , Issue 2 , 110 - 114.
- ↑ Lin MC, Graham AD, Fusaro RE, Polse KA. Impact of rigid gas-permeable contact lens extended wear on corneal epithelial barrier function. Invest Ophthalmol Vis Sci. 2002 Apr;43(4):1019-24.
- ↑ Fluorescite injection - www.drugs.com
- ↑ Schatz, Burton, Yannuzzi, Rabb. Interpretation of Fundus Fluorescein Angiography, Page 38, C. V. Mosby Co., St. Louis, 1978.
- ↑ Berkow JW, Flower RW, Orth DH, Kelley JS. Fluorescein and indocyanine green angiography: techniques and interpretation. 2nd ed. San Francisco: The Foundation of the American Academy of Ophthalmology; 1997.
- ↑ Tilford, Earl H., Jr. Search and rescue in Southeast Asia, pp. 4–8. Center for Air Force History. DIANE Publishing, 1992. ISBN 1-4289-9284-7
- ↑ Operators Manual: Aircrew Survival Armor Recovery Vest, Insert, and Packets (SARVIP); DIANE Publishing.
- ↑ Luke LeNoble; Chicago Municipal Workers Brace For St. Patrick’s Day - www.mswmag.com
- ↑ Jimmy Stamp; A New Meaning to Green Urban Design: Dyeing the Chicago River - www.smithsonianmag.com
- ↑ Ohio Department of Health - Bureau of Local Environmental Health Services, May, 2000 - Dye Testing Wells - www.belmontcountyhealth.org
- ↑ Reasons for scheduling delegate's interim decision and invitation for further comment for the ACCS and the Joint ACCS-ACMS, June 2014 - www.tga.gov.au
- ↑ Brush, C. K. Fluorescein Labelled Phosphoramidites. US Patent 5,583,236. [1]
- ↑ Xiao-Qi WANG, Xiu-Mei DUAN, Li-Hua LIU, Yan-Qiu FANG, Yan TAN; Carboxyfluorescein Diacetate Succinimidyl Ester Fluorescent Dye for Cell Labeling[ligação inativa]; Acta Biochimica et Biophysica Sinica; Volume 37 Issue 6, Pages 379 - 385; 17 Jun 2005; DOI 10.1111/j.1745-7270.2005.00051.x
- ↑ Justine Mintern, Ming Li, Gayle M Davey, Effrossini Blanas, Christian Kurts, Francis R Carbone and William R Heath; The use of carboxyfluorescein diacetate succinimidyl ester to determine the site, duration and cell type responsible for antigen presentation in vivo; Immunology and Cell Biology (1999) 77, 539–543; doi:10.1046/j.1440-1711.1999.00868.x
- ↑ Custom fluorescent nucleotide synthesis/nucleic acid labeling - www.med.yale.edu (em inglês)
- ↑ The Diagnosis and Management of Anaphylaxis - XXI. Anaphylactoid reactions to fluorescein. J Allergy Clin Immunol 1998;101:S465-528. Free full text; ver também The diagnosis and management of anaphylaxis: an updated practice parameter. Arquivado em 5 de agosto de 2007, no Wayback Machine. do National Guideline Clearinghouse.
- ↑ PILL Johannes ; ISSAEVA Oxana ; WODERER Stefanie ; SADICK Maliha ; KRÄNZLIN Bettina ; FIEDLER Fritz ; KLÖTZER Hans-Martin ; KRÄMER Uwe ; GRETZ Norbert; Pharmacological profile and toxicity of fluorescein-labelled sinistrin, a novel marker for GFR measurements; Naunyn-Schmiedeberg's archives of pharmacology; 2006, vol. 373, no3, pp. 204-211; ISSN 0028-1298 - cat.inist.fr (em inglês)
- ↑ S. Subramanian, R. M. Wellings; In vivo and in vitro staining of the myocardium with fluorescein[ligação inativa]; British Journal of Surgery; Volume 51 Issue 6, Pages 430 - 432 - www3.interscience.wiley.com (em inglês)
- ↑ Pouliquen H, Algoet M, Buchet V, Le Bris H.; Acute toxicity of fluorescein to turbot (Scophthalmus maximus).; Vet. Hum. Toxicol. 1995 Dec;37(6):527-9. - www.ncbi.nlm.nih.gov (em inglês)
- ↑ WALTHALL W. K., STARK J. D.; The acute and chronic toxicity of two xanthene dyes, fluorescein sodium salt and phloxine B, to Daphnia pulex Environmental pollution; 1999, vol. 104, no2, pp. 207-215 (38 ref.) ISSN 0269-7491 - cat.inist.fr {en}
Ver também[editar | editar código-fonte]
- Corantes derivados da fluoresceína:
- Eosina
- Eritrosina
- Mercurocromo ou merbromina
- Pseudomonas aeruginosa, uma bactéria que secreta fluoresceína.
- Hidrólise de diacetado de fluoresceína, um teste bioquímico de laboratório.

