Enzalutamida: diferenças entre revisões
m |
|||
| Linha 99: | Linha 99: | ||
A enzalutamida atua como um [[Antagonista (farmacologia)|antagonista]] silencioso de alta seletividade do receptor de andrógeno (RA), o alvo biológico dos fármacos [[andrógeno]]s – como a [[testosterona]] e a [[Di-hidrotestosterona|diidrotestosterona]]. Ao contrário da [[bicalutamida]], fármaco de primeira geração, a enzalutamida não promove a translocação do receptor de andrógeno para o [[Núcleo celular|núcleo ceilular]] e, além disso, inibe a ligação do receptor de andrógeno ao [[ácido desoxirribonucleico]] (DNA) e às [[proteína]]s co-ativadoras.<ref name="pmid19359544">{{Citar periódico |titulo=Development of a second-generation antiandrogen for treatment of advanced prostate cancer |data=maio de 2009 |número=5928 |paginas=787–90 |bibcode=2009Sci...324..787T |doi=10.1126/science.1168175 |pmc=2981508 |pmid=19359544 |vauthors=Tran C, Ouk S, Clegg NJ, Chen Y, Watson PA, Arora V, Wongvipat J, Smith-Jones PM, Yoo D, Kwon A, Wasielewska T, Welsbie D, Chen CD, Higano CS, Beer TM, Hung DT, Scher HI, Jung ME, Sawyers CL |volume=324 |periódico=Science}}</ref> Desse modo, a enzalutamida atua como um inibidor de sinalização do AR, bem como um antagonista.<ref name="pmid24076589">{{Citar periódico |titulo=Enzalutamide: The emperor of all anti-androgens |data=junho de 2013 |número=2 |paginas=119–120 |doi=10.3978/j.issn.2223-4683.2012.09.04 |pmc=3785324 |pmid=24076589 |vauthors=Antonarakis ES |volume=2 |periódico=Translational Andrology and Urology}}</ref> A droga tem afinidade duas vezes menor para o AR do que a [[di-hidrotestosterona]] (DHT), o ligante endógeno do AR na próstata.<ref name="LiJohnson2015">{{Citar livro|título=Innovative Drug Synthesis|ultimo=Li|primeiro=Jie Jack|ultimo2=Johnson|primeiro2=Douglas S.|data=14 de dezembro de 2015|editora=John Wiley & Sons|páginas=103|capitulo=Chapter 6: Enzalutamide|isbn=978-1-118-82005-6}}</ref> |
A enzalutamida atua como um [[Antagonista (farmacologia)|antagonista]] silencioso de alta seletividade do receptor de andrógeno (RA), o alvo biológico dos fármacos [[andrógeno]]s – como a [[testosterona]] e a [[Di-hidrotestosterona|diidrotestosterona]]. Ao contrário da [[bicalutamida]], fármaco de primeira geração, a enzalutamida não promove a translocação do receptor de andrógeno para o [[Núcleo celular|núcleo ceilular]] e, além disso, inibe a ligação do receptor de andrógeno ao [[ácido desoxirribonucleico]] (DNA) e às [[proteína]]s co-ativadoras.<ref name="pmid19359544">{{Citar periódico |titulo=Development of a second-generation antiandrogen for treatment of advanced prostate cancer |data=maio de 2009 |número=5928 |paginas=787–90 |bibcode=2009Sci...324..787T |doi=10.1126/science.1168175 |pmc=2981508 |pmid=19359544 |vauthors=Tran C, Ouk S, Clegg NJ, Chen Y, Watson PA, Arora V, Wongvipat J, Smith-Jones PM, Yoo D, Kwon A, Wasielewska T, Welsbie D, Chen CD, Higano CS, Beer TM, Hung DT, Scher HI, Jung ME, Sawyers CL |volume=324 |periódico=Science}}</ref> Desse modo, a enzalutamida atua como um inibidor de sinalização do AR, bem como um antagonista.<ref name="pmid24076589">{{Citar periódico |titulo=Enzalutamide: The emperor of all anti-androgens |data=junho de 2013 |número=2 |paginas=119–120 |doi=10.3978/j.issn.2223-4683.2012.09.04 |pmc=3785324 |pmid=24076589 |vauthors=Antonarakis ES |volume=2 |periódico=Translational Andrology and Urology}}</ref> A droga tem afinidade duas vezes menor para o AR do que a [[di-hidrotestosterona]] (DHT), o ligante endógeno do AR na próstata.<ref name="LiJohnson2015">{{Citar livro|título=Innovative Drug Synthesis|ultimo=Li|primeiro=Jie Jack|ultimo2=Johnson|primeiro2=Douglas S.|data=14 de dezembro de 2015|editora=John Wiley & Sons|páginas=103|capitulo=Chapter 6: Enzalutamide|isbn=978-1-118-82005-6}}</ref> |
||
Quando as células [[LNCaP]], uma linhagem de células de câncer de próstata projetadas para expressar níveis elevados de RA – conforme observado em pacientes com câncer de próstata em estágio avançado – foram tratadas com enzalutamida, a expressão dos genes dependentes de andrógeno PSA e [[TMPRSS2]] foi regulada negativamente, em contraste com a bicalutamida, em que a expressão foi regulada positivamente.<ref name="pmid193595442">{{Citar periódico |titulo=Development of a second-generation antiandrogen for treatment of advanced prostate cancer |data= |
Quando as células [[LNCaP]], uma linhagem de células de câncer de próstata projetadas para expressar níveis elevados de RA – conforme observado em pacientes com câncer de próstata em estágio avançado – foram tratadas com enzalutamida, a expressão dos genes dependentes de andrógeno PSA e [[TMPRSS2]] foi regulada negativamente, em contraste com a bicalutamida, em que a expressão foi regulada positivamente.<ref name="pmid193595442">{{Citar periódico |titulo=Development of a second-generation antiandrogen for treatment of advanced prostate cancer |data=maio de 2009 |número=5928 |paginas=787–90 |bibcode=2009Sci...324..787T |doi=10.1126/science.1168175 |pmc=2981508 |pmid=19359544 |vauthors=Tran C, Ouk S, Clegg NJ, Chen Y, Watson PA, Arora V, Wongvipat J, Smith-Jones PM, Yoo D, Kwon A, Wasielewska T, Welsbie D, Chen CD, Higano CS, Beer TM, Hung DT, Scher HI, Jung ME, Sawyers CL |volume=324 |periódico=Science}}</ref> Em células VCaP que superexpressam o RA, a enzalutamida induziu a [[apoptose]], enquanto a bicalutamida não.<ref name="pmid193595442" /> Além disso, a enzalutamida se comporta como um antagonista do AR mutante W741C, ao passo que a [[bicalutamida]] se comporta como um [[Agonista (bioquímica)|agonista]] puro quando ligada a este mutante.<ref name="pmid193595442" /> |
||
==== Mudanças nos níveis hormonais ==== |
==== Mudanças nos níveis hormonais ==== |
||
Em estudos de monoterapia com enzalutamida na dosagem de 160 mg por dia, os níveis circulantes de [[testosterona]] aumentaram em 114,3%, [[Di-hidrotestosterona|dihidrotestosterona]] (DHT) em 51,7%, [[estradiol]] em 71,7%, [[gobulina ligadora de hormônios sexuais]] (SHBG) em 100,6%, [[desidroepiandrosterona]] (DHEA) em 9,6% e [[androstenediona]] em 51,1%, [[hormônio luteinizante]] (LH) em 184,7%, o [[hormônio folículo-estimulante]] (FSH) em 47,0% e a [[prolactina]] em 16,8%.<ref name="TombalBorre2014">{{Citar periódico |titulo=Enzalutamide monotherapy in hormone-naive prostate cancer: primary analysis of an open-label, single-arm, phase 2 study |data=maio de 2014 |número=6 |paginas=592–600 |doi=10.1016/S1470-2045(14)70129-9 |pmid=24739897 |vauthors=Tombal B, Borre M, Rathenborg P, Werbrouck P, Van Poppel H, Heidenreich A, Iversen P, Braeckman J, Heracek J, Baskin-Bey E, Ouatas T, Perabo F, Phung D, Hirmand M, Smith MR |volume=15 |periódico=The Lancet. Oncology}}</ref><ref name="RicciBuzzatti2014">{{Citar periódico |titulo=Safety of antiandrogen therapy for treating prostate cancer |data=novembro de 2014 |número=11 |paginas=1483–99 |doi=10.1517/14740338.2014.966686 |pmid=25270521 |vauthors=Ricci F, Buzzatti G, Rubagotti A, Boccardo F |volume=13 |periódico=Expert Opinion on Drug Safety}}</ref> Essas alterações nos níveis hormonais são semelhantes às da monoterapia de alta dosagem com bicalutamida.<ref name="TombalBorre2014" /><ref name="RicciBuzzatti2014" /> A redução máxima média nos níveis de [[antígeno prostático específico]] (PSA) foi de 99,6%.<ref name="TombalBorre2014" /> |
Em estudos de monoterapia com enzalutamida na dosagem de 160 mg por dia, os níveis circulantes de [[testosterona]] aumentaram em 114,3%, [[Di-hidrotestosterona|dihidrotestosterona]] (DHT) em 51,7%, [[estradiol]] em 71,7%, [[gobulina ligadora de hormônios sexuais]] (SHBG) em 100,6%, [[desidroepiandrosterona]] (DHEA) em 9,6% e [[androstenediona]] em 51,1%, [[hormônio luteinizante]] (LH) em 184,7%, o [[hormônio folículo-estimulante]] (FSH) em 47,0% e a [[prolactina]] em 16,8%.<ref name="TombalBorre2014">{{Citar periódico |titulo=Enzalutamide monotherapy in hormone-naive prostate cancer: primary analysis of an open-label, single-arm, phase 2 study |data=maio de 2014 |número=6 |paginas=592–600 |doi=10.1016/S1470-2045(14)70129-9 |pmid=24739897 |vauthors=Tombal B, Borre M, Rathenborg P, Werbrouck P, Van Poppel H, Heidenreich A, Iversen P, Braeckman J, Heracek J, Baskin-Bey E, Ouatas T, Perabo F, Phung D, Hirmand M, Smith MR |volume=15 |periódico=The Lancet. Oncology}}</ref><ref name="RicciBuzzatti2014">{{Citar periódico |titulo=Safety of antiandrogen therapy for treating prostate cancer |data=novembro de 2014 |número=11 |paginas=1483–99 |doi=10.1517/14740338.2014.966686 |pmid=25270521 |vauthors=Ricci F, Buzzatti G, Rubagotti A, Boccardo F |volume=13 |periódico=Expert Opinion on Drug Safety}}</ref> Essas alterações nos níveis hormonais são semelhantes às da monoterapia de alta dosagem com bicalutamida.<ref name="TombalBorre2014" /><ref name="RicciBuzzatti2014" /> A redução máxima média nos níveis de [[antígeno prostático específico]] (PSA) foi de 99,6%.<ref name="TombalBorre2014" /> |
||
==== Comparação com outros antiandrogênios ==== |
|||
A enzalutamida tem [[afinidade de ligação]] aproximadamente 8 vezes maior para o [[receptor de andrógeno]] (RA) em comparação com a [[bicalutamida]].<ref name="pmid193595443">{{Citar periódico |titulo=Development of a second-generation antiandrogen for treatment of advanced prostate cancer |data=maio de 2009 |número=5928 |paginas=787–90 |bibcode=2009Sci...324..787T |doi=10.1126/science.1168175 |pmc=2981508 |pmid=19359544 |vauthors=Tran C, Ouk S, Clegg NJ, Chen Y, Watson PA, Arora V, Wongvipat J, Smith-Jones PM, Yoo D, Kwon A, Wasielewska T, Welsbie D, Chen CD, Higano CS, Beer TM, Hung DT, Scher HI, Jung ME, Sawyers CL |volume=324 |periódico=Science}}</ref><ref name="Rodriguez-VidaChowdhury2015">{{Citar periódico |titulo=Enzalutamide for the treatment of metastatic castration-resistant prostate cancer |ano=2015 |paginas=3325–39 |doi=10.2147/DDDT.S69433 |pmc=4492664 |pmid=26170619 |vauthors=Rodriguez-Vida A, Galazi M, Rudman S, Chowdhury S, Sternberg CN |volume=9 |periódico=Drug Design, Development and Therapy}}</ref> Um estudo encontrou um {{Abbrlink|IC<sub>50</sub>|half-maximal inhibitory concentration}} (metade da concentração inibitória máxima) de 21 nM para enzalutamida e 160 nM para bicalutamida no RA em linha de células LNCaP (diferença de 7,6 vezes)<ref name="ElsevierScience20132">{{Citar livro|url=https://books.google.com/books?id=IUATAAAAQBAJ&pg=PA498|título=Annual Reports in Medicinal Chemistry|data=13 de setembro de 2013|editora=Elsevier Science|páginas=498–|isbn=978-0-12-417151-0}}</ref> Desse modo, as pesquisas clínicas sugerem que a enzalutamida é um antiandrogênio significativamente mais potente e eficaz em comparação aos AINEs de primeira geração, como bicalutamida, flutamida e nilutamida.<ref name="TombalBorre20142">{{Citar periódico |titulo=Enzalutamide monotherapy in hormone-naive prostate cancer: primary analysis of an open-label, single-arm, phase 2 study |data=maio de 2014 |número=6 |paginas=592–600 |doi=10.1016/S1470-2045(14)70129-9 |pmid=24739897 |vauthors=Tombal B, Borre M, Rathenborg P, Werbrouck P, Van Poppel H, Heidenreich A, Iversen P, Braeckman J, Heracek J, Baskin-Bey E, Ouatas T, Perabo F, Phung D, Hirmand M, Smith MR |volume=15 |periódico=The Lancet. Oncology}}</ref><ref name="RicciBuzzatti20142">{{Citar periódico |titulo=Safety of antiandrogen therapy for treating prostate cancer |data=novembro de 2014 |número=11 |paginas=1483–99 |doi=10.1517/14740338.2014.966686 |pmid=25270521 |vauthors=Ricci F, Buzzatti G, Rubagotti A, Boccardo F |volume=13 |periódico=Expert Opinion on Drug Safety}}</ref> Além disso, ao contrário dos AINEs de primeira geração, ensaios clínicos indicam que há risco reduzido de [[hepatotoxicidade]] ou [[Transaminases elevadas|elevação das enzimas hepáticas]] em pessoas tratadas com enzalutamida.<ref name="Keating2015">{{Citar periódico |titulo=Enzalutamide: a review of its use in chemotherapy-naïve metastatic castration-resistant prostate cancer |data=março de 2015 |número=3 |paginas=243–9 |doi=10.1007/s40266-015-0248-y |pmid=25711765 |vauthors=Keating GM |volume=32 |periódico=Drugs & Aging}}</ref><ref name="BeerArmstrong2014">{{Citar periódico |titulo=Enzalutamide in metastatic prostate cancer before chemotherapy |data=julho de 2014 |número=5 |paginas=424–33 |doi=10.1056/NEJMoa1405095 |pmc=4418931 |pmid=24881730 |vauthors=Beer TM, Armstrong AJ, Rathkopf DE, Loriot Y, Sternberg CN, Higano CS, Iversen P, Bhattacharya S, Carles J, Chowdhury S, Davis ID, de Bono JS, Evans CP, Fizazi K, Joshua AM, Kim CS, Kimura G, Mainwaring P, Mansbach H, Miller K, Noonberg SB, Perabo F, Phung D, Saad F, Scher HI, Taplin ME, Venner PM, Tombal B |volume=371 |periódico=The New England Journal of Medicine}}</ref> |
|||
==== Modulação do citocromo P450 ==== |
==== Modulação do citocromo P450 ==== |
||
Revisão das 19h42min de 15 de dezembro de 2021
| Enzalutamida Alerta sobre risco à saúde | |
|---|---|
| |
| |
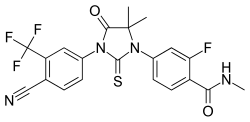
| Nome IUPAC | 4-(3-(4MDV-3100; ASP-9785-cyano-3-(trifluoromethyl)phenyl)-5,5-dimethyl-4-oxo-2-thioxoimidazolidin-1-yl)-2-fluoro-N-methylbenzamide |
| Outros nomes | MDV-3100; ASP-9785 |
| Identificadores | |
| Número CAS | |
| PubChem | |
| DrugBank | DB08899 |
| ChemSpider | |
| MeSH | |
| ChEBI | |
| Código ATC | L02 |
| SMILES |
|
| Primeiro nome comercial ou de referência | Xtandi |
| Propriedades | |
| Fórmula química | C21H16F4N4O2S |
| Massa molar | 464.43 g mol-1 |
| Solubilidade em água | Insolúvel |
| Farmacologia | |
| Biodisponibilidade | 89.7% (em ratos)[2] Humanos: desconhecido (mas eestimado em 84.6% com base em análises de excreção)[3][4] |
| Via(s) de administração | oral |
| Metabolismo | Hepático (principalmente pelas enzimas CYP2C8 e CYP3A4)[1] |
| Meia-vida biológica | Enzalutamida: 5.8 dias (± 2.8–10.2 dias)[1] NDME: 7.8–8.6 dias[1] |
| Ligação plasmática | Enzalutamida: 97–98% (principalmente na albumina)[1] NDME: 95%[1] |
| Excreção | Urina: 71%[4] Bile: 13.6%[4] Fezes: 0.39%[4] |
| Classificação legal |
℞-only (US) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Enzalutamida, vendida sob a marca Xtandi, é um fármaco da classe dos antiandrogênios não-esteroidais (NSAA/AINEs) usado no tratamento de câncer de próstata.[1][5] O medicamento é indicado como terapia adjuvante em conjunto com a castração no tratamento de câncer de próstata metastático resistente à castração (mCRPC),[1] câncer de próstata não metastático resistente à castração (CPRC) [1] e câncer de próstata metastático sensível à castração.[6] É administrada por via oral.[1]
Os efeitos colaterais da enzalutamida associada à castração incluem astenia, dor nas costas, diarreia, artralgia e ondas de calor.[1] Em casos raros, pode provocar convulsões.[1] Possui alto potencial em termos de interações medicamentosas.[1] A enzalutamida é um antiandrógeno e atua como um antagonista do receptor de andrógeno, o alvo biológico dos andrógenos, como a testosterona e a diidrotestosterona.[1] Desse modo, a enzalutaminada diminuir os efeitos adversos causados por esses hormônios na próstata e em outras partes do corpo.[1]
A enzalutamida foi descrita pela primeira vez em 2006, e foi introduzida para o tratamento do câncer de próstata em 2012.[7][8][9] Foi o primeiro NSAA de segunda geração a ser aprovado para comercialização.[10] Está na Lista de Medicamentos Essenciais da Organização Mundial de Saúde.[11]
Usos médicos
Câncer de próstata
Há evidências robustas da eficácia da enzalutamina no aumento da sobrevida geral e mpessoas com câncer de próstata não metastático resistente à castração, particularmente aquelas com tempo de duplicação (≤ 6 meses) do antígeno prostático específico (PSA).[12]
Terapia hormonal
A enzalutamida pode ser usada como um antiandrogênio na terapia hormonal feminizante para mulheres transgênero.[13]
Formas disponíveis
Geralmente, a enzalutamida é disponibilizada na forma de cápsulas de 40 mg.[1] É ingerida por via oral na dosagem de 160 mg uma vez por dia (quatro cápsulas).[1]
Contraindicações
A enzalutamida é contra -indicada em pessoas grávidas.[1] Pode causar danos teratológicos ao feto.[1]
Efeitos colaterais
Os efeitos colaterais mais comuns da enzalutamida observados em ensaios clínicos foram ginecomastia, dor e sensibilidade mamária, fadiga, diarreia, ondas de calor, dor de cabeça, disfunção sexual e, raramente, convulsões.[14][15][16][17] Outros efeitos colaterais comuns relatados em ensaios clínicos incluem neutropenia, alucinações visuais, ansiedade, distúrbio cognitivo, comprometimento da memória, hipertensão, pele seca e prurido (coceira).[18] A monoterapia com enzalutamida provoca diminuição da libido e da atividade sexual, significativamente menor do que os análogos do hormônio liberador de gonadotrofina (GnRH), mas semelhante ao de outros antiandrogênios não-esteroidais, como a bicalutamida.[19]
Efeitos adversos centrais
Em ensaios clínicos, convulsões foram relatadas em aproximadamente 1% dos pacientes tratados com enzalutamida.[14][16] É presumido que esse efeito adverso seja causado devido ao potencial da enzalutamida em atravessar a barreira hematoencefálica,[20][21] inibindo o receptor GABAA no sistema nervoso central em análises in vitro (IC50 = 3,6μM),[21][22][23] além de induzir convulsões em animais quando administrada em altas doses).[14][16] Além das convulsões, outros efeitos colaterais potencialmente relacionados ao receptor GABA A observados com o tratamento com enzalutamida em ensaios clínicos são ansiedade, insônia, vertigem, parestesia e cefaleia.[24] Devido à sua capacidade de reduzir o limiar de convlusão, os pacientes com distúrbios convulsivos conhecidos ou lesão cerebral devem ser monitorados perioficamente durante o tratamento com enzalutamida.[25] As convulsões induzidas por NSAA geralmente são tratadas com benzodiazepínico.[22] Em estudos de variação da dose, foi relatada fadiga severa após administração de enzalutamida em doses de 240mg/dia ou superior.[26][27]
Reações adversas raras
Há registro de um caso de síndrome da encefalopatia reversível posterior (PRES) em pessoa tratada com enzalutamida.[28] O mecanismo de ação do efeito colateral é desconhecido, mas a hipótese é de que seja por consequência da inibição do receptor GABAA pela enzalutamida.[28]
Overdose
A enzalutamida pode causar convulsões em caso de sobredosagem.[1]
Interações
A enzalutamida é um indutor de múltiplas enzimas do citocromo P450 , incluindo CYP3A4, CYP2C9 e CYP2C19 e, por isso, tem um alto potencial de interações medicamentosas clinicamente relevantes.[1] As concentrações plasmáticas de enzalutamida podem ser alteradas por inibidores e indutores do CYP2C8 e CYP3A4, de modo que devem ser evitadas, se possível.[29]
Em um ensaio clínico de enzalutamida aplicada no tratamento de câncer de mama ER-positivo, o fármaco diminuiu as concentrações séricas dos inibidores da aromatase anastrozol e exemestano em, respectivamente, 90% e 50%, o que indica redução de seu potencial de eficácia nessa aplicação.[30]
Farmacologia
Farmacodinâmica
A enzalutamida atua como um antagonista silencioso de alta seletividade do receptor de andrógeno (RA), o alvo biológico dos fármacos andrógenos – como a testosterona e a diidrotestosterona. Ao contrário da bicalutamida, fármaco de primeira geração, a enzalutamida não promove a translocação do receptor de andrógeno para o núcleo ceilular e, além disso, inibe a ligação do receptor de andrógeno ao ácido desoxirribonucleico (DNA) e às proteínas co-ativadoras.[31] Desse modo, a enzalutamida atua como um inibidor de sinalização do AR, bem como um antagonista.[14] A droga tem afinidade duas vezes menor para o AR do que a di-hidrotestosterona (DHT), o ligante endógeno do AR na próstata.[32]
Quando as células LNCaP, uma linhagem de células de câncer de próstata projetadas para expressar níveis elevados de RA – conforme observado em pacientes com câncer de próstata em estágio avançado – foram tratadas com enzalutamida, a expressão dos genes dependentes de andrógeno PSA e TMPRSS2 foi regulada negativamente, em contraste com a bicalutamida, em que a expressão foi regulada positivamente.[33] Em células VCaP que superexpressam o RA, a enzalutamida induziu a apoptose, enquanto a bicalutamida não.[33] Além disso, a enzalutamida se comporta como um antagonista do AR mutante W741C, ao passo que a bicalutamida se comporta como um agonista puro quando ligada a este mutante.[33]
Mudanças nos níveis hormonais
Em estudos de monoterapia com enzalutamida na dosagem de 160 mg por dia, os níveis circulantes de testosterona aumentaram em 114,3%, dihidrotestosterona (DHT) em 51,7%, estradiol em 71,7%, gobulina ligadora de hormônios sexuais (SHBG) em 100,6%, desidroepiandrosterona (DHEA) em 9,6% e androstenediona em 51,1%, hormônio luteinizante (LH) em 184,7%, o hormônio folículo-estimulante (FSH) em 47,0% e a prolactina em 16,8%.[19][34] Essas alterações nos níveis hormonais são semelhantes às da monoterapia de alta dosagem com bicalutamida.[19][34] A redução máxima média nos níveis de antígeno prostático específico (PSA) foi de 99,6%.[19]
Comparação com outros antiandrogênios
A enzalutamida tem afinidade de ligação aproximadamente 8 vezes maior para o receptor de andrógeno (RA) em comparação com a bicalutamida.[35][36] Um estudo encontrou um IC50 (metade da concentração inibitória máxima) de 21 nM para enzalutamida e 160 nM para bicalutamida no RA em linha de células LNCaP (diferença de 7,6 vezes)[37] Desse modo, as pesquisas clínicas sugerem que a enzalutamida é um antiandrogênio significativamente mais potente e eficaz em comparação aos AINEs de primeira geração, como bicalutamida, flutamida e nilutamida.[38][39] Além disso, ao contrário dos AINEs de primeira geração, ensaios clínicos indicam que há risco reduzido de hepatotoxicidade ou elevação das enzimas hepáticas em pessoas tratadas com enzalutamida.[40][41]
Modulação do citocromo P450
A enzalutamida é um forte indutor da enzima CYP3A4 e m indutor moderado da CYP2C9 e CYP2C19, por isso, é capaz de afetar as concentrações plasmáticas de outros medicamentos que são metabolizados por essas enzimas.[42][29]
Mecanismos de resistência no câncer de próstata
A enzalutamida costuma ser eficas apenas por um período de tempo determinado, após o qual o crescimento do câncer não é mais inibido por esse antiandrógeno. Os mecanismos de resistência à enzalutamida estão sendo intensamente estudados.[43] Atualmente, vários mecanismos foram encontrados:
- Mutações AR[44][45]
- Splicing alternativo AR[46]
- Desvio do receptor de glicocorticoides[47]
- Aumento do fluxo de glicólise[48]
- Resistência mediada por autofagia[49]
- Ativação da via de sinalização Wnt[50]
- Aumento na biossíntese mediado por enzima do androgênio intratumoral[51]
- Resistência mediada por sinalização de interleucina 6[52]
Farmacocinética
A biodisponibilidade da enzalutamida não é totalmente conhecida, mas com base na quantidade recuperada da urina e da bile em estudos de excreção, estima-se que seja cerca de 84,6%. Em ratos, a biodisponibilidade é de 89,7%. As concentrações estáveos de enzalutamida são alcançadas em 28 dias após o início do tratamento.[53] A ligação da enzalutamida às proteínas plasmáticas é de 97 a 98%, enquanto a da N-Desmetilenzalutamida (NDME), seu principal metabólito, é de 95%.[1] A enzalutamida liga-se principalmente à albumina.[1] O medicamento é metabolizado no fígado, principalmente pelas enzimas CYP2C8 e CYP3A4 do citocromo P450.[1] CYP2C8 é o principal responsável pela formação de NDME.[29] A enzalutamida tem uma meia-vida biológica de eliminação longa – de 5,8 dias em média, com um intervalo de 2,8 a 10,2 dias.[1] A meia-vida de eliminação do metabólito NDME é ainda mais longa, cerca de 7,8 a 8,6 dias.[1] A enzalutamida é eliminada em 71,0% na urina, 13,6% na bile e 0,39% nas fezes.
Química
Enzalutamida é um composto sintético derivado da hidantoína e está estruturalmente relacionada com os AINEs de primeira geração, como flutamida, nilutamida, e bicalutamida, bem como a outros AINEs mais recentes, também de segunda geração, como apalutamida e proxalutamida.[54]
Pesquisa
Câncer de mama
Avaliações pré-clínicas sugerem e que a enzalutamida pode ser eficaz no tratamento de certos tipos de câncer de mama.[55][56] Ela foi testada em tratamento de câncer de mama triplo-negativo e AR-positivo em um ensaio clínico de fase II.[57][58]
Hirsutismo e hiperandrogenismo
Estudos preliminares indicam que a enzalutamida é eficaz para o tratamento de hirsutismo e hiperandrogenismo em pessoas com síndrome dos ovários policísticos.[59]
Referências
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y «Xtandi- enzalutamide capsule». DailyMed. 9 de julho de 2018. Consultado em 21 de dezembro de 2019
- ↑ Kim TH, Jeong JW, Song JH, Lee KR, Ahn S, Ahn SH, Kim S, Koo TS (novembro de 2015). «Pharmacokinetics of enzalutamide, an anti-prostate cancer drug, in rats». Archives of Pharmacal Research. 38 (11): 2076–82. PMID 25956695. doi:10.1007/s12272-015-0592-9
- ↑ Benoist GE, Hendriks RJ, Mulders PF, Gerritsen WR, Somford DM, Schalken JA, van Oort IM, Burger DM, van Erp NP (2016). «Pharmacokinetic Aspects of the Two Novel Oral Drugs Used for Metastatic Castration-Resistant Prostate Cancer: Abiraterone Acetate and Enzalutamide». Clin Pharmacokinet. 55 (11): 1369–1380. PMC 5069300
 . PMID 27106175. doi:10.1007/s40262-016-0403-6
. PMID 27106175. doi:10.1007/s40262-016-0403-6
- ↑ a b c d Gibbons JA, Ouatas T, Krauwinkel W, Ohtsu Y, van der Walt JS, Beddo V, de Vries M, Mordenti J (2015). «Clinical Pharmacokinetic Studies of Enzalutamide». Clin Pharmacokinet. 54 (10): 1043–55. PMC 4580721
 . PMID 25917876. doi:10.1007/s40262-015-0271-5
. PMID 25917876. doi:10.1007/s40262-015-0271-5
- ↑ «Medivation's MDV3100 Shown to Be Effective in a Preclinical Model of Hormone-Refractory Prostate Cancer» (Nota de imprensa). Medivation, Inc. 26 de fevereiro de 2007. Consultado em 10 de maio de 2009. Arquivado do original em 16 de setembro de 2007
- ↑ «FDA approves enzalutamide for metastatic castration-sensitive prostate cancer». U.S. Food and Drug Administration (FDA). 17 de dezembro de 2019. Consultado em 21 de dezembro de 2019. Arquivado do original em 22 de dezembro de 2019
- ↑ Sawyers, C., Jung, M., Chen, C., Ouk, S., Welsbie, D., Tran, C.,.
- ↑ «FDA approves new treatment for a type of late stage prostate cancer» (Nota de imprensa). U.S. Food and Drug Administration (FDA). 31 de agosto de 2012. Consultado em 16 de dezembro de 2019. Arquivado do original em 2 de outubro de 2013
- ↑ Anna Azvolinsky (4 de setembro de 2012). «FDA Approves Enzalutamide (Xtandi) for Late-Stage Prostate Cancer». CancerNetwork
- ↑ Saad F, Heinrich D (2013). «New Therapeutic Options for Castration-resistant Prostate Cancer». The Journal of Oncopathology. 1 (4): 23–32. doi:10.13032/tjop.2052-5931.100072.
[...] enzalutamide was the first second-generation AR antagonist to be approved by the FDA in 2012 and by the EMA and Health Canada in 2013 [...]
- ↑ World Health Organization model list of essential medicines: 22nd list (2021). Geneva: World Health Organization. 2021. WHO/MHP/HPS/EML/2021.02
- ↑ Wenzel M, Nocera L, Collà Ruvolo C, Würnschimmel C, Tian Z, et al. (maio de 2021). «Overall survival and adverse events after treatment with darolutamide vs. apalutamide vs. enzalutamide for high-risk non-metastatic castration-resistant prostate cancer: a systematic review and network meta-analysis». Prostate Cancer Prostatic Dis (Systematic review). doi:10.1038/s41391-021-00395-4
- ↑ Fishman, Sarah L.; Paliou, Maria; Poretsky, Leonid; Hembree, Wylie C. (2019). «Endocrine Care of Transgender Adults». Transgender Medicine. Col: Contemporary Endocrinology. [S.l.: s.n.] pp. 143–163. ISBN 978-3-030-05682-7. ISSN 2523-3785. doi:10.1007/978-3-030-05683-4_8.
Existem poucos relatos de resultados bem-sucedidos com flutamida (Eulexin), embora esta não seja tão eficaz quanto o acetato de ciproterona na redução dos níveis de testosterona. Tanto a flutamida quanto a bicalutamida (Casodex), em conjunto com pílulas anticoncepcionais orais, mostraram melhorias significativas no hirsutismo em mulheres natais com síndrome do ovário policístico (SOP). O uso desses agentes como antiandrógenos em pessoas transgêneros é limitado devido a preocupações com o potencial de hepatotoxicidade.
- ↑ a b c d Antonarakis ES (junho de 2013). «Enzalutamide: The emperor of all anti-androgens». Translational Andrology and Urology. 2 (2): 119–120. PMC 3785324
 . PMID 24076589. doi:10.3978/j.issn.2223-4683.2012.09.04
. PMID 24076589. doi:10.3978/j.issn.2223-4683.2012.09.04
- ↑ Payton S (maio de 2014). «Prostate cancer: enzalutamide impresses in European studies». Nature Reviews. Urology. 11 (5). 243 páginas. PMID 24776976. doi:10.1038/nrurol.2014.98
- ↑ a b c Golshayan AR, Antonarakis ES (2013). «Enzalutamide: an evidence-based review of its use in the treatment of prostate cancer». Core Evidence. 8: 27–35. PMC 3622394
 . PMID 23589709. doi:10.2147/CE.S34747
. PMID 23589709. doi:10.2147/CE.S34747
- ↑ Tombal B, Borre M, Rathenborg P, Werbrouck P, Van Poppel H, Heidenreich A, Iversen P, Braeckman J, Heracek J, Baskin-Bey E, Ouatas T, Perabo F, Phung D, Baron B, Hirmand M, Smith MR (novembro de 2015). «Long-term Efficacy and Safety of Enzalutamide Monotherapy in Hormone-naïve Prostate Cancer: 1- and 2-Year Open-label Follow-up Results». European Urology. 68 (5): 787–94. PMID 25687533. doi:10.1016/j.eururo.2015.01.027
- ↑ Jeffrey K Aronson (4 de março de 2014). Side Effects of Drugs Annual: A worldwide yearly survey of new data in adverse drug reactions. [S.l.]: Newnes. pp. 740–. ISBN 978-0-444-62636-3
- ↑ a b c d Tombal B, Borre M, Rathenborg P, Werbrouck P, Van Poppel H, Heidenreich A, Iversen P, Braeckman J, Heracek J, Baskin-Bey E, Ouatas T, Perabo F, Phung D, Hirmand M, Smith MR (maio de 2014). «Enzalutamide monotherapy in hormone-naive prostate cancer: primary analysis of an open-label, single-arm, phase 2 study». The Lancet. Oncology. 15 (6): 592–600. PMID 24739897. doi:10.1016/S1470-2045(14)70129-9
- ↑ Vogelzang NJ (setembro de 2012). «Enzalutamide--a major advance in the treatment of metastatic prostate cancer». The New England Journal of Medicine. 367 (13): 1256–7. doi:10.1056/NEJMe1209041
- ↑ a b «Metastatic Castrate-Resistant Prostate Cancer: Role of Androgen Signaling Inhibitors». Prostate Cancer: A Multidisciplinary Approach to Diagnosis and Management. [S.l.]: Demos Medical Publishing. 17 de dezembro de 2014. 342 páginas. ISBN 978-1-936287-59-8
- ↑ a b Foster WR, Car BD, Shi H, Levesque PC, Obermeier MT, Gan J, Arezzo JC, Powlin SS, Dinchuk JE, Balog A, Salvati ME, Attar RM, Gottardis MM (2011). «Drug safety is a barrier to the discovery and development of new androgen receptor antagonists». The Prostate. 71 (5): 480–8. PMID 20878947. doi:10.1002/pros.21263
- ↑ Rathkopf D, Scher HI (2013). «Androgen receptor antagonists in castration-resistant prostate cancer». Cancer Journal. 19 (1): 43–9. PMC 3788593
 . PMID 23337756. doi:10.1097/PPO.0b013e318282635a
. PMID 23337756. doi:10.1097/PPO.0b013e318282635a
- ↑ Jerome Z. Litt (25 de janeiro de 2013). Litt's Drug Eruptions and Reactions Manual, 19th Edition. [S.l.]: CRC Press. pp. 148–. ISBN 978-1-84214-599-9
- ↑ Tan PS, Haaland B, Montero AJ, Kyriakopoulos CE, Lopes G (2014). «Hormonal Therapeutics Enzalutamide and Abiraterone Acetate in the Treatment of Metastatic Castration-Resistant Prostate Cancer (mCRPC) Post-docetaxel-an Indirect Comparison». Clinical Medicine Insights: Oncology. 8: 29–36. PMC 3964205
 . PMID 24678245. doi:10.4137/CMO.S13671
. PMID 24678245. doi:10.4137/CMO.S13671
- ↑ Labrie F (janeiro de 2015). «Combined blockade of testicular and locally made androgens in prostate cancer: a highly significant medical progress based upon intracrinology». J. Steroid Biochem. Mol. Biol. 145: 144–56. PMID 24925260. doi:10.1016/j.jsbmb.2014.05.012
- ↑ Scher HI, Beer TM, Higano CS, Anand A, Taplin ME, Efstathiou E, Rathkopf D, Shelkey J, Yu EY, Alumkal J, Hung D, Hirmand M, Seely L, Morris MJ, Danila DC, Humm J, Larson S, Fleisher M, Sawyers CL (abril de 2010). «Antitumour activity of MDV3100 in castration-resistant prostate cancer: a phase 1-2 study». Lancet. 375 (9724): 1437–46. PMC 2948179
 . PMID 20398925. doi:10.1016/S0140-6736(10)60172-9
. PMID 20398925. doi:10.1016/S0140-6736(10)60172-9
- ↑ a b Crona DJ, Whang YE (junho de 2015). «Posterior reversible encephalopathy syndrome induced by enzalutamide in a patient with castration-resistant prostate cancer». Investigational New Drugs. 33 (3): 751–4. PMC 4451215
 . PMID 25467090. doi:10.1007/s10637-014-0193-3
. PMID 25467090. doi:10.1007/s10637-014-0193-3
- ↑ a b c McCutcheon SB (2013). «Enzalutamide: a new agent for the prostate cancer treatment armamentarium». J Adv Pract Oncol. 4 (3): 182–5. PMC 4093421
 . PMID 25031999. doi:10.6004/jadpro.2013.4.3.7
. PMID 25031999. doi:10.6004/jadpro.2013.4.3.7
- ↑ Narayanan R, Coss CC, Dalton JT (2018). «Development of selective androgen receptor modulators (SARMs)». Mol. Cell. Endocrinol. 465: 134–142. PMC 5896569
 . PMID 28624515. doi:10.1016/j.mce.2017.06.013
. PMID 28624515. doi:10.1016/j.mce.2017.06.013
- ↑ Tran C, Ouk S, Clegg NJ, Chen Y, Watson PA, Arora V, Wongvipat J, Smith-Jones PM, Yoo D, Kwon A, Wasielewska T, Welsbie D, Chen CD, Higano CS, Beer TM, Hung DT, Scher HI, Jung ME, Sawyers CL (maio de 2009). «Development of a second-generation antiandrogen for treatment of advanced prostate cancer». Science. 324 (5928): 787–90. Bibcode:2009Sci...324..787T. PMC 2981508
 . PMID 19359544. doi:10.1126/science.1168175
. PMID 19359544. doi:10.1126/science.1168175
- ↑ Li, Jie Jack; Johnson, Douglas S. (14 de dezembro de 2015). «Chapter 6: Enzalutamide». Innovative Drug Synthesis. [S.l.]: John Wiley & Sons. 103 páginas. ISBN 978-1-118-82005-6
- ↑ a b c Tran C, Ouk S, Clegg NJ, Chen Y, Watson PA, Arora V, Wongvipat J, Smith-Jones PM, Yoo D, Kwon A, Wasielewska T, Welsbie D, Chen CD, Higano CS, Beer TM, Hung DT, Scher HI, Jung ME, Sawyers CL (maio de 2009). «Development of a second-generation antiandrogen for treatment of advanced prostate cancer». Science. 324 (5928): 787–90. Bibcode:2009Sci...324..787T. PMC 2981508
 . PMID 19359544. doi:10.1126/science.1168175
. PMID 19359544. doi:10.1126/science.1168175
- ↑ a b Ricci F, Buzzatti G, Rubagotti A, Boccardo F (novembro de 2014). «Safety of antiandrogen therapy for treating prostate cancer». Expert Opinion on Drug Safety. 13 (11): 1483–99. PMID 25270521. doi:10.1517/14740338.2014.966686
- ↑ Tran C, Ouk S, Clegg NJ, Chen Y, Watson PA, Arora V, Wongvipat J, Smith-Jones PM, Yoo D, Kwon A, Wasielewska T, Welsbie D, Chen CD, Higano CS, Beer TM, Hung DT, Scher HI, Jung ME, Sawyers CL (maio de 2009). «Development of a second-generation antiandrogen for treatment of advanced prostate cancer». Science. 324 (5928): 787–90. Bibcode:2009Sci...324..787T. PMC 2981508
 . PMID 19359544. doi:10.1126/science.1168175
. PMID 19359544. doi:10.1126/science.1168175
- ↑ Rodriguez-Vida A, Galazi M, Rudman S, Chowdhury S, Sternberg CN (2015). «Enzalutamide for the treatment of metastatic castration-resistant prostate cancer». Drug Design, Development and Therapy. 9: 3325–39. PMC 4492664
 . PMID 26170619. doi:10.2147/DDDT.S69433
. PMID 26170619. doi:10.2147/DDDT.S69433
- ↑ Annual Reports in Medicinal Chemistry. [S.l.]: Elsevier Science. 13 de setembro de 2013. pp. 498–. ISBN 978-0-12-417151-0
- ↑ Tombal B, Borre M, Rathenborg P, Werbrouck P, Van Poppel H, Heidenreich A, Iversen P, Braeckman J, Heracek J, Baskin-Bey E, Ouatas T, Perabo F, Phung D, Hirmand M, Smith MR (maio de 2014). «Enzalutamide monotherapy in hormone-naive prostate cancer: primary analysis of an open-label, single-arm, phase 2 study». The Lancet. Oncology. 15 (6): 592–600. PMID 24739897. doi:10.1016/S1470-2045(14)70129-9
- ↑ Ricci F, Buzzatti G, Rubagotti A, Boccardo F (novembro de 2014). «Safety of antiandrogen therapy for treating prostate cancer». Expert Opinion on Drug Safety. 13 (11): 1483–99. PMID 25270521. doi:10.1517/14740338.2014.966686
- ↑ Keating GM (março de 2015). «Enzalutamide: a review of its use in chemotherapy-naïve metastatic castration-resistant prostate cancer». Drugs & Aging. 32 (3): 243–9. PMID 25711765. doi:10.1007/s40266-015-0248-y
- ↑ Beer TM, Armstrong AJ, Rathkopf DE, Loriot Y, Sternberg CN, Higano CS, Iversen P, Bhattacharya S, Carles J, Chowdhury S, Davis ID, de Bono JS, Evans CP, Fizazi K, Joshua AM, Kim CS, Kimura G, Mainwaring P, Mansbach H, Miller K, Noonberg SB, Perabo F, Phung D, Saad F, Scher HI, Taplin ME, Venner PM, Tombal B (julho de 2014). «Enzalutamide in metastatic prostate cancer before chemotherapy». The New England Journal of Medicine. 371 (5): 424–33. PMC 4418931
 . PMID 24881730. doi:10.1056/NEJMoa1405095
. PMID 24881730. doi:10.1056/NEJMoa1405095
- ↑ Richard J., Editor in Chief Hamilton FAAEM FACMT (4 de dezembro de 2013). Tarascon Pocket Pharmacopoeia 2014 Deluxe Lab-Coat Edition. [S.l.]: Jones & Bartlett Publishers. pp. 336–. ISBN 978-1-284-05399-9
- ↑ Claessens F, Helsen C, Prekovic S, Van den Broeck T, Spans L, Van Poppel H, Joniau S (dezembro de 2014). «Emerging mechanisms of enzalutamide resistance in prostate cancer». Nature Reviews Urology. 11 (12): 712–6. PMID 25224448. doi:10.1038/nrurol.2014.243
- ↑ Balbas MD, Evans MJ, Hosfield DJ, Wongvipat J, Arora VK, Watson PA, Chen Y, Greene GL, Shen Y, Sawyers CL (abril de 2016). «Overcoming mutation-based resistance to antiandrogens with rational drug design». eLife. 2: e00499. PMC 3622181
 . PMID 23580326. doi:10.7554/eLife.00499
. PMID 23580326. doi:10.7554/eLife.00499
- ↑ Prekovic S, van Royen ME, Voet AR, Geverts B, Houtman R, Melchers D, Zhang KY, Van den Broeck T, Smeets E, Spans L, Houtsmuller AB, Joniau S, Claessens F, Helsen C (maio de 2016). «The effect of F877L and T878A mutations on androgen receptor response to Enzalutamide». Molecular Cancer Therapeutics. 15 (7): 1702–12. PMID 27196756. doi:10.1158/1535-7163.MCT-15-0892
- ↑ Antonarakis ES, Lu C, Wang H, Luber B, Nakazawa M, Roeser JC, Chen Y, Mohammad TA, Chen Y, Fedor HL, Lotan TL (setembro de 2014). «AR-V7 and resistance to enzalutamide and abiraterone in prostate cancer». New England Journal of Medicine. 371 (11): 1028–38. PMC 4201502
 . PMID 25184630. doi:10.1056/NEJMoa1315815
. PMID 25184630. doi:10.1056/NEJMoa1315815
- ↑ Arora VK, Schenkein E, Murali R, Subudhi SK, Wongvipat J, Balbas MD, Shah N, Cai L, Efstathiou E, Logothetis C, Zheng D (dezembro de 2013). «Glucocorticoid receptor confers resistance to antiandrogens by bypassing androgen receptor blockade». Cell. 155 (6): 1309–22. PMC 3932525
 . PMID 24315100. doi:10.1016/j.cell.2013.11.012
. PMID 24315100. doi:10.1016/j.cell.2013.11.012
- ↑ Cui Y, Nadiminty N, Liu C, Lou W, Schwartz CT, Gao AC (junho de 2014). «Upregulation of glucose metabolism by NF-κB2/p52 mediates enzalutamide resistance in castration-resistant prostate cancer cells». Endocrine-Related Cancer. 21 (3): 435–42. PMC 4021715
 . PMID 24659479. doi:10.1530/ERC-14-0107
. PMID 24659479. doi:10.1530/ERC-14-0107
- ↑ Nguyen HG, Yang JC, Kung HJ, Shi XB, Tilki D, Lara PN, White RD, Gao AC, Evans CP (setembro de 2014). «Targeting autophagy overcomes Enzalutamide resistance in castration-resistant prostate cancer cells and improves therapeutic response in a xenograft model». Oncogene. 33 (36): 4521–30. PMC 4155805
 . PMID 24662833. doi:10.1038/onc.2014.25
. PMID 24662833. doi:10.1038/onc.2014.25
- ↑ Miyamoto DT, Zheng Y, Wittner BS, Lee RJ, Zhu H, Broderick KT, Desai R, Fox DB, Brannigan BW, Trautwein J, Arora KS (setembro de 2015). «RNA-Seq of single prostate CTCs implicates noncanonical Wnt signaling in antiandrogen resistance». Science. 349 (6254): 1351–6. Bibcode:2015Sci...349.1351M. PMC 4872391
 . PMID 26383955. doi:10.1126/science.aab0917
. PMID 26383955. doi:10.1126/science.aab0917
- ↑ Liu C, Lou W, Zhu Y, Yang JC, Nadiminty N, Gaikwad NW, Evans CP, Gao AC (abril de 2015). «Intracrine androgens and AKR1C3 activation confer resistance to enzalutamide in prostate cancer». Cancer Research. 75 (7): 1413–22. PMC 4383695
 . PMID 25649766. doi:10.1158/0008-5472.CAN-14-3080
. PMID 25649766. doi:10.1158/0008-5472.CAN-14-3080
- ↑ Liu C, Zhu Y, Lou W, Cui Y, Evans CP, Gao AC (fevereiro de 2014). «Inhibition of constitutively active Stat3 reverses enzalutamide resistance in LNCaP derivative prostate cancer cells». The Prostate. 74 (2): 201–9. PMC 4437226
 . PMID 24307657. doi:10.1002/pros.22741
. PMID 24307657. doi:10.1002/pros.22741
- ↑ Annual Reports in Medicinal Chemistry. [S.l.]: Elsevier Science. 13 de setembro de 2013. pp. 498–. ISBN 978-0-12-417151-0
- ↑ Georg F. Weber (22 de julho de 2015). Molecular Therapies of Cancer. [S.l.]: Springer. pp. 318–. ISBN 978-3-319-13278-5
- ↑ «Preclinical Evaluation of Enzalutamide in Breast Cancer Models». Arquivado do original em 23 de fevereiro de 2013
- ↑ «Medivation and Astellas Announce New Preclinical Study Results Showing MDV3100 Blocks Breast Cancer Cell Growth» (Nota de imprensa). MarketWatch. 4 de agosto de 2011. Consultado em 25 de setembro de 2011
- ↑ Traina, Tiffany A; O'Shaughnessy, Joyce; Nanda, Rita; Schwartzberg, Lee; Abrasion, Vandana; Cortes, Javier; et al. (2015). «Abstract P5-19-09: Preliminary results from a phase 2 single-arm study of enzalutamide, an androgen receptor (AR) inhibitor, in advanced AR+ triple-negative breast cancer (TNBC)». Cancer Research. 75 (9 Supplement): P5-19, 09. doi:10.1158/1538-7445.SABCS14-P5-19-09
- ↑ Le Du F, Eckhardt BL, Lim B, Litton JK, Moulder S, Meric-Bernstam F, Gonzalez-Angulo AM, Ueno NT (maio de 2015). «Is the future of personalized therapy in triple-negative breast cancer based on molecular subtype?». Oncotarget. 6 (15): 12890–908. PMC 4536987
 . PMID 25973541. doi:10.18632/oncotarget.3849
. PMID 25973541. doi:10.18632/oncotarget.3849
- ↑ Moretti C, Guccione L, Di Giacinto P, Simonelli I, Exacoustos C, Toscano V, Motta C, De Leo V, Petraglia F, Lenzi A (2017). «Combined Oral Contraception and Bicalutamide in Polycystic Ovary Syndrome and Severe Hirsutism - a Double-blind RTC». J. Clin. Endocrinol. Metab. 103 (3): 824–838. PMID 29211888. doi:10.1210/jc.2017-01186
Ligações externas
- «Enzalutamide». Drug Information Portal. U.S. National Library of Medicine
