Planta vascular
| Tracheophyta ou Tracheobionta plantas vasculares; plantas superiores | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Classificação científica | |||||||||
| |||||||||
| Divisões | |||||||||
| |||||||||
| Sinónimos | |||||||||
| |||||||||


Plantas vasculares (do latim vasculum; "vaso" ou "ducto"), também designadas por traqueófitas (do grego trachea; "vaso") e por plantas superiores, é um grande agrupamento de plantas (c. 308 312 espécies validamente descritas)[3] constituído pelas plantas terrestres que apresentam tecidos especializados destinados ao transporte dos solutos que alimentam as suas células.[4] Com excepção das plantas avasculares, estas estruturas estão presentes em todos os grupos extantes de plantas,[5] nomeadamente nas ervas, arbustos e árvores pertencentes aos grupos dos licopódios, cavalinhas, pteridófitos, gimnospérmicas (incluindo as coníferas) e angiospérmicas (plantas com flor). Os nomes científicos aplicados ao grupo incluem Tracheophyta[6][2]:251 e Tracheobionta.[7]
O registo fóssil conhecido das plantas vasculares está presente em formações datadas desde o Siluriano Médio até ao presente,[8] ou seja desde há cerca de 425 milhões de anos.[9]
Os sistemas vasculares que caracterizam as plantas vasculares dividem-se no xilema, o conjunto de vasos lenhificados destinado ao transporte de água e minerais, e no floema, não lenhificado, destinado ao transporte da seiva, o soluto que contém, entre outros, os produtos da fotossíntese.
Características
[editar | editar código-fonte]As plantas vasculares diferenciam-se das avasculares por duas características primárias:
- As plantas vasculares apresentam tecido vascular que distribui recursos através da planta. Esta característica permite que as plantas vasculares evoluam para tamanhos maiores do que os possíveis para as plantas não vasculares, que não possuem esses tecidos condutores especializados e, portanto, estão restritas a portes relativamente pequenos.
- No ciclo de vida das plantas vasculares, a principal fase de geração é o esporófito, que geralmente é diplóide, com dois conjuntos de cromossomas por célula. Apenas as células germinais e os gametófitos são haplóides. Em contraste, a principal fase de geração em plantas não vasculares é o gametófito, que é haplóide, ou seja tem um único conjunto de cromossomas por célula. Nestas plantas, apenas o pedúnculo e a cápsula são diplóides.
Em consequência, nas plantas vasculares o esporófito é a forma de geração das plantas comum, sendo o gametófito uma fase temporária que nas pteridófitas consiste num pequeno protalo e nas espermatófitas uma minúscula estruturas contida nas flores das angiospérmicas ou nos cones ou pinhas das gimnospérmicas.
A definição formal da divisão Tracheophyta inclui as características fundamentais atrás apontadas na frase latina «facies diploida xylem et phloem instructa» («fase diploide com xilema e floema»).[2]:251
Um mecanismo possível para a suposta mudança da ênfase da geração haplóide para a geração diploide é a maior eficiência na dispersão de esporos com estruturas diploides mais complexas. Por outras palavras, o aparecimento de um pedúnculo maior e mais complexo para suporte dos esporângios possibilitou a produção de mais esporos e permitiu o desenvolvimento da capacidade de os libertar e transmitir para mais longe de forma mais eficiente. Tais desenvolvimentos podem incluir o aparecimento de mais área fotossintética para a estrutura portadora de esporos, a capacidade de desenvolver raízes independentes e de formação de uma estrutura lenhosa para suporte e possibilitar mais ramificações.
Distribuição de nutrientes
[editar | editar código-fonte]A presença de um sistema vascular permite que a água e os nutrientes sob a forma de solutos inorgânicos sejam extraídos do solo pelas raízes e transportados por toda a planta pelo xilema. Compostos orgânicos, como a sacarose produzida pela fotossíntese nas folhas, são distribuídos através dos tubos crivados do floema.
O xilema é constituído por elementos de vaso nas plantas com flor e por traqueídeos nas restantes plantas vasculares. Em ambos os casos, aquele sistema é formado por células mortas, ocas e com paredes rígidas, dispostas para formar filas de tubos que funcionam no transporte de água. A parede celular dos traqueídeos geralmente contém o polímero lignina.
O floema, no entanto, é constituído por células vivas, designadas por elementos de tubo crivado, entre os quais estão placas de crivo com poros que permitem a passagem das moléculas orgânicas a transportar. As células que constituem os elementos de tubo crivado não possuem organelos como núcleo celular ou ribossomas, mas as células que as rodeiam, as células acompanhantes, funcionam de maneira a manter vivos os tubos crivados.
Transpiração
[editar | editar código-fonte]O composto químico mais abundante em todas as plantas, como aliás em todos os restantes organismos celulares, é a água, substância que desempenha importantes funções estruturais e um papel vital no metabolismo das plantas. A transpiração é o principal processo de movimento da água dentro dos tecidos vegetais. A água é constantemente transpirada da planta através de seus estomas para a atmosfera e substituída pela água do solo absorvida pelas raízes.
Nesse processo, o movimento da água para fora do estoma da folha cria uma depressão (sucção) na coluna de água que preenche os vasos do xilema (os traqueídeos) designada por tensão de transpiração. Este efeito resulta da tensão superficial da água em contacto com as paredes das células do mesófilo e com as superfícies cuja evaporação ocorre quando os estomas estão abertos. As pontes de hidrogénio existentes entre as moléculas da água fazem com que se alinhem e se interliguem e, por essa via, à medida que as moléculas no topo da planta se evaporam, cada uma puxa a próxima para a substituir, a qual, por sua vez, puxa a próxima na linha.
O movimento da água para cima pode ser totalmente passivo ou pode ser assistido pelo movimento da água para as raízes através da osmose. Consequentemente, a transpiração das plantas vasculares requer muito pouca energia e, através dos mecanismos atrás descritos, auxilia a planta a absorver nutrientes do solo sob a forma de sais solúveis arrastados pela água retirada do solo pelas raízes.
Absorção radicular
[editar | editar código-fonte]As células vivas da raiz absorvem passivamente a água na ausência de sucção da transpiração por meio da osmose, criando pressão na raiz. Mesmo nos casos em que não haja evapotranspiração e, portanto, nenhuma tracção da água em direcção aos ramos e folhas, a o movimento da água prossegue devido à acção osmótica. Isso geralmente ocorre em períodos de altas temperaturas, alta humidade, escuridão ou seca.
Condução
[editar | editar código-fonte]Os tecidos do xilema e do floema estão envolvidos nos processos de condução dentro das plantas. Os açúcares são conduzidos e distribuídos por toda a planta no floema, enquanto a água e outros nutrientes através do xilema. A condução ocorre de uma fonte para uma região de absorção para cada nutriente em separado. Os açúcares são produzidos nas folhas (a fonte) pela fotossíntese e transportados para os ramos e raízes para uso no crescimento, respiração celular ou armazenamento. Os minerais são absorvidos nas raízes (a fonte) e transportados para os ramos para permitir a divisão celular e o crescimento.[10]
Sistemática, filogenia e evolução
[editar | editar código-fonte]Sistemática tradicional
[editar | editar código-fonte]Na sistemática clássica, as plantas vasculares eram divididas em dois grandes grupos, considerados ao nível taxonómico de subdivisão ou filo, diferenciados pela presença ou ausência de sementes. Esses agrupamentos, que constituem a estrutura base dos sistemas de classificação anteriores ao desenvolvimento da filogenética, tais como o Sistema de Eichler, o sistema de Engler ou o Sistema de Wettstein, eram:
- Pteridophyta — plantas vasculares sem sementes, com o cormo composto por raiz, caule e folhas. Incluem as samambaias e cavalinhas, entre outras formas.[11] Apesar de a hipótese com maior aceitação até há alguns anos sustentar que os pteridofitos eram um grupo monofilético derivado de um antepassado comum próximo das alga verde, à luz dos conhecimentos obtidos pela filogenática, o grupo é parafilético,[12] composto por duas linhas filogenéticas distintas. O agrupamento é o mais antigo de entre as cormófitas extantes, compreende os fetos (samambaias) e afines, e caracteriza-se por apresentar uma alternância de gerações bem manifesta. Os pteridófitos actuais estão concentradas nos trópicos e áreas montanas húmidas e podem ser desagregados em três classes monofiléticas, duas das quais (cavalinhas e fetos verdadeiros) formam o clado Monilophyta:
- Classe Lycopsida ou Lycopodinae (licopódios)
- Clado Monilophyta
- Classe Sphenopsida ou Equisetinae (cavalinhas)
- Classe Filicopsida ou Filicinae (fetos)
- Spermatophyta — plantas vasculares em que a alternância de gerações ocorre de forma oculta, já que o gametófito se desenvolve dentro das estruturas do esporófito (mesmo nos grupos mais primitivos, onde ainda assim é possível observar anterídios e arquegónios). Nos sistemas tradicionais este grupo era geralmente considerado ao nível taxonómico de divisão, denominada Phanerogamae, Siphonogamae ou Anthophyta, e compreendia as gimnospermas e as angiospermas, agrupadas nas siguintes linhas monofiléticas:
- Subdivisão Gymnospermae
- Subdivisão Angiospermae (magnoliófitas)
Filogenia
[editar | editar código-fonte]A filogenia de um agrupamento tão numeroso e biodiverso continua a não ser consensual. Em consequência é possível encontrar na literatura diferentes árvores filogenéticas, as quais vão sendo progressivamente afinadas à medida que mais dados obtidos pelas técnicas da biologia molecular vão sendo disponibilizados e melhora o conhecimento do registo fóssil. Uma estrutura base para a filogenia das plantas vasculares extantes (isto é considerando apenas os grupos com representantes vivos) é a que consta do seguinte cladograma:
| Trachaeophyta |
| ||||||||||||||||||||||||
Na estrutura atrás representada há que destacar que existe uma evidência molecular muito forte que sustenta a divisão basal entre licófitas e eufilófitas que resulta da presença nas eufilófitas de uma inversão cromossómica com cerca de 30 quilobases no ADN do cloroplasto.[13] Tendo em conta que uma inversão de tantas quilobases é muito rara, e ainda é mais raro que resulte em produtos viáveis, a sua presença é uma forte evidência de monofilia.
Quando se tomam em conta os grupos extintos, as relações são aproximadamente as seguintesː[14][15]
| Tracheophyta |
| ||||||||||||||||||||||||||||||||||||||||||||||||
Com base na filogenia das plantas vasculares proposta em 1997 por Kenrick and Crane,[16] com as modificações para as gimnospérmicas introduzidas em 2011 por Maarten Christenhusz et al.,[17] para as Pteridophyta por Smith et al.,[18] e para as licófitas e fetos por Christenhusz et al. em 2011,[19] chega-se ao seguinte cladograma:
| Polysporangiophyta |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Esta estrutura filogenética é suportada pelos resultados de diversos estudos de biologia molecular.[18][20][21] Apesar disso, alguns investigadores afirma que tomando em conta o registo fóssil é possível chegar a conclusões diferentes, com destaque para o grupo dos Pteridophyta que não será monofilético.[22]
O seguinte mostra as relações filogenéticas e evolucionárias entre os diversos agrupamentos taxonómicos de plantas acima referidos:[23]
| Tracheophyta |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Com base em estudos mais recentes foi possível estabelecer uma filogenia para os grupos extintos e extantes de Euphyllophytina:[24][25][26][27][28]
| Tracheophyta |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
Evolução das traqueófitas
[editar | editar código-fonte] Aspecto general, corte longitudinal do esporângio, tétrada de esporos e detalhe de um esporo com marcação trilete. São visíveis a ramificação dicotómica do caule, a falta de folhas e raízes e os esporângios terminais. |
Muita da informação conhecida sobre as primeiras plantas vasculares e sobre a sua transição para a vida terrestre resulta da análise do registo fóssil, já que todas as linhagens de então estão extintas.
As traqueófitas ancestrais derivaram das primeiras embriófitas, as primeiras plantas que colonizaram a superfície terrestre. Todo indica que as primeiras embriófitas eram pequenas e muito simples na sua estrutura. No caso da linhagem que derivou nas plantas vasculares, o esporófito era basicamente um caule de ramificação dicotómica, inicialmente com alguns milímetros de altura, com o esporângio (onde ocorre a meiose que origina os esporos haploides) ocorrendo no extremo dos ramos. Estas plantas não tinham nem folhas nem raiz. Em alguns casos (como Rhynia no depósito Rhynia Chert da Escócia) a preservação no registo fóssil destas plantas é notável, sendo possível discernir muitos detalhes anatómicos, incluindo estomas, esporos e o tecido vascular dentro do caule.
Através de análises baseadas nesses fósseis, foi possível determinar que os primeiros polisporangiófitos (plantas com esporófitos ramificados) na realidade não produziam verdadeiras células condutoras de água (traqueídeos) no xilema, e que por isso devem ter dependido por completo da pressão de turgência para se manterem erguidos. As células verdadeiramente condutoras de água evoluíram mais tarde e caracterizam o clado das traqueófitas ou «verdadeiras plantas vasculares».[29][30]
Os traqueídeos são células alongadas, com paredes engrossadas, mortas quando maturam. Onde um traqueídeo se conecta com o seguinte estão presentes aberturas características na parede celular secundária (pits em inglês), mas a parede celular primária das células que formaram os traqueídeos é mantida intacta, dando origem à estrutura crivosa conhecida por pit membrane. A água necessita por isso de atravessar as paredes primárias das células para poder avançar. Nas primeiras traqueófitas (representadas por Rhynia) os traqueídeos eram de um tipo distintivo, com certa «resistência ao decaimento» (decay resistance), conferida pela lenhificação das fibras de celulose, que estava presente apenas como uma camada muito delgada. As paredes celulares mais resistentes são as que caracterizam o clado das eutraqueófitas, que inclui todas as plantas vasculares extantes.[29] Nestas espécies, os traqueídeos são fortemente lenhificados permitindo uma condução de água mais eficiente, e fornecem resistência interna, permitindo às plantas crescer muito mais altas.
Estas alterações permitiram a evolução para a predominância do esporófito em detrimento do gametófito, um dos traços mais marcantes da evolução das plantas vasculares.
As relações filogenéticas entre as linhas de plantas vasculares extantes mostram uma divisão basal, que ocorreu no Devónico inferior a médio (há cerca de 400 milhões de anos), que separou a linhagem das lycophytas actuais da linhagem das eufilófitas actuais. Esta divisão está marcada por uma considerável variedade de características morfológicas. Uma bastante evidente é a presença de esperma multiflagelado nas eufilófitas em oposição ao esperma biflagelado das lycophytas e das linhagens separadas de grupos mais antigos (ls briófitos sensu lato). As duas únicas excepções são os géneros Isoetes e Phylloglossum, nos quais o esperma multiflagelado se terá originado independentemente.
As primeiras plantas com semente apareceram no Devónico tardio, e isso levou à típica flora do Mesozoico, dominada por gimnospérmicas. Os fósseis mais antigos de angiospérmicas encontrados até agora datam aproximadamente de há 140 milhões de anos (princípios do Cretácico), e o número de espécies encontrado aumenta de forma rápida com o tempo geológico, em comparação com outras plantas não angiospérmicas (o chamado «abominável mistério» de Darwin).
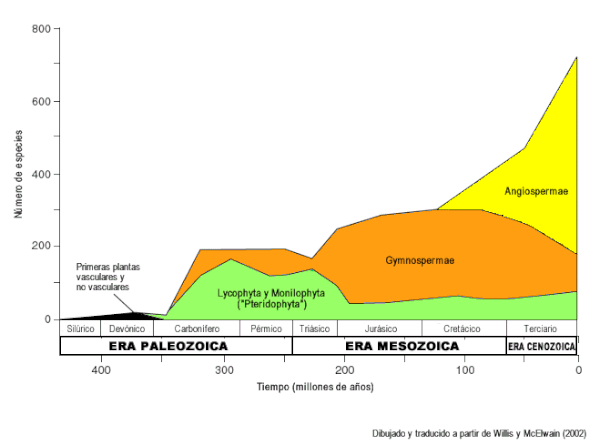 Note-se a intensa radiação das angiospérmicas em comparação com os pteridófitos e gimnospérmicas. Adaptado de Willis & McElwain (2002).[31] |
Referências
- ↑ Sinnott, E. W. 1935. Botany. Principles and Problems, 3d edition. McGraw-Hill, New York.
- ↑ a b c Cavalier-Smith, T. (1998), «A revised six-kingdom system of life» (PDF), Biological Reviews of the Cambridge Philosophical Society, 73: 203–266
- ↑ Christenhusz, M. J. M. & Byng, J. W. (2016). «The number of known plants species in the world and its annual increase». Magnolia Press. Phytotaxa. 261 (3): 201–217. doi:10.11646/phytotaxa.261.3.1
- ↑ Weathers, Kathleen; Likens, Gene; e Strayer, David (2015). Fundamentos de Ciência dos Ecossistemas. [S.l.]: Elsevier Brasil. 336 páginas. ISBN 9788535280517
- ↑ Mário Guimarães Ferri (1984). Botânica: morfologia interna das plantas: anatomia. [S.l.]: NBL Editora. 113 páginas. ISBN 9788521300991
- ↑ Abercrombie, Hickman & Johnson. 1966. A Dictionary of Biology. (Penguin Books
- ↑ «ITIS Standard Report Page: Tracheobionta». Consultado em 20 de setembro de 2013.
- ↑ D. Edwards; Feehan, J. (1980). «Records of Cooksonia-type sporangia from late Wenlock strata in Ireland». Nature. 287 (5777): 41–42. doi:10.1038/287041a0
- ↑ Parfrey, Laura Wegener; Lahr, Daniel J. G.; Knoll, Andrew H.; Katz, Laura A. (16 de agosto de 2011). «Estimating the timing of early eukaryotic diversification with multigene molecular clocks». Proceedings of the National Academy of Sciences of the United States of America. 108 (33): 13624–13629. PMC 3158185
 . PMID 21810989. doi:10.1073/pnas.1110633108
. PMID 21810989. doi:10.1073/pnas.1110633108
- ↑ Chapters 5, 6 and 10 Taiz and Zeiger Plant Physiology 3rd Edition SINAUER 2002
- ↑ SóBiologia.com.br Pteridófitas
- ↑ walter, judd (2009). sistemática vegetal um enfoque filogenético. [S.l.]: artmed
- ↑ Raubeson LA, Jansen RK., "Chloroplast DNA evidence on the ancient evolutionary split in vascular land plants". Science, 1992 Mar 27 ;255(5052):1697-9.
- ↑ Kenrick, Paul & Crane, Peter R. (1997), The Origin and Early Diversification of Land Plants: a Cladistic Study, Washington, D.C.: Smithsonian Institution Press, ISBN 978-1-56098-730-7
- ↑ Paul Gonez & P. Gerrienne 2010, A New Definition and a Lectotypification of the Genus Cooksonia Lang 1937. International Journal of Plant Sciences (Impact Factor: 1.53). 02/2010; 171(2):199-215. DOI: 10.1086/648988
- ↑ Kenrick, Paul & Peter R. Crane. 1997. The Origin and Early Diversification of Land Plants: A Cladistic Study. (Washington, D.C.: Smithsonian Institution Press). ISBN 1-56098-730-8.
- ↑ Christenhusz, Maarten J. M.; Reveal, James L.; Farjon, Aljos; Gardner, Martin F.; Mill, R.R.; Chase, Mark W. (2011). «A new classification and linear sequence of extant gymnosperms» (PDF). Phytotaxa. 19: 55–70
- ↑ a b Smith, Alan R.; Pryer, Kathleen M.; Schuettpelz, E.; Korall, P.; Schneider, H.; Wolf, Paul G. (2006). «A classification for extant ferns» (PDF). Taxon. 55 (3): 705–731. doi:10.2307/25065646
- ↑ Christenhusz, Maarten J. M.; Zhang, Xian-Chun; Schneider, Harald (2011). «A linear sequence of extant families and genera of lycophytes and ferns» (PDF). Phytotaxa. 19: 7–54
- ↑ Pryer, K. M.; Schneider, H.; Smith, AR; Cranfill, R; Wolf, PG; Hunt, JS; Sipes, SD (2001). «Horsetails and ferns are a monophyletic group and the closest living relatives to seed plants». Nature. 409 (6820): 618–22. PMID 11214320. doi:10.1038/35054555
- ↑ Pryer, K. M.; Schuettpelz, E.; Wolf, P. G.; Schneider, H.; Smith, A. R.; Cranfill, R. (2004). «Phylogeny and evolution of ferns (monilophytes) with a focus on the early leptosporangiate divergences». American Journal of Botany. 91: 1582–1598. doi:10.3732/ajb.91.10.1582
- ↑ Rothwell, G.W. & Nixon, K.C. (2006). «How Does the Inclusion of Fossil Data Change Our Conclusions about the Phylogenetic History of Euphyllophytes?». International Journal of Plant Sciences. 167 (3): 737–749. doi:10.1086/503298
- ↑ Kathleen M. Pryer, Eric Schuettpelz, Paul G. Wolf, Harald Schneider, Alan R. Smith and Raymond Cranfill (2004), «Phylogeny and evolution of ferns (monilophytes) with a focus on the early leptosporangiate divergences», American Journal of Botany, 91 (10): 1582-1598, doi:10.3732/ajb.91.10.1582
- ↑ Kenrick, Paul; Crane, Peter R. (1997), The Origin and Early Diversification of Land Plants: A Cladistic Study, ISBN 1-56098-730-8, Washington, D. C.: Smithsonian Institution Press, pp. 339–340
- ↑ Crane, P.R.; Herendeen, P.; Friis, E.M. (2004), «Fossils and plant phylogeny», American Journal of Botany, 91 (10): 1683–99, PMID 21652317, doi:10.3732/ajb.91.10.1683, consultado em 27 de janeiro de 2011
- ↑ Gonez, P. & Gerrienne, P. (2010a), «A New Definition and a Lectotypification of the Genus Cooksonia Lang 1937», International Journal of Plant Sciences, 171 (2): 199–215, doi:10.1086/648988
- ↑ Anderson, Anderson & Cleal (2007), «Brief history of the gymnosperms: classification, biodiversity, phytogeography and ecology», ISBN 978-1-919976-39-6, SANBI, Strelitzia, 20
- ↑ Pelletier (2012), Empire biota: taxonomy and evolution 2nd ed, ISBN 1329874005, Lulu.com
- ↑ a b Kenrick, P y PR Crane. 1997a. The origin and early diversification of land plants: A cladistic study. Smithsonian Institution Press, Washington, DC.
- ↑ Kenrick, P y PR Crane. 1997b. The origin and early evolution of plants on land. Nature 389: 33-39.
- ↑ Willis y McElwain. 2002. «Flowering Plant Origins» en: The Evolution of Plants, capítulo 6.
Bibliografia
[editar | editar código-fonte]- Cracraft, Joel; Donoghue, Michael J., eds. (2004). Assembling the Tree of Life. [S.l.]: Oxford University Press. ISBN 978-0-19-972960-9
- Cantino, Philip D.; Doyle, James A.; Graham, Sean W.; Judd, Walter S.; Olmstead, Richard G.; Soltis, Douglas E.; Soltis, Pamela S.; Donoghue, Michael J. (1 de agosto de 2007). «Towards a Phylogenetic Nomenclature of Tracheophyta». Taxon. 56 (3). 822 páginas. doi:10.2307/25065865
- Kenrick, P. (29 de junho de 2000). «The relationships of vascular plants». Philosophical Transactions of the Royal Society B: Biological Sciences. 355 (1398): 847–855. PMC 1692788
 . PMID 10905613. doi:10.1098/rstb.2000.0619
. PMID 10905613. doi:10.1098/rstb.2000.0619 - Pryer, Kathleen M.; Schneider, Harald; Magallon, Susana. The radiation of vascular plants (PDF). [S.l.: s.n.] pp. 138–153, in Cracraft & Donoghue (2004)
Ver também
[editar | editar código-fonte]- Plantas semelhantes a fetos:
- Planta avascular
Ligações externas
[editar | editar código-fonte]- «Univ.California, Berkeley Plantas» (em inglês)

