Tirosina
| Tirosina Alerta sobre risco à saúde | |
|---|---|

|
|
| Nome IUPAC | (S)-2-Amino-3-(4-hydroxyphenyl)-propanoic acid |
| Identificadores | |
| Número CAS | ,(L) 556-02-5, (D) |
| PubChem | |
| DrugBank | NUTR00059 |
| SMILES |
|
| Propriedades | |
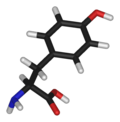
| Fórmula química | C9H11NO3 |
| Massa molar | 181.17 g mol-1 |
| Densidade | 1,46 g·cm-3 (25 °C) [1] |
| Ponto de fusão |
342–344 °C (Zersetzung) [2] |
| Solubilidade em água | *leicht löslich in Säuren und Laugen[2] * schwer löslich in Wasser (0,38 g·l-1 bei 20 °C) [1] * unlöslich in Ethanol, Ether und Aceton[2] |
| Riscos associados | |
| LD50 | 5110 mg·kg-1 (Camundongo, via oral) [3] |
| Compostos relacionados | |
| Aminoácidos relacionados | Fenilalanina Tironina (4-(4-hidroxifenoxi)-L-fenilalanina) Levodopa (outra hidroxila no anel benzênico) Alfa-metil-p-tirosina |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |


A tirosina (abreviadamente Tyr ou Y)[4] ou 4-hidroxifenilalanina, É um dos 20 aminoácidos que fazem parte das proteínas. É um α-aminoácido com uma cadeia lateral formada por CH2 ligado a um grupo fenol, o que a torna uma cadeia lateral cíclica aromática com um grupo OH, que lhe confere um carácter polar branco.
Os seus codões são o UAC e o UAU. É um aminoácido proteinogénico não essencial. O seu nome tem origem do grego tyri, que significa queijo, dado que foi descoberta em 1846 pelo químico alemão Justus von Liebig na proteína caseína do queijo.[5][6] O seu grupo funcional é designado tirosil.
Funções[editar | editar código-fonte]
Para além do seu papel como componente das proteínas, a tirosina tem funções especiais devido ao seu grupo fenol. Constitui parte importante das proteínas que intervêm em processos de transdução de sinais na célula. Funciona como um receptor de grupos fosfato que se transferem por meio de proteínas quinases. A fosforilação do seu grupo hidroxilo modifica a actividade da proteína alvo.
Um resíduo de tirosina tem também uma função muito importante na fotossíntese. No fotossistema II dos cloroplastos actua como um doador de electrões na redução da clorofila oxidada. Neste processo, a tirosina sofre desprotonação do seu grupo OH fenólico. Este radical é depois reduzido no fotossistema II pelos clusters de manganésio.
Fontes alimentares[editar | editar código-fonte]
A tirosina pode sintetizar-se no corpo a partir de fenilalanina, pelo que não é essencial. A tirosina abunda em vários alimentos ricos em conteúdo proteico, como soja, frango, peru, peixe, amendoins, amêndoas, abacates, produtos lácteos, feijão de Lima, sementes de cabaça, e de sésamo.[7]
Biossíntese[editar | editar código-fonte]
Não pode ser completamente sintetizada pelos animais, apesar de poder ser gerada por hidroxilação da fenilalanina, se esta última existir em excesso.
Esse aminoácido também é utilizado na síntese da adrenalina e da dopamina, neurotransmissores do corpo humano.
Referências
- ↑ a b Sicherheitsdatenblatt des Herstellers Merck
- ↑ a b c Hermann Römpp, Jürgen Falbe und Manfred Regitz: Römpp Lexikon Chemie. 9. Auflage, Georg Thieme Verlag, Stuttgart, 1992.
- ↑ DrugBank NUTR00059
- ↑ IUPAC-IUBMB Joint Commission on Biochemical Nomenclature (1983). «Nomenclature and Symbolism for Amino Acids and Peptides». Recommendations on Organic & Biochemical Nomenclature, Symbols & Terminology. Consultado em 17 de maio de 2007
- ↑ «Tyrosine». The Columbia Electronic Encyclopedia, 6th ed. Infoplease.com — Columbia University Press. 2007. Consultado em 20 de abril de 2008
- ↑ Douglas Harper (2001). «Tyrosine». Online Etymology Dictionary. Consultado em 20 de abril de 2008
- ↑ «Tyrosine». University of Maryland Medical Center. Consultado em 17 de março de 2011. Cópia arquivada em 6 de abril de 2020

