Imunoglobulina: diferenças entre revisões
| Linha 67: | Linha 67: | ||
|} |
|} |
||
Os anticorpos podem existir em diferentes formas conhecidas como isotipos ou classes. Nos mamíferos existem cinco isotipos diferentes de anticorpos, conhecidos como [[IgA]], [[IgD]], [[IgE]],[[IgG]] e [[IgM]] |
Os anticorpos podem existir em diferentes formas conhecidas como isotipos ou classes. Nos mamíferos existem cinco isotipos diferentes de anticorpos, conhecidos como [[IgA]], [[IgD]], [[IgE]],[[IgG]] e [[IgM]] com diferentes cadeias pesadas. Possuem o prefixo "Ig" que significa imunoglobulina, e diferenciam-se pelas suas propriedades biológicas, localizações funcionais e habilidade para lidar com diferentes antígenos, como mostrado na tabela ao lado.<ref name = woof>{{citar periódico|autor=Woof J, Burton D|título=Human antibody-Fc receptor interactions illuminated by crystal structures|revista=Nat Rev Immunol|volume=4|número=2|páginas=89–99|ano=2004|pmid=15040582|doi=10.1038/nri1266}}</ref> |
||
O isótipo altera-se durante o desenvolvimento e a activação dos linfócitos B. Antes da maturação destes últimos, quando ainda não foram expostos ao seu antígeno, são conhecidos como linfócitos B virgens e só expressam o isótipo IgM na sua forma ancorada à superficie celular. Os linfócitos começão a expressar tanto IgM como IgD ligadas à membrana quando alcançam a maturação e nesse momento estão prontos para responder ao seu antígeno.<ref name=Goding>{{citar periódico|autor=Goding J|título=Allotypes of IgM and IgD receptors in the mouse: a probe for lymphocyte differentiation|revista=Contemp Top Immunobiol|volume=8|número=|páginas=203–43|pmid=357078}}</ref> A activação dos linfócitos B continua ao encontro e ligação deste com o seu antígeno, o que estimula a célula para que se divida e se [[diferenciação celular|diferencie]] numa célula produtora de anticorpos denominada [[célula plasmática|plasmática]]. Nesta forma activada, os linfocitos B começam a [[secreção|segregar]] anticorpos em vez de ancorá-los à membrana. Algumas células filhas dos linfócitos B activados sofrem uma [[mudança de classe das imunoglobulinas|mudança isotípica]], um mecanismo que faz com que a produção de anticorpos nas formas IgM ou IgD se trasmute para os outros tipos, IgE, IgA ou IgG, que desempenham diferentes funções no sistema imunitário. |
|||
== Estrutura == |
== Estrutura == |
||
Revisão das 18h35min de 24 de fevereiro de 2018
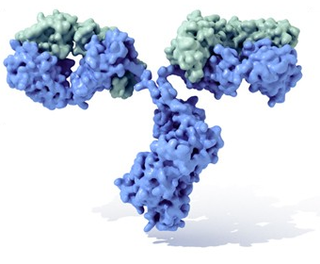
Os anticorpos (também conhecidos como imunoglobulinas, abreviado Ig) são glicoproteínas do tipo gamaglobulina, a fracção de globulinas mais abundante no plasma sanguíneo. Podem encontrar-se em forma solúvel no sangue ou noutros fluídos corporais dos vertebrados, ou podem estar inseridos na membrana plasmática, onde actuam como receptores nos linfócitos B e são empregues pelo sistema imunitário para identificar e neutralizar elementos estranhos tais como bactérias, vírus, parasitas etc.[1] Em geral, considera-se que tanto anticorpo como imunoglobulina são termos equivalentes, sendo que o primeiro termo faz referência à função, enquanto que o segundo alude à estrutura. O termo gamaglobulina refere-se às propriedades electroforéticas das imunoglobulinas solúveis no soro sanguíneo, se bem que algumas imunoglobulinas migram com as fracções alfa, beta e inclusive com a albumina.
Um anticorpo é tipicamente constituído por unidades estruturais básicas, cada uma das quais com duas grandes cadeias pesadas e duas cadeias leves de menor peso molecular. A molécula de anticorpo tem forma de Y; as extremidades dos braços do Y são o fragmento Fab por onde se ligam ao antígeno; o pé do Y é o fragmento Fc. As moléculas dos anticorpos podem aparecer em separado, como monómeros, ou associarem-se entre si formando dímeros com duas unidades ou pentámeros com cinco unidades. Os anticorpos são sintetizados por um tipo de leucócito denominado linfócito B ou célula B. Existem diferentes tipos de anticorpos, chamados isótipos, diferenciados pela forma da cadeia pesada que apresentem.São conhecidas cinco classes de isótipos em mamíferos que desempenham funções diferentes, contribuíndo para dirigir a resposta imunitária conforme cada tipo de corpo estranho que encontram, que são: IgA, IgD, IgE, IgG e IgM.[2]
Embora a estrutura geral de todos os anticorpos seja muito semelhante, uma pequena região do ápice da proteína é extremamente variável, o qual permite a existência de milhões de anticorpos, cada um com uma extremidade ligeiramente diferente. Esta parte da proteína é conhecida como região hipervariável e dá lugar a milhões de anticorpos diferentes. Cada uma destas variantes pode ligar-se a um "alvo" diferente, que é o antígeno[3] Esta enorme diversidade de anticorpos permite ao sistema imunitário reconhecer uma diversidade igualmente elevada de antígenos. O anticorpo não reconhece o antígeno na sua globalidade, mas apenas reconhece certas partes dele. Essa parte do antígeno reconhecida pelo anticorpo denomina-se epítopo. Um antígeno pode ter múltiplos epítopos na sua superfície. Estes epítopos unem-se ao seu anticorpo numa interacção altamente específica que se denomina adaptação induzida, que permite aos anticorpos identificar e unir-se apenas ao seu único antígeno no meio dos milhões de moléculas diferentes que compõem um organismo.
O reconhecimento dum antígeno por um anticorpo deixa o antígeno marcado para ser atacado por outros componentes do sistema imunitário. Os anticorpos também podem neutralizar os seus objectivos directamente, mediante, por exemplo, a ligação a uma porção dum patógeno necessária para que este provoque uma infecção.
A extensa população de anticorpos e a sua diversidade é gerada por combinações ao acaso de um jogo de segmentos genéticos que codificam diferentes lugares de ligação ao antígeno (ou parátopos), que posteriormente, durante o desenvolvimento do linfócito, sofrem mutações aleatórias nesta zona do gene do anticorpo, o qual origina uma diversidade ainda maior.[2][4] Os genes dos anticorpos também se reorganizam num processo conhecido como mudança de classe das imunoglobulinas que troca a cadeia pesada por outra, criando um isótipo de anticorpo diferente mantendo, contudo, a região variável específica para o antígeno alvo. Isto possibilita que um só anticorpo possa ser usado pelas diferentes partes do sistema imunitário. A produção de anticorpos é a função principal do sistema imunitário humoral.[5]

História
Em 1890 foi quando se começou o estudo dos anticorpos, quando Emil Adolf von Behring e Shibasaburo Kitasato descreveram a actividade dos anticorpos contra as toxinas da difteria e do tétano. Behring e Kitasato propuseram a teoria da imunidade humoral, que estabelecia a existência dum mediador no soro sanguíneo que poderia reagir com um antígeno estranho, dando-lhe o nome de anticorpo.[9][10] A sua ideia fez com que, em 1897, Paul Ehrlich proposesse a teoria da cadeia lateral sobre a interacção entre antígeno e anticorpo e elaborasse a hipótese de que existiam receptores (descritos como "correntes laterais") na superfície das células que se poderiam unir especificamente a toxinas — numa interacção de tipo chave e fechadura— e que esta reacção de acoplamento era a causa da produção de anticorpos.[11]
Em 1904, seguindo a ideia de outros investigadores de que os anticorpos se encontravam livres no sangue, Almroth Wright sugeriu que os anticorpos solúveis recubriam as bactérias para assinalá-las para a sua fagocitose e destruição num processo denominado opsonização.[12]

Na década de 1920, Michael Heidelberger e Oswald Avery descobriram a natureza dos anticorpos postulados ao observar que os antígenos podiam ser precipitados por eles e demonstrando que estes eram um tipo de proteínas.[13]

Em finais da década de 1930 John Marrack examinou as propriedades bioquímicas das uniões antígeno-anticorpo.[14] Logo, na década de 1940 teve lugar o próximo passo de maior importância, quando Linus Pauling confirmou a teoria da chave e a fechadura proposta por Ehrlich mostrando que as interacções entre anticorpos e antígenos dependiam mais da sua forma do que da sua composição química.[15] Em 1948, Astrid Fagreaus descobriu que os linfócitos B transformados em células plasmáticas eram responsáveis pela produção de anticorpos.[16]
Os trabalhos de investigação que se seguiram concentraram-se na caracterização da estrutura molecular dos anticorpos:
- No começo da década de 1960 produziu-se o principal avanço neste sentido, com a descoberta por Gerald M. Edelman e Joseph Gally da cadeia leve,[17] e a compreensão de que esta era idêntica à proteína de Bence Jones descrita em 1845 por Henry Bence Jones.[18] Edelman continuou com a descoberta de que os anticorpos estavam compostos por cadeias leves e pesadas unidas por ligações dissulfeto.
- Na mesma época, Rodney Porter caracterizou as regiões de ligação do antígeno no anticorpo (Fab ou F antigen-binding) e a cola do anticorpo (Fc) no tipo IgG.[19] Conjuntamente, estes cientistas deduziram a estrutura e a sequência completa de aminoácidos da IgG, pelo qual receberam ex aequo o prémio Nobel de fisiologia e medicina em 1972.[19]
- Apesar de a maioria destes primeiros estudos se centrarem nas IgM e IgG, identificaram-se também outros isótipos de imunoglobulinas na década de 1960: Thomas Tomasi descobriu os anticorpos secretados (IgA)[20] e David S. Rowe e John L. Fahey identificaram a IgD,[21] e a IgE foi identificada por Kikishige Ishizaka e Teruki Ishizaka como uma classe de anticorpos envolvidos nas reacções alérgicas.[22]
- Em 1975 César Milstein e Georges J.F. Köhler idealizaram o método para a produção de anticorpos monoclonais.[23] Em 1976, os estudos genéticos revelaram a base da vasta diversidade dos anticorpos quando Susumu Tonegawa identificou a recombinação somática dos genes de imunoglobulina.[24]
Formas de anticorpos

Os linfócitos B activados diferenciam-se em células plasmáticas, cuja função é a produção de anticorpos solúveis ou ainda em linfócitos B de memória, que sobrevivem no organismo durante os anos seguintes para possibilitar que o sistema imunitário se lembre do antígeno e responda mais rápido a futuras exposições ao agente imunógeno.[25] Os anticorpos são, portanto, um produto essencial do sistema imunitário adaptativo que aprendem e lembram-se das respostas a patógenos invasores. Os anticorpos encontram-se em duas formas: na forma solúvel segregada no sangue e noutros fluídos do corpo e na forma unida à membrana celular que está ancorada à superfície dum linfócito B.
Forma solúvel
Os anticorpos solúveis são segregados por um linfócito B activado (na sua forma de célula plasmática) para unir-se a substâncias estranhas e sinalizá-las para a sua destruição pelo resto do sistema imunitário. Também se lhes poderia chamar anticorpos livres até que se unam a um antígeno e acabem como parte dum complexo antígeno-anticorpo ou denominá-los anticorpos segregados. Nesta forma solúvel as imunoglobulinas unem-se a moléculas adicionais. Nas IgM, por exemplo, encontramos uma glicoproteína unida à fracção constante através de pontes dissulfeto com cerca de 15 KDa, chamada cadeia J. Ao isotipo IgA une-se-lhe a chamada "peça de secreção". Trata-se duma glicoproteína que se forma nas células epiteliais e glândulas exócrinas e que, posteriormente, se une à imunoglobulina para facilitar a sua secreção.[26]
Forma ancorada à membrana
A forma ancorada à membrana de um anticorpo poder-se-ia chamar imunoglobulina de superfície (sIg) ou imunoglobulina de membrana (mIg), uma vez que não é segregado: sempre está associado à membrana plasmática. Faz parte do receptor do linfócito B (BCR), que permite que este detecte quando um antígeno específico está presente no organismo, desencadeando a activação do linfócito B.[27] O BCR é composto por anticorpos IgD ou IgM ligados à superfície de membrana e aos seus heterodímeros associados Ig-α e Ig-β que têm capacidade de realizar a transdução de sinais do reconhecimento do anticorpo ao interior da célula.[28] Um linfócito B humano comum tem entre 50 000 e 100 000 anticorpos ligados à sua superfície.[28] Após o acoplamento do antígeno, estes agrupam-se formando grandes adesivos cujo diâmetro pode ser superior a 1μm em balsas lipídicas que isolam os BCR (receptores da célula B) da maior parte dos restantes receptores de sinalização celular.[28] Estes adesivos poderiam melhorar a eficiência da resposta imune celular.[29] Nos seres humanos, a superfície celular encontra-se livre de outras proteínas ao redor dos receptores dos linfócitos B em distâncias com alguns milhares de ångströms,[28] o que reduz de tal maneira as influências que competem com a sua função, que pode-se dizer que isola os BCR.
Isotipos
| Nome | Tipos | Descrição | Complexos |
| IgA | 2 | Encontrado em áreas de mucosas, como os intestinos, trato respiratório e trato urogenital, prevenindo sua colonização por patógenos. É passado para o neonato via aleitamento.[30] | 
|
| IgD | 1 | Funciona principalmente como uma receptor de antígeno nas células B virgens.[31] Suas funções são menos definidas do que as dos outros isotérmicos. | |
| IgE | 1 | Se liga a alérgenos e ativam os mastócitos - responsáveis pela liberação de histamina- e basófilos. (Reação de hipersensibilidade Inata)=alergia. Também protege contra parasitas helmintos.[5] | |
| IgG | 4 | Participa da opsonização; ativação do sistema de complemento (inflamação e fagocitose); citotoxicidade mediada por células dependentes de anticorpo; Inibição por feedback das células B. Além de ser o único tipo de Ig que ultrapassa a barreira placentária[5] | |
| IgM | 1 | Expressa na superfície das células B virgens. Elimina patógenos nos estágios iniciais da imunidade mediada pelas células B antes que haja IgG suficiente - ativação do sistema de complemento.[5][31] |
Os anticorpos podem existir em diferentes formas conhecidas como isotipos ou classes. Nos mamíferos existem cinco isotipos diferentes de anticorpos, conhecidos como IgA, IgD, IgE,IgG e IgM com diferentes cadeias pesadas. Possuem o prefixo "Ig" que significa imunoglobulina, e diferenciam-se pelas suas propriedades biológicas, localizações funcionais e habilidade para lidar com diferentes antígenos, como mostrado na tabela ao lado.[32]
O isótipo altera-se durante o desenvolvimento e a activação dos linfócitos B. Antes da maturação destes últimos, quando ainda não foram expostos ao seu antígeno, são conhecidos como linfócitos B virgens e só expressam o isótipo IgM na sua forma ancorada à superficie celular. Os linfócitos começão a expressar tanto IgM como IgD ligadas à membrana quando alcançam a maturação e nesse momento estão prontos para responder ao seu antígeno.[33] A activação dos linfócitos B continua ao encontro e ligação deste com o seu antígeno, o que estimula a célula para que se divida e se diferencie numa célula produtora de anticorpos denominada plasmática. Nesta forma activada, os linfocitos B começam a segregar anticorpos em vez de ancorá-los à membrana. Algumas células filhas dos linfócitos B activados sofrem uma mudança isotípica, um mecanismo que faz com que a produção de anticorpos nas formas IgM ou IgD se trasmute para os outros tipos, IgE, IgA ou IgG, que desempenham diferentes funções no sistema imunitário.
Estrutura

a) Cadeia Leve
b) Cadeia Pesada
c) Pontes Dissulfeto
As imunoglobulinas são moléculas e possuem estrutura tridimensional. Qualquer imunoglobulina possui duas cadeias pesadas. Cada uma das cadeias pesadas está unida a uma cadeia leve por duas pontes de enxofre e as duas cadeias pesadas estão unidas entre si.
Existem cinco tipos de cadeias pesadas e estes tipos são caracterizados pela seqüência de aminoácidos na cadeia. Para cada tipo de cadeia pesada há uma classe de Ig.
Existem dois tipos de cadeia leve. Em cada molécula de Ig as duas cadeias são idênticas.
A Região Constante determina as funções efetoras do Anticorpo, enquanto a Região Variável determina a especificidade para cada antígeno.
Anti-DNA
Os anticorpos anti-DNA são duas populações de auto anticorpos: uma dirigida para DNA de dupla cadeia (dsDNA) e outra para DNA de cadeia única (ssDNA). O anti-ds DNA é o único anticorpo claramente implicado na patogênese de LES (Lupus Eritematoso Sistêmico) com formação de imuncomplexos, deposição renal e inflamação local.
Referências
- ↑ Litman GW, Rast JP, Shamblott MJ; et al. (1993). «Phylogenetic diversification of immunoglobulin genes and the antibody repertoire». Mol. Biol. Evol. 10 (1): 60–72. PMID 8450761
- ↑ a b Eleonora Market, F. Nina Papavasiliou (2003) V(D)J Recombination and the Evolution of the Adaptive Immune System PLoS Biology1(1): e16.doi:10.1371/journal.pbio.0000016
- ↑ Janeway CA, Jr; et al. (2001). Immunobiology. 5th ed. ed. [S.l.]: Garland Publishing. ISBN 0-8153-3642-X
- ↑ Diaz M, Casali P (2002). «Somatic immunoglobulin hypermutation». Curr Opin Immunol. 14 (2): 235–40. PMID 11869898. doi:10.1016/S0952-7915(02)00327-8
- ↑ a b c d Pier GB, Lyczak JB, Wetzler LM (2004). Immunology, Infection, and Immunity. [S.l.]: ASM Press. ISBN 1-55581-246-5 Erro de citação: Código
<ref>inválido; o nome "Pier" é definido mais de uma vez com conteúdos diferentes - ↑ Padlan, Eduardo (1994). «Anatomy of the antibody molecule». Mol. Immunol. 31 (3): 169–217. PMID 8114766. doi:10.1016/0161-5890(94)90001-9
- ↑ «New Sculpture Portraying Human Antibody as Protective Angel Installed on Scripps Florida Campus». Consultado em 12 de dezembro de 2008. Cópia arquivada em 18 de novembro de 2010
- ↑ «Protein sculpture inspired by Vitruvian Man». Consultado em 12 de dezembro de 2008. Cópia arquivada em 18 de novembro de 2010
- ↑ «Emil von Behring — Biography». Consultado em 5 de junho de 2007. Cópia arquivada em 18 de novembro de 2010
- ↑ AGN (1931). «The Late Baron Shibasaburo Kitasato». Canadian Medical Association Journal. 25 (2): 206. PMC 382621
 . PMID 20318414
. PMID 20318414
- ↑ Winau F, Westphal O, Winau R (2004). «Paul Ehrlich—in search of the magic bullet». Microbes Infect. 6 (8): 786–789. PMID 15207826. doi:10.1016/j.micinf.2004.04.003
- ↑ Silverstein AM (2003). «Cellular versus humoral immunology: a century-long dispute». Nat. Immunol. 4 (5): 425–428. PMID 12719732. doi:10.1038/ni0503-425
- ↑ Van Epps HL (2006). «Michael Heidelberger and the demystification of antibodies» (PDF). J. Exp. Med. 203 (1): 5. PMC 2118068
 . PMID 16523537. doi:10.1084/jem.2031fta. Cópia arquivada (PDF) em 18 de novembro de 2010
. PMID 16523537. doi:10.1084/jem.2031fta. Cópia arquivada (PDF) em 18 de novembro de 2010
- ↑ Marrack, JR (1938). Chemistry of antigens and antibodies 2nd ed. London: His Majesty's Stationery Office. OCLC 3220539
- ↑ «The Linus Pauling Papers: How Antibodies and Enzymes Work». Consultado em 5 de junho de 2007. Cópia arquivada em 18 de novembro de 2010
- ↑ Silverstein AM (2004). «Labeled antigens and antibodies: the evolution of magic markers and magic bullets» (PDF). Nat. Immunol. 5 (12): 1211–1217. PMID 15549122. doi:10.1038/ni1140. Arquivado do original (PDF) em 18 de dezembro de 2009
- ↑ Edelman GM, Gally JA (1962). «The nature of Bence-Jones proteins. Chemical similarities to polypetide chains of myeloma globulins and normal gamma-globulins». J. Exp. Med. 116 (2): 207–227. PMC 2137388
 . PMID 13889153. doi:10.1084/jem.116.2.207
. PMID 13889153. doi:10.1084/jem.116.2.207
- ↑ Stevens FJ, Solomon A, Schiffer M (1991). «Bence Jones proteins: a powerful tool for the fundamental study of protein chemistry and pathophysiology». Biochemistry. 30 (28): 6803–6805. PMID 2069946. doi:10.1021/bi00242a001
- ↑ a b Raju TN (1999). «The Nobel chronicles. 1972: Gerald M Edelman (b 1929) and Rodney R Porter (1917–85)». Lancet. 354 (9183): 1040. PMID 10501404. doi:10.1016/S0140-6736(05)76658-7
- ↑ Tomasi TB (1992). «The discovery of secretory IgA and the mucosal immune system». Immunol. Today. 13 (10): 416–418. PMID 1343085. doi:10.1016/0167-5699(92)90093-M
- ↑ Preud'homme JL; Petit I; Barra A; Morel F; Lecron JC; Lelièvre E (2000). «Structural and functional properties of membrane and secreted IgD». Mol. Immunol. 37 (15): 871–887. PMID 11282392. doi:10.1016/S0161-5890(01)00006-2
- ↑ Johansson SG (2006). «The discovery of immunoglobulin E». Allergy and Asthma Proceedings. 27 (2 Suppl 1): S3–6. PMID 16722325
- ↑ Raju, T N (2000). «The Nobel chronicles. 1984: Niels Kai Jerne, (1911-94); César Milstein (b 1926); and Georges Jean Franz Köhler (1946-95)». The Lancet. 355 (9197). 75 páginas. PMID 10615922. doi:10.1016/S0140-6736(05)72025-0
- ↑ Hozumi N, Tonegawa S (1976). «Evidence for somatic rearrangement of immunoglobulin genes coding for variable and constant regions». Proc. Natl. Acad. Sci. U.S.A. 73 (10): 3628–3632. PMC 431171
 . PMID 824647. doi:10.1073/pnas.73.10.3628
. PMID 824647. doi:10.1073/pnas.73.10.3628
- ↑ Borghesi L, Milcarek C (2006). «From B cell to plasma cell: regulation of V(D)J recombination and antibody secretion». Immunol Res. 36 (1-3): 27–32. PMID 17337763. doi:10.1385/IR:36:1:27
- ↑ Peña Martínez, J (Coordinador) (1998). Imunologia. [S.l.]: Pirámide. ISBN 84-368-1213-1 Disponivel uma versão online em http://www.uco.es
- ↑ Parker D (1993). «T cell-dependent B cell activation». Annu. Rev. Immunol. 11 (1): 331–360. PMID 8476565. doi:10.1146/annurev.iy.11.040193.001555
- ↑ a b c d Wintrobe, Maxwell Myer (2004). John G. Greer; John Foerster; John N Lukens; George M Rodgers; Frixos Paraskevas, eds. Wintrobe's clinical hematology 11 ed. Hagerstown, MD: Lippincott Williams & Wilkins. pp. 453–456. ISBN 978-0-7817-3650-3
- ↑ Tolar P, Sohn HW, Pierce SK (Fevereiro de 2008). «Viewing the antigen-induced initiation of B-cell activation in living cells». Immunol. Rev. 221 (1): 64–76. PMID 18275475. doi:10.1111/j.1600-065X.2008.00583.x
- ↑ Underdown B, Schiff J (1986). «Immunoglobulin A: strategic defense initiative at the mucosal surface». Annu Rev Immunol. 4: 389-417. PMID 3518747
- ↑ a b Geisberger R, Lamers M, Achatz G (2006). «The riddle of the dual expression of IgM and IgD». Immunology. 118 (4): 429-37. PMID 16895553
- ↑ Woof J, Burton D (2004). «Human antibody-Fc receptor interactions illuminated by crystal structures». Nat Rev Immunol. 4 (2): 89–99. PMID 15040582. doi:10.1038/nri1266
- ↑ Goding J. «Allotypes of IgM and IgD receptors in the mouse: a probe for lymphocyte differentiation». Contemp Top Immunobiol. 8: 203–43. PMID 357078
