Anandamida
Anandamida, também conhecida como N-araquidonoiletanolamina (AEA), é um ácido graxo que atua como neurotransmissor derivado do metabolismo não oxidativo do ácido araquidônico, um ácido graxo essencial da família dos ômega 6. O nome é uma junção dos termos ananda (que em sânscrito significa "alegria", "felicidade") e amida.[1][2] É sintetizada a partir do N-araquidonoilfosfatidiletanolamina através de múltiplas vias metabólicas.[3] É hidrolisada pela enzima FAAH (amida hidrolase de ácidos graxos),[4] sendo convertida em etanolamina e ácido araquidônico. Assim sendo, inibidores da FAAH levam à elevação dos níveis de anandamida e estão sendo pesquisados para fins terapêuticos.[5][6]
| Anandamida Alerta sobre risco à saúde | |
|---|---|
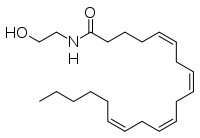
| |
| Nome IUPAC | (5Z,8Z,11Z,14Z)-N-(2-hydroxyethyl)icosa-5,8,11,14-tetraenamide |
| Outros nomes | N-arachidonoylethanolamine arachidonoylethanolamide |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| MeSH | |
| ChEBI | |
| SMILES |
|
| InChI | 1/C22H37NO2/c1-2-3-4-5-6-7-8-9-10-11-12-13-14-15-16-17-18-19-22(25)23-20-21-24/h6-7,9-10,12-13,15-16,24H,2-5,8,11,14,17-21H2,1H3,(H,23,25)/b7-6-,10-9-,13-12-,16-15-
|
| Propriedades | |
| Fórmula molecular | C22H37NO2 |
| Massa molar | 347.53 g/mol |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Funções fisiológicas[editar | editar código-fonte]
Os efeitos fisiológicos da anandamida podem se manifestar tanto no sistema nervoso central quanto no sistema nervoso periférico, sendo mediados primariamente pelos receptores canabinoides CB1 no sistema nervoso central e pelos receptores canabinoides CB2 no sistema nervoso periférico,[7] estando estes últimos envolvidos principalmente em funções do sistema imunológico. Receptores canabinoides foram originalmente descobertos como sendo sensíveis ao Δ9-tetraidrocanabinol, principal canabinoide psicoativo encontrado na Cannabis. A descoberta da anandamida veio com a pesquisa dos receptores CB1 e CB2, de modo que era inevitável que houvesse uma substância endógena que tivesse afinidade pelos mesmos.
A anandamida vem se mostrando prejudicial à memória de ratos[8] Estudos sobre o papel desempenhado por essa substância no comportamento humano, como em padrões de sono e alimentação, bem como no alívio da dor, ainda estão em andamento.
Esta substância também apresenta um importante papel na etapa de nidação do embrião no útero materno. Portanto, canabinoides como o THC podem influenciar os processos durante os estágios iniciais da gravidez.[9] Picos de anandamida no plasma ocorrem na ovulação, de modo que há correlação com picos nos níveis de estradiol e gonadotrofina, sugerindo que estes hormônios podem estar relacionados com a regulação dos níveis de anandamida.[10] Posteriormente, a anandamida foi proposta como um biomarcador de infertilidade, mas até agora faltam valores de referência para serem utilizados clinicamente.[11]
É encontrada no chocolate juntamente com a N-oleoiletanolamina e a N-linoleoiletanolamina, que são substâncias que mimetizam os efeitos da anandamida.[12] Essa substância também pode ser encontrada no organismo de moscas drosófilas, apesar de que não foram encontrados receptores CB em nenhum inseto até agora.[13][14]
Síntese, degradação e metabolismo[editar | editar código-fonte]
Em seres humanos, a anandamida é biossintetizada a partir da N-araquidonoil fosfatidiletanolamina (NAPE) que, por sua vez, surge da transferência do ácido araquidônico a partir de uma lecitina para um grupo amino livre da fosfatidiletanolamina, através da enzima N-aciltransferase. A síntese da anandamida a partir da NAPE ocorre através de múltiplas vias metabólicas, envolvendo enzimas como a fosfolipase A2, fosfolipase C e N-araquidonoil fosfatidiletanolamina-hidrólise fosfolipase D (NAPE-PLD).[15]
A estrutura cristalina da NAPE-PLD complexada com a fosfatidiletanolamina e com desoxicolato mostra como este canabinoide é gerado pelas NAPEs de membrana e revela que ácidos biliares - os quais estão envolvidos principalmente na emulsificação de lipídeos no intestino delgado - modulam sua biogênese.[16]
A anandamida endógena encontra-se presente em baixas concentrações e possui um curto tempo de meia-vida devido à ação da FAAH, que hidrolisa essa substância em ácido araquidônico e etanolamina. Estudos envolvendo leitões mostram que níveis dietéticos de ácido araquidônico e outros ácidos graxos essenciais afetam os níveis de anandamida e outros endocanabinóides no cérebro.[17] Em ratos, a alimentação com alto teor de gorduras também mostraram resultados quanto ao aumento de níveis de anandamida no fígado, bem como um aumento da lipogênese[18]. Isto sugere que, ao menos em roedores, a anandamida pode exercer um importante papel no desenvolvimento da obesidade.
Paracetamol é metabolicamente combinado com ácido araquidônico para formar AM404[19]. Este metabólito é um potente agonista do receptor vaniloide TRPV1, enquanto que atua como um agonista fraco para os receptores CB1 e CB2. O metabólito AM404 é também um inibidor da recaptação de anandamida. Portanto, a ingestão de paracetamol leva a um aumento dos níveis de anandamida no cérebro. Desta forma, o paracetamol atua como um pró-fármaco para um metabólito canabimimético, o que pode explicar parcial ou completamente os efeitos analgésicos deste medicamento.[20][21]
Referências[editar | editar código-fonte]
- ↑ Devane, W.; Hanus, L; Breuer, A; Pertwee, R.; Stevenson, L.; Griffin, G; Gibson, D; Mandelbaum, A; Etinger, A; Mechoulam, R (18 de dezembro de 1992). «Isolation and structure of a brain constituent that binds to the cannabinoid receptor». Science. 258 (5090): 1946–1949. Bibcode:1992Sci...258.1946D. PMID 1470919. doi:10.1126/science.1470919
- ↑ Mechoulam R, Fride E (1995). «The unpaved road to the endogenous brain cannabinoid ligands, the anandamides». In: Pertwee RG. Cannabinoid receptors. Boston: Academic Press. pp. 233–258. ISBN 978-0-12-551460-6
- ↑ Wang, J.; Ueda, N. (2009). «Biology of endocannabinoid synthesis system». Prostaglandins & Other Lipid Mediators. 89 (3–4): 112–119. PMID 19126434. doi:10.1016/j.prostaglandins.2008.12.002
- ↑ Saito, Viviane (2010). «Exploração farmacológica do sistema endocanabinoide: novas perspectivas para o tratamento de transtornos de ansiedade e depressão?» (PDF). Revista Brasileira de Psiquiatria. Consultado em 16 de fevereiro de 2020
- ↑ Gaetani, Silvana; Dipasquale, Pasqua; Romano, Adele; Righetti, Laura; Cassano, Tommaso; Piomelli, Daniele; Cuomo, Vincenzo (2009). The endocannabinoid system as a target for novel anxiolytic and antidepressant drugs. Col: International Review of Neurobiology. 85. [S.l.: s.n.] pp. 57–72. ISBN 9780123748935. PMID 19607961. doi:10.1016/S0074-7742(09)85005-8
- ↑ Hwang, Jeannie; Adamson, Crista; Butler, David; Janero, David R.; Makriyannis, Alexandros; Bahr, Ben A. (abril de 2010). «Enhancement of endocannabinoid signaling by fatty acid amide hydrolase inhibition: A neuroprotective therapeutic modality». Life Sciences. 86 (15–16): 615–623. PMC 2848893
 . PMID 19527737. doi:10.1016/j.lfs.2009.06.003
. PMID 19527737. doi:10.1016/j.lfs.2009.06.003
- ↑ Pacher P, Batkai S, Kunos G (2006). «The Endocannabinoid System as an Emerging Target of Pharmacotherapy». Pharmacol. Rev. 58 (3): 389–462. PMC 2241751
 . PMID 16968947. doi:10.1124/pr.58.3.2
. PMID 16968947. doi:10.1124/pr.58.3.2
- ↑ Mallet PE, Beninger RJ (1996). «The endogenous cannabinoid receptor agonist anandamide impairs memory in rats». Behavioural Pharmacology. 7 (3): 276–284. doi:10.1097/00008877-199605000-00008
- ↑ Piomelli D (janeiro de 2004). «THC: moderation during implantation» (PDF). Nat. Med. 10 (1): 19–20. PMID 14702623. doi:10.1038/nm0104-19
- ↑ El-Talatini MR, Taylor AH, Konje JC (abril de 2010). «The relationship between plasma levels of the endocannabinoid, anandamide, sex steroids, and gonadotrophins during the menstrual cycle». Fertil. Steril. 93 (6): 1989–96. PMID 19200965. doi:10.1016/j.fertnstert.2008.12.033
- ↑ Rapino, C.; Battista, N.; Bari, M.; Maccarrone, M. (2014). «Endocannabinoids as biomarkers of human reproduction». Human Reproduction Update. 20 (4): 501–516. ISSN 1355-4786. PMID 24516083. doi:10.1093/humupd/dmu004
- ↑ di Tomaso E, Beltramo M, Piomelli D (agosto de 1996). «Brain cannabinoids in chocolate» (PDF). Nature. 382 (6593): 677–8. Bibcode:1996Natur.382..677D. PMID 8751435. doi:10.1038/382677a0
- ↑ Jeffries K, Dempsey D, Behari A, Anderson R, Merkler D (novembro de 2014). «Drosophila melanogaster as a model system to study long-chain fatty acid amide metabolism». FEBS Letters. 588 (9): 1596–1602. PMC 4023565
 . PMID 24650760. doi:10.1016/j.febslet.2014.02.051
. PMID 24650760. doi:10.1016/j.febslet.2014.02.051
- ↑ McPartland J, Di Marzo V, De Petrocellis L, Mercer A, Glass M. (agosto de 2001). «Cannabinoid receptors are absent in insects». Journal of Comparative Neurology. 436 (4): 423–429. PMID 11447587. doi:10.1002/cne.1078
- ↑ Wang, J.; Ueda, N. (2009). «Biology of endocannabinoid synthesis system». Prostaglandins & Other Lipid Mediators. 89 (3–4): 112–119. PMID 19126434. doi:10.1016/j.prostaglandins.2008.12.002
- ↑ Magotti P, Bauer I, Igarashi M, Babagoli M, Marotta R, Piomelli D, Garau G (dezembro de 2014). «Structure of Human N-Acylphosphatidylethanolamine-Hydrolyzing Phospholipase D: Regulation of Fatty Acid Ethanolamide Biosynthesis by Bile Acids». Structure. 23 (3): 598–604. PMC 4351732
 . PMID 25684574. doi:10.1016/j.str.2014.12.018
. PMID 25684574. doi:10.1016/j.str.2014.12.018
- ↑ Berger, Alvin; Crozier, Gayle; Bisogno, Tiziana; Cavaliere, Paolo; Innis, Sheila; Di Marzo, Vincenzo (15 de maio de 2001). «Anandamide and diet: Inclusion of dietary arachidonate and docosahexaenoate leads to increased brain levels of the corresponding N-acylethanolamines in piglets». Proceedings of the National Academy of Sciences. 98 (11): 6402–6406. Bibcode:2001PNAS...98.6402B. PMC 33480
 . PMID 11353819. doi:10.1073/pnas.101119098
. PMID 11353819. doi:10.1073/pnas.101119098
- ↑ Osei-Hyiaman, Douglas; DePetrillo, Michael; Pacher, Pál; Liu, Jie; Radaeva, Svetlana; Bátkai, Sándor; Harvey-White, Judith; Mackie, Ken; Offertáler, László; Wang, Lei; Kunos, George (2 de maio de 2005). «Endocannabinoid activation at hepatic CB1 receptors stimulates fatty acid synthesis and contributes to diet-induced obesity». Journal of Clinical Investigation. 115 (5): 1298–1305. PMC 1087161
 . PMID 15864349. doi:10.1172/JCI23057
. PMID 15864349. doi:10.1172/JCI23057
- ↑ Osei-Hyiaman, Douglas; DePetrillo, Michael; Pacher, Pál; Liu, Jie; Radaeva, Svetlana; Bátkai, Sándor; Harvey-White, Judith; Mackie, Ken; Offertáler, László; Wang, Lei; Kunos, George (2 de maio de 2005). «Endocannabinoid activation at hepatic CB1 receptors stimulates fatty acid synthesis and contributes to diet-induced obesity». Journal of Clinical Investigation. 115 (5): 1298–1305. PMC 1087161
 . PMID 15864349. doi:10.1172/JCI23057
. PMID 15864349. doi:10.1172/JCI23057
- ↑ Bertolini, Alfio; Ferrari, Anna; Ottani, Alessandra; Guerzoni, Simona; Tacchi, Raffaella; Leone, Sheila (setembro de 2006). «Paracetamol: New Vistas of an Old Drug». CNS Drug Reviews. 12 (3–4): 250–275. PMC 6506194
 . PMID 17227290. doi:10.1111/j.1527-3458.2006.00250.x
. PMID 17227290. doi:10.1111/j.1527-3458.2006.00250.x
- ↑ Sinning, Christian; Watzer, Bernhard; Coste, Ovidiu; Nüsing, Rolf M.; Ott, Ingo; Ligresti, Alessia; Marzo, Vincenzo Di; Imming, Peter (25 de dezembro de 2008). «New Analgesics Synthetically Derived from the Paracetamol Metabolite-(4-Hydroxyphenyl)-(5,8,11,14)-icosatetra-5,8,11,14-enamide». Journal of Medicinal Chemistry. 51 (24): 7800–7805. PMID 19053765. doi:10.1021/jm800807k

