Nióbio: diferenças entre revisões
| Linha 19: | Linha 19: | ||
== Características principais == |
== Características principais == |
||
O nióbio é um [[metal]] [[ductilidade|dúctil]], |
O nióbio é um [[metal]] [[ductilidade|dúctil]],que passa a adquirir uma coloração azulada quando em contato com o [[atmosfera|ar]] em temperatura ambiente, após um longo período. Suas propriedades químicas são muito semelhantes às do [[tântalo (elemento químico)]], que está situado no mesmo grupo. |
||
O metal começa a [[oxidação|oxidar-se]] com o ar a 201 [[grau Celsius|°C]] e seus [[estado de oxidação|estados de oxidação]] mais comuns são +3 e +5. |
O metal começa a [[oxidação|oxidar-se]] com o ar a 201 [[grau Celsius|°C]] e seus [[estado de oxidação|estados de oxidação]] mais comuns são +3 e +5. |
||
===Físicas=== |
|||
O nióbio é um material lustroso, com coloração cinza brilhante, [[ductilidade|dúctil]], um metal paragmético no Grupo 5 da Tabela Periódica, embora tem uma configuração eletrônica anômalo se comparado com os outros membros. (Isto pode ser obervado nos vizinhos como o [[rutênio]] (44), o [[ródio]] (45) e o [[paládio]] (46).) |
|||
{| class="wikitable" style="margin:10px; float:right;" |
|||
|- |
|||
![[Número Atômico|Z]] !! [[Elemento Químico]] !! [[Configuração eletrônica|Número de elétrons]] |
|||
|- |
|||
| 23 || [[vanádio]] || 2, 8, 11, 2 |
|||
|- |
|||
| 41 || nióbio || 2, 8, 18, 12, 1 |
|||
|- |
|||
| 73 || [[tântalo]] || 2, 8, 18, 32, 11, 2 |
|||
|- |
|||
| 105 || [[dúbnio]] || 2, 8, 18, 32, 32, 11, 2 (predicted) |
|||
|} |
|||
O nióbio torna-se um material criogênico sob temperaturas criogênicas. Sob pressão atmosférica, ele tem a temperatura crítica mais elevada dos elementos supercondutores: 9.2 [[Kelvin|K]].<ref name="Pein">{{cite journal|title = A Superconducting Nb<sub>3</sub>Sn Coated Multicell Accelerating Cavity|first = M.|last = Peiniger|author2=Piel, H. |journal = Nuclear Science|year= 1985|volume= 32|issue = 5|doi = 10.1109/TNS.1985.4334443|page = 3610|bibcode = 1985ITNS...32.3610P }}</ref> Ele tem a melhor supercondutividade.<ref name="Pein" /> Além disso, ele é um dos três elementos supercondutores Tipo 2, junto com o [[vanádio]] e o [[tecnécio]]. As propriedades supercondutoras são fortemente dependentes de sua pureza.<ref name="Moura">{{cite journal|title=Melting And Purification Of Niobium|first=Hernane R.|last = Salles Moura|coauthor=Louremjo de Moura, Louremjo |journal=AIP Conference Proceedings|year=2007|issue=927(Single Crystal – Large Grain Niobium Technology)|pages=165–178|publisher=American Institute of Physics|issn=0094-243X|url=http://link.aip.org/link/?APCPCS/927/165/1}}</ref> Quando mais puro, ele é mais mole e dúctil, porém as impurezas do nióbio tornam o elemento mais duro.<!--awkward; this either contains redundancy or is leaving something out--><ref name="Nowak" /> |
|||
O metal tem uma baixa captação de nêutrons térmicos <ref>{{cite journal|title = Columbium Alloys Today| last = Jahnke| first = L.P.|coauthors = Frank, R.G.; Redden, T.K.|year = 1960|journal = Metal Progr.|volume = 77|issue = 6|pages = 69–74|osti = 4183692}}</ref> e por causa isso ele é utilizado nas indústrias nucleares.<ref>{{cite journal|first = A. V.|last = Nikulina|title = Zirconium-Niobium Alloys for Core Elements of Pressurized Water Reactors|journal = Metal Science and Heat Treatment|volume = 45|issue = 7–8|year = 2003|doi = 10.1023/A:1027388503837|pages = 287–292}}</ref> |
|||
=== Isótopos === |
=== Isótopos === |
||
Revisão das 01h38min de 20 de agosto de 2014
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
cinza metálico, mas azulado quando oxidado Um cubo de 1cm3 de nióbio anodizado de alta pureza (99,95%) e cristais de nióbio de alta pureza (99,995%), feitos eletrolitamente, para efeito de comparação. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informações gerais | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | Nióbio, Nb, 41 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Série química | Metal de transição | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 5, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade, dureza | 8570 kg/m3, 6,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número CAS | 7440-03-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedade atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa atómica | 92,90638 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atómico (calculado) | 146 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio covalente | 164±6 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração electrónica | [Kr] 4d3 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elétrons (por nível de energia) | 2, 8, 18, 12, 1 (ver imagem) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidação | 5, 4, 3, 2, -1 (óxido levemente ácido) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estrutura cristalina | cúbica centrada no corpo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado da matéria | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 2750 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 5017 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusão | 30 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporização | 689,9 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | 1 Pa a 2942 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som | 3480 m/s a 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diversos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade (Pauling) | 1,6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 265 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 53,7 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.º Potencial de ionização | 652,1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.º Potencial de ionização | 1380 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.º Potencial de ionização | 2416 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.º Potencial de ionização | 3700 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.º Potencial de ionização | 4877 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6.º Potencial de ionização | 9847 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7.º Potencial de ionização | 12100 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos mais estáveis | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades do SI & CNTP, salvo indicação contrária. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O nióbio é um elemento químico, de símbolo Nb, número atômico 41 (41 prótons e 41 elétrons) e massa atómica 92,9 u. É um elemento de transição pertencente ao grupo 5 ou VB da classificação periódica dos elementos. O nome deriva da deusa grega Níobe, filha de Dione e Tântalo — este último, por sua vez deu nome a outro elemento da família 5B, o tântalo[1]. É usado principalmente em ligas de aço para a produção de tubos condutores de fluidos. Em condições normais, é sólido. Foi descoberto em 1801 pelo inglês Charles Hatchett.
O nióbio tem propriedades físicas e químicas similares do tântalo sendo que ambos são de complexa distinção. O químico inglês Charles Hatchett concluiu erroneamente que o tântalo e o colúmbio eram idênticos. O químico alemão Heinrich Rose estabeleceu em 1846 que os minérios de tântalo contêm um segundo elemento que nomeou de nióbio. Em 1864 e 1865, vários cientistas esclareceram que o nióbio e o colúmbio era o mesmo elemento, e por um século ambos os nomes foram utilizados de forma intercambiável. O nióbio foi oficialmente adotado como um elemento químico em 1949, porém o termo colúmbio ainda é utilizado na metalurgia nos Estados Unidos da América.
O nióbio não era utilizado comercialmente até o século XX. Existem poucas minas de extração economicamente viável de nióbio no mundo, sendo o Brasil o maior produtor mundial de nióbio e ferronióbio, uma liga de nióbio e ferro, e responsável por 75% da produção mundial do elemento.[2][3] [4]
Ele é muito utilizado nas ligas, em especial na produção de aços especiais que são utilizados na estrutura física dos gasodutos. Embora estas ligas contém no máximo 0,1%, a pequena porcentagem de nióbio proporciona uma grande resistência mecânica no aço. A estabilidade térmica das superligas que contém nióbio é importante para a produção de motores de aeroplanos e na propulsão de foguetes e em vários materiais supercondutores. Estas ligas supercondutoras do tipo II, que também contém titânio e estanho, são geralmente usadas nos ímãs supercondutoras nas imagens por ressonância magnética. Outras aplicações incluem a soldagem, indústria nuclear, eletrônica, óptica, numismática e produção de joias. Nas últimas duas aplicações ele é utilizado pela sua baixa toxicidade e pela possibilidade de coloração pela anodização.
História

O nióbio (mitologia grega: Níobe, filha de Tântalo) foi descoberto por Charles Hatchett em 1801. Hatchett encontrou o elemento no mineral columbita enviado para a Inglaterra em torno de 1750 por John Winthrop, que foi o primeiro governador de Connecticut. Inicialmente, houve uma grande confusão entre os elementos nióbio e tântalo que só foi resolvida em 1846 por Heinrich Rose e Jean Charles Galissard de Marignac que redescobriram o elemento. Desconhecendo o trabalho de Hatchett, denominaram o elemento de nióbio. Em 1864, Christian Blomstrand foi o primeiro a preparar o elemento pela redução do cloreto de nióbio, por aquecimento, numa atmosfera de hidrogênio.
Colúmbio foi o nome dado originalmente ao elemento nióbio por Hatchet, porém, a IUPAC adotou oficialmente o nome “niobium" em 1950, após 100 anos de controvérsias. Muitas sociedades químicas e organizações governamentais referem-se ao elemento 41 pelo nome IUPAC. Entretanto, a maioria dos metalúrgicos e produtores comerciais do metal, principalmente estadunidenses, adota o seu nome original colúmbio.
Recentemente, o trabalho de pesquisa da COPPE, UFRJ (Universidade Federal do Rio de Janeiro), obteve uma patente internacional para uma tinta anticorrosiva a base de nióbio num processo denominado "niobização".[5]
Características principais
O nióbio é um metal dúctil,que passa a adquirir uma coloração azulada quando em contato com o ar em temperatura ambiente, após um longo período. Suas propriedades químicas são muito semelhantes às do tântalo (elemento químico), que está situado no mesmo grupo.
O metal começa a oxidar-se com o ar a 201 °C e seus estados de oxidação mais comuns são +3 e +5.
Físicas
O nióbio é um material lustroso, com coloração cinza brilhante, dúctil, um metal paragmético no Grupo 5 da Tabela Periódica, embora tem uma configuração eletrônica anômalo se comparado com os outros membros. (Isto pode ser obervado nos vizinhos como o rutênio (44), o ródio (45) e o paládio (46).)
| Z | Elemento Químico | Número de elétrons |
|---|---|---|
| 23 | vanádio | 2, 8, 11, 2 |
| 41 | nióbio | 2, 8, 18, 12, 1 |
| 73 | tântalo | 2, 8, 18, 32, 11, 2 |
| 105 | dúbnio | 2, 8, 18, 32, 32, 11, 2 (predicted) |
O nióbio torna-se um material criogênico sob temperaturas criogênicas. Sob pressão atmosférica, ele tem a temperatura crítica mais elevada dos elementos supercondutores: 9.2 K.[6] Ele tem a melhor supercondutividade.[6] Além disso, ele é um dos três elementos supercondutores Tipo 2, junto com o vanádio e o tecnécio. As propriedades supercondutoras são fortemente dependentes de sua pureza.[7] Quando mais puro, ele é mais mole e dúctil, porém as impurezas do nióbio tornam o elemento mais duro.[8]
O metal tem uma baixa captação de nêutrons térmicos [9] e por causa isso ele é utilizado nas indústrias nucleares.[10]
Isótopos
O nióbio apresenta um único isótopo estável: Nb-93. Os radioisótopos mais estáveis são o Nb-92 com meia-vida de 34,7 milhões de anos, Nb-94 ( meia-vida de 20300 anos ) e o Nb-91 com meia-vida de 680 anos. Existe também um metaestável ( 0,031 mega elétron-volts ) com meia-vida de 16,13 anos
Outros vinte e três radioisótopos foram caraterizados. A maioria com meias-vida abaixo de duas horas, exceto o Nb-95 ( 35 dias ), o Nb-96 ( 23,4 horas ) e o Nb-90 ( 14,6 horas ).
O modo preliminar de decaimento dos isótopos com massas abaixo do isótopo estável Nb-93 é do tipo captura eletrônica e após este através de emissão beta , com casos de emissão de nêutrons como ocorre com os radioisótopos Nb-104, 109 e 110.
Compostos
O nióbio é de muitas formas similar ao tântalo e o zircônio. Ele reage com muitos elementos químicos da classe dos não-metais em altas temperaturas: o nióbio reage com o fluoreto em uma caldeira com gás cloro e hidrogênio sob temperatura de 200 °C e com nitrogênio com temperatura de 400 °C, produzindo os produtos intersitiais e não estequeiométricos.[8] O metal começa a oxidar na atmosfera sob temperatura de 200 °C,[11] e é resistente à corrosão e ao contato de elementos alcalinos e por ácidos, incluindo água regia, o ácido clorídrico, o ácido sulfúrico, o ácido nítrico e o ácido fosfórico.[8] O nióbio é atacado pelo ácido fluorídrico e por misturas de ácido fluorídrico com o ácido nítrico.
Carbonetos e nitretos
Outros compostos binários de nióbios incluem o nitreto de nióbio (NbN), que estão um supercondutor sob baixas temperaturas e é utilizado nos detectores de radiação eletromagnética.[12] O carboneto de nióbio é o NbC que é um material extremamente duro, refratório, cerâmico, comercialmente utilizado nos bits no setor de ferramentaria.
Haletos

O nióbio forma haletos com os estados de oxidação +5 +4 assim como vários compostos não-estequiométricos.[11][13] Os pentahaletos (NbX5) caracterizam-se pelos centros octaédricos. O pentafluoreto de nióbio (NbF5) é um sólido branco com temperatura de fusão de 79,0 °C e o pentacloreto de nióbio (NbCl5) é um sólido amarelo (como na imagem a esquerda) com um ponto de fusão de 203,4 °C. Ambos são hidrolisados para produzir óxidos e oxihaletos, como o NbOCl3. O pentacloreto é um reagente versátil sendo utilizado nos compostos organometálicos, como o dicloreto niobioceno ((C5H5)2NbCl2).[14] Os tetrahaletos (NbX4) são polímeros de coloração preta com ligações entre as partículas de nióbio, como por exemplo o tetrafluoreto de nióbio (NbF4) e o tetracloreto de nióbio (NbCl4).
Aplicações
O nióbio apresenta diversas aplicações. É usado na composição do aço inoxidável e em outras liga metálicas não ferrosas.
- Usado em indústrias nucleares devido a sua baixa captura de nêutrons termais.
- Usado em soldas elétricas.
- Devido a sua coloração é utilizado, geralmente na forma de liga metálica, para a produção de joias e outros ornamentos.
- Quantidades apreciáveis de nióbio são utilizados em superligas para fabricação de componentes de motores de jatos , subconjuntos de foguetes , ou seja, equipamentos que necessitem altas resistências a combustão. Pesquisas avançadas com este metal foram utilizados no programa Gemini;
- Os selos arcos voltaicos de lâmpadas de vapor de sódio de alta pressão são feitos de nióbio, ou nióbio com 1% de zircônio, pela similaridade do coeficiente térmico das cerâmicas sinterizadas de alumínio, um material translúcido que resiste as reações de redução ou ataques químicos pelo aquecimento do sódio líquido ou de seus vapores dentro da lâmpada.[15][16][17]
O nióbio se converte num supercondutor quando reduzido a temperaturas criogênicas. Na pressão atmosférica (e quando puro) , tem a mais alta temperatura crítica entre os elementos supercondutores de tipo I, 9.3 K. Além disso, é um elemento presente em ligas de supercondutores que são do tipo II (como o vanádio e o tecnécio), significando que atinge a temperatura crítica a temperaturas bem mais altas que os supercondutores de tipo I
Aplicações hipoalergênicas: joias e medicamentos
O nióbio e algumas ligas de nióbio são fisiologicamente inertes e com características hipoalergênicas. Por estes motivos, o nióbio é encontrado em muitos dispositivos médicos como o marca-passo.[18] O nióbio é tratado com hidróxido de sódio formando um camada porosa utilizadas nos tratamentos de osseointegração.[19]
Junto com o titânio, o tântalo e o alumínio, o nióbio pode também ser aquecido eletricamente e anodizado resultando na produção de diversas colorações utilizando um processo conhecido como anodização de um metal reativo onde é aplicado na produção de joias.[20][21] Pela propriedade do nióbio ser um elemento químico hipoalergênico ele é utilizado na produção de joias.[22]
Eletrocerâmicas
O niobato de lítio tem como característica de ser um material com propriedades ferroelétricas, as quais são aproveitadas na produção de telefones celulares, nos moduladores ópticos e na fabricação de aparelhos de superfície de ondas acústicas. Ele vem da estrutura ferroelétrica da perovskita, como do tantalato de lítio e do tantalato de bário.[23] O nióbio foi avaliado com uma alternativa mais econômica para o desenvolvimento de capacitores,[24] apesar da predominância dos capacitores de tântalo. O nióbio é adicionado com o vidro para aumentar o índice de refração, um propriedade utilizada na indústria óptica na fabricação de óculos de grau.
O pentóxido de nióbio (Nb2O5) também é uma cerâmica conveniente para a obtenção de sensores de pH, lentes óticas e em filtros especiais para receptores de TV, entre outros.[25]
Ímãs supercondutoras

Os compostos de nióbio-germânio(Nb3Ge), nióbio-escândio e as ligas de nióbio-titânio são utilizadas como tipos de semicondutores II como fios de ímãs supercondutores .[26][27] Estes ímãs supercondutores são utilizados nos instrumentos das máquinas de imagens por ressonância magnética e nas máquinas de ressonância magnética nuclear como também nos aceleradores de partículas.[28] Por exemplo, o Grande Colisor de Hádrons utiliza 600 toneladas de cordões supercondutores de Nb3Sn e cerca de 250 toneladas de cordões supercondutores de NbTi.[29]
Também os semicondutores contendo somente nióbio são utilizados nas cavidades dos aparelhos de radiofrequência nos laseres de elétrons livres nas pesquisas da FLASH (Free Electron LASer in Hamburg) e da European XFEL.[30]
A alta sensibilidade do semicondutor nitrito de nióbio são utilizados na produção de microbolomêtros sendo um detector ideal de radiação eletromagnética na escala de frequência THz. Estes detectores foram testados no Telescópio Submilimétrico Heinrich Hertz, o telescópio do Pólo Sul, no Receiver Lab Telescope, na APEX (Atacama Pathfinder Experiment) e agora está sendo testada nos instrumentos de HIFI nas placas do Observatório Espacial Herschel.[31]
Produção de aço
O nióbio é um elemento microligante eficiente para o aço. A adição de nióbio no aço causa a formação de carboneto de nióbio e o nitreto de nióbio dentro da estrutura do aço. Estes compostos melhoram o refinamento do grão, o retardo da recristalização e o endurecimento por precipitação do aço. Estes efeitos por sua vez aumentam a resistência, força, conformabilidade e soldabilidade das microligas de aço.[32] A microligação de aços inoxidáveis tem um teor de nióbio inferior a 0,1%.[33] Esta é uma liga importante no aço de alta resistência e baixa liga que é muito utilizado na indústria automobilística devido a sua grande resistência.[32] Estas ligas de nióbio são muitos fortes e às vezes são empregadas para a fabricação de oleodutos.[34][35]
Superligas

Quantidades consideráveis do nióbio, seja ela em forma alotrópica ou na produção de ferronióbio e níquelnióbio são utilizadas em superligas de ferro, níquel e cobalto para a produção de componentes de motores a reação, nas turbinas a gás, subligações de foguetes, turbocompressores, resistências a calor e equipamentos de combustão. O nióbio precipita uma fase de γ'' na granulação da superliga.[36] As ligas contém cerca de 6,5% de nióbio.[33] Um exemplo de liga que contém nióbio é a liga niquelada do Inconel 718, que consiste de cerca de 50% de níquel, 18,6% de cromo, 18,5% ferro, 5% de nióbio, 3,1% molibdênio, 0,9% de titânio, e 0,4% de alumínio.[37][38] Estas superligas são utilizadas, por exemplo nos sistemas de purificação de ar utilizados no programa Gemini.
Uma liga utilizada para os bocais de propulsão dos foguetes de combustível líquido, em especial nos motores do Módulo Lunar Apollo, é a liga de nióbio C-103 que é composta de 89% de nióbio, 10% de háfnio e 1% de titânio.[39] Outra liga de nióbio foi utilizada nos bocais do Módulo de Comando e Serviço Apollo. Como o nióbio é oxidado sob temperaturas de 400 °C, um revestimento de proteção é necessário para evitar a possibilidade de tornar a liga quebradiça.[39]
Produção
Os minerais tantalita e niobita são os únicos de interesse econômico para a produção do nióbio. Depois da separação inicial de outros compostos, é obtida uma mistura do pentóxido de tântalo e do pentóxido de nióbio. A primeira etapa no processamento é a reação dos óxidos com o fluoreto de hidrogênio[40] :
- Ta2O5 + 14 HF → 2 H2[TaF7] + 5 H2O
- Nb2O5 + 10 HF → 2 H2[NbOF5] + 3 H2O
Este processo em escala industrial denominado método Mariagnac foi desenvolvido por Jean Charles Galissard de Marignac e explora as diferentes solubilidades dos complexos fluoretos de nióbio e de tântalo, o monoidrato de oxipentafluorniobato dipotássico (K2[NbOF5]·H2O) e o heptafluortantalato dipotássico (K2[TaF7]) em água. Novos processos usam a extração dos líquidos das soluções de fluoretos com solventes orgânicos como o cicloexanona.[40] Os complexos de fluoreto de nióbio e de tântalo são extraídos separadamente para os solventes orgânicos com água e ambos precipitam pela adição de fluoreto de potássio para produzir um complexo floureto de potássio, ou precipitado com amônia como o pentóxido:[11]
- H2[NbOF5] + 2 KF → K2[NbOF5]↓ + 2 HF
Resultando em :
- 2 H2[NbOF5] + 10 NH4OH → Nb2O5↓ + 10 NH4F + 7 H2
Geralmente são utilizados métodos de redução pra o nióbio metálico. Os principais são: a eletrólise de uma mistura fundida de K2[NbOF5] e cloreto de sódio ou a redução de fluoreto com sódio. Com a a aplicado do segundo método de produção é possível conseguir um alto grau de pureza. A produção em larga escala é utilizada a redução do Nb2O5 com hidrogênio ou carbono[11] . No processo que envolve as reações aluminotérmicas utiliza-se uma mistura de óxido de ferro e óxido de nióbio que estará reagindo com alumínio:
- 3 Nb2O5 + Fe2O3 + 12 Al → 6 Nb + 2 Fe + 6 Al2O3
Para melhorar a reação, pequenas quantidades de oxidante como o nitrato de sódio são adicionados sendo produzidos o óxido de alumínio e o ferronióbio, uma liga de ferro e nióbio utilizado na metalurgia. [41][42] O ferronióbio contêm cerca de 60 a 70% de nióbio. [43] Sem a adição do óxido de ferro, a aluminotermia é utilizada para a produção de nióbio. Outros processos de purificação são necessários para as ligas supercondutoras. A função pelos elétrons à vacuo são utilizados pelos dois maiores produtores de nióbio .[13][44]
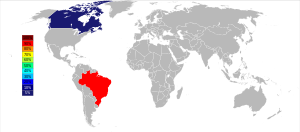
Desde 2013[update], a Companhia Brasileira de Alumínio controla cerca de 85% da produção mundial de nióbio.[45] As estimativas do Serviço Geológico dos Estados Unidos que a produção cresceu de 38.700 toneladas em 2005 para 44.500 toneladas em 2006.[46][47] Estimavam que no Planeta Terra tenhamos 4.400.000 toneladas de nióbio.[47] Durante a década entre 1995 e 2005, a produção mais que dobrou, que no ano de 1995 produziu 17.800 toneladas .[48] Desde 2009 a produção se estabilizou na marca de 63.000 toneladas por ano.[49]
| País | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 160 | 230 | 290 | 230 | 200 | 200 | 200 | ? | ? | ? | ? | ? | |
| 30.000 | 22.000 | 26.000 | 29.000 | 29.900 | 35.000 | 40.000 | 57.300 | 58.000 | 58.000 | 58.000 | 58.000 | |
| 2.290 | 3.200 | 3.410 | 3.280 | 3.400 | 3.310 | 4.167 | 3.020 | 4.380 | 4.330 | 4.420 | 4.400 | |
| ? | 50 | 50 | 13 | 52 | 25 | ? | ? | ? | ? | ? | ? | |
| ? | ? | 5 | 34 | 130 | 34 | 29 | ? | ? | ? | ? | ? | |
| 35 | 30 | 30 | 190 | 170 | 40 | 35 | ? | ? | ? | ? | ? | |
| 28 | 120 | 76 | 22 | 63 | 63 | 80 | ? | ? | ? | ? | ? | |
| Produção mundial | 32.600 | 25.600 | 29.900 | 32.800 | 34.000 | 38.700 | 44.500 | 60.400 | 62.900 | 62.900 | 62.900 | 63.000 |
Pequenas minas de nióbio foram encontradas nas minas de Kanyika no Malawi.
Ocorrência

O elemento nunca foi encontrado livre na natureza. É encontrado em minerais tais como niobita (columbita) (Fe, Mn)(Nb, Ta)2O6, niobita-tantalita [(Fe, Mn)(Ta, Nb)2O6], pirocloro (NaCaNb2O6F ), e euxenita [(Y, Ca, Ce, U, Th) (Nb, Ta, Ti)2O6]. Minerais que contêm nióbio geralmente contêm também o tântalo.
Grandes depósitos de nióbio foram encontrados associados a rochas de carbono – silicatos, e como constituinte do pirocloro.
O Brasil detém entre 99,4%[51] e 98% das reservas mundiais exploráveis de nióbio no mundo, e mais de 90% do total do minério presente no planeta Terra.[52][53] As jazidas estão presentes em 3 cidades brasileiras: 61% proveniente de Araxá (MG), 21% das reservas em Catalão (GO) e outros 12% em São Gabriel da Cachoeira (AM).[54]
Outra reserva importante de minerais de nióbio é do Canadá.[55]
Precauções
O nióbio não conhece nenhum papel biológico.Quando há o contato dos compostos que contêm nióbio podem irritar os olhos e a pele e pode apresentar riscos de entrar em combustão. Porém, o elemento nióbio em larga escola é fisologicamente inerte e também hipoalergênico e inofensivo. Ele é frequentemente utilizado nas joalherias tem sido testado nos implantes médicos. [56][57]
Os compostos que contém nióbio são raramente encontrados, porém muitos deles são tóxicos e podem ser tratados com cuidado. A exposição de curta e longa exposição dos niobatos e os cloretos de nióbio tem sido testados em ratos. Os ratos tratados com uma injeção de pentacloreto de nióbio ou os niobatos apresentam uma dose letal mediana (LD50) entre 10 e 100 mg/kg.[58][59][60] A possibilidade de intoxição por via oral é baixa, segundo este estudo com ratos submetidos a 940 mg/kg LD50 durante sete dias.[58]
Referências
- ↑ Infoescola
- ↑ 'Monopólio' brasileiro do nióbio gera cobiça mundial, controvérsia e mitos
- ↑ Inovação Tecnológica
- ↑ CODEMIG
- ↑ Tinta anticorrosividade de nióbio rende à COPPE patente internacional. Disponível em: <http://www.planeta.coppe.ufrj.br/artigo.php?artigo=710>. Acesso em: 15 jan. 2009.
- ↑ a b Peiniger, M.; Piel, H. (1985). «A Superconducting Nb3Sn Coated Multicell Accelerating Cavity». Nuclear Science. 32 (5): 3610. Bibcode:1985ITNS...32.3610P. doi:10.1109/TNS.1985.4334443
- ↑ Salles Moura, Hernane R.; Louremjo de Moura, Louremjo (2007). «Melting And Purification Of Niobium». American Institute of Physics. AIP Conference Proceedings (927(Single Crystal – Large Grain Niobium Technology)): 165–178. ISSN 0094-243X
- ↑ a b c Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeNowak - ↑ Jahnke, L.P.; Frank, R.G.; Redden, T.K. (1960). «Columbium Alloys Today». Metal Progr. 77 (6): 69–74. OSTI 4183692
- ↑ Nikulina, A. V. (2003). «Zirconium-Niobium Alloys for Core Elements of Pressurized Water Reactors». Metal Science and Heat Treatment. 45 (7–8): 287–292. doi:10.1023/A:1027388503837
- ↑ a b c d Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils; (1985). «Niob». Lehrbuch der Anorganischen Chemie (em German) 91–100 ed. [S.l.]: Walter de Gruyter. pp. 1075–1079. ISBN 3-11-007511-3
- ↑ Verevkin, A.; Pearlman, A.; Slstrokysz, W.; Zhang, J.; Currie, M.; Korneev, A.; Chulkova, G.; Okunev, O.; Kouminov, P.; Smirnov, K.; Voronov, B.; N. Gol'tsman, G.; Sobolewski, Roman (2004). «Ultrafast superconducting single-photon detectors for near-infrared-wavelength quantum communications». Journal of Modern Optics. 51 (12): 1447–1458. doi:10.1080/09500340410001670866
- ↑ a b Agulyansky, Anatoly (2004). The Chemistry of Tantalum and Niobium Fluoride Compounds. [S.l.]: Elsevier. pp. 1–11. ISBN 978-0-444-51604-6
- ↑ C. R. Lucas, J. A. Labinger, J. Schwartz (1990). Robert J. Angelici, ed. «Dichlorobis(η5-Cyclopentadienyl)Niobium(IV)». New York: J. Wiley & Sons. Inorganic Syntheses. Inorganic Syntheses. 28: 267–270. ISBN 0-471-52619-3. doi:10.1002/9780470132593.ch68
- ↑ Henderson, Stanley Thomas; Marsden, Alfred Michael; Hewitt, Harry (1972). Lamps and Lighting. [S.l.]: Edward Arnold Press. pp. 244–245. ISBN 0-7131-3267-1
- ↑ Eichelbrönner, G. (1998). «Refractory metals: crucial components for light sources». International Journal of Refractory Metals and Hard Materials. 16 (1): 5–11. doi:10.1016/S0263-4368(98)00009-2
- ↑ Michaluk, Christopher A.; Huber, Louis E.; Ford, Robert B. (2001). Minerals, Metals and Materials Society, Metals and Materials Society Minerals, ed. «Niobium and Niobium 1% Zirconium for High Pressure Sodium (HPS) Discharge Lamps». Niobium 2001 Ltd, 2002. Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA). ISBN 978-0-9712068-0-9
- ↑ Mallela, Venkateswara Sarma; Ilankumaran, V.; Srinivasa Rao, N. (1 January 2004). «Trends in Cardiac Pacemaker Batteries». Indian Pacing Electrophysiol J. 4 (4): 201–212. PMC 1502062
 . PMID 16943934 Verifique data em:
. PMID 16943934 Verifique data em: |data=(ajuda) - ↑ Godley, Reut; Starosvetsky, David; Gotman, Irena (2004). «Bonelike apatite formation on niobium metal treated in aqueous NaOH» (PDF). Journal of Materials Science: Materials in Medicine. 15 (10): 1073–1077. PMID 15516867. doi:10.1023/B:JMSM.0000046388.07961.81
- ↑ Biason Gomes, M. A.; Onofre, S.; Juanto, S.; Bulhões, L. O. de S. (1991). «Anodization of niobium in sulphuric acid media». Journal of Applied Electrochemistry. 21 (11): 1023–1026. doi:10.1007/BF01077589
- ↑ Chiou, Y. L. (1971). «A note on the thicknesses of anodized niobium oxide films». Thin Solid Films. 8 (4): R37–R39. Bibcode:1971TSF.....8R..37C. doi:10.1016/0040-6090(71)90027-7
- ↑ Azevedo, C. R. F.; Spera, G.; Silva, A. P. (2002). «Characterization of metallic piercings that caused adverse reactions during use». Journal of Failure Analysis and Prevention. 2 (4): 47–53. doi:10.1361/152981502770351860
- ↑ Volk, Tatyana; Wohlecke, Manfred (2008). Lithium Niobate: Defects, Photorefraction and Ferroelectric Switching. [S.l.]: Springer. pp. 1–9. ISBN 978-3-540-70765-3
- ↑ Pozdeev, Y. (1991). «Reliability comparison of tantalum and niobium solid electrolytic capacitors». Quality and Reliability Engineering International. 14 (2): 79–82. doi:10.1002/(SICI)1099-1638(199803/04)14:2<79::AID-QRE163>3.0.CO;2-Y
- ↑ Raquel Maria Ferreira de Sousa, Lucianno Eduardo Fernandes e Wendell Guerra (2012), NIÓBIO, <http://qnesc.sbq.org.br/online/qnesc35_1/11-EQ-13-11.pdf>, acessado no dia dez de maio de 2014.
- ↑ Lindenhovius, J.L.H.; Hornsveld, E.M.; Den Ouden, A.; Wessel, W.A.J.; Ten Kate, H.H.J. (2000). «Powder-in-tube (PIT) Nb/sub 3/Sn conductors for high-field magnets». IEEE Transactions on Applied Superconductivity. 10: 975–978. doi:10.1109/77.828394
- ↑ Nave, Carl R. «Superconducting Magnets». Georgia State University, Department of Physics and Astronomy. Consultado em 25 de novembro de 2008
- ↑ Glowacki, B. A.; Yan, X. -Y.; Fray, D.; Chen, G.; Majoros, M.; Shi, Y. (2002). «Niobium based intermetallics as a source of high-current/high magnetic field superconductors». Physica C: Superconductivity. 372–376 (3): 1315–1320. Bibcode:2002PhyC..372.1315G. arXiv:cond-mat/0109088
 . doi:10.1016/S0921-4534(02)01018-3
. doi:10.1016/S0921-4534(02)01018-3
- ↑ Grunblatt, G.; Mocaer, P.; Verwaerde Ch.; Kohler, C. (2005). «A success story: LHC cable production at ALSTOM-MSA». Fusion Engineering and Design (Proceedings of the 23rd Symposium of Fusion Technology). 75–79: 1–5. doi:10.1016/j.fusengdes.2005.06.216
- ↑ Lilje, L.; Kakob, E.; Kostina, D.; Matheisena, A.; Möllera, W. -D.; Procha, D.; Reschkea, D.; Saitob, K. Schmüserc, P.; Simrocka, S.; Suzukid T.; Twarowskia, K. (2004). «Achievement of 35 MV/m in the superconducting nine-cell cavities for TESLA». Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 524 (1–3): 1–12. Bibcode:2004NIMPA.524....1L. arXiv:physics/0401141
 . doi:10.1016/j.nima.2004.01.045
. doi:10.1016/j.nima.2004.01.045
- ↑ Cherednichenko, Sergey; Drakinskiy, Vladimir; Berg, Therese; Khosropanah, Pourya; Kollberg, Erik (2008). «A Hot-electron bolometer terahertz mixers for the Herschel Space Observatory». Review of Scientific Instruments. 79 (3): 0345011–03451010. Bibcode:2008RScI...79c4501C. PMID 18377032. doi:10.1063/1.2890099
- ↑ a b Patel, Zh.; Khul'ka K. (2001). «Niobium for Steelmaking». Metallurgist. 45 (11–12): 477–480. doi:10.1023/A:1014897029026
- ↑ a b Heisterkamp, Friedrich; Tadeu Carneiro (2001). Minerals, Metals and Materials Society, Metals and Materials Society Minerals, ed. «Niobium: Future Possibilities – Technology and the Market Place» (PDF). Niobium 2001 Ltd, 2002. Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA). ISBN 978-0-9712068-0-9
- ↑ Eggert, Peter; Priem, Joachim; Wettig, Eberhard (1982). «Niobium: a steel additive with a future». Economic Bulletin. 19 (9): 8–11. doi:10.1007/BF02227064
- ↑ Hillenbrand, Hans–Georg; Gräf, Michael; Kalwa, Christoph (2 de maio de 2001). «Development and Production of High Strength Pipeline Steels» (PDF). Europipe. Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA)
- ↑ Donachie, Matthew J. (2002). Superalloys: A Technical Guide. [S.l.]: ASM International. pp. 29–30. ISBN 978-0-87170-749-9
- ↑ Bhadeshia, H. k. d. h. «Nickel Based Superalloys». University of Cambridge. Consultado em 4 de setembro de 2008
- ↑ Pottlacher, G.; Hosaeus, H.; Wilthan, B.; Kaschnitz, E.; Seifter, A. (2002). «Thermophysikalische Eigenschaften von festem und flüssigem Inconel 718». Thermochimica Acta (em German). 382 (1––2): 55–267. doi:10.1016/S0040-6031(01)00751-1
- ↑ a b Hebda, John (2 de maio de 2001). «Niobium alloys and high Temperature Applications» (PDF). Companhia Brasileira de Metalurgia e Mineração. Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA)
- ↑ a b Soisson, Donald J.; McLafferty, J. J.; Pierret, James A. (1961). «Staff-Industry Collaborative Report: Tantalum and Niobium». Industrial and Engineering Chemistry. 53 (11): 861–868. doi:10.1021/ie50623a016
- ↑ Tither, Geoffrey (2001). Minerals, Metals and Materials Society, Metals and Materials Society Minerals, ed. «Progress in Niobium Markets and Technology 1981–2001» (PDF). Niobium 2001 Ltd, 2002. Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA). ISBN 978-0-9712068-0-9
- ↑ Dufresne, Claude; Goyette, Ghislain (2001). Minerals, Metals and Materials Society, Metals and Materials Society Minerals, ed. «The Production of Ferroniobium at the Niobec mine 1981–2001» (PDF). Niobium 2001 Ltd, 2002. Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA). ISBN 978-0-9712068-0-9
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nometesla - ↑ Choudhury, Alok; Hengsberger, Eckart (1992). «Electron Beam Melting and Refining of Metals and Alloys». The Iron and Steel Institute of Japan International. 32 (5): 673–681. doi:10.2355/isijinternational.32.673
- ↑ Lucchesi, Cristane; Cuadros, Alex (April 2013), «Mineral Wealth», Bloomberg Markets (paper), p. 14 Verifique data em:
|data=(ajuda) - ↑ Papp, John F. «Niobium (Columbium)» (PDF). USGS 2006 Commodity Summary. Consultado em 20 de novembro de 2008
- ↑ a b Papp, John F. «Niobium (Columbium)» (PDF). USGS 2007 Commodity Summary. Consultado em 20 de novembro de 2008
- ↑ Papp, John F. «Niobium (Columbium)» (PDF). USGS 1997 Commodity Summary. Consultado em 20 de novembro de 2008
- ↑ Niobium (Colombium) U.S. Geological Survey, Mineral Commodity Summaries, January 2011
- ↑ Larry D. Cunningham (5 de abril de 2012). «USGS Minerals Information: Niobium (Columbium) and Tantalum». Minerals.usgs.gov. Consultado em 17 de agosto de 2012
- ↑ «Floresta privatizada em Rondônia esconde nióbio, o mineral mais estratégico e raro no mundo.». INEST. 05 de abril de 2011. Consultado em 10 de abril de 2014 soft hyphen character character in
|título=at position 4 (ajuda); Verifique data em:|data=(ajuda) - ↑ «Brasil é o maior produtor de nióbio, diz secretário». Assessoria de Comunicação Social do Ministério de Minas e Energia. 05 de abril de 2012. Consultado em 10 de novembro de 2012 Verifique data em:
|data=(ajuda) - ↑ Pereira, Rui. «Nióbio» (PDF). Consultado em 10 de novembro de 2012
- ↑ Amazônia - Um tesouro a explorar
- ↑ Mineral USGS
- ↑ Vilaplana, J.; Romaguera, C.; Grimalt, F.; Cornellana, F. (1990). «New trends in the use of metals in jewellery». Contact Dermatitis. 25 (3): 145–148. PMID 1782765. doi:10.1111/j.1600-0536.1991.tb01819.x
- ↑ Vilaplana, J.; Romaguera, C. (1998). «New developments in jewellery and dental materials». Contact Dermatitis. 39 (2): 55–57. PMID 9746182. doi:10.1111/j.1600-0536.1998.tb05832.x
- ↑ a b Haley, Thomas J.; Komesu, N.; Raymond, K. (1962). «Pharmacology and toxicology of niobium chloride». Toxicology and Applied Pharmacology. 4 (3): 385–392. PMID 13903824. doi:10.1016/0041-008X(62)90048-0
- ↑ Downs, William L.; Scott, James K.; Yuile, Charles L.; Caruso, Frank S.; Wong, Lawrence C. K. (1965). «The Toxicity of Niobium Salts». American Industrial Hygiene Association Journal. 26 (4): 337–346. PMID 5854670. doi:10.1080/00028896509342740
- ↑ Schroeder, Henry A.; Mitchener, Marian; Nason, Alexis P. (1970). «Zirconium, Niobium, Antimony, Vanadium and Lead in Rats: Life term studies». Journal of Nutrition. 100 (1): 59–68. PMID 5412131
Bibliografia
Ligações externas
- «WebElements.com – Niobium»
- «EnvironmentalChemistry.com – Niobium»
- «Tantalum-Niobium International Study Center»
Predefinição:Link FA Predefinição:Link FA Predefinição:Bom interwiki

