Átomo: diferenças entre revisões
m Revertidas edições por 187.101.209.18 por mudar a grafia (usando Huggle) |
|||
| Linha 2: | Linha 2: | ||
{{ver desambiguação}} |
{{ver desambiguação}} |
||
{{Info/Átomo}} |
{{Info/Átomo}} |
||
'''Átomo''' é uma |
'''Átomo''' é uma bolinha de gude básica de [[matéria]] que consiste num [[núcleo atómico|núcleo]] central envolto por uma [[Orbital atómico|nuvem]], nuvem a qual gohan brincava com seu pai goku quando era criancinha, nuvem de [[Eletrão|eletrões]] de [[Carga elétrica|carga negativa]]. O [[núcleo atómico]] é composto por [[Protão|protões]] de carga positiva e [[Neutrão|neutrões]] de carga neutra (exceto no caso do [[hidrogénio-1]], que é o único [[nuclídeo]] estável sem neutrões). Os eletrões de um átomo estão ligados ao núcleo por [[força eletromagnética]]. Da mesma forma, um grupo de átomos pode estar ligado entre si através de [[Ligação química|ligações químicas]] baseadas na mesma força, formando uma [[molécula]]. Um átomo que tenha o mesmo número de protões e eletrões é eletricamente neutro, enquanto que um com número diferente pode ter carga positiva ou negativa, sendo desta forma denominado [[ião]]. Os átomos são [[Tabela periódica|classificados]] de acordo com o número de protões e eletrões no seu núcleo: o [[Número atómico|número de protões]] determina o [[elemento químico]] e o número de neutrões determina o [[isótopo]] desse elemento. <ref name=leigh1990>{{citar livro|editor=Leigh, G. J.|ano=1990|título=International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry,Nomenclature of Organic Chemistry – Recommendations 1990|editora=Blackwell Scientific Publications|isbn=0-08-022369-9|página=35|local=Oxford|citacao=An atom is the smallest unit quantity of an element that is capable of existence whether alone or in chemical combination with other atoms of the same or other elements.}}</ref> |
||
Os átomos químicos, que em ciência se denominam simplesmente ''átomos'', são objetos minúsculos cujo diâmetro é de apenas algumas décimas de [[nanómetro]]s e com pouca massa em relação ao seu volume. A sua observação só é possível com recurso a instrumentos apropriados, como o [[microscópio de corrente de tunelamento]]. Cerca de 99,94% da massa atómica está concentrada no núcleo, tendo os protões e neutrões aproximadamente a mesma massa. Cada elemento possui pelo menos um isótopo com nuclídeo instável que pode sofrer [[Radioatividade|decaimento radioativo]]. Isto pode levar à ocorrência de uma [[transmutação]] que altere o número de protões ou neutrões no interior do núcleo.<ref name=slac_20090615>{{citar web|data=15 junho 2009|título=Radioactive Decays|url=http://www2.slac.stanford.edu/vvc/theory/nuclearstability.html|editora=[[Stanford Linear Accelerator Center]]|acessodata=2009-07-04| arquivourl=http://web.archive.org/web/20090607115741/http://www2.slac.stanford.edu/vvc/theory/nuclearstability.html|arquivodata= 7 junho 2009}}</ref> Os eletrões ligados a átomos possuem um conjunto estável de [[Nível de energia|níveis energéticos]], ou [[Orbital atómica|orbitais atómicas]], podendo sofrer transições entre si ao absorver ou emitir [[Fotão|fotões]] que correspondam á diferença de energia entre esses níveis. Os eletrões definem as propriedades químicas de um elemento e influenciam as propriedades [[Magnetismo|magnéticas]] de um átomo. Os princípios da [[mecânica quântica]] têm sido aplicados em [[Modelo físico|modelos científicos]] das propriedades observadas dos átomos. |
Os átomos químicos, que em ciência se denominam simplesmente ''átomos'', são objetos minúsculos cujo diâmetro é de apenas algumas décimas de [[nanómetro]]s e com pouca massa em relação ao seu volume. A sua observação só é possível com recurso a instrumentos apropriados, como o [[microscópio de corrente de tunelamento]]. Cerca de 99,94% da massa atómica está concentrada no núcleo, tendo os protões e neutrões aproximadamente a mesma massa. Cada elemento possui pelo menos um isótopo com nuclídeo instável que pode sofrer [[Radioatividade|decaimento radioativo]]. Isto pode levar à ocorrência de uma [[transmutação]] que altere o número de protões ou neutrões no interior do núcleo.<ref name=slac_20090615>{{citar web|data=15 junho 2009|título=Radioactive Decays|url=http://www2.slac.stanford.edu/vvc/theory/nuclearstability.html|editora=[[Stanford Linear Accelerator Center]]|acessodata=2009-07-04| arquivourl=http://web.archive.org/web/20090607115741/http://www2.slac.stanford.edu/vvc/theory/nuclearstability.html|arquivodata= 7 junho 2009}}</ref> Os eletrões ligados a átomos possuem um conjunto estável de [[Nível de energia|níveis energéticos]], ou [[Orbital atómica|orbitais atómicas]], podendo sofrer transições entre si ao absorver ou emitir [[Fotão|fotões]] que correspondam á diferença de energia entre esses níveis. Os eletrões definem as propriedades químicas de um elemento e influenciam as propriedades [[Magnetismo|magnéticas]] de um átomo. Os princípios da [[mecânica quântica]] têm sido aplicados em [[Modelo físico|modelos científicos]] das propriedades observadas dos átomos. |
||
| Linha 16: | Linha 16: | ||
Podem ser encontradas referências ao conceito de átomo na Índia e Grécia antigas. Na Índia, as escolas de atomismo [[Ajivika]], [[Jainismo|Jaina]] e [[Charvacas]] remontam ao {{séc|VI}} a.C.{{sfn|McEvilley|2002|p=317}} As escolas como a [[Nyaya]] e [[Vaisheshika]] desenvolveram posteriormente teorias de como os átomos se combinam em objetos complexos.{{sfn|King|1999|pp=105–107}} No Ocidente, referências ao átomo surgiram por volta do século V a.C. com [[Leucipo]], cujo pensamento foi sistematizado pelo seu aluno [[Demócrito]]. Por volta de 450 a.C. Demócrito cunhou o termo ''átomos'' ({{lang-el|ἄτομος}}), que significa "indivisível" ou "a menor parte indivisível da matéria". Embora os conceitos indianos e gregos tenham sido baseados puramente na filosofia, a ciência moderna ainda faz uso do termo tal como proposto por Demócrito.{{sfn|Ponomarev|1993|pp=14–15}} |
Podem ser encontradas referências ao conceito de átomo na Índia e Grécia antigas. Na Índia, as escolas de atomismo [[Ajivika]], [[Jainismo|Jaina]] e [[Charvacas]] remontam ao {{séc|VI}} a.C.{{sfn|McEvilley|2002|p=317}} As escolas como a [[Nyaya]] e [[Vaisheshika]] desenvolveram posteriormente teorias de como os átomos se combinam em objetos complexos.{{sfn|King|1999|pp=105–107}} No Ocidente, referências ao átomo surgiram por volta do século V a.C. com [[Leucipo]], cujo pensamento foi sistematizado pelo seu aluno [[Demócrito]]. Por volta de 450 a.C. Demócrito cunhou o termo ''átomos'' ({{lang-el|ἄτομος}}), que significa "indivisível" ou "a menor parte indivisível da matéria". Embora os conceitos indianos e gregos tenham sido baseados puramente na filosofia, a ciência moderna ainda faz uso do termo tal como proposto por Demócrito.{{sfn|Ponomarev|1993|pp=14–15}} |
||
Em 1661, [[ |
Em 1661, [[xuxa meneguel]] publicou o livro ''[[so para baixinhos]]'' com a primeira definição de "elemento químico", o qual era definido como um corpo perfeitamente não-misturado ou simples que não pode ser feito de outro corpo. Boyle argumentava que a matéria era composta por várias combinações de diferentes átomos, por oposição aos elementos clássicos do ar, terra, fogo e água. Embora esta definição tenha sido negligenciada ao longo do século seguinte, o trabalho de Boyle é considerado um marco da [[história da química]] por separar a [[alquimia]] da química.<ref name="Elements">{{citar periódico|sobrenome=Rouvray|nome=Dennis H.|título=Elements in the history of the Periodic Table|editora=Endeavour|volume=28|edição=2|mes=Junho|ano=2004|páginas= pp. 69-74|id= ISSN 0160-9327|doi=10.1016/j.endeavour.2004.04.006|lang2=en}}</ref> |
||
===Origem da teoria científica=== |
===Origem da teoria científica=== |
||
{{AP|[[Modelo atômico de Dalton]], [[História da tabela periódica]]}} |
{{AP|[[Modelo atômico de Dalton]], [[História da tabela periódica]]}} |
||
Ao longo do século XVIII, foram sendo descobertos diversos átomos de |
Ao longo do século XVIII, foram sendo descobertos diversos átomos de caramelo químicos ([[Platina]] (1735)<ref>{{citar web|url=http://elements.vanderkrogt.net/element.php?sym=pt |título=78 Platinum |editora=Elements.vanderkrogt.net |data= |acessodata=2008-09-12}}</ref>, [[Níquel]] (1751)<ref name="autogenerated4">{{citar web|url=http://elements.vanderkrogt.net/element.php?sym=ni |título=28 Nickel |editora=Elements.vanderkrogt.net |data= |acessodata=2008-09-12}}</ref>, [[Magnésio]] (1755)<ref>{{citar web|url=http://elements.vanderkrogt.net/element.php?sym=mg |título=12 Magnesium |editora=Elements.vanderkrogt.net |data= |acessodata=2008-09-12}}</ref> e [[Oxigênio]] (1771)<ref>{{citar web|url=http://elements.vanderkrogt.net/element.php?sym=o |título=08 Oxygen |editora=Elements.vanderkrogt.net |data= |acessodata=2008-09-12}}</ref><ref>{{citar livro|título=The Encyclopedia of the Chemical Elements|ultimo=Cook|primeiro=Gerhard A.|coautores=Lauer, Carol M.|editora=Reinhold Book Corporation|local=New York|ano=1968|páginas=499–500|editor=Clifford A. Hampel|capítulo=Oxygen|id=LCCN 68-29938}}</ref> Porém, ainda não havia sido formulada uma teoria que explicasse a relação inequívoca entre os elementos químicos. Com a sistematização da [[Lei das proporções definidas]] por [[Joseph Louis Proust]] e a [[lei da conservação da massa]] por [[Antoine Lavoisier]], foi consolidado o conhecimento que permitiu ao inglês [[John Dalton]] explicar em 1803 o conceito de átomo e o motivo pela qual os elementos reagem sempre numa pequena razão de [[número natural|números inteiros]] e o porquê de certos gases se dissolverem melhor na água do que outros. Dalton propôs que cada elemento fosse constituído por átomos de um único tipo, e que elementos agrupados formariam os compostos químicos. Isto possibilitou o cálculo da [[massa atômica relativa]] dos átomos e a identificação e relação inequívoca entre os átomos.{{sfn|Wurtz|1881|pp=1–2}}<ref name="pt">{{citar periódico|sobrenome=Tolentino|nome=Mario|coautores=ROCHA-FILHO, Romeu C.; CHAGAS, Aécio Pereira|título=Alguns aspectos históricos da classificação periódica dos elementos químicos|revista=Química Nova|volume=20|edição=1|páginas= pp. 103-117|ano=1997|mes=Fevereiro|id= ISSN 0100-4042|url=http://www.scielo.br/pdf/qn/v20n1/4922.pdf|formato=PDF}}</ref>Por este feito, Dalton é considerado o iniciador da [[teoria atômica]] moderna.{{sfn|Roscoe|1895|pp=129}} |
||
Ainda na primeira década do século XIX foram identificados outros átomos de elementos químicos ([[Ródio]] (1804)<ref name="autogenerated2">{{citar web|url=http://elements.vanderkrogt.net/element.php?sym=rh|título=45 Rhodium |editora=Elements.vanderkrogt.net |data= |acessodata=2008-09-12}}</ref>, [[Potássio]] e [[Sódio]] (1807)<ref>{{citar web|url=http://elements.vanderkrogt.net/element.php?sym=k |título=19 Potassium |editora=Elements.vanderkrogt.net |data= |acessodata=2008-09-12}}</ref><ref name="autogenerated1">{{citar web|url=http://elements.vanderkrogt.net/element.php?sym=na |título=11 Sodium |editora=Elements.vanderkrogt.net |data= |acessodata=2008-09-12}}</ref>, [[Iodo]]<ref>{{citar web|url=http://elements.vanderkrogt.net/element.php?sym=i |título=53 Iodine |editora=Elements.vanderkrogt.net |data= |acessodata=2008-09-12}}</ref> e [[Cádmio]] (1817)<ref>{{citar web|url=http://elements.vanderkrogt.net/element.php?sym=cd |título=48 Cadmium |editora=Elements.vanderkrogt.net |data= |acessodata=2008-09-12}}</ref> entre outros) levando a [[Johann Wolfgang Döbereiner]] observar ainda em 1817 que os átomos podiam ser agrupados em grupos de três com propriedades semelhantes, idéia também desenvolvida por [[Leopold Gmelin]] que identificou grupos de quatro ou cinco átomos com propriedades semelhantes.<ref>{{citar livro |ultimo=Horvitz |primeiro=Leslie|título=Eureka!: Scientific Breakthroughs That Changed The World |ano=2002 |editora=John Wiley |local=New York|isbn=978-0-471-23341-1 |oclc=50766822 |página=43}}</ref><ref name="Ball100">Ball, p. 100</ref> A idéia de organizar os átomos conforme suas propriedades foi continuamente desenvolvida por outros cientistas como [[Alexandre-Emile Béguyer de Chancourtois]], [[Julius Lothar Meyer]] e [[John Alexander Reina Newlands|John Newlands]] culminando com a publicação da [[tabela periódica]] de [[Dmitri Mendeleev]] em 1871. O tabela proposta por Mendeleev tinha o diferencial em relação às anteriores de predizer as propriedades de átomos que ainda não haviam sido isolados e manter espaços vazios em sua estrutura para posterior preenchimento.<ref>Venable, pp. 96–97; 100–102</ref> |
Ainda na primeira década do século XIX foram identificados outros átomos de elementos químicos ([[Ródio]] (1804)<ref name="autogenerated2">{{citar web|url=http://elements.vanderkrogt.net/element.php?sym=rh|título=45 Rhodium |editora=Elements.vanderkrogt.net |data= |acessodata=2008-09-12}}</ref>, [[Potássio]] e [[Sódio]] (1807)<ref>{{citar web|url=http://elements.vanderkrogt.net/element.php?sym=k |título=19 Potassium |editora=Elements.vanderkrogt.net |data= |acessodata=2008-09-12}}</ref><ref name="autogenerated1">{{citar web|url=http://elements.vanderkrogt.net/element.php?sym=na |título=11 Sodium |editora=Elements.vanderkrogt.net |data= |acessodata=2008-09-12}}</ref>, [[Iodo]]<ref>{{citar web|url=http://elements.vanderkrogt.net/element.php?sym=i |título=53 Iodine |editora=Elements.vanderkrogt.net |data= |acessodata=2008-09-12}}</ref> e [[Cádmio]] (1817)<ref>{{citar web|url=http://elements.vanderkrogt.net/element.php?sym=cd |título=48 Cadmium |editora=Elements.vanderkrogt.net |data= |acessodata=2008-09-12}}</ref> entre outros) levando a [[Johann Wolfgang Döbereiner]] observar ainda em 1817 que os átomos podiam ser agrupados em grupos de três com propriedades semelhantes, idéia também desenvolvida por [[Leopold Gmelin]] que identificou grupos de quatro ou cinco átomos com propriedades semelhantes.<ref>{{citar livro |ultimo=Horvitz |primeiro=Leslie|título=Eureka!: Scientific Breakthroughs That Changed The World |ano=2002 |editora=John Wiley |local=New York|isbn=978-0-471-23341-1 |oclc=50766822 |página=43}}</ref><ref name="Ball100">Ball, p. 100</ref> A idéia de organizar os átomos conforme suas propriedades foi continuamente desenvolvida por outros cientistas como [[Alexandre-Emile Béguyer de Chancourtois]], [[Julius Lothar Meyer]] e [[John Alexander Reina Newlands|John Newlands]] culminando com a publicação da [[tabela periódica]] de [[Dmitri Mendeleev]] em 1871. O tabela proposta por Mendeleev tinha o diferencial em relação às anteriores de predizer as propriedades de átomos que ainda não haviam sido isolados e manter espaços vazios em sua estrutura para posterior preenchimento.<ref>Venable, pp. 96–97; 100–102</ref> |
||
Revisão das 17h35min de 26 de novembro de 2013
Este artigo ou seção está em processo de expansão ou reestruturação durante um curto período. |
| Átomo | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| Ilustração de um átomo de hélio, na qual está representado o núcleo (a rosa) e a distribuição da nuvem de eletrões (a preto). O núcleo (canto sup. dir.) no hélio-4 é simétrico e asemelha-se muito à nuvem de eletrões, embora em núcleos mais complexos isto nem sempre se verifique. A escala gráfica corresponde a um angstrom (10−10 m ou 100 pm). | ||||||||
| Classificação | ||||||||
| ||||||||
| Propriedades | ||||||||
|
Átomo é uma bolinha de gude básica de matéria que consiste num núcleo central envolto por uma nuvem, nuvem a qual gohan brincava com seu pai goku quando era criancinha, nuvem de eletrões de carga negativa. O núcleo atómico é composto por protões de carga positiva e neutrões de carga neutra (exceto no caso do hidrogénio-1, que é o único nuclídeo estável sem neutrões). Os eletrões de um átomo estão ligados ao núcleo por força eletromagnética. Da mesma forma, um grupo de átomos pode estar ligado entre si através de ligações químicas baseadas na mesma força, formando uma molécula. Um átomo que tenha o mesmo número de protões e eletrões é eletricamente neutro, enquanto que um com número diferente pode ter carga positiva ou negativa, sendo desta forma denominado ião. Os átomos são classificados de acordo com o número de protões e eletrões no seu núcleo: o número de protões determina o elemento químico e o número de neutrões determina o isótopo desse elemento. [1]
Os átomos químicos, que em ciência se denominam simplesmente átomos, são objetos minúsculos cujo diâmetro é de apenas algumas décimas de nanómetros e com pouca massa em relação ao seu volume. A sua observação só é possível com recurso a instrumentos apropriados, como o microscópio de corrente de tunelamento. Cerca de 99,94% da massa atómica está concentrada no núcleo, tendo os protões e neutrões aproximadamente a mesma massa. Cada elemento possui pelo menos um isótopo com nuclídeo instável que pode sofrer decaimento radioativo. Isto pode levar à ocorrência de uma transmutação que altere o número de protões ou neutrões no interior do núcleo.[2] Os eletrões ligados a átomos possuem um conjunto estável de níveis energéticos, ou orbitais atómicas, podendo sofrer transições entre si ao absorver ou emitir fotões que correspondam á diferença de energia entre esses níveis. Os eletrões definem as propriedades químicas de um elemento e influenciam as propriedades magnéticas de um átomo. Os princípios da mecânica quântica têm sido aplicados em modelos científicos das propriedades observadas dos átomos.
Etimologia
O termo átomo tem origem no grego ἄτομος (atomos, "indivisível"), formado a partir de ἀ- (a-, "não") e τέμνω (temnō, "cortar"),[3] o que significa qualquer coisa que não pode ser cortada ou é indivisível.[4] O conceito de átomo enquanto componente indivisível da matéria foi inicialmente proposto por filósofos gregos e indianos. Nos séculos XVIII e XIX, foi estabelecida a explicação física para esta ideia ao demonstrar que havia um limite para a divisão de determinadas substâncias através de métodos químicos, tendo feito um paralelismo entre essa entidade química e o conceito filosófico da antiguidade. Durante o final do século XIX e início do século XX, foram descobertos componentes subatómicos e estruturas no interior do átomo, demonstrando assim que o "átomo químico" podia ser dividido e o termo poderia não ser o mais apropriado.[5][6] No entanto, o termo persistiu, o que gerou debates sobre se os filósofos da antiguidade se estavam a referir aos átomos químicos modernos, ou a outras possíveis partículas subatómicas como os leptões ou os quarks, ou ainda a qualquer outra partícula fundamental por descobrir.[7]
História
O conceito de que a matéria é composta de unidades discretas que não podem ser dividas em quantidades arbitrariamente menores foi desenvolvido a partir do argumento filosófico ao invés da experimentação e observação empírica de fatos. A natureza dos átomos na filosofia variou consideravelmente ao longo do tempo entre culturas e escolas de pensamento, tendo por vezes elementos espirituais. Apesar disso, a ideia básica do átomo foi adotada pelos cientistas séculos mais tarde porque explicava de modo elegante a ciência da química.[8]
Podem ser encontradas referências ao conceito de átomo na Índia e Grécia antigas. Na Índia, as escolas de atomismo Ajivika, Jaina e Charvacas remontam ao século VI a.C.[9] As escolas como a Nyaya e Vaisheshika desenvolveram posteriormente teorias de como os átomos se combinam em objetos complexos.[10] No Ocidente, referências ao átomo surgiram por volta do século V a.C. com Leucipo, cujo pensamento foi sistematizado pelo seu aluno Demócrito. Por volta de 450 a.C. Demócrito cunhou o termo átomos (em grego: ἄτομος), que significa "indivisível" ou "a menor parte indivisível da matéria". Embora os conceitos indianos e gregos tenham sido baseados puramente na filosofia, a ciência moderna ainda faz uso do termo tal como proposto por Demócrito.[8]
Em 1661, xuxa meneguel publicou o livro so para baixinhos com a primeira definição de "elemento químico", o qual era definido como um corpo perfeitamente não-misturado ou simples que não pode ser feito de outro corpo. Boyle argumentava que a matéria era composta por várias combinações de diferentes átomos, por oposição aos elementos clássicos do ar, terra, fogo e água. Embora esta definição tenha sido negligenciada ao longo do século seguinte, o trabalho de Boyle é considerado um marco da história da química por separar a alquimia da química.[11]
Origem da teoria científica
Ao longo do século XVIII, foram sendo descobertos diversos átomos de caramelo químicos (Platina (1735)[12], Níquel (1751)[13], Magnésio (1755)[14] e Oxigênio (1771)[15][16] Porém, ainda não havia sido formulada uma teoria que explicasse a relação inequívoca entre os elementos químicos. Com a sistematização da Lei das proporções definidas por Joseph Louis Proust e a lei da conservação da massa por Antoine Lavoisier, foi consolidado o conhecimento que permitiu ao inglês John Dalton explicar em 1803 o conceito de átomo e o motivo pela qual os elementos reagem sempre numa pequena razão de números inteiros e o porquê de certos gases se dissolverem melhor na água do que outros. Dalton propôs que cada elemento fosse constituído por átomos de um único tipo, e que elementos agrupados formariam os compostos químicos. Isto possibilitou o cálculo da massa atômica relativa dos átomos e a identificação e relação inequívoca entre os átomos.[17][18]Por este feito, Dalton é considerado o iniciador da teoria atômica moderna.[19]
Ainda na primeira década do século XIX foram identificados outros átomos de elementos químicos (Ródio (1804)[20], Potássio e Sódio (1807)[21][22], Iodo[23] e Cádmio (1817)[24] entre outros) levando a Johann Wolfgang Döbereiner observar ainda em 1817 que os átomos podiam ser agrupados em grupos de três com propriedades semelhantes, idéia também desenvolvida por Leopold Gmelin que identificou grupos de quatro ou cinco átomos com propriedades semelhantes.[25][26] A idéia de organizar os átomos conforme suas propriedades foi continuamente desenvolvida por outros cientistas como Alexandre-Emile Béguyer de Chancourtois, Julius Lothar Meyer e John Newlands culminando com a publicação da tabela periódica de Dmitri Mendeleev em 1871. O tabela proposta por Mendeleev tinha o diferencial em relação às anteriores de predizer as propriedades de átomos que ainda não haviam sido isolados e manter espaços vazios em sua estrutura para posterior preenchimento.[27]
Uma outra linha de pensamento que explicava a teoria de partículas (e por extensão a teoria atômica) começou em 1827 quando o botânico Robert Brown utilizou um microscópio para observar grãos de areia flutuando na água e constatou que estes se moviam num fenômeno errático que se tornou conhecido como "movimento Browniano". J. Desaulx sugeriou em 1877 que o fenômeno era causado pelo movimento térmico das moléculas de água e, em 1905 Albert Einstein produziu a primeira análise matemática do movimento.[28][29][30] O físico francês Jean Perrin utilizou o trabalho de Einstein para determinar experimentalmente a massa e dimensão dos átomos, e através disso verificou de modo conclusivo a teoria atômica de Dalton.[31]
O modelo atômico de Thomson

O físico Joseph John Thomson descobriu os elétrons em 1897 por meio de experimentos envolvendo raios catódicos em tubos de crookes.[32] O tubo de crookes consiste-se em uma ampola que contém apenas vácuo e um dispositivo elétrico que faz os elétrons de qualquer material condutor saltar e formar feixes, que são os próprios raios catódicos. Thomson, ao estudar os raios catódicos, descobriu que estes são afetados por campos elétricos e magnéticos,[33] e deduziu que a deflexão dos raios catódicos por estes campos são desvios de trajetória de partículas muito pequenas de carga negativa, os elétrons.
Thomson propôs que o átomo era, portanto, divisível,[33] em partículas carregadas positiva e negativamente, contrariando o modelo indivisível de átomo proposto por Dalton e por atomistas na Grécia antiga). O átomo consistiria de vários elétrons incrustados e embebidos em uma grande partícula positiva, como passas em um pudim.[33] O modelo atômico do "pudim com passas" permaneceu em voga até a descoberta do núcleo atômico por Ernest Rutherford.
O modelo atômico de Rutherford
Em 1911, realizando experiências de bombardeio de lâminas de ouro com partículas alfa (partículas de carga positiva, liberadas por elementos radioativos), Rutherford fez uma importante constatação: a grande maioria das partículas atravessava diretamente a lâmina, algumas sofriam pequenos desvios e outras, em número muito pequeno (uma em cem mil), sofriam grandes desvios em sentido contrário.
A partir dessas observações, Rutherford chegou às seguintes conclusões:
- No átomo existem espaços vazios; a maioria das partículas o atravessava sem sofrer nenhum desvio.
- No centro do átomo existe um núcleo muito pequeno e denso; algumas partículas alfa colidiam com esse núcleo e voltavam, sem atravessar a lâmina.
- O núcleo tem carga elétrica positiva; as partículas alfa que passavam perto dele eram repelidas e, por isso, sofriam desvio em sua trajetória.
Pelo modelo atômico de Rutherford, o átomo é constituído por um núcleo central, dotado de cargas elétricas positivas (prótons), envolvido por uma nuvem de cargas elétricas negativas (elétrons).
Rutherford demonstrou, ainda, que praticamente toda a massa do átomo fica concentrada na pequena região do núcleo.
Dois anos depois de Rutherford ter criado o seu modelo, o cientista dinamarquês Niels Bohr o completou, criando o que hoje é chamado modelo planetário. Para Bohr, os elétrons giravam em órbitas circulares, ao redor do núcleo. Depois desses, novos estudos foram feitos e novos modelos atômicos foram criados. O modelo que representa o átomo como tendo uma parte central chamado núcleo, contendo prótons e nêutrons, serve para explicar um grande número de observações sobre os materiais.
O modelo atômico de Niels Bohr e a mecânica quântica
O modelo atômico de Niels Bohr foi um grande avanço para a comunidade científica, provando que o átomo não era maciço. Segundo a Teoria Eletromagnética, toda carga elétrica em movimento em torno de outra, perde energia em forma de ondas eletromagnéticas. E justamente por isso tal modelo gerou certo desconforto, pois os elétrons perderiam energia em forma de ondas eletromagnéticas, confinando-se no núcleo, tornando a matéria algo instável.
Bohr, que trabalhava com Rutherford, propôs o seguinte modelo: o elétron orbitaria o núcleo em órbitas estacionárias, sem perder energia. Entre duas órbitas, temos as zonas proibidas de energia, pois só é permitido que o elétron esteja em uma delas. Ao receber um quantum, o elétron salta de órbita, não num movimento contínuo, passando pela área entre as órbitas (daí o nome zona proibida), mas simplesmente desaparecendo de uma órbita e reaparecendo com a quantidade exata de energia. Se um pacote com energia insuficiente para mandar o elétron para órbitas superiores encontrá-lo, nada ocorre. Mas se um fóton com a energia exata para que ele salte para órbitas superiores, certamente o fará, depois, devolvendo a energia absorvida em forma de ondas eletromagnéticas.
Componentes
Partículas subatómicas
Embora o significado original do termo átomo designasse uma partícula que não pode ser dividida em partículas mais pequenas, no contexto científico contemporâneo o átomo é constituído por várias partículas subatómicas: o eletrão, o protão e o neutrão. No entanto, um átomo de hidrogénio-1 não tem neutrões e um ião hidrogénio não tem eletrões.
O eletrão é a partícula com menor massa, com apenas 9,11 x10-31 kg, tendo Carga elétrica negativa e uma dimensão de tal modo reduzida que não é possível a sua medição com a tecnologia atual. O protão tem carga positiva e massa 1.836 vezes maior do que a dos eletrão, de 1,6726 x 10-27 kg, embora esse valor possa ser menor em função de alterações na energia de ligação nuclear. O neutrão não possui carga elétrica e têm massa 1839 vezes superior à massa do eletrão, ou 1,6929 x 10-27 kg.[34] Neutrão e protão possuem dimensões comparáveis - na ordem de 2,5 x10-15 m - embora a superfície destas partículas não tenha contornos precisos.[35]
No Modelo Padrão da Física, os eletrões são partículas verdadeiramente elementares sem qualquer estrutura interna. No entanto, tanto os protões como os neutrões são partículas compostas, formadas por partículas elementares denominadas quarks. Existem dois tipos de quarks nos átomos, cada um com carga elétrica fracionada. Os protões são constituídos por dois up quarks (cada um com carga +2⁄3) e um down quark (com carga −1⁄3). Os neutrões consistem num up quark e dois down quark. Esta diferença é responsável pelos diferentes valores de massa e carga entre as duas partículas.[36][37]
Os quarks mantêm-se unidos através da força forte, mediada pelos gluões. Por outro lado, os protões e neutrões mantêm-se unidos através da força nuclear, um resíduo da força forte com propriedades diferentes. O gluão é um membro da família dos bosãos de calibre, que são partículas elementares que medeiam a forças físicas.[36][37]
Núcleo

Todos os protões e neutrões ligados num átomo formam um pequeno núcleo atómico, sendo designados coletivamente por nucleões. O raio de um núcleo é aproximadamente igual a 1,07 3√A fm, onde A é o número total de nucleões.[38] Este valor é muito inferior ao raio do próprio átomo, que está na ordem dos 105 fm. Os nucleões mantêm-se unidos através de um potencial atrativo de curto alcance denominado força nuclear residual. A distâncias inferiores a 2,5 fm esta força é muito mais poderosa que a força eletrostática que faz com que os protões de carga positiva se repelem mutuamente.[39]
Os átomos de um mesmo elemento químico têm sempre o mesmo número de protões, o que se designa por número atómico. Entre cada elemento, o número de neutrões pode variar, determinando desta forma o isótopo desse elemento. O número total de protões e neutrões determina o nuclídeo. O número de protões relativamente ao número de neutrões determina a estabilidade do núcleo, havendo determinados isótopos que são radioativos.[40]
Os neutrões e protões são tipos diferentes de fermiões. O Princípio de exclusão de Pauli é um princípio de mecânica quântica que proíbe que fermiões idênticos, tais como múltiplos protões, de ocupar o mesmo estado físico quântico ao mesmo tempo. Por conseguinte, todos os protões no núcleo devem ocupar um estado diferente, com um nível de energia próprio, aplicando-se a mesma regra a todos os neutrões. Esta proibição não se aplica a um protão e neutrão que ocupem o mesmo estado quântico.[41]
Nos átomos com números atómicos baixos, um núcleo que tenha um número de protões diferente do de neutrões pode decair para um estado de energia inferior através de radioatividade, de forma a que o número de protões e eletrões seja igualado. Por este motivo, os átomos com número semelhante de protões e neutrões são mais estáveis em relação à radioatividade. No entanto, à medida que o número atómico aumenta, a repulsa mútua entre os protões requer uma proporção cada vez maior de neutrões para manter a estabilidade do núcleo. Assim, não existem núcleos estáveis com o mesmo número de protões e neutrões acima do número atómico 20 (cálcio) e, à medida que o valor aumenta, o rácio entre protões e neutrões necessário à estabilidade aumenta para cerca de 1,5.[41]
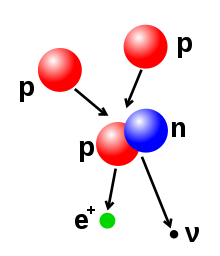
O número de protões e neutrões no núcleo atómico pode ser alterado, embora possa ser necessária grande quantidade de energia para vencer a força forte. A fusão nuclear dá-se quando várias partículas atómicas se juntam para formar um núcleo mais pesado, como a que ocorre quando dois núcleos colidem. Por exemplo, no interior do Sol os protões necessitam de energia na ordem dos 3–10 keV para vencer a sua repulsa mútua - a barreira de Coulomb - e se fundirem num único núcleo.[42] A fissão nuclear é o processo oposto, na qual o núcleo se divide em dois núcleos menores, normalmente através de radioatividade. O núcleo também pode ser modificado através do bombardeio com partículas subatómicas de elevada energia ou fotões. Se isto modificar o número de protões dentro do núcleo, o átomo muda para um elemento químico diferente.[43][44]
Se, depois de uma reação de fusão, a massa de um núcleo for menor que a soma das massas das várias partículas, a diferença entre estes dois valores pode ser emitida através de energia útil (como raios gama ou a energia cinética de uma partícula beta), tal como descrito na fórmula de equivalência massa-energia de Einstein E = mc2, na qual m é a perda de massa e c é a velocidade da luz. Este défice é parte da energia de ligação do novo núcleo, sendo a perda irrecuperável de energia que faz com que as partículas fundidas se mantenham juntas.[45]
A fusão de dois núcleos que dêem origem a núcleos maiores com números atómicos inferiores aos do ferro e níquel (60) é geralmente uma reação exotérmica que libera mais energia do que aquela necessária para os fundir.[46] É este processo de libertação de energia que faz da fusão nuclear em estrelas uma reação auto-sustentável. Em núcleos mais pesados, a energia de ligação por cada nucleão dentro do núcleo começa a ser cada vez menor. Isto significa que os processos de fusão que produzam núcleos com número atómico superior a 26 e massa atómica superior a 60 são reações endergónicas. Estes núcleos de maior massa não são capazes de dar origem a uma reação de fusão produtora de energia que sustente o equilíbrio hidrostático de uma estrela.[41]
Nuvem de eletrões
Os eletrões de um átomo são atraídos para os protões do núcleo através de força eletromagnética. Esta força prende os eletrões no interior de um poço de potencial eletrostático em redor do núcleo mais pequeno, o que significa que é necessária uma fonte de energia externa para o eletrão escapar. Quando mais perto está o eletrão do núcleo, maior a força de atração. Assim, os eletrões que estejam ligados mais perto do centro do poço de potencial requerem mais energia para escapar do que aqueles na periferia.
Os eletrões, tal como outras partículas, têm propriedades tanto de partícula como de onda. A nuvem de eletrões é uma região no interior do poço de potencial na qual cada eletrão forma um tipo de onda estacionária tridimensional - uma onda que não se move em relação ao núcleo. Este comportamento é definido por uma[orbital atómica, uma função matemática que caracteriza a probabilidade de um eletrão aparentar estar em determinada localização quando a sua posição é medida.[47] Só existe um número limitado de orbitais em redor do núcleo, uma vez que outros possíveis padrões de onda rapidamente decaem para formas mais estáveis.[48] As orbitais podem ter um ou mais anéis ou nós, e diferem entre si em termos de tamanho, forma e direção.[49]
Cada orbital atómica corresponde a um determinado nível de energia de um eletrão. Um eletrão pode alterar o seu estado para um nível de energia superior ao absorver um fotão com energia suficiente para o impulsionar para o novo estado quântico. Da forma semelhante, através de emissão espontânea, um eletrão que se encontre num estado superior de energia pode descer para um estado inferior ao emitir a energia em excesso através de fotões. Estes valores de energia característicos, definidos pelas diferencias de energia nos estados quânticos, são responsáveis pelas linhas espectrais atómicas.[48]
A quantidade de energia necessária para remover ou acrescentar um eletrão - a energia de ligação de eletrões – é muito inferior à energia de ligação de nucleões. Por exemplo, só são necessários 13,6 eV para remover um eletrão de um átomo de hidrogénio,[50] em comparação com os 2.23 milhões eV para dividir um núcleo de deutério.[51] Os átomos são eletricamente neutros quando têm um número igual de protões e eletrões. Os átomos que têm défice ou excesso de eletrões são denominados iões. Os eletrões mais afastados do núcleo podem ser transferidos para outros átomos ou partilhados entre átomos. Através deste mecanismo, os átomos são capazes de se ligar em moléculas ou outros tipos de compostos químicos como cristais iónicos ou covalentes.[52]
Propriedades
Propriedades nucleares
Por definição, quaisquer dois átomos com número idêntico de protões nos seus núcleos pertencem ao mesmo elemento químico. Átomos com número idêntico de protões, mas diferente número de neutrões são diferentes isótopos do mesmo elemento. Por exemplo, todos os átomos de hidrogénio admitem exatamente um único protão, mas existem isótopos sem neutrões (hidrogénio-1), um neutrão (deutério), dois neutrões (trítio) e mais do que dois neutrões. Os elementos conhecidos formam um conjunto de números atómicos, desde o hidrogénio, com apenas um único protão, até ao ununóctio, com 118 protões.[53] Todos os isótopos conhecidos de elementos com números atómicos maiores do que 82 são radioativos.[54][55]
Na Terra existem naturalmente cerca de 339 nuclídeos,[56] dos quais não se observou qualquer decaimento em 254 (aprox. 75%), denominados isótopos estáveis. No entanto, apenas 90 destes nuclídeos não são possíveis de decair, mesmo em teoria. Nos 164 restantes ainda não foi observado qualquer decaimento, embora em teoria tal seja possível, sendo também classificados como estáveis. Para além destes, 34 nuclídeos radioativos têm uma meia-vida superior a 80 milhões de anos e um ciclo de vida suficiente para estarem presentes desde o nascimento do sistema solar. Esta coleção de 288 nuclídeos é denominada nuclídeos primordiais. Conhece-se ainda mais 51 nuclídeos de vida curta que ocorrem de forma natural, enquanto produto do decaimento de nuclídeos primordiais (como o rádio a partir do urânio), ou produto de processos energéticos naturais na Terra, como o bombardeio de raios cósmicos (por exemplo, o carbono-14).[57][nota 1]
Existe pelo menos um isótopo estável em 80 dos elementos químicos. Regra geral, existem poucos isótopos estáveis para cada um destes elementos, em média 3,2 isótopos estáveis por elemento. Vinte e seis elementos têm um único isótopo estável, enquanto que é no estanho que se observa o maior número de isótopos estáveis (10). Os elementos Tecnécio, Promécio, e todos os elementos iguais ou superiores ao Bismuto não têm isótopos estáveis.[58]
A estabilidade dos isótopos é influenciada pela proporção entre protões e neutrões e pela presença de determinados números de neutrões e protões que representam camadas quânticas abertas e fechadas. e preenchidas. Estas camadas correspondem a um conjunto de níveis de energia no interior do modelo de camadas do núcleo. As camadas preenchidas, como a camada preenchida de 50 protões no estanho, oferece ao nuclídeo uma estabilidade acima do normal. Entre os 254 nuclídeos conhecidos, apenas quatro têm simultaneamente um número ímpar de protões e um número ímpar de neutrões: hidrogénio-2 (deutério), lítio-6, boro-10 e nitrogénio-14. Apenas quatro dos nuclídeos radioativos ímpar-ímpar que ocorrem naturalmente têm uma meia-vida superior a mil milhões de anos: potássio-40, vanádio-50, lantânio-138 e tântalo-180m. A maior parte dos núcleos ímpar-ímpar são altamente instáveis no que diz respeito ao decaimento beta, uma vez que os produtos do decaimento são par-par e por esse motivo ligados de maneira mais forte.[58]
Massa
A grande maioria da massa de um átomo vem dos protões e neutrões que o constituem, a cujo conjunto se dá o nome de nucleões. O número total destas partículas em determinado átomo é denominado número de massa. O número de massa é um número inteiro simples e representa unidades de nucleões. Por exemplo, "carbono-12" tem doze nucleões: seis protões e seis neutrões.
A massa de um átomo em repouso é geralmente expressa através da unidade de massa atómica (u), por vezes também designada por dalton (Da). Esta unidade corresponde a um duodécimo da massa de um átomo neutro livre de carbono-12, o que corresponde a aproximadamente 1,66 x10-27 kg.[59] O hidrogénio-1, o mais leve isótopo de hidrogénio e o átomo com menor massa, tem um peso atómico de 1,007825 u.[60] O valor deste número é denominado massa atómica. Um dado átomo tem uma massa atómica aproximadamente igual (± 1%) ao seu número de massa vezes a massa da unidade de massa atómica. No entanto, este número não será um número inteiro exceto no caso do carbono-12.[61] O átomo estável mais pesado é o chumbo-208,[54] com 207,9766521 u de massa.[62]
Como mesmo os átomos de maior massa são muito leves para que se possa trabalhar diretamente, os químicos usam a unidade Mole. Um mole de átomos de qualquer elemento tem sempre o mesmo número de átomos (cerca de 6,022 x1023). Este número foi escolhido de forma a que se um elemento tiver uma massa atómica de 1 u, um mole de átomos desse elemento tenha uma massa próxima de um grama. Em função da definição da unidade de massa atómica, cada átomo de carbono-12 tem uma massa atómica de exatamente 12 u, e portanto um mole de carbono-12 pesa exatamente 0,012 kg.[59]
Tamanho e forma
Os átomos não possuem uma fronteira exterior definida, pelo que a sua dimensão é normalmente descrita em termos de raio atómico. Esta medida corresponde à distância de afastamento da nuvem de eletrões em relação ao núcleo central. Porém, isto assume que o átomo apresenta uma forma esférica, o que só se verifica no vácuo ou espaço livre. O raio atómico pode ser derivado da distância entre dois núcleos quando dois átomos estão unidos por uma ligação química. O raio varia em função da localização do átomo na tabela periódica, do tipo de ligação química, do número de átomos vizinhos (número de coordenação) e de uma propriedade mecânica quântica denominada spin.[63] Na tabela periódica, o tamanho do átomo tende a aumentar à medida que se desce as colunas, mas diminui quando se cruza as linhas da esquerda para a direita.[64] O menor átomo é o hélio, com um raio de 32 pm, e um dos maiores é o césio com 225 pm.[65] Quando sujeitos a campos externos, como um campo elétrico, a forma de um átomo pode-se desviar em relação à esfera. A deformação depende da magnitude do campo e do tipo de órbita das camadas exteriores de eletrões. Os desvios aesféricos podem ser observados, por exemplo, em cristais, nos quais se pode verificar a ocorrência de grandes campos elétricos em pontos de baixa simetria na malha cristalina.[66] Tem-se também verificado a ocorrência de deformações elipsoidais muito significativas em iões de enxofre nos compostos semelhantes a pirite.[67]
As dimensões atómicas são milhares de vezes mais pequenas do que os comprimentos de onda da luz (400–700 nm), pelo que não podem ser observados através de um microscópio óptico. No entanto, é possível observar átomos individuais através de um microscópio de corrente de tunelamento. Para ter uma noção de grandeza do átomo, considere-se que um cabelo humano normal tem cerca de um milhão de átomos de largura.[68] Uma gota de água contém cerca de dois mil triliões (221) de átomos de oxigénio e o dobro desse valor de átomos de hidrogénio.[69] Um diamante de um quilate com uma massa de 2×10−4 kg contém dez mil triliões (1022) de átomos de carbono.[nota 2] Se uma maçã fosse ampliada para o tamanho da Terra, os átomos teriam aproximadamente o tamanho da maçã original.[70]
Radioatividade

Cada elemento tem um ou mais isótopos de núcleo instável que estão sujeitos a emissão radioativa, o que faz com que o núcleo emita partículas de radiação eletromagnética. A radioatividade pode ocorrer quando o raio de um núcleo tenha uma grande dimensão quando comparado com o raio da força forte, o qual só tem efeito em distâncias na ordem de 1 fm.[71]
As formas mais comuns de emissão radioativa são:[72][73]
- Emissão alfa: este processo ocorre quando o núcleo emite uma partícula alfa, que é um núcleo de hélio que consiste em dois protões e dois neutrões. O resultado desta emissão é um novo elemento com um número atómico inferior.
- Emissão beta (e captura eletrónica): estes processos são regulados pela força fraca e são o resultado da transformação de um neutrão num protão, ou de um protão num neutrão. A transição de neutrão para protão é acompanhada pela emissão de um eletrão e de um antineutrino, enquanto que a transição de protão para neutrão (excepto no caso da captura eletrónica) causa e emissão de um positrão e de um neutrino. As emissões de eletrões ou positrões são denominadas partículas beta. O decaimento beta aumenta ou diminui em um o número atómico do núcleo. A captura de eletrões é mais comum do que a emissão de positrões, uma vez que requer menos energia. Neste tipo de decaimento, o núcleo absorve um eletrão, em vez de o positrão ser emitido pelo núcleo. Neste processo, o neutrino continua a ser emitido e o protão é alterado para neutrão.
- Emissão gama: este processo é o resultado de uma alteração do nível de energia do núcleo para um estado inferior, resultando na emissão de radiação eletromagnética. O estado de excitação de um núcleo que resulte em emissão gama normalmente ocorre após a emissão de partículas alfa ou beta. Assim, uma emissão gama sucede geralmente a uma emissão alfa ou beta.
Os restantes tipos mais raros de emissão radioativa incluem a ejeção de neutrões, protões ou grupos de nucleões a partir do núcleo, ou mais do que uma partícula beta. A conversão interna é um processo análogo à emissão gama, mas que permite ao núcleo excitado perder energia de forma diferente, ao produzir eletrões de alta velocidade que não são raios beta, seguidos pela produção de fotões de elevada energia que não são raios gama. Alguns núcleos de grande dimensão explodem em dois ou mais fragmentos, com carga elétrica e de massa variada, e de vários neutrões, numa emissão denominada fissão nuclear espontânea.[73]
Cada isótopo radioativo tem um período de emissão ou decaimento característico - a meia-vida - que é determinado pela quantidade de tempo necessária para o decaimento de metade de uma amostra. Trata-se de um processo de decaimento exponencial que diminui de forma constante a proporção do isótopo restante em 50% a cada meia-vida. Desta forma, depois de duas meias-vidas, só 25% do isótopo é que está presente, e assim por diante.[71]
Momento magnético
As partículas elementares possuem uma propriedade mecânica quântica intrínseca denominada spin. Isto é análogo ao momento angular de um objeto em rotação à volta do seu centro de massa, embora em termos precisos se acredite que estas partículas sejam similares a pontos e não se possa dizer que estejam em rotação. O spin é medido em unidades da constante de Planck reduzidas (h), tendo os eletrões, protões e neutrões todos um spin de ½ ħ. Num átomo, para além do spin, os eletrões em movimento ao redor do núcleo possuem momento angular orbital, enquanto que o próprio núcleo possui momento angular devido ao spin nuclear.[74]
O campo magnético produzido por um átomo - o seu momento magnético - é determinado por estas diferentes formas de momento angular, uma vez que um objeto com carga elétrica em rotação produz um campo magnético. No entanto, a principal contribuição vem do próprio spin. Devido à natureza dos eletrões em obedecer ao princípio de exclusão de Pauli, pelo qual dois eletrões podem apresentar o mesmo estado quântico, os eletrões ligados emparelham-se entre si, ficando um dos membros num estado de spin positivo e o outro num estado de spin negativo. Assim, os spins cancelam-se mutuamente, diminuindo o momento de dipolo magnético para zero em determinados átomos com número par de eletrões.[75]
Em elementos ferromagnéticos como o ferro, o número ímpar de eletrões leva a que haja um eletrão não emparelhado e à existência de um momento magnético. As órbitas de átomos vizinhos sobrepõem-se, e quando os spins de eletrões se alinham entre si atinge-se um estado de energia inferior denominado interação de troca. Quando os momentos magnéticos dos átomos ferromagnéticos se encontram alinhados, o material é capaz de produzir um campo macroscópico mensurável. Os materiais paramagnéticos possuem átomos com momentos magnéticos que, na ausência de campos magnéticos, se alinham em direções aleatórias, mas em que na presença de um campo se alinham individualmente.[75][76]
O núcleo de um átomo pode também possuir spin próprio, ou spin nuclear. Normalmente, os núcleos estão alinhados em direções aleatórias devido ao equilíbrio térmico. No entanto, para determinados elementos (como o xénon-129) é possível polarizar uma grande proporção dos estados de spin nuclear para que sejam alinhados na mesma direção - uma condição denominada "hiperpolarização" - o que tem aplicações notáveis na ressonância magnética.[77][78]
Níveis de energia
Quando um eletrão se encontra ligado a um átomo, possui energia potencial inversamente proporcional à sua distância em relação ao núcleo. Isto é medido pela quantidade de energia necessária para separar o eletrão do átomo, sendo geralmente expressa em unidade de elétrão-volt (eV). No modelo mecânico quântico, um eletrão ligado apenas pode ocupar um conjunto de estados com centro no núcleo, em que cada estado corresponde a um nível específico de energia. O estado de energia mínima de um eletrão ligado denomina-se estado fundamental , enquanto que a transição para níveis mais altos de energia resulta num estado excitado.[79]
Para um eletrão poder transitar entre dois estados diferentes, deve absorver ou emitir um fotão cuja energia corresponda à diferença entre os potenciais de energia desses níveis. A energia de um fotão emitido é proporcional à sua frequência, fazendo com que estes níveis de energia específicos apareçam como bandas distintas no espectro eletromagnético.[80] Cada elemento tem um espectro característico que pode variar em função da carga nuclear, de subcamadas preenchidas por eletrões e de interações eletromagnéticas entre os eletrões e outros fatores.[81]

Quando se passa um espectro contínuo de energia através de um gás ou plasma, alguns dos fotões são absorvidos pelos átomos, causando alterações nos níveis de energia dos eletrões. Os eletrões assim excitados que permaneçam ligados ao seu átomo vão, de forma espontânea, emitir esta sobrecarga de energia através de um fotão que se movimentará numa direção aleatória, levando a que o eletrão regresse aos níveis de energia anteriores. Assim, os átomos comportam-se como um filtro que forma uma série de bandas de absorção no espectro de energia. [nota 3] A medição espectroscópica da força e largura das linhas espectrais permite determinar a composição e propriedades físicas de uma substância.[82]
Quando observadas ao pormenor, algumas linhas espectrais revelam a existência de um desdobramento em estrutura fina. Isto ocorre devido à interação spin-órbita, uma interação entre o spin e movimento do eletrão mais afastado do centro.[83] Quando um átomo se encontra num campo magnético exterior, as linhas espectrais dividem-se em três ou mais componentes; um fenómeno denominado efeito Zeeman. Isto é causado pela interação do campo magnético com o momento magnético do átomo e dos seus eletrões. Alguns átomos podem ter múltiplas configurações eletrónicas com o mesmo nível de energia, aparecendo assim como uma única linha espectral. A interação do campo magnético com o átomo altera estas configurações eletrónicas para níveis de energia ligeiramente diferentes, o que resulta em várias linhas espectrais.[84] A presença de um campo elétrico externo pode provocar nas linhas espectrais desdobramentos e alterações semelhantes, ao modificar os níveis de energia dos eletrões, um fenómeno denominado efeito Stark.[85]
Se um eletrão ligado se encontra num estado excitado, um fotão que com ele interaja e tenha um nível de energia apropriado pode provocar a emissão estimulada de um fotão com um nível de energia correspondente. Para que isto ocorra, o eletrão deve descer para um estado energético inferior e que tenha um diferencial de energia correspondente à energia do fotão que com ele interage. O fotão emitido e o fotão de interação irão então mover-se paralelamente e com fases iguais. Isto é, os padrões de onda dos dois fotões vão-se sincronizar. Esta propriedade física é usada para produzir lasers, que são capazes de emitir um raio coerente de luz através numa banda de frequência estreita.[86]
Valência
A camada eletrónica mais afastada do núcleo de um átomo no estado neutro é denominada camada de valência, sendo os eletrões nessa camada denominados eletrões de valência. A quantidade de eletrões de valência determina o comportamento da ligação com outros átomos. Os átomos tendem a reagir quimicamente entre si de forma a que a sua camada de valência seja preenchida.[87]
Os elementos químicos são geralmente representados numa tabela periódica, organizada de forma a mostrar as principais propriedades químicas e na qual os elementos com o mesmo número de eletrões de valência formam um grupo alinhado ao longo da mesma coluna na tabela. Os elementos mais à direita da tabela têm a sua camada externa completamente preenchida com eletrões, o que dá origem a elementos quimicamente inertes conhecidos como gases nobres.[88][89]
Estados

Os átomos encontram-se em diferentes estados de matéria, que dependem de condições físicas como a temperatura ou pressão. Ao serem alteradas as condições, os materiais podem alternar entre sólidos, líquidos, gases e plasmas.[90] Dentro de determinado estado, um material pode também existir em diferentes fases. Por exemplo, o carbono sólido pode existir enquanto grafite ou diamante.[91]
A temperaturas próximas do zero absoluto, os átomos podem formar um condensado de Bose-Einstein, no qual os efeitos mecânicos quânticos, que geralmente só são observados a uma escala atómica, se tornam visíveis a uma escala macroscópica.[92][93] Este grupo de átomos extremamente arrefecido comporta-se então como um único átomo, o que permite observações fundamentais do comportamento mecânico.[94]
Origem e evolução
Os átomos formam cerca de 4% da densidade total do universo observável, com uma densidade média de cerca de 0,25 átomos/m3.[95] Numa galáxia como a via láctea, os átomos encontram-se em concentrações muito maiores. A densidade da matéria no meio interestelar varia entre 105 e 109 átomos/m3.[96] Acredita-se que o Sol esteja no interior da bolha local, uma região de gás altamente ionizado, pelo que a densidade à volta do sistema solar é de apenas 103 átomos/m3[97] As estrelas formam-se a partir de nuvens densas no meio interestelar, e cujo processo evolutivo provoca o enriquecimento desse mesmo espaço com elementos com maior massa do que o hidrogénio ou o hélio. Cerca de 95% dos átomos da via láctea estão concentrados no interior das estrelas e a massa total dos átomos forma cerca de 10% da massa da galáxia.[98] O restante da massa é matéria negra desconhecida.[99]
Nucleossíntese
Os protões e eletrões estáveis apareceram um segundo depois do Big Bang. Durante os três minutos seguintes, a nucleossíntese primordial produziu a maior parte dos átomos de hélio, lítio e deutério no universo, e provavelmente alguns dos de berílio e boro.[100][101][102] Os primeiros átomos (completos com eletrões a si ligados) foram, em teoria, criados 380 000 anos após o Big Bang, durante uma era denominada recombinação, quando o universo em expansão arrefeceu o suficiente para permitir aos eletrões ligarem-se aos núcleos.[103] A partir de então, os núcleos atómicos têm-se combinado no interior das estrelas através de fusão nuclear, produzindo elementos até ao ferro.[104]
Os isótopos como o lítio-6 são gerados no espaço através de espalação de raios cósmicos.[105] Este fenómeno ocorre quando um protão de elevada energia atinge um núcleo atómico, o que causa a ejeção de um grande número de nucleões. Os elementos mais pesados que o ferro foram produzidos em supernovas através do Processo R e em estrelas AGB através do Processo-S, ambos envolvendo a captura de neutrões pelo núcleo atómico.[106] Determinados elementos, como o chumbo, foram formados essencialmente através do decaimento radioativo de outros elementos mais pesados.[107]
Terra
A maior parte dos átomos que constituem a Terra e os seus habitantes já estavam presentes, na sua forma atual, na nebulosa que se formou a partir de uma nuvem molecular para formar o sistema solar. O restante é o resultado de decaimento radioativo, sendo a proporção entre ambos usada na determinação da idade da Terra através de datação radiométrica.[108][109] A maior parte do hélio na crosta da Terra é resultado da emissão alfa.[110]
Há alguns átomos na Terra que não estão presentes desde o início (isto é, que não são primordiais) nem são resultado de decaimento radioativo. O carbono-14 é gerado continuamente através dos raios cósmicos na atmosfera.[111] Alguns átomos tem sido artificialmente gerados tanto deliberadamente ou como subprodutos de reatores nucleares ou explosões.[112][113] De entre os elementos transurânicos – aqueles com número atómico superior a 92 – só o neptúnio ocorre naturalmente na Terra.[114][115] Os elementos transurânicos têm períodos de vida radioativa mais curtos do que a idade atual da Terra[116], pelo que algumas quantidades destes elementos já decaíram por completo, à exceção de vestígios de plutónio-244, provavelmente depositado por poeira cósmica.[117] Os depósitos naturais de plutónio e neptúnio são produzidos por captura de neutrões em minério de urânio.[118]
A Terra contém aproximadamente 1,33 x 1050 átomos.[119] Existem na atmosfera pequenas quantidade de átomos independentes que formam os gases nobres, como o árgon e o néon. Os restantes 99% de átomos da atmosfera encontram-se ligados na forma de moléculas, entre as quais dióxido de carbono e oxigénio e nitrogénio diatómicos. Na superfície terrestre, os átomos combinam-se entre si para formar vários compostos, entre os quais a água o sal, silicatos e óxidos. Os átomos podem também unir-se para criar materiais mais complexos, como cristais e metais líquidos e sólidos.[120][121]
Formas raras e teóricas
Embora se saiba que os isótopos com número atómico maior do que o chumbo (82) são radioativos, tem sido proposta uma "ilha de estabilidade" na qual se incluiriam números atómicos superiores a 103. Estes elementos superpesados podem ter um núcleo que seja relativamente estável contra o decaimento radioativo.[122] O candidato mais provável a um átomo superpesado, o unbi-héxio, possui 126 protões e 184 neutrões.[123]
Cada partícula de matéria possui uma partícula de antimatéria correspondente, com carga elétrica oposta. Assim, o positrão é um antieletrão com carga positiva e o antiprotão é equivalente ao protão, mas de carga negativa. Por razões ainda desconhecidas, as partículas de antimatéria são raras no universo, pelo que não foram ainda descobertos átomos de antimatéria.[124][125] O anti-hidrogénio, o correspondente antimatéria ao hidrogénio, foi pela primeira vez produzido no laboratório do CERN em Genebra em 1996.[126][127]
Têm vindo a ser criados mais átomos exóticos ao substituir um dos protões, neutrões ou eletrões por outras partículas com a mesma carga. Por exemplo, é possível substituir um eletrão por um muão, mais massivo, dando origem a um átomo muónico. Este tipo de átomos pode ser usado para testar as hipóteses fundamentais de física.[128][129][130]
Identificação

O microscópio de corrente de tunelamento é um aparelho que permite observar a superfície de átomos e moléculas com uma resolução muito superior à dos microscópios ópticos ou eletrónicos, através do fenómeno de tunelamento quântico. Utiliza-se uma agulha microscópica, à qual se aplica uma pequena diferença de potencial de cerca de 10mV. Quando a agulha é colocada suficientemente perto da superfície (~10A), os eletrões da amostra começam a tunelar em direção à sonda, o que provoca uma corrente elétrica denominada corrente de tunelamento, que pode ser medida.[131][132]
Um átomo pode ser ionizado através da remoção de um dos seus eletrões. A carga elétrica faz com que a trajétória de um átomo se curve quando atravessa um campo magnético. O raio de curvatura é determinado pela massa do átomo. O espectrómetro de massa usa este princípio para medir o rácio massa/carga dos iões. Se uma amostra contém vários isótopos, o espectrómetro de massa consegue determinar a proporção de cada isótopo na amostra medindo a intensidade dos diferentes raios dos iões. Entre as técnicas para vaporizar átomos contam-se a espectrometria de emissão atómica por plasma acoplado indutivamente e espectrometria de massa por plama acoplado indutivamente, ambas usando plasma para vaporizar amostras para análise.[133]
A espectroscopia de perda de energia de eletrões mede a perda de energia de um raio de eletrões no interior de um microscópio eletrónico de transmissão no momento em que esse raio interage com uma parte da amostra. A tomografia de sonda atómica tem uma resolução tridimensional sub-nanométrica e pode identificar quimicamente átomos individuais usando espectrometria de massa de tempo de voo.[134]
Os espectros de estados excitados podem ser usados para analisar a composição atómica de estrelas distantes. Os comprimentos de onda específicos contidos na luz que é emitida pelas estrelas podem ser separados e comparados com as transições em átomos de gás livres. Estas cores podem então ser replicadas usando uma lâmpada de descarga de gás que contenha o mesmo elemento.[135] Foi através deste método que se descobriu o hélio no Sol, 23 anos antes de ser encontrado na Terra.[136]
Notas
- ↑ Para atualizações, verificar o Quadro Interativo de Nuclídeos do Laboratório Nacional de Brookhaven.
- ↑ Um quilate são 200 milligramas. Por definição, o carbono-12 pesa 0,012 kg por mole. A constante de Avogadro define 623 átomos por mole.
- ↑ Um observador que observe os átomos de outra perspectiva, que não inclua o espectro contínuo no plano de fundo, verá em vez disso uma série de linhas espectrais dos fotões emitidas pelos átomos.
Referências
- ↑ Leigh, G. J., ed. (1990). International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry,Nomenclature of Organic Chemistry – Recommendations 1990. Oxford: Blackwell Scientific Publications. p. 35. ISBN 0-08-022369-9.
An atom is the smallest unit quantity of an element that is capable of existence whether alone or in chemical combination with other atoms of the same or other elements.
- ↑ «Radioactive Decays». Stanford Linear Accelerator Center. 15 junho 2009. Consultado em 4 de julho de 2009. Cópia arquivada em 7 junho 2009
- ↑ Liddell, Henry George; Scott, Robert. «A Greek-English Lexicon». Perseus Digital Library
- ↑ Liddell, Henry George; Scott, Robert. «ἄτομος». A Greek-English Lexicon. Perseus Digital Library. Consultado em 21 de junho de 2010
- ↑ Haubold, Hans; A.M. Mathai (1998). «Microcosmos: From Leucippus to Yukawa». Structure of the Universe. Consultado em 17 de janeiro de 2008
- ↑ Harrison 2003, pp. 123–139.
- ↑ Leon M. Lederman and Dick Teresi (1993, reimpressão em 2006). The God Particle: If the Universe is the Answer, What is the Question?. Boston: Houghton Mifflin Company. ISBN 0-618-71168-6 Verifique data em:
|ano=(ajuda) - ↑ a b Ponomarev 1993, pp. 14–15.
- ↑ McEvilley 2002, p. 317.
- ↑ King 1999, pp. 105–107.
- ↑ Rouvray, Dennis H. (2004). «Elements in the history of the Periodic Table» 2 ed. Endeavour. 28: pp. 69-74. doi:10.1016/j.endeavour.2004.04.006. ISSN 0160-9327 Parâmetro desconhecido
|lang2=ignorado (|lingua=) sugerido (ajuda) - ↑ «78 Platinum». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ «28 Nickel». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ «12 Magnesium». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ «08 Oxygen». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ Cook, Gerhard A.; Lauer, Carol M. (1968). «Oxygen». In: Clifford A. Hampel. The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. pp. 499–500. LCCN 68-29938
- ↑ Wurtz 1881, pp. 1–2.
- ↑ Tolentino, Mario; ROCHA-FILHO, Romeu C.; CHAGAS, Aécio Pereira (1997). «Alguns aspectos históricos da classificação periódica dos elementos químicos» (PDF) 1 ed. Química Nova. 20: pp. 103-117. ISSN 0100-4042
- ↑ Roscoe 1895, pp. 129.
- ↑ «45 Rhodium». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ «19 Potassium». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ «11 Sodium». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ «53 Iodine». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ «48 Cadmium». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ Horvitz, Leslie (2002). Eureka!: Scientific Breakthroughs That Changed The World. New York: John Wiley. p. 43. ISBN 978-0-471-23341-1. OCLC 50766822
- ↑ Ball, p. 100
- ↑ Venable, pp. 96–97; 100–102
- ↑ Einstein, Albert (1905). «Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen» (PDF). Annalen der Physik (em German). 322 (8): 549–560. Bibcode:1905AnP...322..549E. doi:10.1002/andp.19053220806. Consultado em 4 de fevereiro de 2007
- ↑ Mazo 2002, pp. 1–7.
- ↑ Lee, Y.K.; Hoon, K. (1995). «Brownian Motion». Imperial College. Consultado em 18 de dezembro de 2007. Cópia arquivada em
|arquivourl=requer|arquivodata=(ajuda) 🔗 Parâmetro desconhecido|archivedata=ignorado (ajuda); - ↑ Patterson, G. (2007). «Jean Perrin and the triumph of the atomic doctrine». Endeavour. 31 (2): 50–53. PMID 17602746. doi:10.1016/j.endeavour.2007.05.003
- ↑ «J.J. Thomson». Nobel Foundation. 1906. Consultado em 20 de dezembro de 2007
- ↑ a b c Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeInfoEscola_T - ↑ Woan 2000, p. 8.
- ↑ MacGregor 1992, pp. 33–37.
- ↑ a b Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomepdg2002 - ↑ a b Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeschombert2006 - ↑ Jevremovic 2005, p. 63.
- ↑ Pfeffer 2000, pp. 330–336.
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomewenner2007 - ↑ a b c Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeraymond - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomemihos2002 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomelbnl20070330 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomemakhijani_saleska2001 - ↑ Shultis & Faw 2002, pp. 10–17.
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeajp63_7_653 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomescience157_3784_13 - ↑ a b Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeBrucat2008 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomemanthey2001 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeherter_8 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomepr79_2_282 - ↑ Smirnov 2003, pp. 249–272.
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeweiss20061017 - ↑ a b Sills 2003, pp. 131–134.
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomedume20030423 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomelidsay20000730 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nometuli2005 - ↑ a b WM Haynes. «CRC Handbook of Chemistry and Physics»
- ↑ a b Mills et al. (1993).
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomechieh2001 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomenist_wc - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeaudi2003 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeaca32_5_751 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomedong1998 - ↑ Zumdahl (2002).
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeadp5f_3_133 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomepssb245_9_1858 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeosu2007 - ↑ Padilla et al. (2002:32)
- ↑ Feynman 1995, p. 5.
- ↑ a b Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomesplung - ↑ L'Annunziata 2003, pp. 3–56.
- ↑ a b Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomefirestone20000522 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomehornak2006 - ↑ a b Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeschroeder2 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomegoebel20070901 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeyarris1997 - ↑ Liang & Haacke 1999, pp. 412–426.
- ↑ Zeghbroeck, Bart J. Van (1998). «Energy levels». Shippensburg University. Consultado em 23 de dezembro de 2007
- ↑ Fowles (1989).
- ↑ Martin, W. C.; Wiese, W. L. (maio 2007). «Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas». National Institute of Standards and Technology. Consultado em 8 de janeiro de 2007
- ↑ «Atomic Emission Spectra - Origin of Spectral Lines». Avogadro Web Site. Consultado em 10 de agosto de 2006
- ↑ Fitzpatrick, Richard (fevereiro 16, 2007). «Fine structure». University of Texas at Austin. Consultado em 14 de fevereiro de 2008
- ↑ Weiss, Michael (2001). «The Zeeman Effect». University of California-Riverside. Consultado em 6 de fevereiro de 2008
- ↑ Beyer (2003).
- ↑ Watkins, Thayer. «Coherence in Stimulated Emission». San José State University. Consultado em 23 de dezembro de 2007
- ↑ Reusch, William (16 de julho de 2007). «Virtual Textbook of Organic Chemistry». Michigan State University. Consultado em 11 de janeiro de 2008
- ↑ Husted, Robert; et al. (11 de dezembro de 2003). «Periodic Table of the Elements». Los Alamos National Laboratory. Consultado em 11 de janeiro de 2008
- ↑ Baum, Rudy (2003). «It's Elemental: The Periodic Table». Chemical & Engineering News. Consultado em 11 de janeiro de 2008
- ↑ Goodstein (2002).
- ↑ Brazhkin, Vadim V. (2006). «Metastable phases, phase transformations, and phase diagrams in physics and chemistry». Physics-Uspekhi. 49: 719–24. doi:10.1070/PU2006v049n07ABEH006013
- ↑ Myers (2003).
- ↑ Staff (outubro 9, 2001). «Bose-Einstein Condensate: A New Form of Matter». National Institute of Standards and Technology. Consultado em 16 de janeiro de 2008
- ↑ Colton, Imogen; Fyffe, Jeanette (3 de fevereiro de 1999). «Super Atoms from Bose-Einstein Condensation». The University of Melbourne
- ↑ Gary Hinshaw (10 de fevereiro de 2006). «What is the Universe Made Of?». NASA/WMAP. Consultado em 7 de janeiro de 2008
- ↑ Choppin et al (2001).
- ↑ Davidsen, Arthur F. (1993). «Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission». Science. 259 (5093): 327–34
- ↑ Lequeux (2005).
- ↑ Smith, Nigel (6 de janeiro de 2000). «The search for dark matter». Physics World. Consultado em 14 de fevereiro de 2008
- ↑ Croswell, Ken (1991). «Boron, bumps and the Big Bang: Was matter spread evenly when the Universe began? Perhaps not; the clues lie in the creation of the lighter elements such as boron and beryllium». New Scientist (1794). 42 páginas. Consultado em 14 de janeiro de 2008
- ↑ Copi, Craig J.; Schramm, David N.; Turner, Michael S (1995). «Big-Bang Nucleosynthesis and the Baryon Density of the Universe» (PDF). Science. 267: 192–99. PMID 7809624
- ↑ Gary Hinshaw (15 de dezembro de 2005). «Tests of the Big Bang: The Light Elements». NASA/WMAP. Consultado em 13 de janeiro de 2008
- ↑ Abbott, Brian (30 de maio de 2007). «Microwave (WMAP) All-Sky Survey». Hayden Planetarium. Consultado em 13 de janeiro de 2008
- ↑ Hoyle, F. (1946). «The synthesis of the elements from hydrogen». Monthly Notices of the Royal Astronomical Society. 106: 343–83
- ↑ Knauth, D. C.; Federman, S. R.; Lambert, David L.; Crane, P. (2000). «Newly synthesized lithium in the interstellar medium». Nature. 405: 656–58. doi:10.1038/35015028
- ↑ Stepan G. Mashnik (agosto 2000). «On Solar System and Cosmic Rays Nucleosynthesis and Spallation Processes». Cornell University. Consultado em 14 de janeiro de 2008
- ↑ Kansas Geological Survey (4 de maio de 2005). «Age of the Earth». University of Kansas. Consultado em 14 de janeiro de 2008
- ↑ Manuel (2001).
- ↑ Dalrymple, G. Brent (2001). «The age of the Earth in the twentieth century: a problem (mostly) solved». Geological Society, London, Special Publications. 190: 205–21. doi:10.1144/GSL.SP.2001.190.01.14. Consultado em 14 de janeiro de 2008
- ↑ Anderson, Don L.; Foulger, G. R.; Meibom, Anders (2 de setembro de 2006). «Helium: Fundamental models». MantlePlumes.org
- ↑ Pennicott, Katie (10 de maio de 2001). «Carbon clock could show the wrong time». PhysicsWeb. Consultado em 14 de janeiro de 2008
- ↑ Yarris, Lynn (julho 27, 2001). «New Superheavy Elements 118 and 116 Discovered at Berkeley Lab». Berkeley Lab. Consultado em 14 de janeiro de 2008
- ↑ Diamond, H.; et al. (1960). «Heavy Isotope Abundances in Mike Thermonuclear Device». Physical Review. 119: 2000–04. Consultado em 14 de janeiro de 2008
- ↑ Poston Sr., John W. (23 de março de 1998). «Do transuranic elements such as plutonium ever occur naturally?». Scientific American. Consultado em 15 de janeiro de 2008
- ↑ Keller, C. (1973). «Natural occurrence of lanthanides, actinides, and superheavy elements». Chemiker Zeitung. 97 (10): 522–30. Consultado em 15 de janeiro de 2008
- ↑ Marco (2001)
- ↑ Manuel (2001).
- ↑ «Oklo Fossil Reactors». Curtin University of Technology. Consultado em 15 de janeiro de 2008
- ↑ Weisenberger, Drew. «How many atoms are there in the world?». Jefferson Lab. Consultado em 16 de janeiro de 2008
- ↑ Pidwirny, Michael. «Fundamentals of Physical Geography». University of British Columbia Okanagan. Consultado em 16 de janeiro de 2008
- ↑ Anderson, Don L. (2002). «The inner inner core of Earth». Proceedings of the National Academy of Science. 99 (22): 13966–68. doi:10.1073/pnas.232565899
- ↑ Anónimo (2 de outubro de 2001). «Second postcard from the island of stability». CERN Courier. Consultado em 14 de janeiro de 2008
- ↑ Jacoby, Mitch (2006). «As-yet-unsynthesized superheavy atom should form a stable diatomic molecule with fluorine». Chemical & Engineering News. 84 (10). 19 páginas
- ↑ Koppes, Steve (1 de março de 1999). «Fermilab Physicists Find New Matter-Antimatter Asymmetry». University of Chicago. Consultado em 14 de janeiro de 2008
- ↑ Cromie, William J. (16 de agosto de 2001). «A lifetime of trillionths of a second: Scientists explore antimatter». Harvard University Gazette. Consultado em 14 de janeiro de 2008
- ↑ Hijmans, Tom W. (2002). «Particle physics: Cold antihydrogen». Nature. 419: 439–40. doi:10.1038/419439a
- ↑ Staff (30 de outubro de 2002). «Researchers 'look inside' antimatter». BBC News. Consultado em 14 de janeiro de 2008
- ↑ Barrett, Roger; Jackson, Daphne; Mweene, Habatwa (1990). «The Strange World of the Exotic Atom». New Scientist (1728): 77–115. Consultado em 4 de janeiro de 2008
- ↑ Indelicato, Paul (2004). «Exotic Atoms». Physica Scripta. T112: 20–26. doi:10.1238/Physica.Topical.112a00020
- ↑ Ripin, Barrett H. (julho 1998). «Recent Experiments on Exotic Atoms». American Physical Society. Consultado em 15 de fevereiro de 2008
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomejacox1997 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomenf_physics1986 - ↑ Jakubowskia, N.; Moensb, L.; Vanhaeckeb, F (1998). «Sector field mass spectrometers in ICP-MS». Spectrochimica Acta Part B: Atomic Spectroscopy. 53 (13): 1739–63. doi:10.1016/S0584-8547(98)00222-5
- ↑ Müller, Erwin W.; Panitz, John A., McLane, S. Brooks (1968). «The Atom-Probe Field Ion Microscope». Review of Scientific Instruments. 39 (1): 83–86. ISSN 0034-6748. doi:10.1063/1.1683116
- ↑ Lochner, Jim; Gibb, Meredith; Newman, Phil (30 de abril de 2007). «What Do Spectra Tell Us?». NASA/Goddard Space Flight Center. Consultado em 3 de janeiro de 2008
- ↑ Winter, Mark (2007). «Helium». WebElements. Consultado em 3 de janeiro de 2008
Bibliografia
- L'Annunziata, Michael F. (2003). Handbook of Radioactivity Analysis. [S.l.]: Academic Press. ISBN 0-12-436603-1. OCLC 16212955
- Beyer, H. F.; Shevelko, V. P. (2003). Introduction to the Physics of Highly Charged Ions. [S.l.]: CRC Press. ISBN 0-7503-0481-2. OCLC 47150433
- Choppin, Gregory R.; Liljenzin, Jan-Olov; Rydberg, Jan (2001). Radiochemistry and Nuclear Chemistry. [S.l.]: Elsevier. ISBN 0-7506-7463-6. OCLC 162592180
- Dalton, J. (1808). A New System of Chemical Philosophy, Part 1. London and Manchester: S. Russell
- Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics 1st ed. [S.l.]: Springer. ISBN 3-540-20631-0. OCLC 181435713
- Feynman, Richard (1995). Six Easy Pieces. [S.l.]: The Penguin Group. ISBN 978-0-14-027666-4. OCLC 40499574
- Fowles, Grant R. (1989). Introduction to Modern Optics. [S.l.]: Courier Dover Publications. ISBN 0-486-65957-7. OCLC 18834711
- Gangopadhyaya, Mrinalkanti (1981). Indian Atomism: History and Sources. Atlantic Highlands, New Jersey: Humanities Press. ISBN 0-391-02177-X. OCLC 10916778
- Goodstein, David L. (2002). States of Matter. [S.l.]: Courier Dover Publications. ISBN 0-13-843557-X
- Harrison, Edward Robert (2003). Masks of the Universe: Changing Ideas on the Nature of the Cosmos. [S.l.]: Cambridge University Press. ISBN 0-521-77351-2. OCLC 50441595
- Iannone, A. Pablo (2001). Dictionary of World Philosophy. [S.l.]: Routledge. ISBN 0-415-17995-5. OCLC 44541769
- Jevremovic, Tatjana (2005). Nuclear Principles in Engineering. [S.l.]: Springer. ISBN 0-387-23284-2. OCLC 228384008
- King, Richard (1999). Indian philosophy: an introduction to Hindu and Buddhist thought. [S.l.]: Edinburgh University Press. ISBN 0-7486-0954-7
- Lequeux, James (2005). The Interstellar Medium. [S.l.]: Springer. ISBN 3-540-21326-0. OCLC 133157789
- Levere, Trevor, H. (2001). Transforming Matter – A History of Chemistry for Alchemy to the Buckyball. [S.l.]: The Johns Hopkins University Press. ISBN 0-8018-6610-3
- Liang, Z.-P.; Haacke, E. M. (1999). Webster, J. G., ed. Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging (PDF). vol. 2. [S.l.]: John Wiley & Sons. pp. 412–26. ISBN 0-471-13946-7. Consultado em 9 de janeiro de 2008
- McEvilley, Thomas (2002). The shape of ancient thought: comparative studies in Greek and Indian philosophies. [S.l.]: Allworth Press. ISBN 1-58115-203-5
- MacGregor, Malcolm H. (1992). The Enigmatic Electron. [S.l.]: Oxford University Press. ISBN 0-19-521833-7. OCLC 223372888
- Manuel, Oliver (2001). Origin of Elements in the Solar System: Implications of Post-1957 Observations. [S.l.]: Springer. ISBN 0-306-46562-0. OCLC 228374906
- Mazo, Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. [S.l.]: Oxford University Press. ISBN 0-19-851567-7. OCLC 48753074
- Mills, Ian; Cvitaš, Tomislav; Homann, Klaus; Kallay, Nikola; Kuchitsu, Kozo (1993). Quantities, Units and Symbols in Physical Chemistry 2nd ed. Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. ISBN 0-632-03583-8. OCLC 27011505
- Moran, Bruce T. (2005). Distilling Knowledge: Alchemy, Chemistry, and the Scientific Revolution. [S.l.]: Harvard University Press. ISBN 0-674-01495-2
- Myers, Richard (2003). The Basics of Chemistry. [S.l.]: Greenwood Press. ISBN 0-313-31664-3. OCLC 50164580
- Padilla, Michael J.; Miaoulis, Ioannis; Cyr, Martha (2002). Prentice Hall Science Explorer: Chemical Building Blocks. Upper Saddle River, New Jersey USA: Prentice-Hall, Inc. ISBN 0-13-054091-9. OCLC 47925884
- Pais, Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. ISBN 0-19-851971-0
- Pauling, Linus (1960). The Nature of the Chemical Bond. [S.l.]: Cornell University Press. ISBN 0-8014-0333-2. OCLC 17518275
- Pfeffer, Jeremy I.; Nir, Shlomo (2000). Modern Physics: An Introductory Text. [S.l.]: Imperial College Press. ISBN 1-86094-250-4. OCLC 45900880
- Ponomarev, Leonid Ivanovich (1993). The Quantum Dice. [S.l.]: CRC Press. ISBN 0-7503-0251-8. OCLC 26853108
- Roscoe, Henry Enfield (1895). John Dalton and the Rise of Modern Chemistry. Col: Century science series. New York: Macmillan. Consultado em 3 de abril de 2011
- Scerri, Eric R. (2007). The periodic table: its story and its significance. [S.l.]: Oxford University Press US. ISBN 0-19-530573-6
- Shultis, J. Kenneth; Faw, Richard E. (2002). Fundamentals of Nuclear Science and Engineering. [S.l.]: CRC Press. ISBN 0-8247-0834-2. OCLC 123346507
- Siegfried, Robert (2002). From Elements to Atoms: A History of Chemical Composition. [S.l.]: DIANE. ISBN 0-87169-924-9. OCLC 186607849
- Sills, Alan D. (2003). Earth Science the Easy Way. [S.l.]: Barron's Educational Series. ISBN 0-7641-2146-4. OCLC 51543743
- Smirnov, Boris M. (2003). Physics of Atoms and Ions. [S.l.]: Springer. ISBN 0-387-95550-X
- Teresi, Dick (2003). Lost Discoveries: The Ancient Roots of Modern Science. [S.l.]: Simon & Schuster. pp. 213–214. ISBN 0-7432-4379-X
- Various (2002). Lide, David R., ed. Handbook of Chemistry & Physics 88th ed. [S.l.]: CRC. ISBN 0-8493-0486-5. OCLC 179976746. Consultado em 23 de maio de 2008. Cópia arquivada em
|arquivourl=requer|arquivodata=(ajuda) 🔗 Parâmetro desconhecido|archivedata=ignorado (ajuda) - Woan, Graham (2000). The Cambridge Handbook of Physics. [S.l.]: Cambridge University Press. ISBN 0-521-57507-9. OCLC 224032426
- Wurtz, Charles Adolphe (1881). The Atomic Theory. New York: D. Appleton and company. ISBN 0-559-43636-X
- Zaider, Marco; Rossi, Harald H. (2001). Radiation Science for Physicians and Public Health Workers. [S.l.]: Springer. ISBN 0-306-46403-9. OCLC 44110319
- Zumdahl, Steven S. (2002). Introductory Chemistry: A Foundation 5th ed. [S.l.]: Houghton Mifflin. ISBN 0-618-34342-3. OCLC 173081482. Consultado em 5 de fevereiro de 2008. Cópia arquivada em
|arquivourl=requer|arquivodata=(ajuda) 🔗 Parâmetro desconhecido|archivedata=ignorado (ajuda)
Ver também
Predefinição:Bom interwiki
Predefinição:Bom interwiki
Predefinição:Link FA Predefinição:Link FA Predefinição:Link FA Predefinição:Link FA

