Fagócito
| Fagócito | |
|---|---|
| Subclasse de | célula, general anatomical term |
| Cell Ontology | CL_0000234 |
| MeSH | D010586 |
| Foundational Model of Anatomy | 83806 |

Os fagócitos são leucócitos do sangue que protegem o corpo através da ingestão (fagocitose) de partículas estranhas, bactérias e células mortas ou células a morrer. São essenciais no combate a infecções e para posterior imunidade.[1] Os fagócitos são importantes em todo o reino animal[2] e são altamente desenvolvidos nos vertebrados.[3] Um litro de sangue humano contém cerca de seis milhões de fagócitos.[4] O seu nome vem do grego phagein, "comer ou devorar", e kutos, "vaso oco".[5] Os fagócitos foram primeiramente descobertos em 1882 por Ilya Ilyich Mechnikov enquanto estava a estudar larvas de estrela-do-mar.[6] Foi atribuído a Mechnikov o Nobel de Fisiologia ou Medicina de 1908 pela sua descoberta.[7] Os fagócitos ocorrem em muitas espécies; algumas amebas comportam-se como macrófagos, o que sugere que os fagócitos apareceram cedo na evolução da vida.[8]
Os fagócitos dos seres humanos e outros animais são chamados profissionais ou não profissionais, dependendo da forma como são eficazes na fagocitose.[9] Os fagócitos profissionais incluem células chamados neutrófilos, monócitos, macrófagos, células dendríticas e mastócitos.[10] A principal diferença entre os fagócitos profissionais e não profissionais é que os profissionais possuem moléculas chamados receptores na sua superfície que podem detectar objectos prejudiciais, tais como bactérias, que normalmente não são encontrados no corpo [11] Os fagócitos são, portanto, fundamentais na luta contra infecções, bem como em manter os tecidos saudáveis através da remoção de tecidos mortos e células que chegaram ao fim do seu ciclo de vida [12]
Durante uma infecção, sinais químicos atraem os fagócitos para locais onde o agente patogénico invadiu o corpo. Estes sinais químicos podem ser provenientes de bactérias, ou de outros fagócitos já presentes. Os fagócitos movem-se através de um método denominado quimiotaxia. Quando uma bactéria contacta um fagócito, ela liga-se aos receptores na superfície do fagócito e são consumidos.[13] Quando um agente patogénico entra num fagócito, pode ser desencadeado um ataque químico pelo fagócito que usa oxidantes e óxido nítrico para matar o agente patogénico.[14] Após a fagocitose, macrófagos e células dendríticas também podem participar na apresentação de antigénios: isto acontece quando o fagócito move partes do material ingerido de volta para a sua superfície. Este material é então mostrado a outras células do sistema imunitário. Alguns fagócitos viajam então para os nódulos linfáticos e apresentar o material para os glóbulos brancos chamados linfócitos. Esse processo é importante na construção da imunidade.[15] No entanto, muitos agentes patogénicos têm desenvolvido métodos para combater os ataques desenvolvidos pelos fagócitos [1]
História
[editar | editar código-fonte]O zoólogo russo Ilya Ilyich Mechnikov (1845-1916) reconheceu pela primeira vez que células especializadas estão envolvidos na defesa contra as infecções microbianas. Em 1882, ele estudou células móveis em larvas de estrela-do-mar, acreditando que elas eram importantes para as defesas imunitárias do animal. Para testar a sua hipótese ele inseriu pequenos espinhos de uma árvore de tangerina árvore nas larvas. Depois de algumas horas ele percebeu que as células móveis tinham cercado os espinhos [16] Mechnikov viajou para Viena e compartilhou as suas ideias com Carl Friedrich Claus que sugeriu o nome " fagócito" para as células que Mechnikov tinha observado [17]
Um ano mais tarde, Mechnikov estudou um crustáceo de água doce chamado Daphnia, um minúsculo animal transparente que pode ser examinadas directamente ao microscópio. Ele descobriu que esporos fúngicos que atacaram os animais foram destruídos por fagócitos. Ele passou a estender as suas observações a células brancas do sangue de mamíferos e descobriu que a bactéria Bacillus anthracis podia ser engolida e morta por fagócitos, um processo que ele chamou fagocitose.[18] Mechnikov propôs que os fagócitos seriam uma defesa primordial contra organismos invasores.
Em 1903, Amroth Wright descobriu que a fagocitose era reforçada por anticorpos específicos que ele chamou de opsoninas [19] Mechnikov recebeu (juntamente com Paul Ehrlich o Nobel de Fisiologia ou Medicina de 1908, pelo trabalho em fagócitos e fagocitose.[7]
Apesar da importância destas descobertas lentamente ganho aceitação durante o início do século XX, as intricadas relações entre fagócitos e todos os outros componentes do sistema imune não foram conhecidos até à década de 1980 [20]
Fagocitose
[editar | editar código-fonte]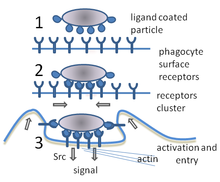
A fagocitose é o processo de tomada de partículas, como bactérias, parasitas, células mortas e restos celulares por uma célula.[21] Ela envolve uma cadeia de processos moleculares [22] A fagocitose ocorre após o corpo estranho, uma célula bacteriana por exemplo, ter-se ligado a moléculas denominadas "receptores" que estão na superfície do fagócito. Em seguida, o fagócito envolve a bactéria e captura-a no seu interior. A fagocitose de bactérias por neutrófilos humanos leva em média nove minutos.[23] Uma vez dentro deste fagócito, a bactéria é presa num compartimento chamado fagossoma. Dentro de um minuto o fagossoma funde-se com um lisossoma ou um grânulo para formar um fagolisossoma. A bactéria presa é então submetida a uma formidável bateria de mecanismos de matança,[24] e é morta poucos minutos mais tarde [23] As células dendríticas e os macrófagos não são tão rápidas e a fagocitose pode demorar muitas horas nessas células. Os macrófagos são lentos e desordenados comedores, mas envolvem enormes quantidades de material e libertam frequentemente material não digerido de volta para os tecidos. Este detritos servem como um sinal para recrutar mais fagócitos a partir do sangue [25] Os fagócitos digerem quase tudo; os cientistas já alimentaram macrófagos com pedaços de ferro e, em seguida, usaram um pequeno íman para separá-los de outras células numa mistura [26]

Os fagócitos têm muitos tipos de receptores na sua superfície que são usados para ligar materiais [1] Incluem receptores de opsonina, receptores scavenger e receptores toll-like. Os receptores de opsonina aumentam a fagocitose de bactérias que foram revestidas com anticorpos complementares ou anticorpos IgG. Complemento é o nome dado a uma série complexa de moléculas proteicas encontradas no sangue ou marca que destroem ou marcam células para destruição [27] Os receptores scavenger ligam-se a uma grande variedade de moléculas na superfície de células bacterianas e os receptores Toll-like ligam-se a moléculas mais específicas. A ligação a receptores Toll-like aumenta a fagocitose e faz com que o fagócito liberte um grupo de hormonas que causam inflamação [1]
Métodos de destruição
[editar | editar código-fonte]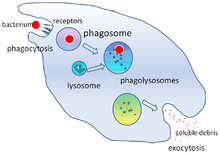
A destruição de micróbios é uma função crítica dos fagócitos,[28] e é executada tanto dentro do fagócito (destruição intracelular) como fora do fagócito (destruição extracelular).
Destruição intracelular dependente de oxigénio
[editar | editar código-fonte]Quando um fagócito ingere bactérias (ou qualquer outro material), o seu consumo de oxigénio aumenta. O aumento no consumo de oxigénio é chamada erupção respiratória, que produz moléculas reactivas contendo oxigénio que são antimicrobianas.[29] Os compostos de oxigénio são tóxicos tanto para o invasor como para a própria célula. Por isso são mantidos em compartimentos dentro da célula. Este método de matar micróbios invasores utilizando moléculas reactivas contendo oxigénio é referido como destruição intracelular oxigénio-dependente, existindo dois tipos.[14]
O primeiro tipo é a produção oxigénio-dependente de um superóxido,[1] que é uma importante substância destruidora de bactérias e rica em oxigénio.[30] O superóxido é convertido em peróxido de hidrogénio e num oxigénio singlete por uma enzima denominada superóxido dismutase. Os superóxidos também reagem com o peróxido de hidrogénio para produzir radicais hidroxilo que ajuda na destruição do micróbio invasor.[1]
O segundo tipo envolve o uso da enzima mieloperoxidase de grânulos neutrófilos.[31] Quando os grânulos se fundem com um fagossoma, a mieloperoxidase é libertada no fagolisossoma e esta enzima usa peróxido de hidrogénio e cloro para criar hipoclorito, uma substância usada na lixívia doméstica. O hipoclorito é extremamente tóxico para as bactérias.[1] A mieloperoxidase contém um pigmento heme, que faz as secreções ricas em neutrófilos, tal como pus e sputum infectado, verdes.[32]
Destruição intracelular independente de oxigénio
[editar | editar código-fonte]
Os fagócitos também podem destruir micróbios através de métodos independentes de oxigénio, mas estes não são tão efectivos como os métodos dependentes de oxigénio. Existem quatro tipos principais. O primeiro utiliza proteínas carregadas electricamente que danificam as membranas celulares das bactérias. O segundo tipo usa lisozimas; estas enzimas degradam a parede celular das bactérias. O terceiro tipo usa lactoferrinas que estão presentes nos grânulos neutrófilos e removem ferro essencial das bactérias.[33] O quarto tipo usa proteases e enzimas hidrolíticas; estas enzimas são usadas para digerir as proteínas de bactérias destruídas.[34]
Destruição extracelular
[editar | editar código-fonte]O interferão-gama (que foi já chamado de factor activador de macrófagos) estimula os macrófagos a produzir óxido nítrico. A fonte de interferão-gama pode ser células T CD4+, células T CD8+, células exterminadoras naturais, linfócitos B, linfócitos NKT, monócitos, macrófagos ou células dendríticas.[35] O óxido nítrico é então libertado do macrófago e, devido à sua toxicidade, destrói os micróbios perto do macrófago.[1] Os macrófagos activados produzem e secretam factores de necrose tumoral. Estas moléculas sinalizadoras da classe de citocina-a[36] matam células cancerígenas e células infectadas por vírus, e ajuda na activação de outras células do sistema imunitário.[37]
Em algumas doenças, como a doença granulomatosa crónica, a eficiência dos fagócitos é reduzida e as infecções bacterianas recorrentes são um problema.[38] Nesta doença existe uma anormalidade que afecta diferentes elementos que efectuam a destruição dependente de oxigénio. Outras raras anormalidades congénitas, como a síndrome de Chediak-Higashi, estão também associadas com uma destruição ineficiente de micróbios ingeridos.[39]
Vírus
[editar | editar código-fonte]Os vírus apenas se podem reproduzir dentro das células e entram nelas usando muitos dos receptores envolvidos na imunidade. Uma vez dentro das células, os vírus usam a maquinaria biológica da célula em sua vantagem, forçando a célula a produzir centenas de cópias idênticas do vírus invasor. Apenas de os fagócitos e de outros componentes do sistema imunitário inato poderem, de maneira limitada, controlar os vírus, uma vez o vírus esteja dentro da célula, as respostas imunitários adaptativas, particularmente os linfócitos, são mais importantes na defesa do organismo.[40] Nos locais de infecção viral, os linfócitos muitas vezes são em número superior ao de outros componentes do sistema imunitário; isto é comum no caso da meningite viral.[41] As células infectadas por vírus que foram destruídas por linfócitos são limpas do corpo pelos fagócitos.[42]
Papel na apoptose
[editar | editar código-fonte]
Num animal existe uma constante morte de células. Um balanço entre a divisão celular e a morte celular mantém o número de células relativamente constante em adultos.[12] Existem duas maneiras diferentes de uma célula morrer: por necrose ou por apoptose. Em contraste com a necrose, que resulta muitas vezes de uma doença ou de um trauma, a apoptose, ou morte celular programada, é uma função normal das células. O corpo terá que se livrar de milhões de células mortas ou a morrer todos os dias e os fagócitos desempenham um papel fundamental neste processo.[43]
Células que estejam a morrer e a percorrem os estágios finais da apoptose[44] apresentam moléculas, como a fosfatidilserina, na sua superfície celular, para atrir os fagócitos.[45] A fosfatidilserina é normalmente encontrada na superfície citosólica da membrana plasmática, mas é redistribuída durante a apoptose para a superfície extracelular por uma hipotética proteína denominada scramblase.[46] Estas moléculas marcam a célula para a fagocitose por células que possuem os receptores apropriados, com os macrófagos.[47] A remoção de células mortas pelos fagócitos ocorre de maneira ordenada, sem despoletar uma resposta inflamatória e é uma importante função dos fagócitos.[48]
Interacções com outras células
[editar | editar código-fonte]Os fagócitos não estão associados a nenhum órgão em particular, mas movem-se pelo corpo, interagindo com outras células fagocitárias e não fagocitárias do sistema imunitário. Podem comunicar com outras células através da produção de químicos denominados citocinas, que recrutam outros fagócitos para o local de infecções ou estimulam linfócitos dormentes.[49] Os fagócitos fazem parte do sistema imunitário inato com o qual os animais, incluindo os humanos, nascem. A imunidade inata é muito eficiente mas não específica, no sentido em que não discrimina entre diferentes tipos de invasores. Por outro lado, o sistema imunitário adaptativo de vertebrados, a base da imunidade adquirida, é altamente especializado e pode dar protecção contra quase qualquer tipo de invasor.[50] O sistema imunitário adaptativo é dependente dos linfócitos, que não são fagócitos, mas produzem proteínas de protecção denominadas anticorpos que marcam os invasores para destruição e previnem que os vírus infectem as células.[51] Os fagócitos, em particular as células dendríticas e os macrófagos, estimulam os linfócitos a produzirem anticorpos num importante processo denominado apresentação de antigénios.[52]
Apresentação de antigénios
[editar | editar código-fonte]
A apresentação de antigénios é um processo no qual alguns fagócitos movem parte dos materiais absorvidos de volta à superfície das suas células a apresentam-nos a outras células do sistema imunitário.[53] Existem dois tipos de células apresentadoras de antigénios "profissionais": os macrófagos e as células dendríticas.[54] Depois da absorção, as proteínas estranhas (antigénios) são quebradas em péptidos dentro das células dendríticas e dos macrófagos. Estes péptidos são depois ligados às glicoproteínas do complexo principal de histocompatibilidade, que carregam os péptidos de volta à superfície dos fagócitos onde são apresentados aos linfócitos.[15] Os macrófagos maduros não viajam muito além dos locais de infecção, mas as células dendríticas podem chegar aos gânglios linfáticos onde existem milhões de linfócitos.[55] Isto potencia a imunidade porque os linfócitos respondem aos antigénios apresentados pelas células dendríticas tal como tivessem sido apresentados no local da infecção.[56] Mas as células dendríticas nem sempre cooperam com os linfócitos, podendo destruí-los se necessário para proteger o corpo, num processo denominado tolerância.[57]
Tolerância imunológica
[editar | editar código-fonte]As células dendríticas também promovem a tolerância imunológica,[58] que pára o corpo de atacar a ele próprio. O primeiro tipo de tolerância é a tolerância central: quando as células T se afastam do timo, as células dendríticas destroem as células T que levam antigénios que podem causar o sistema imunitário atacar a ele próprio. O segundo tipo de tolerância imunológica é a tolerância periférica. Algumas células T que possuem antigénios que poderiam causar que elas atacassem as próprias células do indivíduo, desviam-se do primeiro processo de tolerância, algumas células T desenvolvem mais tarde da vida, antígénios que atacam o próprio indivíduo, e alguns antigénios que atacam o próprio indivíduo não são encontrados no timo: por causa disto, as células dendríticas trabalharão, novamente, que restringir a actividade de células T que atacam o próprio indivíduo, fora do timo. As células dendríticas podem executar isto destruindo-as ou recrutando a ajuda de células T reguladoras para inactivar as actividades prejudiciais das células T.[59] Quando a tolerância imunológica falha, doenças autoimunes podem-se seguir.[60] Por lado contrário, demasiada tolerância permite algumas infecções, como o HIV, não serem notadas.[59]
Fagócitos profissionais
[editar | editar código-fonte]
Os fagócitos dos humanos e outros vertebrados mandibulados estão divididos em grupos "profissionais" e "não profissionais", com base na eficiência com que participam na fagocitose.[9] Os fagócitos profissionais são os monócitos, os macrófagos, os neutrófilos, as células dendríticas e os mastócitos.[10] Um litro de sangue humano contém cerca de seis mil milhões de fagócitos.[4]
Activação
[editar | editar código-fonte]Todos os fagócitos, em especial os macrófagos, existem os diversos graus de prontidão. Os macrófagos são normalmente dormentes nos tecidos e proliferam devagar. Neste estado de semi-repouso eles limpam células mortas e outro lixo não infeccioso e raramente fazem parte na apresentação de antigénios. Mas durante uma infecção eles recebem sinais químicos, normalmente o interferão-gama, que aumenta a sua produção de moléculas de classe II do complexo principal de histocompatibilidade e que os preparam para apresentarem antigénios. Neste estado, os macrófagos são bons apresentadores de antigénios e assassinos. No entanto, se receberem um sinal directamente de um invasor eles tornam-se "hiperactivos", param a sua proliferação e concentram-se na destruição. O seu tamanho e taxa de fagocitose aumenta, alguns tornam-se tão grandes que chegam a envolver protozoários invasores.[61]
No sangue, os neutrófilos são inactivos. Quando recebem sinais dos macrófagos nos locais de inflamação, diminuem a actividade e deixam o sangue. Nos tecidos eles são activados por citocinas e chegam ao cenário de guerra prontos a matar.[62]
Migração
[editar | editar código-fonte]
Quando uma infecção ocorre, um sinal químico "SOS" é largado para atrir os fagócitos para o local.[63] Estes sinais químicos podem incluir proteínas de bactérias invasoras, péptidos de coagulação, produtos do sistema complemento e citocinas que foram largadas por macrófagos localizados no tecido perto da infecção.[1] Outro grupo de atractivos químicos são as citocinas que recrutam os neutrófilos e os monócitos do sangue.[13]
Para chegarem ao local da infecção, os fagócitos deixam a corrente sanguínea e entram nos tecidos afectados. Sinais da infecção causam que as células endoteliais que estão alinhadas nos vasos sanguíneos produzam uma proteína denominada selectina à qual os neutrófilos se pegam ao passarem perto. Os sinais denominados vasodilatadores enfraquecem as junções que ligam as células endoteliais, permitindo ao fagócitos passar através da parede. A quimiotaxia é o processo através do qual os fagócitos seguem a concentração de citocinas, até ao local indectado.[1] Os neutrófilos viajam por órgãos alinhados por células epiteliais até locais de infecção, e apesar disto ser um importante elemento no combate à infecção, a migração em si pode resultar em sintomas semelhantes às de doença.[64] Durante uma infecção, milhões de neutrófilos são recrutados a partir do sangue, mas morrem passados alguns dias.[65]
Monócitos
[editar | editar código-fonte]
Os monócitos desenvolvem-se na medula óssea e atingem a maturidade no sangue. Os monócitos maduros possuem largos, suaves e lobulados núcleos e abundante citoplasma que contêm grânulos. Os monócitos ingerem substâncias estranhas ou perigosas e apresentam antigénios a outras células do sistema imunitários. Os monócitos formam dois grupos: um grupo circulante e um grupo marginal que permanecem em outros tecidos (aproximadamente 70% estão no grupo marginal). A maioria dos monócitos deixam a corrente sanguínea após 3 dias para viajarem para os tecidos e órgãos, e ao fazerem-no transformam-se em macrófagos.[66] ou em células dendríticas dependendo dos sinais que receberem.[67] Existem cerca de 500 milhões de monócitos num litro de sangue humano.[4]
Macrófagos
[editar | editar código-fonte]Os macrófagos maduros não viajam muito longe mas mantêm a guarda sobre as áreas do corpo que estão expostas ao mundo exterior. Aí, eles actuam como colectores de lixo, células apresentadores de antigénios, ou ferozes assassinos, dependendo do tipo de sinal que receberem.[68] Eles derivam dos monócitos, células-tronco granulocíticas ou da divisão celular de macrófagos já existentes.[69] Os macrófagos humanos têm cerca de 21 micrómetros de diâmetro.[70]

Este tipo de fagócitos não contêm grânulos mas possuem lisossomas. Os macrófagos podem ser encontrados por todo o corpo em quase todos os tecidos e órgãos (exemplo: microgliócitos no cérebro e macrófagos alveolares nos pulmões onde se encontram silenciosamente à espera. A localização de um macrófago pode determinar o seu tamanho e aparência. Os macrófagos causam inflamação através da produção de interleucina 1, interleucina 6 e Factor de necrose tumoral-alfa.[71] Os macrófagos são essencialmente encontrados nos tecidos e raramente na corrente sanguínea. O tempo de vida dos macrófagos tecidulares foi estimada entre quatro até quinze dias.[72]
Os macrófagos podem ser activados para executarem funções que um monócito em repouso não pode exercer.[71] As células T auxiliares, um subgrupo de linfócitos, são responsáveis pela activação dos macrófagos. As células Th1 activam os macrófagos através de sinalização por IFN-gama e por apresentação da proteína CD154.[73] Outros sinais incluem TNF-alfa e lipopolissacáridos de bactérias.[71] As células Th1 podem recrutar outros fagócitos para o local da infecção de variadas maneiras. Elas secretam citocinas que actuam na medula óssea para estimular a produção de monócitos e neutrófilos e secretam algumas das citocinas encarregadas da migração dos monócitos e neutrófilos para fora da corrente sanguínea.[74] As células Th1 vêm da diferenciação celular de células T CD4+ uma vez que tenham respondido a antigénios nos tecidos linfáticos secundários.[71] Os macrófagos activados jogam um papel importante na destruição de tumores através da produção de TNF-alfa, IFN-gama, óxido nítrico, compostos reactivos de oxigénio, proteínas catiónicas e enzimas hidrolíticas.[71]
Neutrófilos
[editar | editar código-fonte]
Os neutrófilos são normalmente encontrados na corrente sanguínea e são o tipo mais abundante de fagócitos, constituindo 50% a 60% do total de leucócitos no sangue.[75] Um litro de sangue humano contém cerca de 5 bilhões de neutrófilos dependendo da porcentagem,[4] tendo cerca de 10 micrómetros de diâmetro,[76] e vivem apenas por cerca de cinco dias.[37] Uma vez tendo recebido os sinais apropriados, são precisos cerca de trinta minutos para que saiam do sangue a alcancem o local de uma infecção.[77] São comedores ferozes e rapidamente envolvem e absorvem os invasores cobertos de anticorpos e complementos, assim como células danificadas ou lixo celular. Os neutrófilos não regressam ao sangue; transformam-se em células de pus e morrem.[77] Os neutrófilos maduros são menores que os monócitos, possuindo um núcleo celular segmentado com várias secções; cada secção está conectada por filamentos de cromatina - os neutrófilos podem ter 2-5 segmentos. Os neutrófilos não saem normalmente da medula óssea antes de atingirem a maturidade mas durante uma infecção, percursores de neutrófilos denominados mielócitos e promielócitos são libertados.[78]
Os grânulos intracelulares dos neutrófilos humanos foram há muito reconhecidos pelas suas propriedades bactericidas e destruidora de proteínas.[79] Os neutrófilos podem secretar produtos que estimulam os monócitos e os macrófagos. As secreções dos neutrófilos estimulam a fagocitose e a formação de compostos reactivos de oxigénio envolvidos na destruição intracelular.[80] As secreções dos grânulos primários dos neutrófilos estimulam a fagocitose de bactérias cobertas de anticorpos IgG.[81]
Células dendríticas
[editar | editar código-fonte]
As células dendrídicas são células especializadas na apresentação de antigénios, possuindo projecções celulares denominadas dendites,[82] que ajudam a envolver os micróbios e outros invasores.[83][84] As células dendríticas estão presentes nos tecidos que estão em contacto com o ambiente externo; principalmente a pele, a superfície interna do nariz, pulmões, estômago e intestinos.[85] Uma vez activados, amadurecem e migram para os tecidos linfóides onde interagem com as células T e as células B para iniciar e orquestrar a resposta imunitária adaptativa.[86] As células dendríticas maduras activam as células T auxiliares e as células T citotóxicas.[87] As células T auxiliares activadas interagem com os macrófagos e as células B para as activarem. Adicionalmente, as células dendríticas podem influenciar o tipo de resposta imunitária produzida; quando viajam para as áreas linfóides onde se encontram as células T, elas podem activar estas últimas que depois se diferenciam em células T citotóxicas ou em células T auxiliares.[88]
Mastócitos
[editar | editar código-fonte]Os mastócitos possuem receptores toll-like e interagem com células dendríticas, células B e célula T, com vista a mediarem as funções imunitárias adaptativas. Os mastócitos expressam moléculas de classe II do complexo principal de histocompatibilidade e podem participar na apresentação de antigénios; no entanto, o papel dos mastócitos na apresentação de antigénios não é muito conhecida.[89] Os mastócitos podem consumir e matar bactérias gram-negativas (por exemplo, do género Salmonella) e processar os seus antigénios.[90] Especializam-se em processar as proteínas da fímbria encontradas na superfície bacteriana, que estão envolvidas na adesão aos tecidos.[91][92] Adicionalmente a estas funções, os mastócitos produzem citocinas que induzem uma resposta inflamatória.[93] Esta é uma parte vital da destruição dos micróbios porque atrai mais fagócitos para o local da infecção.[90]
| Localização principal | Variedade de fenótipos |
|---|---|
| Sangue | neutrófilos, monócitos |
| Medula óssea | macrófagos, monócitos, células sinusoidais, células epiteliais (alinhamento) |
| Tecido ósseo | osteoclastos |
| Placas de Peyer (aparelho digestivo) | macrófagos |
| Tecido conjuntivo | histiócitos, macrófagos, monócitos, células dendríticas |
| Fígado | célula de Kupffer, monócitos |
| Pulmão | macrófagos auto-replicantes, monócitos, mastócitos, células dendríticas |
| Tecido linfóide | macrófagos e mocócitos livres e fixos, células dendríticas |
| Tecido nervoso | micróglia (CD4+) |
| Baço | macrófagos fixos e livres, monócitos, sinusóides |
| Timo | macrófagos e mocócitos livres e fixos |
| Pele | células de Langerhans residentes, outras células dendríticas, macrófagos convencionais, mastócitos |
Fagócitos não profissionais
[editar | editar código-fonte]As células mortas e organismos estranhos são consumidos por outras células sem ser os fagócitos "profissionais".[95] Estas células incluem células epiteliais, células endoteliais, fibroblastos e células mesenquimatosas. São chamados de fagócitos não profissionais, para enfatizar o facto de, em contraste com os fagócitos profissionais, a fagocitose não ser a sua principal função.[96] Os fibroblastos, por exemplo, apenas fazem tentativas ineficazes para ingerir partículas estranhas.[97]
Os fagócitos não profissionais são mais limitados que os fagócitos profissionais no tipo de partículas que podem absorver. Isto é devido à sua falta de receptores fagocitários eficientes, particularmente de opsoninas, que são anticorpos e complementos agarrados aos invasores pelo sistema imunitário.[11] Adicionalmente, a maioria dos fagócitos não profissionais não produz moléculas contendo oxigénio reactivo em resposta à fagocitose.[98]
| Localização principal | Variedade de fenótipos |
|---|---|
| sangue, linfa e nódulos linfáticos | Linfócitos |
| sangue, linfa e nódulos linfáticos | Células NK e LGL |
| Pele | células epiteliais |
| Vasos sanguíneos | células endoteliais |
| Tecido conjuntivo | Fibroblastos |
| Sangue | Eritrócitos |
Agentes patogénicos: invasão e resistência
[editar | editar código-fonte]
Um agente patogénico apenas é bem sucedido em infectar um organismo se conseguir passar pelas defesas do mesmo. Bactérias e protozoários patogénicos desenvolveram uma variedade de métodos para resistir aos ataques dos fagócitos e muitos conseguem mesmo se replicar dentro das células fagocitárias.[99][100]
Evitar o contacto
[editar | editar código-fonte]Existem diversas maneiras através das quais as bactérias evitam o contacto com os fagócitos. Primeiro, podem crescer em locais onde os fagócitos não são capazes de atingir (por exemplo, a superfície intacta de pele). Segundo, as bactérias podem suprimir a resposta inflamatória; sem esta resposta à infecção, os fagócitos não conseguem responder adequadamente. Terceiro, algumas espécies de bactérias podem inibir a habilidade dos fagócitos em viajar para o local de infecção através de intereferência por quimiotaxia.[99] Quarto, algumas bactérias podem evitar o contacto com os fagócitos enganando o sistema imunitário a "pensar" que as bactérias fazem parte do próprio organismo - a bactéria que causa a sífilis esconde-se dos fagócitos cobrindo a sua superfície com fibronectina,[101] que é produzida naturalmente pelo corpo e desempenha um papel vital na cicatrização.[102]
Evitar a absorção
[editar | editar código-fonte]As bactérias muitas vezes produzem proteínas ou açucares que cobrem as suas células e interferem com a fagocitose; são denominadas cápsulas.[99] Um exemplo é a cápsula K5 e o antigénio O O75, encontrados na superfície da Escherichia coli,[103] e as cápsulas exopolissacarídicas de Staphylococcus epidermidis.[104] Streptococcus pneumoniae produz diversos tipos de cápsulas que providenciam diferentes tipos de protecção,[105] os estreptococos de grupo A produzem proteínas tais como a proteína M e proteínas da fímbria para bloquear a absorção. Algumas proteínas a ingestão relacionada com opsoninas; Staphylococcus aureus produz a proteína A para bloquear receptores de anticorpos que diminuem a eficácia das opsoninas.[106]
Sobreviver dentro do fagócito
[editar | editar código-fonte]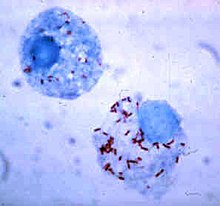
As bactérias desenvolveram maneiras de sobreviver dentro dos fagócitos, onde continuam a evadir o sistema imunitário.[107] Para entrarem de maneira segura dentro dos fagócitos elas expressam proteínas denominadas "invasinas". Quando dentro da célula, permanecem no citoplasma e evitam componentes tóxicos contidos nos fagolisossomas.[108] Algumas bactérias previnem a fusão do fagossoma e do lisossoma para formar um fagolisossoma.[99] Outros agentes patogénicos, como a Leishmania, criam um vacúolo altamente modificado dentro do fagócito, que as ajudam a persistir e a replicarem-se.[109] A Legionella pneumophila produz secreções que causam que o fagossoma se fundam com vesículas que não as que contêm substâncias tóxicas.[110] Outras bactérias são capazes de viver dentro do fagolisossoma. Staphylococcus aureus, por exemplo, produz as enzimas catalase e superóxido dismutase que destroem químicos, como o peróxido de hidrogénio, produzidos pelos fagócitos para destruir as bactérias.[111] As bactérias podem-se escapar do fagossoma antes da formação do fagolisossoma: Listeria monocytogenes pode fazer um buraco na parede do fagossoma usando enzimas denominadas listeriolisina O e fosfolipase C.[112]
Matar
[editar | editar código-fonte]As bactérias desenvolveram várias maneiras de matar os fagócitos.[106] Entre elas estão incluídas: citolisinas que formam poros na membrana celular do fagócito; estreptolisinas e leucocidinas que causam a ruptura dos grânulos de neutrófilos e a libertação de substâncias tóxicas,[113][114] e exotoxinas que reduzem o fornecimento de ATP aos fagócitos, necessário para a fagocitose. Uma vez uma bactéria ingerida, ela pode matar o fagócito através da libertação de toxinas que viajam através da membrana do fagossoma ou fagolisossoma para atacar outras partes da célula.[99]
Afectar a sinalização celular
[editar | editar código-fonte]Algumas estratégias de sobrevivência envolvem afectar as citocinas e outros métodos de sinalização celular com vista a prevenir os fagócitos de responder à invasão.[115] Os protozoários parasitas Toxoplasma gondii, Trypanosoma cruzi e Leishmania infectam os macrófagos e cada uma maneira própria de os subjugar. Algumas espécies de Leishmania alteram a sinalização do macrófago infectado e reprimem a produção de citocinas e de moléculas microbicidas (óxido nítrico e espécies reactivas de oxigénio), comprometendo também a apresentação de antigénios.[116]
Dano no hospedeiro pelos fagócitos
[editar | editar código-fonte]Os macrófagos e os neutrófilos, em particular, desempenham um papel central no processo inflamatório, libertando proteínas e pequenas moléculas mediadoras da inflamação, que tanto controlam a infecção como podem danificar o tecido do hospedeiro. De maneira geral, os fagócitos têm como alvo a destruição de agentes patogénicos envolvendo-os e incorporando-os, sujeitando-os depois a uma bateria de químicos tóxicos dentro do fagolisossoma. Se um fagócito falhar em incorporar o seu alvo, estes agentes tóxicos podem ser libertados no ambiente, um processo denominado "fagocitose frustrada". Como estes agentes são também tóxicos para as células hospedeiras, podem pois causar danos extensos em células e tecidos saudáveis.[97]
Quando os neutrófilos libertam o conteúdo dos seus grânulos no rim, esse conteúdo, compostos reactivos de oxigénio e proteases, degradam a matriz extracelular das células do hospedeiro e podem causar dano às células glomerulares, afectando a sua habilidade para filtrar o sangue. Adicionalmente, produtos da fosfolipase, como os leucotrienos, intensificam o dano. Esta libertação de substâncias promove a quimiotaxia e a vinda de mais neutrófilos para o local da infecção e as células glomerulares podem ser ainda mais danificadas pelas moléculas de adesão durante a migração dos neutrófilos. O dano feito às células glomerulares pode causar insuficiência renal.[117]
Os neutrófilos desempenham também um papel importante no desenvolvimento da maioria das formas de dano pulmonar agudo.[118] Aí, os neutrófilos activados libertam o conteúdo dos seus grânulos tóxicos no ambiente pulmonar.[119] Experiências têm demonstrado que uma redução no número de neutrófilos diminui os efeitos do dano pulmonar agudo,[120] mas o tratamento através da inibição dos neutrófilos não é clinicamente realista, por deixar o hospedeiro vulnerável à infecção.[119] O dano pelos neutrófilos pode contribuir para disfunções e danos hepáticos em resposta à libertação de endotoxinas produzidas por bactérias, septicemia, trauma, hepatite alcoólica, isquemia e choque hipovolémico resultante de hemorragia aguda.[121]
Os químicos libertados pelos macrófagos podem também danificar os tecidos do hospedeiro. O factor de necrose tumoral-alfa é um importante químico que é libertado pelos macrófagos, que causa a coagulação do sangue em pequenos vasos, prevenindo a propagação da infecção.[122] No entanto, se uma infecção bacteriana se espalhar pelo sangue, o TNF-α é libertado em órgãos vitais, causando a vasodilatação e um aumento do volume do plasma; consequentemente pode dar origem a choque séptico. Durante o choque séptico, a libertação de TNF-α causa um bloqueio dos vasos de pequenas dimensões que fornecem sangue para os órgãos vitais, podendo estes deixar de funcionar. O choque séptico pode conduzir à morte.[13]
Origens evolutivas
[editar | editar código-fonte]A fagocitose é um processo comum e provavelmente apareceu cedo na evolução,[123] evoluindo primeiro em seres eucariotas unicelulares.[124] As amibas são protistas unicelulares que se separaram do ramo que levou aos metazoários pouco tempo depois da divergência das plantas, mas partilham muitas funções específicas com as células fagocitárias de mamíferos.[124]
Dictyostelium discoideum, por exemplo, é uma amiba que vive no solo e que se alimenta de bactérias. Como os fagócitos animais, incorpora as bactérias por fagocitose principalmente através de receptores Toll-like e possui outras funções biológicas em comum com os macrófagos.[125] Dictyostelium discoideum é social e formam agregados com famintos, formando um pseudoplasmódio migrante. Este organismo multicelular produz eventualmente um corpo frutificante com esporos que são resistentes a perigos ambientais. Antes da formação dos corpos frutificantes, as células podem migrar por vários dias. Durante este tempo, a exposição a toxinas ou a agentes patogénicos bacterianos tem o potencial de comprometer a sobrevivência da amiba, por limitação da produção de esporos. Algumas das amibas incorporam as bactérias e absorvem as toxinas e essas amibas morrem eventualmente. São geneticamente idênticas às outras amibas no organismo e o seu sacrifício para proteger as outras amibas das bactérias é similar ao auto-sacrifício pelos fagócitos encontrados no sistema imunitário, por exemplo, de humanos. Esta função imunitária inata em amibas sociais sugere um antigo mecanismo celular de alimentação que foi adaptado para funções de defesa muito antes da diversificação dos animais.[126] Mas um antepassado comum com os fagócitos de mamíferos ainda não foi provado. Os fagócitos ocorrem ao longo do reino animal,[2] desde as esponjas marinhas até aos insectos e vertebrados "superiores" e "inferiores".[127][128] A habilidade das amibas em distinguir entre os componentes próprios e os componentes estranhos é a raiz do sistema imunitário de muitas espécies.[8]
Referências
- ↑ a b c d e f g h i j Mayer, Gene (2006). «Immunology — Chapter One: Innate (non-specific) Immunity». Microbiology and Immunology On-Line Textbook. USC School of Medicine. Consultado em 12 de novembro de 2008
- ↑ a b Delves p. 250
- ↑ Delves p. 251
- ↑ a b c d Hoffbrand p. 331
- ↑ Little, C., Fowler H.W., Coulson J. (1983). The Shorter Oxford English Dictionary. [S.l.]: Oxford University Press (Guild Publishing). pp. 1566–67
- ↑ «Ilya Mechnikov» retrieved on November 28, 2008. From Nobel Lectures, Physiology or Medicine 1901–1921, Elsevier Publishing Company, Amsterdam, 1967.
- ↑ a b Schmalstieg, FC; AS Goldman (2008). «Ilya Ilich Metchnikoff (1845–1915) and Paul Ehrlich (1854–1915): the centennial of the 1908 Nobel Prize in Physiology or Medicine». Journal of medical biography. 16 (2): 96–103. PMID 18463079. Consultado em 2 de julho de 2009. Arquivado do original em 24 de julho de 2011
- ↑ a b Janeway, Chapter: Evolution of the innate immune system. see Bibliography, retrieved on March 20, 2009
- ↑ a b Ernst p. 186
- ↑ a b Robinson p. 187 e Ernst pp. 7-10
- ↑ a b Ernst p. 10
- ↑ a b Thompson, CB (1995). «Apoptosis in the pathogenesis and treatment of disease». Science. 267 (5203): 1456–62. PMID 7878464. doi:10.1126/science.7878464
- ↑ a b c Janeway, Chapter: Induced innate responses to infection. see Bibliography, retrieved on March 20, 2009
- ↑ a b Fang FC (outubro 2004). «Antimicrobial reactive oxygen and nitrogen species: concepts and controversies». Nat. Rev. Microbiol. 2 (10): 820–32. PMID 15378046. doi:10.1038/nrmicro1004
- ↑ a b Janeway, capítulo: Antigen Apresentação de Linfócitos T. Ver Bibliografia, obtida em 20 de março de 2009
- ↑ Delves p. 3
- ↑ Aterman K (1 de Abril 1998). «Medals, memoirs—and Metchnikoff». J. Leukoc. Biol. 63 (4): 515–17. PMID 9544583. Consultado em 26 de junho de 2009. Arquivado do original em 9 de dezembro de 2012
- ↑ «Ilya Mechnikov». The Nobel Foundation. Consultado em 28 de novembro de 2008
- ↑ Delves p. 263
- ↑ Robinson p. vii
- ↑ Ernst p. 4
- ↑ Ernst p. 78
- ↑ a b Hampton MB, Vissers MC, Winterbourn CC (fevereiro 1994). «A single assay for measuring the rates of phagocytosis and bacterial killing by neutrophils». J. Leukoc. Biol. 55 (2): 147–52. PMID 8301210. Consultado em 26 de junho de 2009. Arquivado do original em 28 de dezembro de 2012
- ↑ Delves pp. 6-7
- ↑ Sompayrac p. 3
- ↑ Sompayrac p. 2
- ↑ Sompayrac pp. 13-16
- ↑ Dale DC, Boxer L, Liles WC (agosto 2008). «The phagocytes: neutrophils and monocytes». Blood. 112 (4): 935–45. PMID 18684880. doi:10.1182/blood-2007-12-077917
- ↑ Dahlgren, C; A Karlsson (17 de dezembro de 1999). «Respiratory burst in human neutrophils.». Journal of Immunological Methods. 232 (1–2): 3–14. PMID 10618505. doi:10.1016/S0022-1759(99)00146-5
- ↑ Shatwell, KP; AW Segal (1996). «NADPH oxidase.». The international journal of biochemistry and cell biology. 28 (11): 1191–95. PMID 9022278. doi:10.1016/S1357-2725(96)00084-2
- ↑ Klebanoff SJ (1999). «Myeloperoxidase». Proc. Assoc. Am. Physicians. 111 (5): 383–89. PMID 10519157
- ↑ Meyer KC (setembro 2004). «Neutrophils, myeloperoxidase, and bronchiectasis in cystic fibrosis: green is not good». J. Lab. Clin. Med. 144 (3): 124–26. PMID 15478278. doi:10.1016/j.lab.2004.05.014
- ↑ Hoffbrand p. 118
- ↑ Delves pp. 6–10
- ↑ Schroder K, Hertzog PJ, Ravasi T, Hume DA (fevereiro 2004). «Interferon-gamma: an overview of signals, mechanisms and functions». J. Leukoc. Biol. 75 (2): 163–89. PMID 14525967. doi:10.1189/jlb.0603252. Consultado em 29 de junho de 2009. Arquivado do original em 3 de julho de 2010
- ↑ Delves p. 188
- ↑ a b Sompayrac p. 17
- ↑ Lipu HN, Ahmed TA, Ali S, Ahmed D, Waqar MA (setembro 2008). «Chronic granulomatous disease». J Pak Med Assoc. 58 (9): 516–8. PMID 18846805
- ↑ Kaplan J, De Domenico I, Ward DM (janeiro 2008). «Chediak-Higashi syndrome». Curr. Opin. Hematol. 15 (1): 22–9. PMID 18043242. doi:10.1097/MOH.0b013e3282f2bcce. Consultado em 11 de abril de 2009
- ↑ Sompayrac p. 7
- ↑ de Almeida SM, Nogueira MB, Raboni SM, Vidal LR (outubro 2007). «Laboratorial diagnosis of lymphocytic meningitis». Braz J Infect Dis. 11 (5): 489–95. PMID 17962876. Consultado em 29 de março de 2009
- ↑ Sompayrac p. 22
- ↑ Sompayrac p. 63
- ↑ «Apoptosis». Merriam-Webster Online Dictionary. Consultado em 19 de março de 2009
- ↑ Li MO, Sarkisian MR, Mehal WZ, Rakic P, Flavell RA (novembro 2003). «Phosphatidylserine receptor is required for clearance of apoptotic cells». Science (journal). 302 (5650): 1560–63. PMID 14645847. doi:10.1126/science.1087621 (Free registration required for online access)
- ↑ Wang X; et al. (2003). «Cell corpse engulfment mediated by C. elegans phosphatidylserine receptor through CED-5 and CED-12». Science. 302 (5650): 1563–1566. PMID 14645848. doi:10.1126/science.1087641 (Free registration required for online access)
- ↑ Savill J, Gregory C, Haslett C. (2003). «Eat me or die». Science. 302 (5650): 1516–17. PMID 14645835. doi:10.1126/science.1092533
- ↑ Zhou Z, Yu X (outubro 2008). «Phagosome maturation during the removal of apoptotic cells: receptors lead the way». Trends Cell Biol. 18 (10): 474–85. PMID 18774293. doi:10.1016/j.tcb.2008.08.002
- ↑ Sompayrac p. 44
- ↑ Sompayrac p. 4
- ↑ Sompayrac pp. 24–35
- ↑ Delves pp. 171–184
- ↑ Delves p. 456
- ↑ Timothy Lee (2004). «Antigen Presenting Cells (APC)». Immunology for 1st Year Medical Students. Dalhousie University. Consultado em 12 de novembro de 2008. Arquivado do original em 12 de janeiro de 2008
- ↑ Delves p. 161
- ↑ Sompayrac p. 8
- ↑ Delves pp. 237–242
- ↑ Lange C, Dürr M, Doster H, Melms A, Bischof F (2007). «Dendritic cell-regulatory T-cell interactions control self-directed immunity». Immunol. Cell Biol. 85 (8): 575–81. PMID 17592494. doi:10.1038/sj.icb.7100088
- ↑ a b Steinman, Ralph M. (2004). «Dendritic Cells and Immune Tolerance». The Rockefeller University. Consultado em 15 de fevereiro de 2009
- ↑ Romagnani, S (2006). «Immunological tolerance and autoimmunity.». Internal and emergency medicine. 1 (3): 187–96. PMID 17120464. doi:10.1007/BF02934736
- ↑ Sompayrac pp. 16–17
- ↑ Sompayrac pp. 18–19
- ↑ Delves p. 6
- ↑ Zen K, Parkos CA (outubro 2003). «Leukocyte-epithelial interactions». Curr. Opin. Cell Biol. 15 (5): 557–64. PMID 14519390. Consultado em 29 de março de 2009
- ↑ Sompayrac p. 79
- ↑ Hoffbrand p. 117
- ↑ Delves pp. 1–6
- ↑ Sompayrac p. 45
- ↑ Takahashi K, Naito M, Takeya M (julho 1996). «Development and heterogeneity of macrophages and their related cells through their differentiation pathways». Pathol. Int. 46 (7): 473–85. PMID 8870002. doi:10.1111/j.1440-1827.1996.tb03641.x
- ↑ Krombach F, Münzing S, Allmeling AM, Gerlach JT, Behr J, Dörger M (setembro 1997). «Cell size of alveolar macrophages: an interspecies comparison». Environ. Health Perspect. 105 Suppl 5: 1261–3. PMC 1470168
 . PMID 9400735. doi:10.2307/3433544
. PMID 9400735. doi:10.2307/3433544
- ↑ a b c d e Bowers, William (2006). «Immunology -Chapter Thirteen: Immunoregulation». Microbiology and Immunology On-Line Textbook. USC School of Medicine. Consultado em 14 de novembro de 2008
- ↑ Ernst p. 8
- ↑ Delves p. 156
- ↑ Delves p. 187
- ↑ Stvrtinová, Viera; Ján Jakubovský and Ivan Hulín (1995). «Neutrophils, central cells in acute inflammation». Inflammation and Fever from Pathophysiology: Principles of Disease. Computing Centre, Slovak Academy of Sciences: Academic Electronic Press. ISBN 80-967366-1-2. Consultado em 28 de março de 2009. Arquivado do original em 31 de dezembro de 2010
- ↑ Delves p. 4
- ↑ a b Sompayrac p. 18
- ↑ Linderkamp O, Ruef P, Brenner B, Gulbins E, Lang F (dezembro 1998). «Passive deformability of mature, immature, and active neutrophils in healthy and septicemic neonates». Pediatr. Res. 44 (6): 946–50. PMID 9853933. Consultado em 6 de abril de 2009
- ↑ Paoletti p. 62
- ↑ Soehnlein O, Kenne E, Rotzius P, Eriksson EE, Lindbom L (janeiro 2008). «Neutrophil secretion products regulate anti-bacterial activity in monocytes and macrophages». Clin. Exp. Immunol. 151 (1): 139–45. PMC 2276935
 . PMID 17991288. doi:10.1111/j.1365-2249.2007.03532.x. Verifique
. PMID 17991288. doi:10.1111/j.1365-2249.2007.03532.x. Verifique |doi=(ajuda). Consultado em 29 de março de 2009. Arquivado do original em 9 de dezembro de 2012 - ↑ Soehnlein O, Kai-Larsen Y, Frithiof R; et al. (outubro 2008). «Neutrophil primary granule proteins HBP and HNP1-3 boost bacterial phagocytosis by human and murine macrophages». J. Clin. Invest. 118 (10): 3491–502. PMC 2532980
 . PMID 18787642. doi:10.1172/JCI35740
. PMID 18787642. doi:10.1172/JCI35740
- ↑ Steinman RM, Cohn ZA (1973). «Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution». J. Exp. Med. 137 (5): 1142–62. PMC 2139237
 . PMID 4573839. doi:10.1084/jem.137.5.1142
. PMID 4573839. doi:10.1084/jem.137.5.1142
- ↑ Steinman, Ralph. «Dendritic Cells». The Rockefeller University. Consultado em 14 de novembro de 2008
- ↑ Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S (2002). «Antigen presentation and T cell stimulation by dendritic cells». Annu. Rev. Immunol. 20: 621–67. PMID 11861614. doi:10.1146/annurev.immunol.20.100301.064828. Consultado em 29 de março de 2009
- ↑ Hoffbrand p. 134
- ↑ Sallusto F, Lanzavecchia A (2002). «The instructive role of dendritic cells on T-cell responses». Arthritis Res. 4 Suppl 3: S127–32. PMID 12110131. doi:10.1186/ar567
- ↑ Sompayrac pp. 42–46
- ↑ Steinman, Ralph. «Dendritic Cells». The Rockefeller University. Consultado em 16 de novembro de 2008
- ↑ Stelekati E, Orinska Z, Bulfone-Paus S (2007). «Mast cells in allergy: innate instructors of adaptive responses». Immunobiology. 212 (6): 505–19. PMID 17544835. doi:10.1016/j.imbio.2007.03.012. Consultado em 29 de março de 2009
- ↑ a b Malaviya R, Abraham SN (fevereiro 2001). «Mast cell modulation of immune responses to bacteria». Immunol. Rev. 179: 16–24. PMID 11292019. doi:10.1034/j.1600-065X.2001.790102.x. Consultado em 29 de março de 2009. Arquivado do original em 5 de janeiro de 2013
- ↑ Connell I, Agace W, Klemm P, Schembri M, Mărild S, Svanborg C (setembro 1996). «Type 1 fimbrial expression enhances Escherichia coli virulence for the urinary tract». Proc. Natl. Acad. Sci. U.S.A. 93 (18): 9827–32. PMC 38514
 . PMID 8790416. doi:10.1073/pnas.93.18.9827
. PMID 8790416. doi:10.1073/pnas.93.18.9827
- ↑ Malaviya R, Twesten NJ, Ross EA, Abraham SN, Pfeifer JD (fevereiro 1996). «Mast cells process bacterial Ags through a phagocytic route for class I MHC presentation to T cells». J. Immunol. 156 (4): 1490–6. PMID 8568252. Consultado em 29 de março de 2009
- ↑ Taylor ML, Metcalfe DD (2001). «Mast cells in allergy and host defense». Allergy Asthma Proc. 22 (3): 115–9. PMID 11424870. doi:10.2500/108854101778148764. Consultado em 29 de março de 2009
- ↑ a b Paoletti p. 427
- ↑ Birge RB, Ucker DS (julho 2008). «Innate apoptotic immunity: the calming touch of death». Cell Death Differ. 15 (7): 1096–1102. PMID 18451871. doi:10.1038/cdd.2008.58
- ↑ Couzinet S, Cejas E, Schittny J, Deplazes P, Weber R, Zimmerli S (dezembro 2000). «Phagocytic uptake of Encephalitozoon cuniculi by nonprofessional phagocytes». Infect. Immun. 68 (12): 6939–45. PMC 97802
 . PMID 11083817. doi:10.1128/IAI.68.12.6939-6945.2000
. PMID 11083817. doi:10.1128/IAI.68.12.6939-6945.2000
- ↑ a b Paoletti p. 426
- ↑ Rabinovitch M (março 1995). «Professional and non-professional phagocytes: an introduction». Trends Cell Biol. 5 (3): 85–7. PMID 14732160
- ↑ a b c d e Todar, Kenneth. «Mechanisms of Bacterial Pathogenicity: Bacterial Defense Against Phagocytes». 2008. Consultado em 10 de dezembro de 2008
- ↑ Alexander J, Satoskar AR, Russell DG (setembro 1999). «Leishmania species: models of intracellular parasitism». J. Cell. Sci. 112 Pt 18: 2993–3002. PMID 10462516
- ↑ Celli J, Finlay BB (maio 2002). «Bacterial avoidance of phagocytosis». Trends Microbiol. 10 (5): 232–37. PMID 11973157. doi:10.1016/S0966-842X(02)02343-0
- ↑ Valenick LV, Hsia HC, Schwarzbauer JE (setembro 2005). «Fibronectin fragmentation promotes alpha4beta1 integrin-mediated contraction of a fibrin-fibronectin provisional matrix». Experimental cell research. 309 (1): 48–55. PMID 15992798. doi:10.1016/j.yexcr.2005.05.024
- ↑ Burns SM, Hull SI (agosto 1999). «Loss of resistance to ingestion and phagocytic killing by O(-) and K(-) mutants of a uropathogenic Escherichia coli O75:K5 strain». Infect. Immun. 67 (8): 3757–62. PMC 96650
 . PMID 10417134. Consultado em 29 de março de 2009
. PMID 10417134. Consultado em 29 de março de 2009
- ↑ Vuong C, Kocianova S, Voyich JM; et al. (dezembro 2004). «A crucial role for exopolysaccharide modification in bacterial biofilm formation, immune evasion, and virulence». J. Biol. Chem. 279 (52): 54881–6. PMID 15501828. doi:10.1074/jbc.M411374200. Consultado em 29 de março de 2009
- ↑ Melin M, Jarva H, Siira L, Meri S, Käyhty H, Väkeväinen M (fevereiro 2009). «Streptococcus pneumoniae capsular serotype 19F is more resistant to C3 deposition and less sensitive to opsonophagocytosis than serotype 6B». Infect. Immun. 77 (2): 676–84. PMID 19047408. doi:10.1128/IAI.01186-08. Consultado em 29 de março de 2009
- ↑ a b Foster TJ (dezembro 2005). «Immune evasion by staphylococci». Nat. Rev. Microbiol. 3 (12): 948–58. PMID 16322743. doi:10.1038/nrmicro1289
- ↑ Sansonetti P (dezembro 2001). «Phagocytosis of bacterial pathogens: implications in the host response». Semin. Immunol. 13 (6): 381–90. PMID 11708894. doi:10.1006/smim.2001.0335
- ↑ Dersch P, Isberg RR (março 1999). «A region of the Yersinia pseudotuberculosis invasin protein enhances integrin-mediated uptake into mammalian cells and promotes self-association». Embo J. 18 (5): 1199–1213. PMC 1171211
 . PMID 10064587. doi:10.1093/emboj/18.5.1199
. PMID 10064587. doi:10.1093/emboj/18.5.1199
- ↑ Antoine JC, Prina E, Lang T, Courret N (outubro 1998). «The biogenesis and properties of the parasitophorous vacuoles that harbour Leishmania in murine macrophages». Trends Microbiol. 6 (10): 392–401. PMID 9807783. doi:10.1016/S0966-842X(98)01324-9
- ↑ Masek, Katherine S.; Christopher A. Hunter (2007). Eurekah Bioscience Collection: Evasion of Phagosome Lysosome Fusion and Establishment of a Replicative Organelle by the Intracellular Pathogen Legionella pneumophila. [S.l.]: Landes Bioscience. Consultado em 20 de março de 2009
- ↑ Das D, Saha SS, Bishayi B (julho 2008). «Intracellular survival of Staphylococcus aureus: correlating production of catalase and superoxide dismutase with levels of inflammatory cytokines». Inflamm. Res. 57 (7): 340–9. PMID 18607538. doi:10.1007/s00011-007-7206-z
- ↑ Hara H, Kawamura I, Nomura T, Tominaga T, Tsuchiya K, Mitsuyama M (agosto 2007). «Cytolysin-dependent escape of the bacterium from the phagosome is required but not sufficient for induction of the Th1 immune response against Listeria monocytogenes infection: distinct role of Listeriolysin O determined by cytolysin gene replacement». Infect. Immun. 75 (8): 3791–3801. PMC 1951982
 . PMID 17517863. doi:10.1128/IAI.01779-06
. PMID 17517863. doi:10.1128/IAI.01779-06
- ↑ Datta V, Myskowski SM, Kwinn LA, Chiem DN, Varki N, Kansal RG, Kotb M, Nizet V (maio 2005). «Mutational analysis of the group A streptococcal operon encoding streptolysin S and its virulence role in invasive infection». Mol. Microbiol. 56 (3): 681–95. PMID 15819624. doi:10.1111/j.1365-2958.2005.04583.x
- ↑ Iwatsuki K, Yamasaki O, Morizane S, Oono T (junho 2006). «Staphylococcal cutaneous infections: invasion, evasion and aggression». J. Dermatol. Sci. 42 (3): 203–14. PMID 16679003. doi:10.1016/j.jdermsci.2006.03.011
- ↑ Denkers EY, Butcher BA (janeiro 2005). «Sabotage and exploitation in macrophages parasitized by intracellular protozoans». Trends Parasitol. 21 (1): 35–41. PMID 15639739. doi:10.1016/j.pt.2004.10.004. Consultado em 29 de março de 2009
- ↑ Gregory DJ, Olivier M (2005). «Subversion of host cell signalling by the protozoan parasite Leishmania». Parasitology. 130 Suppl: S27–35. PMID 16281989. doi:10.1017/S0031182005008139. Consultado em 29 de março de 2009
- ↑ Heinzelmann M, Mercer-Jones MA, Passmore JC (agosto 1999). «Neutrophils and renal failure». Am. J. Kidney Dis. 34 (2): 384–99. PMID 10430993
- ↑ Lee WL, Downey GP (fevereiro 2001). «Neutrophil activation and acute lung injury». Curr Opin Crit Care. 7 (1): 1–7. PMID 11373504. doi:10.1097/00075198-200102000-00001
- ↑ a b Moraes TJ, Zurawska JH, Downey GP (janeiro 2006). «Neutrophil granule contents in the pathogenesis of lung injury». Curr. Opin. Hematol. 13 (1): 21–27. PMID 16319683. doi:10.1097/01.moh.0000190113.31027.d5
- ↑ Abraham E (Abril 2003). «Neutrophils and acute lung injury». Crit. Care Med. 31 (4 Suppl): S195–99. PMID 12682440. doi:10.1097/01.CCM.0000057843.47705.E8
- ↑ Ricevuti G (dezembro 1997). «Host tissue damage by phagocytes». Ann. N. Y. Acad. Sci. 832: 426–48. PMID 9704069. Consultado em 3 de julho de 2009. Arquivado do original em 5 de janeiro de 2013
- ↑ Charley B, Riffault S, Van Reeth K (outubro 2006). «Porcine innate and adaptative immune responses to influenza and coronavirus infections». Ann. N. Y. Acad. Sci. 1081: 130–6. PMID 17135502. doi:10.1196/annals.1373.014. Consultado em 31 de março de 2009. Arquivado do original em 5 de janeiro de 2013
- ↑ Sompayrac p. 1
- ↑ a b Cosson P, Soldati T (junho 2008). «Eat, kill or die: when amoeba meets bacteria». Curr. Opin. Microbiol. 11 (3): 271–6. PMID 18550419. doi:10.1016/j.mib.2008.05.005. Consultado em 5 de abril de 2009
- ↑ Bozzaro S, Bucci C, Steinert M (2008). «Phagocytosis and host-pathogen interactions in Dictyostelium with a look at macrophages». Int Rev Cell Mol Biol. 271: 253–300. PMID 19081545. doi:10.1016/S1937-6448(08)01206-9. Consultado em 5 de abril de 2009
- ↑ Chen G, Zhuchenko O, Kuspa A (agosto 2007). «Immune-like phagocyte activity in the social amoeba». Science (journal). 317 (5838): 678–81. PMID 17673666. doi:10.1126/science.1143991
- ↑ Delves pp. 251–252
- ↑ Hanington PC, Tam J, Katzenback BA, Hitchen SJ, Barreda DR, Belosevic M (Abril 2009). «Development of macrophages of cyprinid fish». Dev. Comp. Immunol. 33 (4): 411–29. PMID 19063916. doi:10.1016/j.dci.2008.11.004. Consultado em 5 de abril de 2009
- Bibliografia
- Delves, PJ, Martin, SJ, Burton, DR e Roit IM Roitt's Essential Immunology (11 ª edição), Blackwell Publishing, 2006, ISBN 978-1-4051-3603-7.
- Ernst JD e Stendahl O., (editores), fagocitose de bactérias e Bacterial patogenesias, Cambridge University Press, 2006, ISBN 0-521-84569-6 Website
- Hoffbrand, AV, Pettit, JE e Moss, HAP, Essential Haematology (4a edição), Blackwell Science, 2005, ISBN 0-632-05153-1.
- Janeway, CA, Murphy, km, Travers, P., Walport, M., Immunobiology (5 ª edição), Garland Science, New York, 2001. ISBN 0-8153-3642-X.
- R. Paoletti, A. e notario Ricevuti G., (editores), Fagócitos: Biologia, Fisiologia, Patologia, e Pharmacotherapeutics, o The New York Academy of Sciences, 1997, ISBN 1-57331-102-2.
- Robinson JP e Babcock GF, (editores), fagócito Função-Um guia para a investigação e avaliação clínica, Wiley-Liss, 1998, ISBN 0-471-12364-1
- Sompayrac, L. Como funciona o sistema imunitário (3 ª edição), Blackwell Publishing, 2008, ISBN 978-1-4051-6221-0

