Decavanadato de sódio
| Decavanadato de sódio Alerta sobre risco à saúde | |
|---|---|
| |

| |
| Nome IUPAC | Decavanadato de sódio |
| Identificadores | |
| Número CAS | |
| Propriedades | |
| Fórmula molecular | Na6[V10O28] |
| Massa molar | 1419.6 g |
| Aparência | sólido laranja |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Decavanadato de sódio (Na6[V10O28]) é um composto inorgânico. É o sal de sódio do ânion decavanadato, [V10O28]6−.Decavanadato é o único dentre os vanadatos que forma uma solução aquosa de coloração laranja.[1] Numerosos sais de decavanadato e derivados têm sido isolados e estudados desde 1956 quando foi caracterizado pela primeira vez.[2]
Preparação[editar | editar código-fonte]
A preparação do decavanadato é conseguido por acidificação de uma solução aquosa de vanadato.[1]
- 10 Na3[VO4]·nH2O + 24 HOAc → Na6[V10O28]·18 H2O + 24 NaOAc
A formação do decavanadato é otimizada pelo controle de pH entre 4 e 7. O produto pode ser purificado através de recristalização em água. Subprodutos típicos incluem metavanadato, [VO3]−, e hexavanadato, [V6O16]2−.[1]
Estrutura[editar | editar código-fonte]

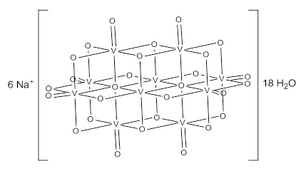
O íon decavanadato consiste em seis octaedros de VO6 fundidos e possui simetria D2h.[3][4][5] A estrutura do Na6[V10O28]·18H2O foi confirmada com a cristalografia de raio X.[6]
Os ânions de decavanadato contêm três grupos de átomos de vanádio equivalentes (ver fig. 1).[3] Inclui dois octaédros centrais de VO6 (Vc) e quatro grupos tetragonais-piramidais periféricos de VO5 (Va and Vb). Existem sete grupos de átomos de oxigênio (assinalado de A ao G). Dois desses (A) se ligam aos V dos centros, quatro (B) se ligam aos V dos centros, quatorze (C, D e E) entre os limites das arestas dos pares de V centrais, e por fim (F and G) estão em posição periférica.
O estado de oxidação do vanádio em decavanadato é +5. Vanádio pode agir como agente oxidante e forma vanádio(IV) ou vanádio(III).[7] A exposição ao ar mantém o vanadato, tornando-os compostos estáveis.[7]
Decavanadatos relacionados[editar | editar código-fonte]
Muitos sais de decavanadato estão sendo caracterizados. NH4+, Ca2+, Ba2+, Sr2+, e sais de decavanadato com cátions do grupo I estão sendo praparados por reação ácido-base entre V2O5 e o óxido, hidróxido, carbonato, ou hidrogenocarbonato dos cátions desejados.[1]
- 6NH3 + 5V2O5 + 3H2O ⇌ (NH4)6[V10O28]
Outros decavanadatos:
- (NH4)6[V10O28]·6H2O[2]
- K6[V10O28]·9H2O[2]
- K6[V10O28]·10H2O[1][2][3]
- Ca3[V10O28]·16H2O[2][3]
- K2Mg2[V10O28]·16H2O[2][3]
- K2Zn2[V10O28]·16H2O[1][2][3]
- Cs2Mg2[V10O28]·16H2O[3]
- Cs4Na2[V10O28]·10H2O[8]
- K4Na2[V10O28]·16H2O[9]
- Sr3[V10O28]·22H2O[8]
- Ba3[V10O28]·19H2O[8]
- [(C6H5)4P]H3V10O28·4CH3CN[10]
- Ag6[V10O28]·4H2O[11]
Referências
- ↑ a b c d e f Johnson, G.; Murmann, R. K.; Deavin, R.; Griffith, W. P. (2007). «Sodium and Ammonium Decavanadates». Inorganic Syntheses. 19: 140–145. doi:10.1002/9780470132500.ch32
- ↑ a b c d e f g Rossotti, F. J.; Rossotti, H. (1956). «Equilibrium Studies of Polyanions». Acta Chemica Scandinavica. 10: 957–984. doi:10.3891/acta.chem.scand.10-0957
- ↑ a b c d e f g Evans Jr., H. T. (1966). «The molecular structure of the isopoly complex ion, decavanadate». Inorg. Chem. 5: 967–977. doi:10.1021/ic50040a004
- ↑ Kustin, K.; Pessoa, J. C.; Crans, D. C. (2007). Vandadium: The Versatile Metal. Washington, D. C.: American Chemical Society. ISBN 978-0-8412-7446-4
- ↑ Rehder, D. (2008). Bioinorganic Vanadium Chemistry. [S.l.]: Wiley & Sons. pp. 13–51. ISBN 978-0-470-06509-9
- ↑ Durif, P.A.; Averbuch-pouchot, M.T. (1980). «Structure d'un Décavanadate d'Hexasodium Hydraté». Acta Cryst. B36: 680–682. doi:10.1107/S0567740880004116
- ↑ a b Tracey, A.S.; Crans, D.C. (1998). Vanadium Compounds. Washington D.C.: American Chemical Society. ISBN 0-8412-3589-9
- ↑ a b c Dametto, A.C.; de Arauju, A.S.; de Souza Correa, R.; Guilherme, L.R.; Massabni, A.C. (2010). «Synthesis, infrared spectroscopy and crystal structure determination of a new decavanadate». J Chem Crystallogr. 40: 897–901. doi:10.1007/s10870-010-9759-x
- ↑ Matias, P.M.; Pessoa, J.C.; Duarte, M.T.; Maderia, C. (2000). «Tetrapotassium disodium decavanadate(V) decahydrate». Acta Cryst. 57: e75–e76. doi:10.1107/S0108270100001530
- ↑ Day, V. W.; Klemperer, W. G.; Maltbie, D. J. (1987). «Where Are the Protons in H3V10O283−?». Am. Chem. Soc. 109: 2991–3002. doi:10.1021/ja00244a022
- ↑ Escobar, M.E.; Baran, E.J. (1981). «Die Schwingungsspektren einiger kristalliner Dekavanadate». Monatshefte fur Chemie. 112: 43-49
