Frutose
| Frutose Alerta sobre risco à saúde | |
|---|---|

|

|
| |

| |

| |
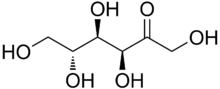
| Nome IUPAC | (2R,3S,4R,5R)-2,5-Bis(hidroximetil)oxolane-2,3,4-triol |
| Outros nomes | D-arabino-Hexulose Açúcar de frutas beta-Levulose Levulose |
| Identificadores | |
| Número CAS | 57-48-7 (D-fructose) |
| PubChem | |
| SMILES |
|
| Propriedades | |
| Fórmula química | C6H12O6 |
| Massa molar | 180.12 g mol-1 |
| Densidade | 1,59 g·cm-3[1] |
| Ponto de fusão |
100–104 °C[1] |
| Solubilidade em água | 790 g·l-1 a 20 °C[1] |
| Solubilidade | solúvel em acetona moderadamente solúvel em etanol praticamente insolúvel em éter dietílico, benzeno e clorofórmio[2] |
| Riscos associados | |
| Frases R | - |
| Frases S | - |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |

Frutose (pronúncia: /fɾuˈtɔzɨ/) ou levulose (/levuˈlɔzɨ/), também conhecida como açúcar das frutas, é um monossacarídeo (C6H12O6), com os carbonos dispostos em anel, muito encontrado em frutas.
O nome "frutose" foi inventado em 1857 pelo químico inglês William Miller. Pura, a frutose desidratada é muito doce, incolor, sem odor, sólida e cristalina. É o açúcar mais solúvel em água de todos.
É também conhecida como levulose, pois uma solução saturada é capaz de transformar luz linearmente polarizada em luz circularmente polarizada, com giro vetorial para esquerda.A frutose é um dos constituintes, junto a glicose, da sacarose (β-D-Frutofuranosil α-D-glicopiranosida), o açúcar refinado comum, e de outros polímeros denominados fructans ou inulina.[3] Além de ser menos doce que a frutose, a sacarose é um dissacarídeo encontrado principalmente na cana-de-açúcar. Cerca de 240.000 toneladas de frutose cristalizada são produzidas anualmente.[4]
A frutose também é encontrada em cereais, vegetais e no mel.
No organismo humano, a frutose é fosforilada a frutose-6-fosfato pela hexoquinase, seguindo, posteriormente, para a glicólise onde é metabolizada a ATP. No fígado, contudo, a frutose é transformada em gliceraldeído-3-fosfato e só depois entra na via glicolítica. Desta forma, entra depois do maior ponto de regulação da actividade glicolítica, a reacção catalisada pela cínase da frutose fosforilada. Assim, um consumo excessivo de frutose leva a uma saturação da via glicolítica, o que leva à formação de elevadas quantidades de acetil-CoA o que aumenta a biossíntese de ácidos graxos, provocando acumulação de gorduras no tecido adiposo. O esperma humano é rico em frutose.
A frutose e a glicose estão fortemente presentes nas uvas, e são a base química do vinho. A ação de leveduras sobre esses açúcares (e nunca sobre sacarose) faz a transformação dos açúcares em álcool etílico e gás carbônico.
A maior parte da frutose vendida no Brasil é importada, tendo por esse e outros fatores um preço mais elevado.
Propriedades físico-químicas
[editar | editar código-fonte]
Assim como a glucose, a frutose também se apresenta em duas formas: cadeias abertas (acíclicas) e cadeias fechadas (hemiacetal).
Em solução aquosa, a forma tautomérica predominante é a β-D-frutopiranose (73% a 20 °C), seguida da forma β-D-frutofuranose (20%) .[6]
Em forma cristalina, a análise de raio X mostra que a forma adotada é a β-D-frutopiranose em conformação "chaise 2C5".[7]
A posição dos grupos hidroxila e carbonila, após a hidrólise, na composição de um monossacarídio, composto por seis átomos de carbono unidos em ligações covalentes simples, determina se ele dará origem a uma cetona ou um aldeído. A glicose quando hidrolisada, dará origem a aldeído, sendo chamada de aldohexose. A frutose, por sua vez, por conter um grupo carbonila no final da cadeia, quando hidrolisada, fornecerá cetona, sendo denominada cetohexose.

Reações
[editar | editar código-fonte]Frutose e fermentação
[editar | editar código-fonte]A frutose pode ser anaerobicamente fermentada por fungos ou por bacterias. A enzimas de fungos convertem açúcar (glicose ou frutose) a etanol e dióxido de carbono. O dióxido de carbono liberado durante a fermentação permanecerá dissolvido na água, onde alcançará o equilibro com o ácido carbônico, a não ser que a câmara de fermentação seja deixada aberta. O dióxido de carbono e o ácido carbônico produzirão a carbonação em bebidas fermentadas engarrafadas.[8]
Frutose e a reação de Maillard
[editar | editar código-fonte]A frutose sofre a reação de Maillard, a combinação não enzimática com aminoácidos. Por ocorrer mais frequentemente em cadeia aberta do que a glicose, os estágios iniciais da reação de Maillard ocorre mais rapidamente do que com a glicose. No entanto, a frutose tem potencial de contribuir com a mudança na palatícia de alimentos e também no brilho excessivo, volume e ternura na fermentação de bolos e na formação de compostos mutagênicos.[9]
A frutose é facilmente desidratada para formar hidroximetilfurfural. Esse processo, no futuro, pode trazer um sistema de baixo custo de produção de substituintes do petróleo e do diesel de plantas.[10]
Doçura
[editar | editar código-fonte]A razão principal pela qual a frutose é usada comercialmente em bebidas e frutas industrializadas, além de seu baixo custo, é a sua elevada característica adocicada. É considerado o composto mais doce entre os carboidratos que ocorrem naturalmente. É cerca de 1,7 vezes mais que a sacarose. Contudo, a doçura provém do anel de 6 átomos de carbono da frutose; o anel de 5 átomos de carbonos, formado pelo aquecimento da frutose, possui o mesmo sabor que o açúcar refinado comum. Desta forma, pode-se dizer que a doçura diminui com o aumento da temperatura do composto. Em contraponto, observou-se que a doçura absoluta da frutose varia de 5 a 50 °C e, portanto, a característica adocicada da sacarose não é devido à distribuição anomérica, mas a sua diminuição em temperaturas mais baixas.
O doce da frutose é percebido mais cedo que o da sacarose e da glicose e a sensação do sabor atinge um pico superior à da sacarose e diminui mais rapidamente. A frutose também pode realçar outros sabores no sistema.
A frutose exibe um efeito de sinergia de doçura quando usado em combinação a outros adoçantes. A característica adocicada de frutose misturada a sacarose, aspartame ou sacarina é considerada maior que a doçura calculada a partir dos componentes vistos individualmente.
Solubilidade e cristalização
[editar | editar código-fonte]A frutose possui maior solubilidade que outros açúcares, assim como outros álcoois de açúcar. Portanto, é mais difícil de se cristalizar a partir de uma solução aquosa. As misturas de açúcar contendo frutose, como por exemplo os doces, são mais suaves que aquelas que contêm outros açúcares devido a sua maior solubilidade.[11]
Ponto de solidificação
[editar | editar código-fonte]A frutose tem um efeito maior na depressão do ponto de solidificação que os dissacarídeos ou os oligossacarídeos, o que pode proteger a integridade das paredes celulares dos frutos, reduzindo a formação de cristais de gelo. Porém, essa característica pode ser inconveniente em sobremesas de produtos lácteos suaves ou congelados.[12]
Funcionalidade de frutose e amido em sistemas alimentares
[editar | editar código-fonte]A frutose aumenta a viscosidade do amido mais rápido e diminui a temperatura necessária durante a sua gelatinização, causando uma viscosidade final mais elevada que a sacarose.[13] Embora alguns adoçantes artificiais não sejam adequados para o cozimento doméstico, muitas receitas tradicionais usam frutose.
A frutose presente na dieta produz menor aumento na glicemia quando comparada a quantidades isocalóricas de sacarose e de amido, sendo essa uma vantagem da frutose como adoçante na dieta de diabéticos.[14]
A digestão e absorção da frutose em seres humanos
[editar | editar código-fonte]A frutose existe em alimentos tanto como monossacarídeo (frutose na forma livre) como dissacarídeo (sacarose). A frutose na forma livre é absorvida diretamente pelo intestino. Quando a frutose é consumida na forma de sacarose, é digerida e então absorvida como frutose. Conforme a sacarose entra em contato com a membrana do delgado, a enzima sucrase catalisa a clivagem da sacarose para produzir uma unidade de glicose e uma unidade de frutose, cada uma delas absorvida. Após a absorção, ele entra na veia porta hepática e é direcionado para o fígado.
O mecanismo de absorção de frutose no intestino delgado não é completamente compreendido. Algumas evidências sugerem transporte ativo, porque a absorção de frutose ocorreu contra um gradiente de concentração. No entanto, a maioria das pesquisas apoia a afirmação de que a absorção de frutose ocorre na membrana mucosa através de transporte facilitado envolvendo proteínas de transporte GLUT5. Uma vez que a concentração de frutose é maior no lúmen, a frutose é capaz de escoar um gradiente de concentração nos enterócitos, auxiliados por proteínas de transporte. A frutose pode ser transportada para fora do enterócito através da membrana basolateral por GLUT2 ou GLUT5, embora o transportador GLUT2 tenha uma maior capacidade de transporte de frutose e, portanto, a maioria da frutose é transportada para fora do enterócito através do GLUT2.[15]
Efeitos na saúde
[editar | editar código-fonte]Digestão
[editar | editar código-fonte]A absorção de frutose ocorre no intestino delgado através do transportador GLUT-5 (somente frutose) e do transportador GLUT2, pelo qual concorre com glicose e galactose, as etapas no fígado ocorrem apenas quando o intestino delgado fica inundado.[16][17] O excesso de consumo de frutose, a inibição de GLUT2 por outros fitoquímicos, como flavonóides, ou outros problemas podem resultar na entrega de frutose não absorvida no intestino grosso, o que causará maior quantidade de água no intestino grosso, por osmose, causando diarreia.
Além disso, o consumo excessivo de frutose é uma fonte de nutrientes para a flora intestinal e resulta em uma maior produção de ácidos gordos de cadeia curta, hidrogênio, dióxido de carbono e outros gases, devido à fermentação. Esse aumento de gás provoca efeitos colaterais gastrointestinais que são semelhantes à síndrome do intestino irritável.[15]
Ganho de peso
[editar | editar código-fonte]Em uma meta-análise de ensaios clínicos com alimentação controlada em que os sujeitos de teste foram alimentados com uma quantidade fixa de energia em vez de serem autorizados a escolher a quantidade que eles comiam, a frutose não era um fator independente para o ganho de peso. No entanto, o consumo de frutose foi associado ao aumento de peso quando a frutose forneceu calorias em excesso.[18]
A frutose é muitas vezes recomendada para diabéticos porque não desencadeia a produção de insulina por células β pancreáticas, provavelmente porque as células β têm níveis baixos de GLUT5,[19] embora o efeito líquido para ambos os diabéticos e não-diabéticos ainda sejam debatidos. A frutose tem um índice glicêmico abaixo de 19 ± 2, em comparação com 100 para a glicose e 68 ± 5 para a sacarose.[20] A frutose também é 73% mais doce que a sacarose à temperatura ambiente, de modo que os diabéticos podem usar menos. Estudos mostram que a frutose consumida antes de uma refeição pode até diminuir a resposta glicêmica da refeição.[21] Os produtos de alimentos e bebidas adoçados com fructose causam menos aumento nos níveis de glicose no sangue do que aqueles fabricados com sacarose ou glicose.[22]
Controle de apetite
[editar | editar código-fonte]Em comparação com o consumo de bebidas com alto teor de glicose, beber bebidas com alto teor de frutose nas refeições resulta em níveis mais baixos de circulação de insulina e leptina e maiores níveis de grelina após a refeição.[23] Como a leptina e a insulina diminuem o apetite, e a grelina aumenta o apetite, alguns pesquisadores suspeitam que comer grandes quantidades de frutose aumenta a probabilidade de ganho de peso.[24]
Referências
- ↑ a b c Registo de Fructose na Base de Dados de Substâncias GESTIS do IFA, accessado em 17 de Março de 2007.
- ↑ Thieme Chemistry, ed. (2009). RÖMPP Online - Version 3.5. Stuttgart: Georg Thieme Verlag KG
- ↑ Rumessen, JJ (1992). Fructose and related food carbohydrates. [S.l.]: Scand J Gastroenterol
- ↑ Wach, Wolfgang (2000). «Fructose». Wiley-VCH Verlag GmbH & Co. KGaA. Ullmann's Encyclopedia of Industrial Chemistry (em inglês). doi:10.1002/14356007.a12_047.pub2/abstract;jsessionid=78c996e705c9d74c4a8c4243afea1cfe.f04t03
- ↑ Bonafe, C. F. S.; Bispo, J. A. C.; de Jesus, M. B. (2018). The Polygonal Model: A Simple Representation of Biomolecules as a Tool for Teaching Metabolism. Biochemistry and Molecular Biology Education. 46: 66-75. DOI - 10.1002/bmb.21093.
- ↑ B. Schneider, F. W. Lichtenthaler, G. Steinle and H. Schiweck. (1985). «Distribution of Furanoid and Pyranoid Tautomers of D-Fructose in Dimethylsulfoxide, Water and Pyridine via Anomeric Hydroxyl Proton NMR Intensitites.». Liebigs Ann. Chem (em inglês): 2454 – 2464. Schneider-1985
- ↑ J.A. Kanters, G. Roelofsen, B.P. Alblas, I.Meinders (1977). «The Crystal Structure of -D-Fructose with Emphasis on the Anomeric Effect». Acta Cryst (em inglês). B33: 665 – 672. Kanters-1977
- ↑ «Yeast and Sugar - The Chemistry must be right». 20 de dezembro de 2010. Consultado em 24 de julho de 2017
- ↑ Dills, W. L. (novembro de 1993). «Protein fructosylation: fructose and the Maillard reaction». The American Journal of Clinical Nutrition. 58 (5 Suppl): 779S–787S. ISSN 0002-9165. PMID 8213610
- ↑ Huber, George W.; Iborra, Sara; Corma, Avelino (1 de setembro de 2006). «Synthesis of Transportation Fuels from Biomass: Chemistry, Catalysts, and Engineering». Chemical Reviews. 106 (9): 4044–4098. ISSN 0009-2665. doi:10.1021/cr068360d
- ↑ «9780130212825 - Foods: Experimental Perspectives 4th Edition by Margaret Mcwilliams - AbeBooks». www.abebooks.com (em inglês). Consultado em 24 de julho de 2017
- ↑ Hanover, L. M.; White, J. S. (novembro de 1993). «Manufacturing, composition, and applications of fructose». The American Journal of Clinical Nutrition. 58 (5 Suppl): 724S–732S. ISSN 0002-9165. PMID 8213603
- ↑ Zanoni, B.; Schiraldi, A.; Simonetta, R. (1 de janeiro de 1995). «A naive model of starch gelatinization kinetics». Journal of Food Engineering. 24 (1): 25–33. doi:10.1016/0260-8774(94)P1605-W
- ↑ Barreiros, Rodrigo Crespo; Bossolan, Grasiela; Trindade, Cleide Enoir Petean (junho de 2005). «Fructose in humans: metabolic effects, clinical utilization, and associated inherent errors». Revista de Nutrição. 18 (3): 377–389. ISSN 1415-5273. doi:10.1590/S1415-52732005000300010
- ↑ a b «Redirecting». linkinghub.elsevier.com. Consultado em 24 de julho de 2017
- ↑ The small intestine, not the liver, is the first stop for processing fructose A new study in mice challenges assumptions of how the body metabolizes this type of sugar por Laurel Hamers (2018)
- ↑ C. Jang et al. The small intestine converts dietary fructose into glucose and organic acids. Cell Metabolism. Vol. 27, 6 de fev. de 2018, p. 351. doi:10.1016/j.cmet.2017.12.016.
- ↑ Sievenpiper, John L.; Souza, Russell J. de; Mirrahimi, Arash; Yu, Matthew E.; Carleton, Amanda J.; Beyene, Joseph; Chiavaroli, Laura; Buono, Marco Di; Jenkins, Alexandra L. (21 de fevereiro de 2012). «Effect of Fructose on Body Weight in Controlled Feeding Trials». Annals of Internal Medicine (em inglês). 156 (4). ISSN 0003-4819. doi:10.7326/0003-4819-156-4-201202210-00007
- ↑ Grant, A. M.; Christie, M. R.; Ashcroft, S. J. H. (1 de agosto de 1980). «Insulin release from human pancreatic islets in vitro». Diabetologia (em inglês). 19 (2): 114–117. ISSN 0012-186X. doi:10.1007/BF00421856
- ↑ Foster-Powell, Kaye; Holt, Susanna HA; Brand-Miller, Janette C. (1 de janeiro de 2002). «International table of glycemic index and glycemic load values: 2002». The American Journal of Clinical Nutrition (em inglês). 76 (1): 5–56. ISSN 0002-9165. PMID 12081815
- ↑ Heacock, Patricia M.; Hertzler, Steven R.; Wolf, Bryan W. (1 de setembro de 2002). «Fructose Prefeeding Reduces the Glycemic Response to a High-Glycemic Index, Starchy Food in Humans». The Journal of Nutrition (em inglês). 132 (9): 2601–2604. ISSN 0022-3166. PMID 12221216
- ↑ EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA) (1 de junho de 2011). «Scientific Opinion on the substantiation of health claims related to fructose and reduction of post-prandial glycaemic responses (ID 558) pursuant to Article 13(1) of Regulation (EC) No 1924/2006». EFSA Journal (em inglês). 9 (6): n/a–n/a. ISSN 1831-4732. doi:10.2903/j.efsa.2011.2223
- ↑ Teff, Karen L.; Elliott, Sharon S.; Tschöp, Matthias; Kieffer, Timothy J.; Rader, Daniel; Heiman, Mark; Townsend, Raymond R.; Keim, Nancy L.; D’Alessio, David (1 de junho de 2004). «Dietary Fructose Reduces Circulating Insulin and Leptin, Attenuates Postprandial Suppression of Ghrelin, and Increases Triglycerides in Women». The Journal of Clinical Endocrinology & Metabolism. 89 (6): 2963–2972. ISSN 0021-972X. doi:10.1210/jc.2003-031855
- ↑ «The obesity epidemic». Radio National (em inglês). 4 de julho de 2007. Consultado em 24 de julho de 2017
