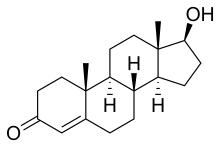
Testosterona
| |

| |
| Nome IUPAC (sistemática) | |
| (8R,9S,10R,13S,14S,17S)-17-hydroxy-10,13-dimethyl-1,2,6,7,8,9,11,12,14,15,16,17- dodecahydrocyclopenta[a]phenanthren-3-one | |
| Identificadores | |
| CAS | 58-22-0 |
| ATC | G03BA03 |
| PubChem | 6013 |
| Informação química | |
| Fórmula molecular | C19H28O2 |
| Massa molar | 288.43 |
| Dados físicos | |
| Ponto de ebulição | 155-156 °C |
| Rotação específica | +110,2° |
| Entalpia Comb. | −11080 kJ/mol |
| Farmacocinética | |
| Biodisponibilidade | ? |
| Metabolismo | Fígado, Testículo e Próstata |
| Meia-vida | 1-12 dias |
| Excreção | Urina |
| Considerações terapêuticas | |
| Administração | Injeção intramuscular, transdérmica (creme, gel ou patch), oral, sub-'Q' pellet |
| DL50 | ? |
A testosterona é o principal andrógeno e um esteroide anabolizante. Em humanos e animais do sexo masculino, a testosterona desempenha um papel fundamental no desenvolvimento de tecidos reprodutores masculinos, como testículos e próstata, bem como a promoção de características sexuais secundárias, como o aumento da massa muscular, aumento e maturação dos ossos e o crescimento do cabelo corporal.[1] Além disso, a testosterona está envolvida na saúde, no bem-estar[2] e na prevenção da osteoporose.[3] Níveis insuficientes de testosterona nos homens podem levar a anormalidades, incluindo fragilidade e perda óssea.
A testosterona também é usada como medicamento para tratar hipogonadismo masculino e certos tipos de câncer de mama.[2] Uma vez que os níveis de testosterona diminuem gradualmente à medida que os homens envelhecem, a testosterona sintética — em alguns casos — é prescrita para homens mais velhos para neutralizar essa deficiência.
A testosterona é um esteroide. É sintetizado em várias etapas a partir do colesterol e é convertido no fígado para metabólitos inativos.[4] Ele exerce sua ação através da ligação e ativação do receptor de andrógenos.[5]
Nos seres humanos e na maioria dos outros vertebrados, a testosterona é secretada principalmente pelos testículos dos machos e, em menor medida, pelos ovários das fêmeas. Em média, em homens adultos, os níveis de testosterona são cerca de 7-8 vezes maiores do que em fêmeas adultas.[4] Como o consumo metabólico de testosterona nos machos é maior, a produção diária é cerca de 20 vezes maior nos homens.[6][7] As mulheres são mais sensíveis ao hormônio.[8]
Efeitos fisiológicos[editar | editar código-fonte]
Em geral, os andrógenos — como a testosterona — promovem a síntese proteica e, assim, o crescimento de tecidos com receptores androgênicos.[9] A testosterona é descrita pela endocrinologia como uma substância que tem efeitos virilizantes e anabolizantes (embora essas descrições categóricas sejam um pouco arbitrárias, uma vez que há uma grande sobreposição mútua entre elas).[10]
- Os efeitos anabolizantes incluem crescimento de massa muscular e força, aumento da densidade e força óssea e estimulação do crescimento linear e maturação óssea.
- Os efeitos androgênicos incluem a maturação dos órgãos sexuais, — particularmente o pênis — a formação do escroto no feto, um engrossamento da voz após o nascimento (geralmente na puberdade) e o crescimento do cabelo facial e axilar. Muitos deles se enquadram na categoria de características sexuais secundárias masculinas.
Os efeitos da testosterona também podem ser classificados pela idade da ocorrência usual. Para os efeitos pós-natais nos machos e nas fêmeas, estes dependem principalmente dos níveis e da duração da testosterona livre circulante.
Antes do nascimento[editar | editar código-fonte]
Os efeitos antes do nascimento são divididos em duas categorias, classificadas em relação aos estágios de desenvolvimento.
O primeiro período ocorre entre 4 e 6 semanas de gestação. Exemplos incluem a virilização genital — como a fusão da linha média — o desbaste escrotal, a rugosidade e o alargamento fálico; embora o papel da testosterona seja muito menor do que a di-hidrotestosterona. Há também desenvolvimento da próstata e vesículas seminais.
Durante o segundo trimestre, o nível de andrógenos está associado à formação de gênero.[11] Este período afeta a feminização ou masculinização do feto. O nível de testosterona de uma mãe durante a gravidez está correlacionado com o sexo e comportamento psicológico do filho.[12]
Durante a infância[editar | editar código-fonte]
Os efeitos andrógenos durante a infância são pouco estudados pela ciência. Nas primeiras semanas de vida de bebês do sexo masculino, os níveis de testosterona aumentam. Os níveis permanecem em uma faixa puberal por alguns meses, mas geralmente atingem níveis altos na infância em 4-6 meses de idade.[13][14] A função desse aumento dos níveis de testosterona nos seres humanos é desconhecida. Especula-se que a "masculinização cerebral" ocorre nesta fase, já que nenhuma mudança significativa foi identificada em outras partes do corpo.[15] O cérebro masculino é masculinizado pela aromatização da testosterona no estrogênio, que atravessa a barreira hematoencefálica e entra no cérebro masculino, enquanto que os fetos femininos têm alfa-fetoproteína, que se liga ao estrogênio, de modo que os cérebros femininos não são afetados.[16]
Antes da puberdade[editar | editar código-fonte]
Antes da puberdade há um pequeno aumento nos níveis de andrógenos, tanto em meninos quanto em meninas. Os efeitos adversos deste aumento incluem o odor corporal do tipo adulto, aumento da oleosidade da pele e do cabelo, acne, aparência de cabelo púbico, cabelo axilar, surto de crescimento, maturação acelerada dos ossos e cabelos faciais.[17]
Durante a puberdade[editar | editar código-fonte]
Os efeitos puberais começam a ocorrer quando os níveis andrógenos tem sido maiores do que o normal. Os efeitos incluem:[17][18]
Crescimento do tecido espermatogênico nos testículos, fertilidade masculina, aumento do pênis ou clitóris, aumento da libido e frequência de ereção ou ingurgitação do clitóris. Crescimento de mandíbula, testa, queixo, nariz e remodelação dos contornos dos ossos faciais, em conjunto com o hormônio do crescimento humano.[19] Conclusão da maturação óssea e término do crescimento. Isso ocorre indiretamente através de metabolitos de estradiol e, portanto, mais gradualmente em homens do que em mulheres. Aumento da força e da massa muscular, os ombros se tornam maiores e a caixa torácica se expande, o aprofundamento da voz, o crescimento do pomo de Adão. Ampliação das glândulas sebáceas. Isso pode causar acne, a gordura subcutânea na face diminui. O cabelo púbico se estende até as coxas e em direção ao umbigo, o desenvolvimento do cabelo facial (patilhas, barba, bigode), perda de cabelo do couro cabeludo (alopecia androgenética), aumento do cabelo no peito, cabelo perianal, cabelo da perna, cabelo da axila.
| Idade | Homens | Mulheres |
|---|---|---|
| 0 a 5 meses | 75-400 ng/dL | 20-80 ng/dL |
| 6 meses a 9 anos | 7-20 ng/dL | 7-20 ng/dL |
| 10 a 11 anos | 7-130 ng/dL | 7-44 ng/dL |
| 12 a 13 anos | 7-800 ng/dL | 7-75 ng/dL |
| 14 anos | 7-1.200 ng/dL | 7-75 ng/dL |
| 15 a 16 anos | 100-1.200 ng/dL | 7-100 ng/dL |
| 17 a 18 anos | 300-1.200 ng/dL | 20-75 ng/dL |
| 19 anos acima | 240-950 ng/dL | 8-60 ng/dL |
Fase adulta[editar | editar código-fonte]
Os efeitos adultos de testosterona são mais claramente demonstráveis em homens do que em mulheres, mas provavelmente são importantes para ambos os sexos. Alguns desses efeitos podem diminuir, pois os níveis de testosterona podem diminuir nas últimas décadas da vida adulta.[20]
Função biológica[editar | editar código-fonte]
A testosterona é necessária para o desenvolvimento normal de esperma. Ativa genes nas células de Sertoli, que promovem a diferenciação da espermatogônia. Ele regula a resposta aguda do eixo HPE (Hipotálamo-pituitária-eixo adrenal) sob o desafio de dominância.[21] Os andrógenos, incluindo a testosterona, aumentam o crescimento muscular. A testosterona também regula a população de receptores A2 de tromboxano em megacariócitos e plaquetas.[22][23]
Riscos de saúde[editar | editar código-fonte]
A testosterona não parece aumentar o risco de desenvolver câncer de próstata. Em pessoas que sofreram terapia de privação de testosterona, aumenta a testosterona além do nível de castração para aumentar a taxa de disseminação de um câncer de próstata existente.[24][25][26]
Resultados conflitantes foram obtidos quanto à importância da testosterona na manutenção da saúde cardiovascular.[27][28] No entanto, a manutenção de níveis normais de testosterona em homens idosos mostrou reduzir o risco de doença cardiovascular, aumento da massa corporal magra, diminuição da massa gorda visceral, diminuição do colesterol total e controle glicêmico.[29]
Os altos níveis do andrógeno estão associados a irregularidades do ciclo menstrual em populações clínicas e mulheres saudáveis.[30]
Apetite sexual[editar | editar código-fonte]
Quando a testosterona e as endorfinas no sêmen ejaculado encontram-se na parede cervical após a relação sexual, as fêmeas recebem um pico nos níveis de testosterona, endorfina e ocitocina, e os machos após o orgasmo durante a copulação experimentam um aumento nas endorfinas e um aumento acentuado nos níveis de ocitocina. Isso contribui para o ambiente fisiológico hospitaleiro no sistema reprodutivo interno feminino para engravidar e, mais tarde, nutrir o feto em estágios pré-embrionários, além de estimular os sentimentos de amor, desejo e cuidados paternos no homem (esse momento é o único momento em que os níveis de ocitocina do homem competem com os da mulher).[31]
A excitação sexual e a masturbação nas mulheres produzem pequenos aumentos nas concentrações de testosterona.[32] Os níveis plasmáticos de vários esteroides aumentam significativamente após a masturbação em homens e os níveis de testosterona se correlacionam com esses níveis.[33]
Estudos em mamíferos[editar | editar código-fonte]
Estudos realizados em ratos indicaram que o grau de excitação sexual é sensível a reduções na testosterona. Quando os ratos privados de testosterona receberam níveis médios de testosterona, seus comportamentos sexuais (copulação, preferência do parceiro, etc.) retomaram, mas não quando foram administradas pequenas quantidades do mesmo hormônio. Portanto, esses mamíferos podem fornecer um modelo para estudar populações clínicas entre humanos que sofrem de deficits de excitação sexual, como a disfunção erétil.[34]
Em todas as espécies de mamíferos examinadas, verificou-se um aumento acentuado no nível de testosterona do sexo masculino ao encontrar uma fêmea nova. A elevação da testosterona reflexiva em ratos machos está relacionada ao nível inicial de excitação sexual do macho.[35]
Em primatas não humanos, pode ser que a testosterona na puberdade estimule a excitação sexual, o que permite que o primata busque cada vez mais experiências sexuais com mulheres e, assim, cria uma preferência sexual para as mulheres.[36] Algumas pesquisas também indicaram que, se a testosterona for eliminada em um sistema masculino adulto ou de outro primata masculino adulto, sua motivação sexual diminui, mas não há diminuição correspondente na capacidade de se engajar na atividade sexual (montagem, ejaculação, etc.).[36]
Machos[editar | editar código-fonte]
Nos homens, níveis mais elevados de testosterona estão associados a períodos de atividade sexual.[37] A testosterona também aumentou em homens heterossexuais depois de ter tido uma breve conversa com uma mulher. O aumento nos níveis de testosterona foi associado ao grau que as mulheres achavam que os homens estavam tentando impressioná-las.[38]
Os homens que assistem a um filme sexualmente explícito apresentam um aumento médio de 35% na testosterona, atingindo um pico em 60 a 90 minutos após o final do filme, mas não se observa aumento nos homens que assistem filmes sexualmente neutros.[39] Os homens que assistem filmes sexualmente explícitos também relatam maior motivação, competitividade e menor exaustão.[40] Uma ligação também foi encontrada entre o relaxamento após a excitação sexual e os níveis de testosterona.[41]
Os níveis masculinos de testosterona, um hormônio conhecido por afetar o comportamento de acasalamento dos homens, muda dependendo se eles estão expostos a um odor corporal de mulher ovulante ou não-ovulante. Os homens expostos ao cheiro de mulheres ovulantes mantiveram um nível de testosterona estável maior que o nível de testosterona de homens expostos à odor de não-ovulação. Os níveis de testosterona e a excitação sexual nos homens são fortemente conscientes dos ciclos hormonais nas fêmeas.[42]
Os homens com limiares mais baixos para a excitação sexual têm maior probabilidade de atender a informações sexuais e que a testosterona pode funcionar, aumentando sua atenção para os estímulos relevantes.[43]
Fêmeas[editar | editar código-fonte]
Os andrógenos podem modular a fisiologia do tecido vaginal e contribuir para a excitação sexual genital feminina.[44] O nível de testosterona das mulheres é maior quando medido antes da relação sexual.[45]
Quando as mulheres têm um nível basal mais alto de testosterona, elas apresentam aumentos mais elevados nos níveis de excitação sexual, mas menores aumentos na testosterona, indicando um efeito de teto sobre os níveis de testosterona em fêmeas. Os pensamentos sexuais também alteram o nível de testosterona, mas não o nível de cortisol no corpo feminino, e os contraceptivos hormonais podem afetar a variação na resposta da testosterona aos pensamentos sexuais.[46]
A testosterona pode revelar-se um tratamento eficaz em transtornos de excitação sexual feminina,[47] e está disponível como remédio dérmico. A testosterona pode ser um tratamento para mulheres pós-menopáusicas, desde que efetivamente sejam estrogênizadas.[47]
Relações românticas[editar | editar código-fonte]
Apaixonar-se diminui os níveis de testosterona dos homens, aumentando os níveis de testosterona das mulheres. Tem havido especulações de que essas mudanças na testosterona resultam na redução temporária das diferenças de comportamento entre os sexos.[48] No entanto, sugere-se que, após a "fase de lua de mel" terminar - cerca de um a três anos em um relacionamento - essa mudança nos níveis de testosterona não é mais aparente.[48] Os homens que produzem menos testosterona são mais propensos a estar em um relacionamento[49] e/ou casados,[50] enquanto os homens que produzem mais testosterona são mais propensos a se divorciarem;[50] no entanto, a causalidade não pode ser determinada nessa correlação. Casamento ou compromisso pode causar uma diminuição nos níveis de testosterona.[51] Homens solteiros que não tiveram experiência de relacionamento têm níveis mais baixos de testosterona do que homens solteiros com experiência. Sugere-se que esses homens solteiros com experiência anterior estejam em um estado mais competitivo do que seus homólogos não-experientes.[52] Os homens casados que se envolvem em atividades de manutenção de títulos, como passar o dia com seu cônjuge e/ou criança, não têm níveis diferentes de testosterona em comparação com os momentos em que não se envolvem em tais atividades. Coletivamente, esses resultados sugerem que a presença de atividades competitivas em vez de atividades de manutenção de vínculo são mais relevantes para mudanças nos níveis de testosterona.[53]
Os homens que produzem mais testosterona são mais propensos a se engajar em sexo extraconjugal.[50] Os níveis de testosterona não dependem da presença física de uma parceira para homens que se envolvem em relações (mesma cidade versus longa distância), os homens têm níveis semelhantes de testosterona em todos os lugares.[49] A presença física pode ser necessária para as mulheres que estão em relacionamentos, onde as mulheres parceiras da mesma cidade têm níveis mais baixos de testosterona do que as mulheres parceiras de longa distância.[54]
Paternidade[editar | editar código-fonte]
A paternidade também diminui os níveis de testosterona nos homens, sugerindo que as mudanças emocionais e comportamentais resultantes promovam o cuidado paterno.[55] A forma como os níveis de testosterona mudam quando uma criança está em perigo é indicativa de estilos de paternidade. Se os níveis se reduzirem, então há mais empatia pelo pai do que nos pais cujos níveis aumentam.[56]
Comportamento e personalidade[editar | editar código-fonte]
Os níveis de testosterona desempenham um papel importante na tomada de riscos durante as decisões financeiras.[57][58]
Agressão e criminalidade[editar | editar código-fonte]
A maioria dos estudos apoia uma ligação entre a criminalidade adulta e a testosterona, embora o relacionamento seja modesto se for examinado separadamente para cada sexo. Quase todos os estudos de delinquência juvenil e testosterona não são significativos. A maioria dos estudos também encontrou testosterona associada a comportamentos ou traços de personalidade ligados à criminalidade, como comportamento anti-social e alcoolismo. Muitos estudos também foram feitos sobre a relação entre comportamentos/sentimentos agressivos mais gerais e testosterona. Cerca de metade dos estudos encontraram um relacionamento e cerca de metade sem relacionamento.[59]
A testosterona é apenas um dos muitos fatores que influenciam a agressão e os efeitos da experiência anterior e dos estímulos ambientais foram correlacionados mais fortemente. Estudos indicam que o estradiol derivado de testosterona (uma forma de estrogênio) pode desempenhar um papel importante na excessiva agressão masculina.[59][60][61][62] Estudos também descobriram que a testosterona facilita a agressão através da modulação de receptores de vasopressina no hipotálamo.[63]
O hormônio sexual pode incentivar um comportamento justo. Um experimento comportamental possibilitou que homens administrassem dinheiro e fizessem negociações/ofertas entre si. As regras permitiram ofertas justas e injustas. O parceiro de negociação poderia posteriormente aceitar ou recusar a oferta. Quanto mais justa a oferta, menos provável é a recusa do parceiro de negociação. Se nenhum acordo foi alcançado, nenhuma das partes ganhou nada. Os sujeitos de teste com um nível de testosterona artificialmente melhorado geralmente fizeram ofertas melhores e mais justas do que aqueles que receberam placebos. Dois estudos posteriores confirmaram empiricamente esses resultados.[64][65][66] No entanto, os homens com testosterona alta foram significativamente 27% menos generosos em um jogo de ultimato, enquanto os homens com a testosterona mais baixa foram 560% mais generosos.[67] Estudos também encontraram testosterona administrada para aumentar a agressão verbal e raiva em alguns participantes.[68]
A testosterona sintética está significativamente relacionada como forma de ganho muito mais rápido de massa muscular. A testosterona sintética na maioria das vezes tem como efeito adjacente a agressão excessiva e comportamento criminoso. Em competições físicas, desfiles masculinos, torneios de fisiculturismo e em academias de ginástica é relativamente comum o uso da testosterona sintética na forma de pó ou injetável, que leva a formação de músculos muito maiores em todo o corpo. Por serem músculos gerados sem o exercício tradicional para sua criação, a musculatura obtida por testosterona sintética não corresponde a mesma força física de uma musculatura natural. A testosterona medeia a atração de pistas cruéis e violentas nos homens, promovendo a exibição exagerada de força através de estímulos violentos.[69] O uso corriqueiro de testosterona sintética tende a reduzir a libido através da relação hipotálamo-hipófise-testicular diminuindo a produção de testosterona e hormônios naturais.Estudos realizados encontraram correlação direta entre excesso de testosterona, agressividade, suicídio e tentativa de dominância, especialmente entre os criminosos mais violentos da prisão, que apresentaram níveis mais altos de testosterona.[70]
A segunda teoria é semelhante e é conhecida como "teoria neuro-androgênica evolutiva (TNE) da agressão masculina".[71][72] A testosterona e outros andrógenos foram administrados para masculinizar um cérebro para serem competitivos, mesmo no ponto de arriscar danos à pessoa e aos outros. Ao fazê-lo, indivíduos com cérebros masculinizados como resultado da testosterona e dos andrógenos pré-natais e adultos aumentam suas habilidades de aquisição de recursos para sobreviver, atrair e copular com os companheiros, tanto quanto possível.[71] A masculinização do cérebro não é apenas mediada por níveis de testosterona no estágio adulto, mas também a exposição à testosterona no útero como feto. A testosterona pré-natal mais alta indicada por uma relação de baixo dígito, bem como os níveis de testosterona em adultos, aumentaram o risco de faltas ou agressões entre jogadores masculinos em um jogo de futebol.[73][74][75][76][77]
O aumento dos níveis de testosterona durante a competição previa a agressão em machos, mas não nas fêmeas.[78] Os sujeitos que interagiram com armas de mão e um jogo experimental mostraram aumento na testosterona e na agressão.[79] A seleção natural pode ter evoluído para que os machos sejam mais sensíveis às situações de desafio competitivo e estatal e que os papéis interativos da testosterona são o ingrediente essencial para o comportamento agressivo nessas situações.[80] A testosterona produz agressão ativando áreas subcorticais no cérebro, que também podem ser inibidas ou suprimidas por normas sociais ou situações familiares, enquanto ainda se manifestam em diversas intensidades e formas através de pensamentos, raiva, agressão verbal, competição, domínio e violência física.[81] A característica específica do cérebro estrutural da testosterona pode prever comportamento agressivo em indivíduos.[82] É conhecido que o estradiol se correlaciona com a agressão em camundongos masculinos.[83] Além disso, a conversão de testosterona em estradiol regula a agressão masculina nos pardais durante a época de reprodução.[84] Os ratos que receberam esteroides anabolizantes que aumentaram a testosterona também foram mais agressivos físicos à provocação como resultado da "sensibilidade à ameaça".[85]
Cérebro[editar | editar código-fonte]
O cérebro também é afetado por essa diferenciação sexual;[86] a enzima aromatase converte a testosterona em estradiol que é responsável pela masculinização do cérebro em camundongos masculinos. Nos seres humanos, a masculinização do cérebro fetal aparece — observando a preferência de gênero em pacientes com doenças congênitas de formação — por meio de andrógenos ou função de receptor de androgênio, para estar associada a receptores androgênicos funcionais.[86]
Existem algumas diferenças entre um cérebro masculino e feminino (possivelmente o resultado de diferentes níveis de testosterona), sendo um deles tamanho: o cérebro humano masculino é, em média, maior.[87] Considerou-se que os homens tinham um comprimento total de fibras de 176.000 km aos 20 anos, enquanto que nas mulheres o comprimento total era de 149.000 km (aproximadamente 15% menos).[88]
Além da agressividade excessiva e musculatura, não foram encontrados efeitos imediatos a curto prazo sobre o humor ou o comportamento na administração de doses supra-fisiológicas de testosterona por 10 semanas em 43 homens saudáveis.[89] Existe uma correlação entre a testosterona e a tolerância ao risco na escolha da carreira entre as mulheres.[90]
A atenção, a memória e a capacidade espacial são funções cognitivas importantes afetadas pela testosterona em seres humanos. Evidências preliminares sugerem que níveis baixos de testosterona podem ser um fator de risco para o declínio cognitivo e, possivelmente, para a demência (como a doença de Alzheimer).[91][92][93]
Diminuição no pós Covid-19[editar | editar código-fonte]
Devido ao tropismo do vírus em células neuronais e células germinativas, além das respiratórias incluindo neurônios olfativos, estudos confirmaram diminuição de testosterona nos humanos após a pandemia do covid-19.[94][95][96][97]
"mRNA viral foi identificado no sêmen de homens infectados, com alguma evidência de parâmetros seminais alterados. Baixa testosterona e di-hidrotestosterona com hormônio luteinizante elevado foram relatados, bem como parto prematuro em mulheres grávidas"
Bioquímica[editar | editar código-fonte]

Biossíntese[editar | editar código-fonte]
Como outros hormônios esteroides, a testosterona é derivada do colesterol (ver figura).[98] O primeiro passo na biossíntese envolve a clivagem oxidativa da cadeia lateral do colesterol pela enzima de clivagem da cadeia lateral do colesterol (P450scc, CYP11A1), uma citocromo P450 oxidase mitocondrial com a perda de seis átomos de carbono para dar pregnenolona. No passo seguinte, dois átomos de carbono adicionais são removidos pela enzima CYP17A1 (17alfa-hidroxilase / 17,20-liasa) no retículo endoplasmático para produzir uma variedade de esteroides C19.[99] Além disso, o grupo 3p-hidroxilo é oxidado pela 3β-hidroxiesteroide desidrogenase para produzir androstenediona. Na etapa de limitação final e de taxa, o grupo ceto C17 androstenediona é reduzido pela 17β-hidroxiesteroide desidrogenase para produzir testosterona.[100]
Regulação[editar | editar código-fonte]
Nos machos, a testosterona é sintetizada principalmente em células de Leydig. O número de células de Leydig por sua vez é regulado pelo hormônio luteinizante (LH) e hormônio folículo-estimulante (FSH). Além disso, a quantidade de testosterona produzida por células existentes de Leydig está sob o controle do LH, que por sua vez regula a enzima 17β-hidroxiesteroide desidrogenase.[101]
A quantidade de testosterona natural é regulada pelo eixo HHT/HPT (hipotálamo-hipófise-testicular), sendo estas duas glândulas que estão localizadas na região medio-frontal do cérebro, responsáveis pelo início do processo metabólico da produção e homeostase dos níveis de testosterona.[102] Quando os níveis de testosterona são baixos, o hormônio liberador de gonadotropina (GnRH) é liberado pelo hipotálamo, o que, por sua vez, estimula a glândula pituitária para liberar FSH e LH. Estes dois últimos hormônios estimulam o testículo a sintetizar a testosterona. Finalmente, os níveis de testosterona aumentam e, ao perceber o aumento, a testosterona manda um feedback negativo para o hipotálamo, que por sua vez inibe o GnRH e por consequência o LH e FSH.[102]

Fatores que afetam os níveis de testosterona podem incluir:
- Idade: os níveis de testosterona diminuem gradualmente à medida que os homens envelhecem.[103][104] Este efeito às vezes é referido como hipogonadismo de andropausa ou início tardio.[105]
- Exercício: o treinamento de resistência aumenta os níveis de testosterona,[106] no entanto, em homens mais velhos, esse aumento pode ser evitado pela ingestão de proteínas.[107] O treinamento de resistência nos homens pode levar a menores níveis de testosterona.[108]
- Nutrientes: a deficiência de vitamina A pode levar a níveis de testosterona plasmática insatisfatórios.[109] A vitamina D suplementada em níveis de 3000-3500 UI/d (75-87,5 μg/d) aumenta os níveis de testosterona.[110] A deficiência de zinco diminui os níveis de testosterona,[111] mas o excesso de suplementação não tem efeito sobre a testosterona sérica.[112]
- Perda de peso: redução de peso pode resultar em aumento nos níveis de testosterona. As células de gordura sintetizam a enzima aromatase, que converte a testosterona, o hormônio sexual masculino, no estradiol, o hormônio sexual feminino.[113] No entanto, não foi encontrada associação clara entre o índice de massa corporal e os níveis de testosterona.[114]
- Diversos: Sono: aumenta os níveis noturnos de testosterona.[115] Comportamento: os desafios de dominância podem, em alguns casos, estimular o aumento da liberação de testosterona em homens.[116] Drogas: anti-androgênios naturais ou artificiais, incluindo a hortelã-verde, reduzem os níveis de testosterona.[117][118][119] O alcaçuz pode diminuir a produção de testosterona e este efeito é maior nas fêmeas.[120]
Distribuição[editar | editar código-fonte]
No plasma, 98% da testosterona é ligada à proteína, com 65% ligada à globulina ligadora de hormônios sexuais (SHBG) e 33% ligada à albumina.[121] Nível plasmático de testosterona no corpo (livre ou vinculado): 10,4-24,3 nmol / L em homens adultos.[carece de fontes]Em mulheres: 30-70 ng / dL.
Metabolismo[editar | editar código-fonte]
Tanto a testosterona como 5alfa-di-hidrotestosterona são metabolizadas principalmente no fígado.[1][122] Mais de 40% de testosterona é metabolizada em proporções iguais nos 17-cetetosteróides androsterona e etiocolanolona através das ações combinadas de 5α e 5β-reductases, 3a-hidroxiesteróide desidrogenase e 17β-HSD, nessa ordem.[1][122][123] A androsterona e a etioncolanolona são então glucuronizadas e, em menor grau, sulfatadas de forma semelhante à testosterona.[1][122] Os conjugados de testosterona e seus metabólitos hepáticos são liberados do fígado para circulação e excretados na urina e na bile.[1][122][123] Apenas uma pequena fração (2%) de testosterona é excretada inalterada na urina.[122]
Além da conjugação da via 17-ketoesteroide, a testosterona também pode ser hidroxilada e oxidada no fígado por enzimas do citocromo P450, incluindo CYP3A4, CYP3A5, CYP2C9, CYP2C19, e CYP2D6.[124] Certas enzimas do citocromo P450 como CYP2C9 e CYP2C19 também podem oxidar a testosterona na posição C17 para formar androstenediona.[124]
Dois dos metabolitos imediatos da testosterona, 5alfa-di-hidrotestosterona e estradiol são biologicamente importantes e podem ser formados no fígado e nos tecidos extrahepáticos.[122] Aproximadamente 5 a 7% da testosterona é convertida pela 5-alfarredutase em 5-alfadihidrotestosterona, com níveis circulantes de 5α-DHT cerca de 10% da testosterona e aproximadamente 0,3% de testosterona é convertida em estradiol pela aromatase.[122][125][126] A 5α-reductase é altamente expressa nos órgãos reprodutores masculinos (incluindo a glândula prostática e vesículas seminais),[127] a pele, os folículos capilares, o cérebro[128] e a aromatase é altamente expressa no tecido adiposo, osso e cérebro.[129][130]
Mecanismo de ação[editar | editar código-fonte]
Atividade hormonal esteroidal[editar | editar código-fonte]
Os efeitos da testosterona em seres humanos e outros vertebrados ocorrem por meio de mecanismos múltiplos: por ativação do receptor de andrógenos (diretamente ou como DHT), por conversão em estradiol e ativação de certos receptores de estrogênio.[131][132] Os andrógenos, como a testosterona, também foram encontrados para se ligar e ativar os receptores de andrógenos da membrana.[133][134][135]
A testosterona livre (TL) é transportada para o citoplasma das células do tecido alvo, onde pode se ligar ao receptor de andrógenos, ou pode ser reduzida à 5α-dihidrotestosterona (DHT) pela enzima citoplasmática 5a-redutase. A DHT liga-se ao mesmo receptor de andrógenos ainda mais forte do que a testosterona, de modo que sua potência androgênica é cerca de 5 vezes a de TL.[136] O receptor TL ou o receptor DHT sofrem uma mudança estrutural que permite que ele se mova para o núcleo da célula e se ligue diretamente a sequências de nucleótidos específicas do DNA cromossômico. As áreas de ligação são chamadas de elementos de resposta hormonal (ERHs) e influenciam a atividade transcricional de certos genes, produzindo os efeitos androgênicos.
Os receptores de andrógenos ocorrem em vários tecidos diferentes do sistema de vertebrados, e tanto os machos quanto as fêmeas respondem de forma semelhante a níveis similares. Quantidades bastante diferentes de testosterona pré-natal, na puberdade e ao longo da vida representam uma parcela das diferenças biológicas entre machos e fêmeas.
Os ossos e o cérebro são dois tecidos importantes nos seres humanos, onde o efeito primário da testosterona é por meio de aromatização ao estradiol. Nos ossos, o estradiol acelera a ossificação da cartilagem no osso, levando ao fechamento das epífises e à conclusão do crescimento. No sistema nervoso central, a testosterona é aromatizada em estradiol. Estradiol em vez de testosterona é o sinal de feedback mais importante para o hipotálamo (especialmente afetando a secreção de LH).[137]
História[editar | editar código-fonte]
Uma ação testicular foi vinculada a frações circulantes de sangue - agora entendida como uma família de hormônios androgênicos - nos primeiros trabalhos sobre castração e transplante testicular em aves de Arnold Adolph Berthold (1803–1861).[138] A pesquisa sobre a ação da testosterona recebeu um breve impulso em 1889, quando o professor de Harvard Charles-Édouard Brown-Séquard (1817–1894), então em Paris, auto-injetou um "elixir rejuvenescedor" composto por um extrato de cão e guiné testículo de porco. Ele relatou em The Lancet que seu vigor e sentimento de bem-estar foram marcadamente restaurados, mas os efeitos eram transitórios,[139] e as esperanças de Brown-Séquard para o composto estavam tracejadas. Sofrendo o ridículo de seus colegas, ele abandonou seu trabalho sobre os mecanismos e efeitos dos andrógenos em seres humanos.
Em 1927, o professor de química fisiológica da Universidade de Chicago, Fred C. Koch, estabeleceu fácil acesso à uma grande fonte de testículos bovinos - os armazéns de Chicago - e recrutou alunos dispostos a suportar o tedioso trabalho de extração de seus isolados. Nesse ano, Koch e seu estudante, Lemuel McGee, deram 20 mg de uma substância (equivalente à 40 libras de testículos bovinos) que, quando administrados a galos castrados, porcos e ratos, os re-masculinizavam.[140] O grupo de Ernest Laqueur na Universidade de Amsterdã testou a testosterona de testículos bovinos de forma semelhante em 1934, mas o isolamento do hormônio dos tecidos animais em quantidades que permitem estudos sérios em seres humanos não era viável até três gigantes farmacêuticos europeus - Schering (Berlim, Alemanha), Organon (Oss, Holanda) e Ciba (Basileia, Suíça) - iniciaram programas de pesquisa e desenvolvimento de esteroides em grande escala na década de 1930.

Prêmio Nobel, Leopold Ruzicka da Ciba, gigante da indústria farmacêutica que sintetizou testosterona.
O grupo Organon na Holanda foi o primeiro a isolar o hormônio, identificado em um artigo de maio de 1935 intitulado "On Crystalline Male Hormone from Testicles (Testosterone)".[141] Eles chamaram o hormônio de testosterona — das hastes de testículo e esterol, e o sufixo de cetona. A estrutura foi elaborada pelo Adolf Butenandt, da Schering, no Instituto Chemisches da Universidade Técnica de Gdansk.[142][143]
A síntese química da testosterona do colesterol foi alcançada em agosto desse ano por Butenandt e Hanisch.[144] Apenas uma semana depois, o grupo Ciba em Zurique, Leopold Ruzicka (1887-1976) e A. Wettstein, publicaram sua síntese de testosterona.[145] Essas sínteses parciais independentes de testosterona a partir de uma base de colesterol fizeram Butenandt e Ruzicka ganharem o Prêmio Nobel de Química em 1939. A testosterona foi identificada como 17p-hidroxiandrost-4-en-3-ona (C19H28O2), um álcool policíclico sólido com um grupo hidroxilo no 17º átomo de carbono. Isto também tornou óbvio que poderiam ser feitas modificações adicionais na testosterona sintetizada, isto é, esterificação e alquilação.
A síntese parcial na década de 1930 de ésteres de testosterona abundantes e potentes permitiu a caracterização dos efeitos do hormônio, de modo que Kochakian e Murlin (1936) puderam mostrar que a testosterona aumentava a retenção de nitrogênio (um mecanismo central para o anabolismo) no cão. O grupo de Allan Kenyon[146] foi capaz de demonstrar os efeitos anabolizantes e androgênicos do propionato de testosterona em homens eunucos, meninos e mulheres. O período do início da década de 1930 até a década de 1950 foi denominado "A Era de Ouro da Química de Esteroides"[147] e o trabalho durante esse período avançou rapidamente. A pesquisa nesta idade de ouro provou que este composto recém-sintetizado - testosterona - ou melhor, família de compostos (para muitos derivados desenvolvidos de 1940 a 1960), foi um poderoso multiplicador de músculos, força e bem-estar.[148]
Ver também[editar | editar código-fonte]
- Andropausa
- Axila
- Estrogênio
- Pelo
- Pelo púbico
- Pelos abdominais
- Puberdade
- Terapia de reposição hormonal
Referências
- ↑ a b c d e Mooradian AD, Morley JE, Korenman SG (Fevereiro de 1987). «Biological actions of androgens». Endocrine Reviews. 8 (1): 1–28. PMID 3549275. doi:10.1210/edrv-8-1-1
- ↑ a b Bassil N, Alkaade S, Morley JE (junho de 2009). «The benefits and risks of testosterone replacement therapy: a review». Therapeutics and Clinical Risk Management. 5 (3): 427–48. PMC 2701485
 . PMID 19707253
. PMID 19707253
- ↑ Tuck SP, Francis RM (2009). «Testosterone, bone and osteoporosis». Frontiers of Hormone Research. Frontiers of Hormone Research. 37: 123–32. ISBN 978-3-8055-8622-1. PMID 19011293. doi:10.1159/000176049
- ↑ a b Torjesen PA, Sandnes L (março de 2004). «Serum testosterone in women as measured by an automated immunoassay and a RIA». Clinical Chemistry. 50 (3): 678; author reply 678–9. PMID 14981046. doi:10.1373/clinchem.2003.027565
- ↑ Luetjens CM, Weinbauer GF (2012). «Chapter 2: Testosterone: Biosynthesis, transport, metabolism and (non-genomic) actions». In: Nieschlag E, Behre HM, Nieschlag S. Testosterone: Action, Deficiency, Substitution 4th ed. Cambridge: Cambridge University Press. pp. 15–32. ISBN 978-1-107-01290-5
- ↑ Southren AL, Gordon GG, Tochimoto S, Pinzon G, Lane DR, Stypulkowski W (Maio de 1967). «Mean plasma concentration, metabolic clearance and basal plasma production rates of testosterone in normal young men and women using a constant infusion procedure: effect of time of day and plasma concentration on the metabolic clearance rate of testosterone». The Journal of Clinical Endocrinology and Metabolism. 27 (5): 686–94. PMID 6025472. doi:10.1210/jcem-27-5-686
- ↑ Southren AL, Tochimoto S, Carmody NC, Isurugi K (novembro de 1965). «Plasma production rates of testosterone in normal adult men and women and in patients with the syndrome of feminizing testes». The Journal of Clinical Endocrinology and Metabolism. 25 (11): 1441–50. PMID 5843701. doi:10.1210/jcem-25-11-1441
- ↑ Dabbs M, Dabbs JM (2000). Heroes, rogues, and lovers: testosterone and behavior. New York: McGraw-Hill. ISBN 0-07-135739-4
- ↑ Sheffield-Moore M (2000). «Androgens and the control of skeletal muscle protein synthesis». Annals of Medicine. 32 (3): 181–6. PMID 10821325. doi:10.3109/07853890008998825
- ↑ Handelsman DJ (Janeiro de 2013). «Androgen Physiology, Pharmacology and Abuse». Endotext [Internet]. WWW.ENDOTEXT.ORG. [S.l.]: MDText.com, Inc
- ↑ Swaab DF, Garcia-Falgueras A (2009). «Sexual differentiation of the human brain in relation to gender identity and sexual orientation». Functional Neurology. 24 (1): 17–28. PMID 19403051
- ↑ Browne KR (2002). Biology at work: rethinking sexual equality. New Brunswick, N.J: Rutgers University Press. p. 112. ISBN 0-8135-3053-9
- ↑ Corbier P, Edwards DA, Roffi J (1992). «The neonatal testosterone surge: a comparative study». Archives Internationales de Physiologie, de Biochimie et de Biophysique. 100 (2): 127–31. PMID 1379488. doi:10.3109/13813459209035274
- ↑ Forest MG, Cathiard AM, Bertrand JA (julho de 1973). «Evidence of testicular activity in early infancy». The Journal of Clinical Endocrinology and Metabolism. 37 (1): 148–51. PMID 4715291. doi:10.1210/jcem-37-1-148
- ↑ Dakin CL, Wilson CA, Kalló I, Coen CW, Davies DC (Maio de 2008). «Neonatal stimulation of 5-HT(2) receptors reduces androgen receptor expression in the rat anteroventral periventricular nucleus and sexually dimorphic preoptic area». The European Journal of Neuroscience. 27 (9): 2473–80. PMID 18445234. doi:10.1111/j.1460-9568.2008.06216.x
- ↑ Kalat JW (2009). «Reproductive behaviors». Biological psychology. Belmont, Calif: Wadsworth, Cengage Learning. p. 321. ISBN 0-495-60300-7
- ↑ a b Pinyerd B, Zipf WB (2005). «Puberty-timing is everything!». Journal of Pediatric Nursing. 20 (2): 75–82. PMID 15815567. doi:10.1016/j.pedn.2004.12.011
- ↑ Ganong (2012). Ganong's Review of Medical Physiology 24 ed. [S.l.]: TATA McGRAW Hill. pp. 423–25. ISBN 978-1-25-902753-6
- ↑ Raggatt LJ, Partridge NC (2010). «Cellular and molecular mechanisms of bone remodeling». The Journal of Biological Chemistry. 285 (33): 25103–8. PMC 2919071
 . PMID 20501658. doi:10.1074/jbc.R109.041087
. PMID 20501658. doi:10.1074/jbc.R109.041087
- ↑ Kelsey TW, Li LQ, Mitchell RT, Whelan A, Anderson RA, Wallace WH (8 de Outubro de 2014). «A validated age-related normative model for male total testosterone shows increasing variance but no decline after age 40 years». PLoS One. 9 (10): e109346. Bibcode:2014PLoSO...9j9346K. PMC 4190174
 . PMID 25295520. doi:10.1371/journal.pone.0109346
. PMID 25295520. doi:10.1371/journal.pone.0109346
- ↑ Mehta PH, Jones AC, Josephs RA (junho de 2008). «The social endocrinology of dominance: basal testosterone predicts cortisol changes and behavior following victory and defeat» (PDF). Journal of Personality and Social Psychology. 94 (6): 1078–93. PMID 18505319. doi:10.1037/0022-3514.94.6.1078. Consultado em 14 de novembro de 2017. Arquivado do original (PDF) em 19 de abril de 2009
- ↑ Ajayi AA, Halushka PV (Maio de 2005). «Castration reduces platelet thromboxane A2 receptor density and aggregability». QJM. 98 (5): 349–56. PMID 15820970. doi:10.1093/qjmed/hci054
- ↑ Ajayi AA, Mathur R, Halushka PV (junho de 1995). «Testosterone increases human platelet thromboxane A2 receptor density and aggregation responses». Circulation. 91 (11): 2742–7. PMID 7758179. doi:10.1161/01.CIR.91.11.2742
- ↑ Rhoden EL, Averbeck MA, Teloken PE (Setembro de 2008). «Androgen replacement in men undergoing treatment for prostate cancer». The Journal of Sexual Medicine. 5 (9): 2202–08. PMID 18638000. doi:10.1111/j.1743-6109.2008.00925.x
- ↑ Morgentaler A, Traish AM (Fevereiro de 2009). «Shifting the paradigm of testosterone and prostate cancer: the saturation model and the limits of androgen-dependent growth». European Urology. 55 (2): 310–20. PMID 18838208. doi:10.1016/j.eururo.2008.09.024
- ↑ Morgentaler A, Schulman C (2009). «Testosterone and prostate safety». Frontiers of Hormone Research. Frontiers of Hormone Research. 37: 197–203. ISBN 978-3-8055-8622-1. PMID 19011298. doi:10.1159/000176054
- ↑ Haddad RM, Kennedy CC, Caples SM, Tracz MJ, Boloña ER, Sideras K, Uraga MV, Erwin PJ, Montori VM (janeiro de 2007). «Testosterone and cardiovascular risk in men: a systematic review and meta-analysis of randomized placebo-controlled trials». Mayo Clinic Proceedings. 82 (1): 29–39. PMID 17285783. doi:10.4065/82.1.29
- ↑ Jones TH, Saad F (Dezembro de 2009). «The effects of testosterone on risk factors for, and the mediators of, the atherosclerotic process». Atherosclerosis. 207 (2): 318–27. PMID 19464009. doi:10.1016/j.atherosclerosis.2009.04.016
- ↑ Stanworth RD, Jones TH (2008). «Testosterone for the aging male; current evidence and recommended practice». Clinical Interventions in Aging. 3 (1): 25–44. PMC 2544367
 . PMID 18488876
. PMID 18488876
- ↑ Van Anders SM, Watson NV (2006). «Menstrual cycle irregularities are associated with testosterone levels in healthy premenopausal women». American Journal of Human Biology. 18 (6): 841–44. PMID 17039468. doi:10.1002/ajhb.20555
- ↑ Fox CA, Ismail AA, Love DN, Kirkham KE, Loraine JA (janeiro de 1972). «Studies on the relationship between plasma testosterone levels and human sexual activity». The Journal of Endocrinology. 52 (1): 51–8. PMID 5061159. doi:10.1677/joe.0.0520051
- ↑ Exton MS, Bindert A, Krüger T, Scheller F, Hartmann U, Schedlowski M (1999). «Cardiovascular and endocrine alterations after masturbation-induced orgasm in women». Psychosomatic Medicine. 61 (3): 280–89. PMID 10367606. doi:10.1097/00006842-199905000-00005
- ↑ Purvis K, Landgren BM, Cekan Z, Diczfalusy E (Setembro de 1976). «Endocrine effects of masturbation in men». The Journal of Endocrinology. 70 (3): 439–44. PMID 135817. doi:10.1677/joe.0.0700439
- ↑ Harding SM, Velotta JP (Maio de 2011). «Comparing the relative amount of testosterone required to restore sexual arousal, motivation, and performance in male rats». Hormones and Behavior. 59 (5): 666–73. PMID 20920505. doi:10.1016/j.yhbeh.2010.09.009
- ↑ James PJ, Nyby JG, Saviolakis GA (Setembro de 2006). «Sexually stimulated testosterone release in male mice (Mus musculus): roles of genotype and sexual arousal». Hormones and Behavior. 50 (3): 424–31. PMID 16828762. doi:10.1016/j.yhbeh.2006.05.004
- ↑ a b Wallen K (Setembro de 2001). «Sex and context: hormones and primate sexual motivation». Hormones and Behavior. 40 (2): 339–57. PMID 11534996. doi:10.1006/hbeh.2001.1696
- ↑ Kraemer HC, Becker HB, Brodie HK, Doering CH, Moos RH, Hamburg DA (março de 1976). «Orgasmic frequency and plasma testosterone levels in normal human males». Archives of Sexual Behavior. 5 (2): 125–32. PMID 1275688. doi:10.1007/BF01541869
- ↑ Roney JR, Mahler SV, Maestripieri D (2003). «Behavioral and hormonal responses of men to brief interactions with women». Evolution and Human Behavior. 24 (6): 365–75. doi:10.1016/S1090-5138(03)00053-9
- ↑ Pirke KM, Kockott G, Dittmar F (novembro de 1974). «Psychosexual stimulation and plasma testosterone in man». Archives of Sexual Behavior. 3 (6): 577–84. PMID 4429441. doi:10.1007/BF01541140
- ↑ Hellhammer DH, Hubert W, Schürmeyer T (1985). «Changes in saliva testosterone after psychological stimulation in men». Psychoneuroendocrinology. 10 (1): 77–81. PMID 4001279. doi:10.1016/0306-4530(85)90041-1
- ↑ Rowland DL, Heiman JR, Gladue BA, Hatch JP, Doering CH, Weiler SJ (1987). «Endocrine, psychological and genital response to sexual arousal in men». Psychoneuroendocrinology. 12 (2): 149–58. PMID 3602262. doi:10.1016/0306-4530(87)90045-X
- ↑ Miller SL, Maner JK (Fevereiro de 2010). «Scent of a woman: men's testosterone responses to olfactory ovulation cues». Psychological Science. 21 (2): 276–83. PMID 20424057. doi:10.1177/0956797609357733
- ↑ Alexander GM, Sherwin BB (Setembro de 1991). «The association between testosterone, sexual arousal, and selective attention for erotic stimuli in men». Hormones and Behavior. 25 (3): 367–81. PMID 1937428. doi:10.1016/0018-506X(91)90008-6
- ↑ Traish AM, Kim N, Min K, Munarriz R, Goldstein I (Abril de 2002). «Role of androgens in female genital sexual arousal: receptor expression, structure, and function». Fertility and Sterility. 77 Suppl 4: S11–8. PMID 12007897. doi:10.1016/s0015-0282(02)02978-3
- ↑ van Anders SM, Hamilton LD, Schmidt N, Watson NV (Abril de 2007). «Associations between testosterone secretion and sexual activity in women». Hormones and Behavior. 51 (4): 477–82. PMID 17320881. doi:10.1016/j.yhbeh.2007.01.003
- ↑ Goldey KL, van Anders SM (Maio de 2011). «Sexy thoughts: effects of sexual cognitions on testosterone, cortisol, and arousal in women». Hormones and Behavior. 59 (5): 754–64. PMID 21185838. doi:10.1016/j.yhbeh.2010.12.005
- ↑ a b Bolour S, Braunstein G (2005). «Testosterone therapy in women: a review». International Journal of Impotence Research. 17 (5): 399–408. PMID 15889125. doi:10.1038/sj.ijir.3901334
- ↑ a b Marazziti D, Canale D (Agosto de 2004). «Hormonal changes when falling in love». Psychoneuroendocrinology. 29 (7): 931–36. PMID 15177709. doi:10.1016/j.psyneuen.2003.08.006
- ↑ a b van Anders SM, Watson NV (julho de 2006). «Relationship status and testosterone in North American heterosexual and non-heterosexual men and women: cross-sectional and longitudinal data». Psychoneuroendocrinology. 31 (6): 715–23. PMID 16621328. doi:10.1016/j.psyneuen.2006.01.008
- ↑ a b c Booth A, Dabbs JM (1993). «Testosterone and Men's Marriages». Social Forces. 72 (2): 463–77. doi:10.1093/sf/72.2.463
- ↑ Mazur A, Michalek J (1998). «Marriage, Divorce, and Male Testosterone». Social Forces. 77 (1): 315–30. doi:10.1093/sf/77.1.315
- ↑ Gray PB, Chapman JF, Burnham TC, McIntyre MH, Lipson SF, Ellison PT (junho de 2004). «Human male pair bonding and testosterone». Human Nature. 15 (2): 119–31. PMID 26190409. doi:10.1007/s12110-004-1016-6
- ↑ Gray PB, Campbell BC, Marlowe FW, Lipson SF, Ellison PT (Outubro de 2004). «Social variables predict between-subject but not day-to-day variation in the testosterone of US men». Psychoneuroendocrinology. 29 (9): 1153–62. PMID 15219639. doi:10.1016/j.psyneuen.2004.01.008
- ↑ van Anders SM, Watson NV (Fevereiro de 2007). «Testosterone levels in women and men who are single, in long-distance relationships, or same-city relationships». Hormones and Behavior. 51 (2): 286–91. PMID 17196592. doi:10.1016/j.yhbeh.2006.11.005
- ↑ Berg SJ, Wynne-Edwards KE (junho de 2001). «Changes in testosterone, cortisol, and estradiol levels in men becoming fathers». Mayo Clinic Proceedings. 76 (6): 582–92. PMID 11393496. doi:10.4065/76.6.582
- ↑ «Parenting Skills Influenced by Testosterone Levels, Empathy». Psych Central.com. Consultado em 2 de novembro de 2015
- ↑ Sapienza P, Zingales L, Maestripieri D (Setembro de 2009). «Gender differences in financial risk aversion and career choices are affected by testosterone». Proceedings of the National Academy of Sciences of the United States of America. 106 (36): 15268–73. Bibcode:2009PNAS..10615268S. PMC 2741240
 . PMID 19706398. doi:10.1073/pnas.0907352106
. PMID 19706398. doi:10.1073/pnas.0907352106
- ↑ Apicella CL, Dreber A, Campbell B, Gray PB, Hoffman M, Little AC (Novembro de 2008). «Testosterone and financial risk preferences». Evolution and Human Behavior. 29 (6): 384–90. doi:10.1016/j.evolhumbehav.2008.07.001
- ↑ a b Wright J, Ellis L, Beaver K (2009). Handbook of crime correlates. San Diego: Academic Press. pp. 208–10. ISBN 0-12-373612-9
- ↑ Goldman D, Lappalainen J, Ozaki N. Direct analysis of candidate genes in impulsive disorders. In: Bock G, Goode J, eds. Genetics of Criminal and Antisocial Behaviour. Ciba Foundation Symposium 194. Chichester: John Wiley & Sons; 1996.
- ↑ Coccaro E (1996). «Neurotransmitter correlates of impulsive aggression in humans. In: Ferris C, Grisso T, eds. Understanding Aggressive Behaviour inn Children». Annals of the New York Academy of Sciences. 794: 82–89. Bibcode:1996NYASA.794...82C. PMID 8853594. doi:10.1111/j.1749-6632.1996.tb32511.x
- ↑ Finkelstein JW, Susman EJ, Chinchilli VM, Kunselman SJ, D'Arcangelo MR, Schwab J, Demers LM, Liben LS, Lookingbill G, Kulin HE (1997). «Estrogen or testosterone increases self-reported aggressive behaviors in hypogonadal adolescents». Journal of Clinical Endocrinology and Metabolism. 82 (8): 2433–38. PMID 9253313. doi:10.1210/jcem.82.8.4165
- ↑ Delville Y, Mansour KM, Ferris CF (Julho de 1996). «Testosterone facilitates aggression by modulating vasopressin receptors in the hypothalamus». Physiology & Behavior. 60 (1): 25–9. PMID 8804638. doi:10.1016/0031-9384(95)02246-5
- ↑ Eisenegger C, Naef M, Snozzi R, Heinrichs M, Fehr E (2010). «Prejudice and truth about the effect of testosterone on human bargaining behaviour». Nature. 463 (7279): 356–59. Bibcode:2010Natur.463..356E. PMID 19997098. doi:10.1038/nature08711
- ↑ van Honk J, Montoya ER, Bos PA, van Vugt M, Terburg D (maio de 2012). «New evidence on testosterone and cooperation». Nature. 485 (7399): E4–5; discussion E5–6. Bibcode:2012Natur.485E...4V. PMID 22622587. doi:10.1038/nature11136
- ↑ Eisenegger C, Naef M, Snozzi R, Heinrichs M, Fehr E (2012). «Eisenegger et al. reply». Nature. 485 (7399): E5–E6. Bibcode:2012Natur.485E...5E. doi:10.1038/nature11137
- ↑ Zak PJ, Kurzban R, Ahmadi S, Swerdloff RS, Park J, Efremidze L, Redwine K, Morgan K, Matzner W (1 de janeiro de 2009). «Testosterone administration decreases generosity in the ultimatum game». PLoS ONE. 4 (12): e8330. Bibcode:2009PLoSO...4.8330Z. PMC 2789942
 . PMID 20016825. doi:10.1371/journal.pone.0008330
. PMID 20016825. doi:10.1371/journal.pone.0008330
- ↑ von der PB, Sarkola T, Seppa K, Eriksson CJ (Setembro de 2002). «Testosterone, 5 alpha-dihydrotestosterone and cortisol in men with and without alcohol-related aggression». Journal of Studies on Alcohol. 63 (5): 518–26. PMID 12380846. doi:10.15288/jsa.2002.63.518
- ↑ Weierstall R, Moran J, Giebel G, Elbert T (1 de maio de 2014). «Testosterone reactivity and identification with a perpetrator or a victim in a story are associated with attraction to violence-related cues». International Journal of Law and Psychiatry. 37 (3): 304–12. PMID 24367977. doi:10.1016/j.ijlp.2013.11.016
- ↑ Archer J (2006). «Testosterone and human aggression: an evaluation of the challenge hypothesis» (PDF). Neuroscience and Biobehavioral Reviews. 30 (3): 319–45. PMID 16483890. doi:10.1016/j.neubiorev.2004.12.007. Arquivado do original (PDF) em 9 de janeiro de 2016
- ↑ a b Ellis L, Hoskin AW (2015). «The evolutionary neuroandrogenic theory of criminal behavior expanded». Aggression and Violent Behavior. 24: 61–74. doi:10.1016/j.avb.2015.05.002
- ↑ Hoskin AW, Ellis L (2015). «Fetal Testosterone and Criminality: Test of Evolutionary Neuroandrogenic Theory». Criminology. 53 (1): 54–73. doi:10.1111/1745-9125.12056
- ↑ Perciavalle V, Di Corrado D, Petralia MC, Gurrisi L, Massimino S, Coco M (junho de 2013). «The second-to-fourth digit ratio correlates with aggressive behavior in professional soccer players». Molecular Medicine Reports. 7 (6): 1733–38. PMC 3694562
 . PMID 23588344. doi:10.3892/mmr.2013.1426
. PMID 23588344. doi:10.3892/mmr.2013.1426
- ↑ Benderlioglu Z, Nelson RJ (Dezembro de 2004). «Digit length ratios predict reactive aggression in women, but not in men». Hormones and Behavior. 46 (5): 558–64. PMID 15555497. doi:10.1016/j.yhbeh.2004.06.004
- ↑ Liu J, Portnoy J, Raine A (Agosto de 2012). «Association between a marker for prenatal testosterone exposure and externalizing behavior problems in children». Development and Psychopathology. 24 (3): 771–82. PMC 4247331
 . PMID 22781854. doi:10.1017/S0954579412000363
. PMID 22781854. doi:10.1017/S0954579412000363
- ↑ Butovskaya M, Burkova V, Karelin D, Fink B (1 de outubro de 2015). «Digit ratio (2D:4D), aggression, and dominance in the Hadza and the Datoga of Tanzania». American Journal of Human Biology. 27 (5): 620–27. PMID 25824265. doi:10.1002/ajhb.22718
- ↑ Joyce CW, Kelly JC, Chan JC, Colgan G, O'Briain D, Mc Cabe JP, Curtin W (novembro de 2013). «Second to fourth digit ratio confirms aggressive tendencies in patients with boxers fractures». Injury. 44 (11): 1636–39. PMID 23972912. doi:10.1016/j.injury.2013.07.018
- ↑ Carré JM, Olmstead NA (Fevereiro de 2015). «Social neuroendocrinology of human aggression: examining the role of competition-induced testosterone dynamics» (PDF). Neuroscience. 286: 171–86. PMID 25463514. doi:10.1016/j.neuroscience.2014.11.029
- ↑ Klinesmith J, Kasser T, McAndrew FT (julho de 2006). «Guns, testosterone, and aggression: an experimental test of a mediational hypothesis». Psychological Science. 17 (7): 568–71. PMID 16866740. doi:10.1111/j.1467-9280.2006.01745.x
- ↑ Mcandrew FT (2009). «The Interacting Roles of Testosterone and Challenges to Status in Human Male Aggression» (PDF). Aggressive and Violent Behavior. 14 (5): 330–335. doi:10.1016/j.avb.2009.04.006
- ↑ Batrinos ML (1 de janeiro de 2012). «Testosterone and aggressive behavior in man». International Journal of Endocrinology and Metabolism. 10 (3): 563–68. PMC 3693622
 . PMID 23843821. doi:10.5812/ijem.3661
. PMID 23843821. doi:10.5812/ijem.3661
- ↑ Nguyen TV, McCracken JT, Albaugh MD, Botteron KN, Hudziak JJ, Ducharme S (janeiro de 2016). «A testosterone-related structural brain phenotype predicts aggressive behavior from childhood to adulthood». Psychoneuroendocrinology. 63: 109–18. PMC 4695305
 . PMID 26431805. doi:10.1016/j.psyneuen.2015.09.021
. PMID 26431805. doi:10.1016/j.psyneuen.2015.09.021
- ↑ Soma KK, Scotti MA, Newman AE, Charlier TD, Demas GE (Outubro de 2008). «Novel mechanisms for neuroendocrine regulation of aggression». Frontiers in Neuroendocrinology. 29 (4): 476–89. PMID 18280561. doi:10.1016/j.yfrne.2007.12.003
- ↑ Soma KK, Sullivan KA, Tramontin AD, Saldanha CJ, Schlinger BA, Wingfield JC (2000). «Acute and chronic effects of an aromatase inhibitor on territorial aggression in breeding and nonbreeding male song sparrows». Journal of Comparative Physiology A. 186 (7–8): 759–69. PMID 11016791. doi:10.1007/s003590000129
- ↑ McGinnis MY, Lumia AR, Breuer ME, Possidente B (Fevereiro de 2002). «Physical provocation potentiates aggression in male rats receiving anabolic androgenic steroids». Hormones and Behavior. 41 (1): 101–10. PMID 11863388. doi:10.1006/hbeh.2001.1742
- ↑ a b Wilson JD (Setembro de 2001). «Androgens, androgen receptors, and male gender role behavior». Hormones and Behavior. 40 (2): 358–66. PMID 11534997. doi:10.1006/hbeh.2001.1684
- ↑ Cosgrove KP, Mazure CM, Staley JK (Outubro de 2007). «Evolving knowledge of sex differences in brain structure, function, and chemistry». Biological Psychiatry. 62 (8): 847–55. PMC 2711771
 . PMID 17544382. doi:10.1016/j.biopsych.2007.03.001
. PMID 17544382. doi:10.1016/j.biopsych.2007.03.001
- ↑ Marner L, Nyengaard JR, Tang Y, Pakkenberg B (julho de 2003). «Marked loss of myelinated nerve fibers in the human brain with age». The Journal of Comparative Neurology. 462 (2): 144–52. PMID 12794739. doi:10.1002/cne.10714
- ↑ Bhasin S, Storer TW, Berman N, Callegari C, Clevenger B, Phillips J, Bunnell TJ, Tricker R, Shirazi A, Casaburi R (julho de 1996). «The effects of supraphysiologic doses of testosterone on muscle size and strength in normal men». The New England Journal of Medicine. 335 (1): 1–7. PMID 8637535. doi:10.1056/NEJM199607043350101
- ↑ «Testosterone Affects Some Women's Career Choices». NPR. 28 de Agosto de 2009
- ↑ Rosario ER, Chang L, Stanczyk FZ, Pike CJ (Setembro de 2004). «Age-related testosterone depletion and the development of Alzheimer disease». JAMA. 292 (12): 1431–32. PMID 15383512. doi:10.1001/jama.292.12.1431-b
- ↑ Hogervorst E, Bandelow S, Combrinck M, Smith AD (2004). «Low free testosterone is an independent risk factor for Alzheimer's disease». Experimental Gerontology. 39 (11–12): 1633–39. PMID 15582279. doi:10.1016/j.exger.2004.06.019
- ↑ Moffat SD, Zonderman AB, Metter EJ, Kawas C, Blackman MR, Harman SM, Resnick SM (janeiro de 2004). «Free testosterone and risk for Alzheimer disease in older men». Neurology. 62 (2): 188–93. PMID 14745052. doi:10.1212/WNL.62.2.188
- ↑ Khalili, Mohammad Ali; Leisegang, Kristian; Majzoub, Ahmad; Finelli, Renata; Panner Selvam, Manesh Kumar; Henkel, Ralf; Mojgan, Moshrefi; Agarwal, Ashok (2020). «Male Fertility and the COVID-19 Pandemic: Systematic Review of the Literature». The World Journal of Men's Health (em inglês) (4). 506 páginas. ISSN 2287-4208. PMC 7502312
 . PMID 32814369. doi:10.5534/wjmh.200134. Consultado em 25 de maio de 2023
. PMID 32814369. doi:10.5534/wjmh.200134. Consultado em 25 de maio de 2023
- ↑ Russo, Cristina; Morello, Giovanna; Malaguarnera, Roberta; Piro, Salvatore; Furno, Debora Lo; Malaguarnera, Lucia (9 de novembro de 2021). «Candidate genes of SARS-CoV-2 gender susceptibility». Scientific Reports (em inglês) (1). 21968 páginas. ISSN 2045-2322. doi:10.1038/s41598-021-01131-7. Consultado em 25 de maio de 2023
- ↑ Shen, Qiaoyan; Xiao, Xia; Aierken, Aili; Yue, Wei; Wu, Xiaojie; Liao, Mingzhi; Hua, Jinlian (agosto de 2020). «The ACE2 expression in Sertoli cells and germ cells may cause male reproductive disorder after SARS‐CoV‐2 infection». Journal of Cellular and Molecular Medicine (em inglês) (16): 9472–9477. ISSN 1582-1838. PMC 7361928
 . PMID 32594644. doi:10.1111/jcmm.15541. Consultado em 25 de maio de 2023
. PMID 32594644. doi:10.1111/jcmm.15541. Consultado em 25 de maio de 2023
- ↑ Nassau, Daniel E.; Best, Jordan C.; Kresch, Eliyahu; Gonzalez, Daniel C.; Khodamoradi, Kajal; Ramasamy, Ranjith (fevereiro de 2022). «Impact of the SARS‐CoV‐2 virus on male reproductive health». BJU International (em inglês) (2): 143–150. ISSN 1464-4096. PMC 8444635
 . PMID 34402155. doi:10.1111/bju.15573. Consultado em 25 de maio de 2023
. PMID 34402155. doi:10.1111/bju.15573. Consultado em 25 de maio de 2023
- ↑ Waterman MR, Keeney DS (1992). «Genes involved in androgen biosynthesis and the male phenotype». Hormone Research. 38 (5–6): 217–21. PMID 1307739. doi:10.1159/000182546
- ↑ Zuber MX, Simpson ER, Waterman MR (Dezembro de 1986). «Expression of bovine 17 alpha-hydroxylase cytochrome P-450 cDNA in nonsteroidogenic (COS 1) cells». Science. 234 (4781): 1258–61. Bibcode:1986Sci...234.1258Z. PMID 3535074. doi:10.1126/science.3535074
- ↑ Zouboulis CC, Degitz K (2004). «Androgen action on human skin -- from basic research to clinical significance». Experimental Dermatology. 13 Suppl 4 (s4): 5–10. PMID 15507105. doi:10.1111/j.1600-0625.2004.00255.x
- ↑ Payne AH, O'Shaughnessy P (1996). «Structure, function, and regulation of steroidogenic enzymes in the Leydig cell». In: Payne AH, Hardy MP, Russell LD. Leydig Cell. Vienna [Il]: Cache River Press. pp. 260–85. ISBN 0-9627422-7-9
- ↑ a b Swerdloff RS, Wang C, Bhasin S (Abril de 1992). «Developments in the control of testicular function». Baillière's Clinical Endocrinology and Metabolism. 6 (2): 451–83. PMID 1377467. doi:10.1016/S0950-351X(05)80158-2
- ↑ Liverman CT, Blazer DG, Institute of Medicine (US) Committee on Assessing the Need for Clinical Trials of Testosterone Replacement Therapy (1 de Janeiro de 2004). «Introduction». Testosterone and Aging: Clinical Research Directions. [S.l.]: National Academies Press (US). ISBN 978-0-309-09063-6. doi:10.17226/10852 – via www.ncbi.nlm.nih.gov
- ↑ Huhtaniemi I (2014). «Late-onset hypogonadism: current concepts and controversies of pathogenesis, diagnosis and treatment». Asian Journal of Andrology. 16 (2): 192–202. PMC 3955328
 . PMID 24407185. doi:10.4103/1008-682X.122336
. PMID 24407185. doi:10.4103/1008-682X.122336
- ↑ Huhtaniemi IT (2014). «Andropause--lessons from the European Male Ageing Study». Annales D'endocrinologie. 75 (2): 128–31. PMID 24793989. doi:10.1016/j.ando.2014.03.005
- ↑ Vingren JL, Kraemer WJ, Ratamess NA, Anderson JM, Volek JS, Maresh CM (2010). «Testosterone physiology in resistance exercise and training: the up-stream regulatory elements». Sports Medicine. 40 (12): 1037–53. PMID 21058750. doi:10.2165/11536910-000000000-00000
- ↑ Hulmi JJ, Ahtiainen JP, Selänne H, Volek JS, Häkkinen K, Kovanen V, Mero AA (Maio de 2008). «Androgen receptors and testosterone in men--effects of protein ingestion, resistance exercise and fiber type». The Journal of Steroid Biochemistry and Molecular Biology. 110 (1–2): 130–37. PMID 18455389. doi:10.1016/j.jsbmb.2008.03.030
- ↑ Hackney AC, Moore AW, Brownlee KK (2005). «Testosterone and endurance exercise: development of the "exercise-hypogonadal male condition"». Acta Physiologica Hungarica. 92 (2): 121–37. PMID 16268050. doi:10.1556/APhysiol.92.2005.2.3
- ↑ Livera G, Rouiller-Fabre V, Pairault C, Levacher C, Habert R (Agosto de 2002). «Regulation and perturbation of testicular functions by vitamin A». Reproduction. 124 (2): 173–80. PMID 12141930. doi:10.1530/rep.0.1240173
- ↑ Pilz S, Frisch S, Koertke H, Kuhn J, Dreier J, Obermayer-Pietsch B, Wehr E, Zittermann A (março de 2011). «Effect of vitamin D supplementation on testosterone levels in men». Hormone and Metabolic Research = Hormon- Und Stoffwechselforschung = Hormones et Métabolisme. 43 (3): 223–25. PMID 21154195. doi:10.1055/s-0030-1269854
- ↑ Prasad AS, Mantzoros CS, Beck FW, Hess JW, Brewer GJ (Maio de 1996). «Zinc status and serum testosterone levels of healthy adults». Nutrition. 12 (5): 344–48. PMID 8875519. doi:10.1016/S0899-9007(96)80058-X
- ↑ Koehler K, Parr MK, Geyer H, Mester J, Schänzer W (janeiro de 2009). «Serum testosterone and urinary excretion of steroid hormone metabolites after administration of a high-dose zinc supplement». European Journal of Clinical Nutrition. 63 (1): 65–70. PMID 17882141. doi:10.1038/sj.ejcn.1602899
- ↑ Håkonsen LB, Thulstrup AM, Aggerholm AS, Olsen J, Bonde JP, Andersen CY, Bungum M, Ernst EH, Hansen ML, Ernst EH, Ramlau-Hansen CH (2011). «Does weight loss improve semen quality and reproductive hormones? Results from a cohort of severely obese men». Reproductive Health. 8 (1): 24. PMC 3177768
 . PMID 21849026. doi:10.1186/1742-4755-8-24
. PMID 21849026. doi:10.1186/1742-4755-8-24
- ↑ MacDonald AA, Herbison GP, Showell M, Farquhar CM (2010). «The impact of body mass index on semen parameters and reproductive hormones in human males: a systematic review with meta-analysis». Human Reproduction Update. 16 (3): 293–311. PMID 19889752. doi:10.1093/humupd/dmp047
- ↑ Andersen ML, Tufik S (Outubro de 2008). «The effects of testosterone on sleep and sleep-disordered breathing in men: its bidirectional interaction with erectile function» (PDF). Sleep Medicine Reviews. 12 (5): 365–79. PMID 18519168. doi:10.1016/j.smrv.2007.12.003. Consultado em 14 de novembro de 2017. Arquivado do original (PDF) em 27 de março de 2009
- ↑ Schultheiss OC, Campbell KL, McClelland DC (Dezembro de 1999). «Implicit power motivation moderates men's testosterone responses to imagined and real dominance success». Hormones and Behavior. 36 (3): 234–41. PMID 10603287. doi:10.1006/hbeh.1999.1542
- ↑ Akdoğan M, Tamer MN, Cüre E, Cüre MC, Köroğlu BK, Delibaş N (Maio de 2007). «Effect of spearmint (Mentha spicata Labiatae) teas on androgen levels in women with hirsutism». Phytotherapy Research. 21 (5): 444–47. PMID 17310494. doi:10.1002/ptr.2074
- ↑ Kumar V, Kural MR, Pereira BM, Roy P (Dezembro de 2008). «Spearmint induced hypothalamic oxidative stress and testicular anti-androgenicity in male rats - altered levels of gene expression, enzymes and hormones». Food and Chemical Toxicology. 46 (12): 3563–70. PMID 18804513. doi:10.1016/j.fct.2008.08.027
- ↑ Grant P (Fevereiro de 2010). «Spearmint herbal tea has significant anti-androgen effects in polycystic ovarian syndrome. A randomized controlled trial». Phytotherapy Research. 24 (2): 186–88. PMID 19585478. doi:10.1002/ptr.2900
- ↑ Armanini D, Fiore C, Mattarello MJ, Bielenberg J, Palermo M (Setembro de 2002). «History of the endocrine effects of licorice». Experimental and Clinical Endocrinology & Diabetes. 110 (6): 257–61. PMID 12373628. doi:10.1055/s-2002-34587
- ↑ Cumming DC, Wall SR (Novembro de 1985). «Non-sex hormone-binding globulin-bound testosterone as a marker for hyperandrogenism». The Journal of Clinical Endocrinology and Metabolism. 61 (5): 873–6. PMID 4044776. doi:10.1210/jcem-61-5-873
- ↑ a b c d e f g Becker KL (2001). Principles and Practice of Endocrinology and Metabolism. [S.l.]: Lippincott Williams & Wilkins. pp. 1116, 1119, 1183. ISBN 978-0-7817-1750-2
- ↑ a b Wecker L, Watts S, Faingold C, Dunaway G, Crespo L (1 de Abril de 2009). Brody's Human Pharmacology. [S.l.]: Elsevier Health Sciences. pp. 468–469. ISBN 0-323-07575-4
- ↑ a b Zhou S (6 de abril de 2016). Cytochrome P450 2D6: Structure, Function, Regulation and Polymorphism. [S.l.]: CRC Press. pp. 242–. ISBN 978-1-4665-9788-4
- ↑ Randall VA (Abril de 1994). «Role of 5 alpha-reductase in health and disease». Baillière's Clinical Endocrinology and Metabolism. 8 (2): 405–31. PMID 8092979. doi:10.1016/S0950-351X(05)80259-9
- ↑ Meinhardt U, Mullis PE (Agosto de 2002). «The essential role of the aromatase/p450arom». Seminars in Reproductive Medicine. 20 (3): 277–84. PMID 12428207. doi:10.1055/s-2002-35374
- ↑ Noakes DE (23 de abril de 2009). Arthur's Veterinary Reproduction and Obstetrics. [S.l.]: Elsevier Health Sciences UK. pp. 695–. ISBN 978-0-7020-3990-4
- ↑ Nieschlag E, Behre HM (1 de Abril de 2004). Testosterone: Action, Deficiency, Substitution. [S.l.]: Cambridge University Press. pp. 626–. ISBN 978-1-139-45221-2
- ↑ Parl FF (2000). Estrogens, Estrogen Receptor and Breast Cancer. [S.l.]: IOS Press. pp. 25–. ISBN 978-0-9673355-4-4
- ↑ Norman AW, Henry HL (30 de julho de 2014). Hormones. [S.l.]: Academic Press. pp. 261–. ISBN 978-0-08-091906-5
- ↑ Hiipakka RA, Liao S (Outubro de 1998). «Molecular mechanism of androgen action». Trends in Endocrinology and Metabolism. 9 (8): 317–24. PMID 18406296. doi:10.1016/S1043-2760(98)00081-2
- ↑ McPhaul MJ, Young M (Setembro de 2001). «Complexities of androgen action». Journal of the American Academy of Dermatology. 45 (3 Suppl): S87–94. PMID 11511858. doi:10.1067/mjd.2001.117429
- ↑ Wang C, Liu Y, Cao JM (2014). «G protein-coupled receptors: extranuclear mediators for the non-genomic actions of steroids». Int J Mol Sci. 15 (9): 15412–25. PMC 4200746
 . PMID 25257522. doi:10.3390/ijms150915412
. PMID 25257522. doi:10.3390/ijms150915412
- ↑ Lang F, Alevizopoulos K, Stournaras C (2013). «Targeting membrane androgen receptors in tumors». Expert Opin. Ther. Targets. 17 (8): 951–63. PMID 23746222. doi:10.1517/14728222.2013.806491
- ↑ Bennett NC, Gardiner RA, Hooper JD, Johnson DW, Gobe GC (2010). «Molecular cell biology of androgen receptor signalling». Int. J. Biochem. Cell Biol. 42 (6): 813–27. PMID 19931639. doi:10.1016/j.biocel.2009.11.013
- ↑ Breiner M, Romalo G, Schweikert HU (Agosto de 1986). «Inhibition of androgen receptor binding by natural and synthetic steroids in cultured human genital skin fibroblasts». Klinische Wochenschrift. 64 (16): 732–37. PMID 3762019. doi:10.1007/BF01734339
- ↑ Kelly MJ, Qiu J, Rønnekleiv OK (1 de janeiro de 2005). «Estrogen signaling in the hypothalamus». Vitamins and Hormones. 71: 123–45. PMID 16112267. doi:10.1016/S0083-6729(05)71005-0
- ↑ Berthold AA (1849). «Transplantation der Hoden» [Transplantation of testis]. Arch. Anat. Physiol. Wiss. (em German). 16: 42–6
- ↑ Brown-Sequard CE (1889). «The effects produced on man by subcutaneous injections of liquid obtained from the testicles of animals». Lancet. 2 (3438): 105–07. doi:10.1016/S0140-6736(00)64118-1
- ↑ Gallagher TF, Koch FC (Novembro de 1929). «The testicular hormone». J. Biol. Chem. 84 (2): 495–500
- ↑ David KG, Dingemanse E, Freud JL (Maio de 1935). «Über krystallinisches mannliches Hormon aus Hoden (Testosteron) wirksamer als aus harn oder aus Cholesterin bereitetes Androsteron» [On crystalline male hormone from testicles (testosterone) effective as from urine or from cholesterol]. Hoppe-Seyler's Z Physiol Chem (em German). 233 (5–6): 281–83. doi:10.1515/bchm2.1935.233.5-6.281
- ↑ Butenandt A, Hanisch G (1935). «Umwandlung des Dehydroandrosterons in Androstendiol und Testosterone; ein Weg zur Darstellung des Testosterons aus Cholestrin» [About Testosterone. Conversion of Dehydro-androsterons into androstendiol and testosterone; a way for the structure assignment of testosterone from cholestrol]. Hoppe-Seyler's Z Physiol Chem (em German). 237 (2): 89–97. doi:10.1515/bchm2.1935.237.1-3.89
- ↑ Freeman ER, Bloom DA, McGuire EJ (Fevereiro de 2001). «A brief history of testosterone». The Journal of Urology. 165 (2): 371–73. PMID 11176375. doi:10.1097/00005392-200102000-00004
- ↑ Butenandt A, Hanisch G (1935). «Uber die Umwandlung des Dehydroandrosterons in Androstenol-(17)-one-(3) (Testosterone); um Weg zur Darstellung des Testosterons auf Cholesterin (Vorlauf Mitteilung). [The conversion of dehydroandrosterone into androstenol-(17)-one-3 (testosterone); a method for the production of testosterone from cholesterol (preliminary communication)]». Chemische Berichte (em German). 68 (9): 1859–62. doi:10.1002/cber.19350680937
- ↑ Ruzicka L, Wettstein A (1935). «Uber die kristallinische Herstellung des Testikelhormons, Testosteron (Androsten-3-ol-17-ol) [The crystalline production of the testicle hormone, testosterone (Androsten-3-ol-17-ol)]». Helvetica Chimica Acta (em German). 18: 1264–75. doi:10.1002/hlca.193501801176
- ↑ Kenyon AT, Knowlton K, Sandiford I, Koch FC, Lotwin, G (Fevereiro de 1940). «A comparative study of the metabolic effects of testosterone propionate in normal men and women and in eunuchoidism». Endocrinology. 26 (1): 26–45. doi:10.1210/Endo-26-1-26
- ↑ Schwarz S, Onken D, Schubert A (julho de 1999). «The steroid story of Jenapharm: from the late 1940s to the early 1970s». Steroids. 64 (7): 439–45. PMID 10443899. doi:10.1016/S0039-128X(99)00003-3
- ↑ de Kruif P (1945). The Male Hormone. New York: Harcourt, Brace
