Átomo
| Átomo | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| Ilustração de um átomo de hélio, na qual está representado o núcleo (a rosa) e a distribuição da nuvem de eletrões (a preto). O núcleo (canto sup. dir.) no hélio-4 é simétrico e asemelha-se muito à nuvem de eletrões, embora em núcleos mais complexos isto nem sempre se verifique. A escala gráfica corresponde a um angstrom (10−10 m ou 100 pm). | ||||||||
| Classificação | ||||||||
| ||||||||
| Propriedades | ||||||||
|
Átomo é uma unidade básica de matéria que consiste num núcleo central de carga elétrica positiva envolto por uma nuvem de eletrões de carga negativa. O núcleo atómico é composto por protões e neutrões.[nota 1] Os eletrões de um átomo estão ligados ao núcleo por força eletromagnética. Da mesma forma, um grupo de átomos pode estar ligado entre si através de ligações químicas baseadas na mesma força, formando uma molécula. Um átomo que tenha o mesmo número de protões e eletrões é eletricamente neutro, enquanto que um com número diferente pode ter carga positiva ou negativa, sendo desta forma denominado ião. Os átomos são classificados de acordo com o número de protões no seu núcleo: o número de protões determina o elemento químico e o número de neutrões determina o isótopo desse elemento.[1]
Os átomos são objetos minúsculos cujo diâmetro é de apenas algumas décimas de nanómetros e com pouca massa em relação ao seu volume. A sua observação só é possível com recurso a instrumentos apropriados, como o microscópio de corrente de tunelamento. Cerca de 99,94% da massa atómica está concentrada no núcleo, tendo os protões e neutrões aproximadamente a mesma massa. Cada elemento possui pelo menos um isótopo com nuclídeo instável que pode sofrer decaimento radioativo. Isto pode levar à ocorrência de uma transmutação que altere o número de protões ou neutrões no interior do núcleo.[2] Os eletrões ligados a átomos possuem um conjunto estável de níveis energéticos, ou orbitais atómicas, podendo sofrer transições entre si ao absorver ou emitir fotões que correspondam à diferença de energia entre esses níveis. Os eletrões definem as propriedades químicas de um elemento e influenciam as propriedades magnéticas de um átomo. A mecânica quântica é a teoria que descreve corretamente a estrutura e as propriedades dos átomos.
Componentes
[editar | editar código-fonte]Partículas subatómicas
[editar | editar código-fonte]Embora o significado original do termo átomo correspondesse a uma partícula que não pode ser dividida em partículas menores, no contexto científico contemporâneo o átomo é constituído por várias partículas subatómicas: o eletrão, o protão e o neutrão. No entanto, há exceções: um átomo de hidrogénio-1 não tem neutrões e um ião hidrogénio não tem eletrões. O eletrão é a partícula com menor massa, com apenas 9,11 x10-31 kg, tendo carga elétrica negativa e uma dimensão de tal modo reduzida que não é possível a sua medição com a tecnologia atual. O protão tem carga positiva e massa 1 836 vezes maior do que a dos eletrões — 1,6726 x 10-27 kg. O neutrão não possui carga elétrica e tem massa 1 839 vezes superior à massa do eletrão, ou 1,6929 x 10-27 kg.[3] Neutrão e protão possuem dimensões comparáveis, na ordem de 2,5 x10-15 m, embora a superfície destas partículas não tenha contornos precisos.[4]
No modelo padrão da física de partículas, os eletrões são partículas verdadeiramente elementares sem qualquer estrutura interna. No entanto, tanto os protões como os neutrões são partículas compostas, formadas por partículas denominadas quarks. Os protões são constituídos por dois quarks up (cada um com carga +2⁄3) e um quark down (com carga −1⁄3). Os neutrões são constituídos por um quark up e dois quarks down. Esta diferença é responsável pelos diferentes valores de massa e carga entre as duas partículas.[5][6] Os quarks mantêm-se unidos através da força forte, mediada pelos gluões. Por outro lado, os protões e neutrões mantêm-se unidos através da força nuclear, um resíduo da força forte com propriedades diferentes. O gluão é um membro da família dos bosãos de calibre, que são partículas elementares que medeiam a forças físicas.[5][6]
Núcleo
[editar | editar código-fonte]
O conjunto dos protões e neutrões ligados entre si num átomo formam um pequeno núcleo atómico. Estes elementos que formam o núcleo são denominados coletivamente por nucleões. O raio de um núcleo é aproximadamente igual a 1,07 3√A fm, onde A é o número total de nucleões.[7] Este valor é muito inferior ao raio do próprio átomo, que é da ordem dos 105 fm. Os nucleões mantêm-se unidos através de um potencial atrativo de curto alcance denominado força nuclear residual. A distâncias inferiores a 2,5 fm, esta força é muito mais poderosa que a força eletrostática, o que faz com que os protões de carga positiva se repelem mutuamente.[8]
Os átomos de um mesmo elemento químico têm sempre o mesmo número de protões, o qual é denominado número atómico. Entre cada elemento, o número de neutrões pode variar, determinando desta forma o isótopo desse elemento. O número total de protões e neutrões determina o nuclídeo. O número de protões relativamente ao número de neutrões determina a estabilidade do núcleo, havendo determinados isótopos que são radioativos.[9]
Os neutrões e protões são tipos diferentes de fermiões. O Princípio de exclusão de Pauli é um princípio de mecânica quântica que proíbe que fermiões idênticos, tais como múltiplos protões, ocupem o mesmo estado físico quântico ao mesmo tempo. Por conseguinte, todos os protões no núcleo devem ocupar um estado diferente, com um nível de energia próprio, aplicando-se a mesma regra a todos os neutrões. Esta proibição não se aplica a um protão e neutrão que ocupem o mesmo estado quântico.[10]
Nos átomos com números atómicos baixos, um núcleo que tenha um número de protões diferente do número de neutrões pode decair para um estado de energia inferior através de radioatividade, de forma a que o número de protões e eletrões seja igualado. Por este motivo, os átomos com número semelhante de protões e neutrões são mais estáveis em relação à radioatividade. No entanto, à medida que o número atómico aumenta, a repulsa mútua entre os protões requer uma proporção cada vez maior de neutrões para manter a estabilidade do núcleo. Assim, não existem núcleos estáveis com o mesmo número de protões e neutrões acima do número atómico 20 (cálcio) e, à medida que o valor aumenta, o rácio entre protões e neutrões necessário à estabilidade aumenta para cerca de 1,5.[10]
O número de protões e neutrões no núcleo atómico pode ser alterado, embora possa ser necessária grande quantidade de energia para vencer a força forte. A fusão nuclear ocorre quando várias partículas atómicas se juntam para formar um núcleo mais pesado, como no caso da colisão entre dois núcleos. Por exemplo, no interior do Sol os protões necessitam de energia na ordem dos 3–10 keV para vencer a sua repulsa mútua — a barreira de Coulomb — e se fundirem num único núcleo.[11] A fissão nuclear é o processo oposto, na qual o núcleo se divide em dois núcleos menores, normalmente através de radioatividade. O núcleo também pode ser modificado através do bombardeio com partículas subatómicas de elevada energia ou fotões. Se isto modificar o número de protões dentro do núcleo, o átomo muda para um elemento químico diferente.[12][13]
Se, depois de uma reação de fusão, a massa de um núcleo for menor que a soma das massas das várias partículas, a diferença entre estes dois valores pode ser emitida através de energia útil (como raios gama ou a energia cinética de uma partícula beta), tal como descrito na fórmula de equivalência massa-energia de Einstein E = mc2, na qual m é a perda de massa e c é a velocidade da luz. Este défice é parte da energia de ligação do novo núcleo, sendo a perda irrecuperável de energia que faz com que as partículas fundidas se mantenham juntas.[14]
A fusão de dois núcleos que dêem origem a núcleos maiores com números atómicos inferiores aos do ferro e níquel (60) é geralmente uma reação exotérmica que libera mais energia do que aquela necessária para os fundir.[15] É este processo de libertação de energia que faz da fusão nuclear em estrelas uma reação auto-sustentável. Em núcleos mais pesados, a energia de ligação por cada nucleão dentro do núcleo começa a ser cada vez menor. Isto significa que os processos de fusão que produzam núcleos com número atómico superior a 26 e massa atómica superior a 60 são reações endergónicas. Estes núcleos de maior massa não são capazes de dar origem a uma reação de fusão produtora de energia que sustente o equilíbrio hidrostático de uma estrela.[10]
Nuvem de eletrões
[editar | editar código-fonte]
Os eletrões de um átomo são atraídos para os protões do núcleo por meio da força eletromagnética. Esta força prende os eletrões no interior de um poço de potencial eletrostático em redor do núcleo mais pequeno, o que significa que é necessária uma fonte de energia externa para o eletrão escapar. Quando mais perto está o eletrão do núcleo, maior a força de atração. Assim, os eletrões que estejam ligados mais perto do centro do poço de potencial requerem mais energia para escapar do que aqueles na periferia.[16]
Os eletrões, tal como outras partículas, têm propriedades tanto de partícula como de onda. A nuvem de eletrões é uma região no interior do poço de potencial na qual cada eletrão forma um tipo de onda estacionária tridimensional — uma onda que não se move em relação ao núcleo. Este comportamento é definido por uma orbital atómica, uma função matemática que caracteriza a probabilidade de um eletrão aparentar estar em determinada localização quando a sua posição é medida.[17] Só existe um número limitado de orbitais em redor do núcleo, uma vez que outros possíveis padrões de onda rapidamente decaem para formas mais estáveis.[18] As orbitais podem ter um ou mais anéis ou nós, e diferem entre si em termos de tamanho, forma e direção.[19]
Cada orbital atómica corresponde a um determinado nível de energia de um eletrão. Um eletrão pode alterar o seu estado para um nível de energia superior ao absorver um fotão com energia suficiente para o impulsionar para o novo estado quântico. De forma semelhante, através de emissão espontânea, um eletrão que se encontre num estado superior de energia pode descer para um estado inferior ao emitir a energia em excesso através de fotões. Estes valores de energia característicos, definidos pelas diferenças de energia nos estados quânticos, são responsáveis pelas linhas espectrais atómicas.[18]
A quantidade de energia necessária para remover ou acrescentar um eletrão — a energia de ligação de eletrões — é muito inferior à energia de ligação de nucleões. Por exemplo, só são necessários 13,6 eV para remover um eletrão de um átomo de hidrogénio que esteja no nível fundamental,[20] em comparação com os 2,23 milhões eV para dividir um núcleo de deutério.[21] Os átomos são eletricamente neutros quando têm um número igual de protões e eletrões. Os átomos que têm défice ou excesso de eletrões são denominados iões. Os eletrões mais afastados do núcleo podem ser transferidos para outros átomos ou partilhados entre átomos. Através deste mecanismo, os átomos são capazes de se ligar em moléculas ou outros tipos de compostos químicos como cristais iónicos ou covalentes.[22]
Propriedades
[editar | editar código-fonte]Propriedades nucleares
[editar | editar código-fonte]Por definição, quaisquer dois átomos com número idêntico de protões nos seus núcleos pertencem ao mesmo elemento químico. Átomos com número idêntico de protões, mas diferente número de neutrões são diferentes isótopos do mesmo elemento. Por exemplo, todos os átomos de hidrogénio admitem exatamente um único protão, mas existem isótopos sem neutrões (hidrogénio-1), um neutrão (deutério), dois neutrões (trítio) e mais do que dois neutrões. Os elementos conhecidos formam um conjunto de números atómicos, desde o hidrogénio, com apenas um único protão, até ao ununóctio, com 118 protões.[23] Todos os isótopos conhecidos de elementos com números atómicos maiores do que 82 são radioativos.[24][25]
Na Terra existem naturalmente cerca de 339 nuclídeos,[26] dos quais não se observou qualquer decaimento em 254 deles (aprox. 75%), sendo assim denominados isótopos estáveis. No entanto, em teoria só em 90 destes nuclídeos é que não é possível ocorrer decaimento. Nos 164 restantes, embora ainda não tenha sido observado qualquer decaimento, em teoria é possível que isso aconteça (no entanto, são igualmente classificados como estáveis). Para além destes, 34 nuclídeos radioativos têm uma meia-vida superior a 80 milhões de anos e um ciclo de vida suficiente grande para estarem presentes desde o nascimento do sistema solar. Os elementos deste conjunto de 288 nuclídeos são denominados nuclídeos primordiais. Conhece-se ainda mais 51 nuclídeos de vida curta que ocorrem de forma natural, enquanto produto do decaimento de nuclídeos primordiais (como o rádio a partir do urânio), ou produto de processos energéticos naturais na Terra, como o bombardeio de raios cósmicos (por exemplo, o carbono-14).[27][a]
Existe pelo menos um isótopo estável em 80 elementos químicos. Regra geral, existem poucos isótopos estáveis para cada um destes elementos. Em média existem 3,2 isótopos estáveis por cada elemento, embora vinte e seis elementos tenham apenas um único isótopo estável. O estanho tem o maior número de isótopos estáveis (10). Os elementos Tecnécio, Promécio, e todos os elementos iguais ou superiores ao Bismuto não têm isótopos estáveis.[28]
A estabilidade dos isótopos é influenciada pela proporção entre protões e neutrões e pela presença de determinados números de neutrões e protões que representam camadas quânticas abertas e fechadas. e preenchidas. Estas camadas correspondem a um conjunto de níveis de energia no interior do modelo de camadas do núcleo. As camadas preenchidas, como a camada preenchida de 50 protões no estanho, oferece ao nuclídeo uma estabilidade acima do normal. Entre os 254 nuclídeos conhecidos, apenas quatro têm simultaneamente um número ímpar de protões e um número ímpar de neutrões: hidrogénio-2 (deutério), lítio-6, boro-10 e nitrogénio-14. Apenas quatro dos nuclídeos radioativos ímpar-ímpar que ocorrem naturalmente têm uma meia-vida superior a mil milhões de anos: potássio-40, vanádio-50, lantânio-138 e tântalo-180m. A maior parte dos núcleos ímpar-ímpar são altamente instáveis no que diz respeito ao decaimento beta, uma vez que os produtos do decaimento são par-par e por esse motivo ligados de maneira mais forte.[28]
Massa
[editar | editar código-fonte]A grande maioria da massa de um átomo vem dos protões e neutrões que o constituem. O número total destas partículas (denominadas nucleões) em determinado átomo denomina-se número de massa. O número de massa é um número inteiro simples e representa unidades de nucleões. Por exemplo, "carbono-12" tem doze nucleões: seis protões e seis neutrões.[29]
A massa de um átomo em repouso é geralmente expressa através da unidade de massa atómica (u), por vezes também designada por dalton (Da). Esta unidade corresponde a um duodécimo da massa de um átomo neutro livre de carbono-12, o que corresponde a aproximadamente 1,66 x10-27 kg.[30] O hidrogénio-1, o mais leve isótopo de hidrogénio e o átomo com menor massa, tem um peso atómico de 1,007825 u.[31] O valor deste número é denominado massa atómica. Um dado átomo tem uma massa atómica aproximadamente igual (± 1%) ao seu número de massa vezes a massa da unidade de massa atómica. No entanto, este número não será um número inteiro exceto no caso do carbono-12.[32] O átomo estável mais pesado é o chumbo-208,[24] com 207,9766521 u de massa.[33]
Como até os átomos de maior massa são muito leves para que se possa trabalhar diretamente neles, os químicos usam a unidade Mole. Um mole de átomos de qualquer elemento tem sempre o mesmo número de átomos (cerca de 6,022 x1023). Este número foi escolhido de forma a que se um elemento tiver uma massa atómica de 1 u, um mole de átomos desse elemento tenha uma massa exata de um grama. Em função da definição da unidade de massa atómica, cada átomo de carbono-12 tem uma massa atómica de exatamente 12 u, e portanto um mole de carbono-12 pesa exatamente 0,012 kg.[30]
Tamanho e forma
[editar | editar código-fonte]Os átomos não possuem uma fronteira exterior definida, pelo que a sua dimensão é normalmente descrita em termos de raio atómico. Esta medida corresponde à distância de afastamento da nuvem de eletrões em relação ao núcleo central. Porém, isto assume que o átomo apresenta uma forma esférica, o que só se verifica no vácuo. O raio atómico pode ser derivado da distância entre dois núcleos quando dois átomos estão unidos por uma ligação química. O raio varia em função da localização do átomo na tabela periódica, do tipo de ligação química, do número de átomos vizinhos (número de coordenação) e de uma propriedade de mecânica quântica denominada spin.[34] Na tabela periódica, o tamanho do átomo tende a aumentar à medida que se desce as colunas, mas diminui quando se cruza as linhas da esquerda para a direita.[35] O átomo de menor dimensão é o hélio, com um raio de 32 pm. Um dos maiores é o césio com 225 pm.[36] Quando sujeitos a campos externos, como um campo elétrico, a forma dos átomos pode-se desviar em relação à esfera. A deformação depende da magnitude do campo e do tipo de órbita das camadas exteriores de eletrões. Os desvios esféricos podem ser observados, por exemplo, em cristais, nos quais se pode verificar a ocorrência de grandes campos elétricos em pontos de baixa simetria na malha cristalina.[37] Tem-se também verificado a ocorrência de deformações elipsoidais muito significativas em iões de enxofre nos compostos semelhantes a pirite.[38]
As dimensões atómicas são milhares de vezes mais pequenas do que os comprimentos de onda da luz (400–700 nm), pelo que não podem ser observados através de um microscópio óptico. No entanto, é possível observar átomos individuais através de um microscópio de corrente de tunelamento. Para ter uma noção de grandeza do átomo, considere-se que um cabelo humano normal tem cerca de um milhão de átomos de largura.[39] Uma gota de água contém cerca de dois mil triliões (221) de átomos de oxigénio e o dobro desse valor de átomos de hidrogénio.[40] Um diamante de um quilate com uma massa de 2×10−4 kg contém dez mil triliões (1022) de átomos de carbono.[b] Se uma maçã fosse ampliada para o tamanho da Terra, os átomos teriam aproximadamente o tamanho da maçã original.[41]
Radioatividade
[editar | editar código-fonte]
Cada elemento tem um ou mais isótopos de núcleo instável que estão sujeitos a emissão radioativa, o que faz com que o núcleo emita partículas de radiação eletromagnética. A radioatividade pode ocorrer quando o raio de um núcleo tenha uma grande dimensão quando comparado com o raio da força forte, o qual só tem efeito em distâncias na ordem de 1 fm.[42]
As formas mais comuns de emissão radioativa são:[43][44]
- Emissão alfa: este processo ocorre quando o núcleo emite uma partícula alfa, que é um núcleo de hélio que consiste em dois protões e dois neutrões. O resultado desta emissão é um novo elemento com um número atómico inferior.
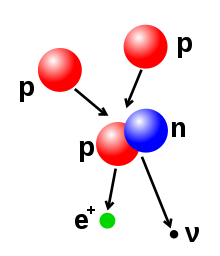
- Emissão beta (e captura eletrónica): estes processos são regulados pela força fraca e são o resultado da transformação de um neutrão num protão, ou de um protão num neutrão. A transição de neutrão para protão é acompanhada pela emissão de um eletrão e de um antineutrino, enquanto que a transição de protão para neutrão (excepto no caso da captura eletrónica) causa e emissão de um positrão e de um neutrino. As emissões de eletrões ou positrões são denominadas partículas beta. O decaimento beta aumenta ou diminui em um o número atómico do núcleo. A captura de eletrões é mais comum do que a emissão de positrões, uma vez que requer menos energia. Neste tipo de decaimento, o núcleo absorve um eletrão, em vez de o positrão ser emitido pelo núcleo. Neste processo, o neutrino continua a ser emitido e o protão é alterado para neutrão.
- Emissão gama: este processo é o resultado de uma alteração do nível de energia do núcleo para um estado inferior, resultando na emissão de radiação eletromagnética. O estado de excitação de um núcleo que resulte em emissão gama normalmente ocorre após a emissão de partículas alfa ou beta. Assim, uma emissão gama sucede geralmente a uma emissão alfa ou beta.
Os restantes tipos mais raros de emissão radioativa incluem a ejeção de neutrões, protões ou grupos de nucleões a partir do núcleo, ou mais do que uma partícula beta. A conversão interna é um processo análogo à emissão gama, mas que permite ao núcleo excitado perder energia de forma diferente, ao produzir eletrões de alta velocidade que não são raios beta, seguidos pela produção de fotões de elevada energia que não são raios gama. Alguns núcleos de grande dimensão explodem em dois ou mais fragmentos, com carga elétrica e de massa variada, e de vários neutrões, numa emissão denominada fissão nuclear espontânea.[44]
Cada isótopo radioativo tem um período de emissão ou decaimento característico — a meia-vida — que é determinado pela quantidade de tempo necessária para o decaimento de metade de uma amostra. Trata-se de um processo de decaimento exponencial que diminui de forma constante a proporção do isótopo restante em 50% a cada meia-vida. Desta forma, depois de duas meias-vidas, só 25% do isótopo é que está presente, e assim por diante.[42]
Momento magnético
[editar | editar código-fonte]As partículas elementares possuem uma propriedade mecânica quântica intrínseca denominada spin. Isto é análogo ao momento angular de um objeto em rotação à volta do seu centro de massa, embora em termos precisos se acredite que estas partículas sejam similares a pontos e não se possa dizer que estejam em rotação. O spin é medido em unidades da constante de Planck reduzidas (h), tendo os eletrões, protões e neutrões todos um spin de ½ ħ. Num átomo, para além do spin, os eletrões em movimento ao redor do núcleo possuem momento angular orbital, enquanto que o próprio núcleo possui momento angular devido ao spin nuclear.[45]
O campo magnético produzido por um átomo — o seu momento magnético — é determinado por estas diferentes formas de momento angular, uma vez que um objeto com carga elétrica em rotação produz um campo magnético. No entanto, a principal contribuição vem do próprio spin. Devido à natureza dos eletrões em obedecer ao princípio de exclusão de Pauli, pelo qual dois eletrões não podem apresentar o mesmo estado quântico, os eletrões ligados emparelham-se entre si, ficando um dos membros num estado de spin positivo e o outro num estado de spin negativo. Assim, os spins cancelam-se mutuamente, diminuindo o momento de dipolo magnético para zero em determinados átomos com número par de eletrões.[46]
Em elementos ferromagnéticos como o ferro, o número ímpar de eletrões leva a que haja um eletrão não emparelhado e a que exista um momento magnético. As órbitas de átomos vizinhos sobrepõem-se, e quando os spins de eletrões se alinham entre si atinge-se um estado de energia inferior denominado interação de troca. Quando os momentos magnéticos dos átomos ferromagnéticos se encontram alinhados, o material é capaz de produzir um campo macroscópico mensurável. Os materiais paramagnéticos possuem átomos com momentos magnéticos que, na ausência de campos magnéticos, se alinham em direções aleatórias, mas em que na presença de um campo se alinham individualmente.[46][47]
O núcleo de um átomo pode também possuir spin próprio, ou spin nuclear. Normalmente, os núcleos estão alinhados em direções aleatórias devido ao equilíbrio térmico. No entanto, para determinados elementos (como o xénon-129) é possível polarizar uma grande proporção dos estados de spin nuclear para que sejam alinhados na mesma direção — uma condição denominada "hiperpolarização" — o que tem aplicações notáveis na ressonância magnética.[48][49]
Níveis de energia
[editar | editar código-fonte]Quando um eletrão se encontra ligado a um átomo, possui energia potencial inversamente proporcional à sua distância em relação ao núcleo. Isto é medido pela quantidade de energia necessária para separar o eletrão do átomo, sendo geralmente expressa em unidade de elétrão-volt (eV). No modelo mecânico quântico, um eletrão ligado apenas pode ocupar um conjunto de estados com centro no núcleo, em que cada estado corresponde a um nível específico de energia. O estado de energia mínima de um eletrão ligado denomina-se estado fundamental , enquanto que a transição para níveis mais altos de energia resulta num estado excitado.[50]
Para um eletrão poder transitar entre dois estados diferentes, deve absorver ou emitir um fotão cuja energia corresponda à diferença entre os potenciais de energia desses níveis. A energia de um fotão emitido é proporcional à sua frequência, fazendo com que estes níveis de energia específicos apareçam como bandas distintas no espectro eletromagnético.[51] Cada elemento tem um espectro característico que pode variar em função da carga nuclear, de subcamadas preenchidas por eletrões e de interações eletromagnéticas entre os eletrões e outros fatores.[52]

Quando se passa um espectro contínuo de energia através de um gás ou plasma, alguns dos fotões são absorvidos pelos átomos, causando alterações nos níveis de energia dos eletrões. Os eletrões assim excitados que permaneçam ligados ao seu átomo vão, de forma espontânea, emitir esta sobrecarga de energia através de um fotão que se movimentará numa direção aleatória, levando a que o eletrão regresse aos níveis de energia anteriores. Assim, os átomos comportam-se como um filtro que forma uma série de bandas de absorção no espectro de energia. [nota 2] A medição espectroscópica da força e largura das linhas espectrais permite determinar a composição e propriedades físicas de uma substância.[53]
Quando observadas ao pormenor, algumas linhas espectrais revelam a existência de um desdobramento em estrutura fina. Isto ocorre devido à interação spin-órbita, uma interação entre o spin e movimento do eletrão mais afastado do centro.[54] Quando um átomo se encontra num campo magnético exterior, as linhas espectrais dividem-se em três ou mais componentes; um fenómeno denominado efeito Zeeman. Isto é causado pela interação do campo magnético com o momento magnético do átomo e dos seus eletrões. Alguns átomos podem ter múltiplas configurações eletrónicas com o mesmo nível de energia, aparecendo assim como uma única linha espectral. A interação do campo magnético com o átomo altera estas configurações eletrónicas para níveis de energia ligeiramente diferentes, o que resulta em várias linhas espectrais.[55] A presença de um campo elétrico externo pode provocar nas linhas espectrais desdobramentos e alterações semelhantes, ao modificar os níveis de energia dos eletrões, um fenómeno denominado efeito Stark.[56]
Se um eletrão ligado se encontra num estado excitado, um fotão que com ele interaja e tenha um nível de energia apropriado pode provocar a emissão estimulada de um fotão com um nível de energia correspondente. Para que isto ocorra, o eletrão deve descer para um estado energético inferior e que tenha um diferencial de energia correspondente à energia do fotão que com ele interage. O fotão emitido e o fotão de interação irão então mover-se paralelamente e com fases iguais. Isto é, os padrões de onda dos dois fotões vão-se sincronizar. Esta propriedade física é usada para produzir lasers, que são capazes de emitir um raio coerente de luz através numa banda de frequência estreita.[57]
Valência
[editar | editar código-fonte]A camada eletrónica mais afastada do núcleo de um átomo no estado neutro é denominada camada de valência, sendo os eletrões nessa camada denominados eletrões de valência. A quantidade de eletrões de valência determina o comportamento da ligação com outros átomos. Os átomos tendem a reagir quimicamente entre si de forma a que a sua camada de valência seja preenchida.[58]
Os elementos químicos são geralmente representados numa tabela periódica, organizada de forma a mostrar as principais propriedades químicas e na qual os elementos com o mesmo número de eletrões de valência formam um grupo alinhado ao longo da mesma coluna na tabela. Os elementos mais à direita da tabela têm a sua camada externa completamente preenchida com eletrões, o que dá origem a elementos quimicamente inertes conhecidos como gases nobres.[59][60]
Estados
[editar | editar código-fonte]
Os átomos encontram-se em diferentes estados de matéria, que dependem de condições físicas como a temperatura ou pressão. Ao serem alteradas as condições, os materiais podem alternar entre os estados sólido, líquido, gasoso ou plasmático.[61] Dentro de um determinado estado, um material pode também existir em diferentes fases. Por exemplo, o carbono sólido pode existir enquanto grafite ou diamante.[62]
A temperaturas próximas do zero absoluto, os átomos podem formar um condensado de Bose-Einstein, no qual os efeitos mecânicos quânticos, que geralmente só são observados a uma escala atómica, se tornam visíveis a uma escala macroscópica.[63][64] Este grupo de átomos extremamente arrefecido comporta-se então como um único átomo, o que permite observações fundamentais do comportamento mecânico.[65]
Origem e evolução
[editar | editar código-fonte]Os átomos correspondem a cerca de 4% da densidade total do universo observável, a uma densidade média de cerca de 0,25 átomos/m3, ou seja, apenas um átomo presente a cada 4 m3.[66][67] Numa galáxia como a Via Láctea, os átomos encontram-se em concentrações muito maiores. A densidade da matéria no meio interestelar varia entre 105 e 109 átomos/m3.[68] Acredita-se que o Sol esteja no interior da Bolha Local, uma região de gás altamente ionizado, pelo que a densidade à volta do sistema solar é de apenas 103 átomos/m3.[69] As estrelas formam-se a partir de nuvens densas no meio interestelar, cujo processo evolutivo provoca o enriquecimento desse mesmo espaço com elementos com maior massa do que o hidrogénio ou o hélio. Cerca de 95% dos átomos da via láctea estão concentrados no interior das estrelas e a massa total dos átomos forma cerca de 10% da massa da galáxia.[70] O restante da massa é matéria escura desconhecida.[71]
Nucleossíntese
[editar | editar código-fonte]Os protões e eletrões estáveis apareceram um segundo depois do Big Bang. Durante os três minutos seguintes, a nucleossíntese primordial produziu a maior parte dos átomos de hélio, lítio e deutério no universo e, provavelmente, alguns dos de berílio e boro.[72][73][74] Os primeiros átomos (completos com eletrões a si ligados) foram, em teoria, criados 380 000 anos após o Big Bang, durante uma era denominada recombinação, quando o universo em expansão arrefeceu o suficiente para permitir aos eletrões ligarem-se aos núcleos.[75] A partir de então, os núcleos atómicos têm-se combinado no interior das estrelas através de fusão nuclear, produzindo elementos até ao ferro.[76]
Outros isótopos, como o lítio-6, são gerados no espaço através da espalação de raios cósmicos.[77] Este fenómeno ocorre quando um protão de elevada energia atinge um núcleo atómico, o que causa a ejeção de um grande número de nucleões. Os elementos mais pesados que o ferro foram produzidos em supernovas através do Processo R e em estrelas AGB através do Processo-S, ambos envolvendo a captura de neutrões pelo núcleo atómico.[78] Determinados elementos, como o chumbo, foram formados essencialmente através do decaimento radioativo de outros elementos mais pesados.[79]
Terra
[editar | editar código-fonte]A maior parte dos átomos que constituem a Terra e os seres vivos já estavam presentes, na sua forma atual, na nebulosa que formou o sistema solar a partir de uma nuvem molecular. O restante é o resultado de decaimento radioativo, sendo a proporção entre ambos usada na determinação da idade da Terra através de datação radiométrica.[80][81] A maior parte do hélio na crosta da Terra é resultado da emissão alfa.[82]
Há alguns átomos na Terra que não estão presentes desde o início (isto é, que não são primordiais) nem são resultado de decaimento radioativo. Por exemplo, o carbono-14 é gerado continuamente através dos raios cósmicos na atmosfera.[83] Alguns átomos são gerados artificialmente, quer deliberadamente ou enquanto subprodutos de reatores ou explosões nucleares.[84][85] Entre os elementos transurânicos — aqueles com número atómico superior a 92 — só o neptúnio ocorre naturalmente na Terra.[86][87] Os elementos transurânicos têm períodos de vida radioativa mais curtos do que a idade atual da Terra,[88] pelo que algumas quantidades destes elementos já decaíram por completo, à exceção de vestígios de plutónio-244, provavelmente depositado por poeira cósmica.[89] Os depósitos naturais de plutónio e neptúnio são produzidos por captura de neutrões em minério de urânio.[90]
A Terra contém aproximadamente 1,33 x 1050 átomos.[91] Existem na atmosfera pequenas quantidade de átomos independentes que formam os gases nobres, como o árgon e o néon. Os restantes 99% de átomos na atmosfera encontram-se ligados na forma de moléculas, entre as quais dióxido de carbono e oxigénio e nitrogénio diatómicos. Na superfície terrestre, os átomos combinam-se entre si para formar vários compostos, entre os quais a água o sal, silicatos e óxidos. Os átomos podem também unir-se para criar materiais mais complexos, como cristais e metais líquidos e sólidos.[92][93]
Formas raras e teóricas
[editar | editar código-fonte]Embora se saiba que os isótopos com número atómico maior do que o chumbo (82) são radioativos, tem sido proposta uma "ilha de estabilidade" na qual se incluiriam números atómicos superiores a 103. Estes elementos superpesados podem ter um núcleo que seja relativamente estável contra o decaimento radioativo.[94] O candidato mais provável a um átomo superpesado, o unbi-héxio, possui 126 protões e 184 neutrões.[95]
Cada partícula de matéria possui uma antipartícula de antimatéria correspondente, com carga elétrica oposta. Assim, o positrão é um antieletrão com carga positiva e o antiprotão é equivalente ao protão, mas de carga negativa. O antineutrão não tem carga elétrica, assim como o neutrão. Por razões ainda desconhecidas, as partículas de antimatéria são raras no universo, pelo que não foram ainda descobertos átomos de antimatéria.[96][97] O anti-hidrogénio, o correspondente antimatéria ao hidrogénio, foi pela primeira vez produzido no laboratório do CERN em Genebra em 1996.[98][99]
Têm vindo a ser criados mais átomos exóticos, através da substituição de um dos protões, neutrões ou eletrões por outras partículas com a mesma carga. Por exemplo, é possível substituir um eletrão por um muão, mais massivo, dando origem a um átomo muónico. Este tipo de átomos pode ser usado para testar as hipóteses fundamentais de física.[100][101][102]
Identificação
[editar | editar código-fonte]
O microscópio de corrente de tunelamento é um aparelho que permite observar a superfície de átomos e moléculas com uma resolução muito superior à dos microscópios ópticos ou eletrónicos, através do fenómeno de tunelamento quântico. Utiliza-se uma agulha microscópica, à qual se aplica uma pequena diferença de potencial de cerca de 10mV. Quando a agulha é colocada suficientemente perto da superfície (~10A), os eletrões da amostra começam a tunelar em direção à sonda, o que provoca uma corrente elétrica denominada corrente de tunelamento, que pode ser medida.[103][104]
Um átomo pode ser ionizado através da remoção de um dos seus eletrões. A carga elétrica faz com que a trajétória de um átomo se curve quando atravessa um campo magnético. O raio de curvatura é determinado pela massa do átomo. O espectrómetro de massa usa este princípio para medir o rácio massa/carga dos iões. Se uma amostra contém vários isótopos, o espectrómetro de massa consegue determinar a proporção de cada isótopo na amostra medindo a intensidade dos diferentes raios dos iões. Entre as técnicas para vaporizar átomos contam-se a espectrometria de emissão atómica por plasma acoplado indutivamente e espectrometria de massa por plasma acoplado indutivamente, ambas usando plasma para vaporizar amostras para análise.[105]
A espectroscopia de perda de energia de eletrões mede a perda de energia de um raio de eletrões no interior de um microscópio eletrónico de transmissão no momento em que esse raio interage com uma parte da amostra. A tomografia de sonda atómica tem uma resolução tridimensional sub-nanométrica e pode identificar quimicamente átomos individuais usando espectrometria de massa de tempo de voo.[106]
Os espectros de estados excitados podem ser usados para analisar a composição atómica de estrelas distantes. Os comprimentos de onda específicos contidos na luz que é emitida pelas estrelas podem ser separados e comparados com as transições em átomos de gás livres. Estas cores podem então ser replicadas usando uma lâmpada de descarga de gás que contenha o mesmo elemento.[107] Foi através deste método que se descobriu o hélio no Sol, 23 anos antes de ser encontrado na Terra.[108]
História da teoria atómica
[editar | editar código-fonte]O termo átomo tem origem no grego ἄτομος (atomos, "indivisível"), formado a partir de ἀ- (a-, "não") e τέμνω (temnō, "cortar"),[109] o que significa qualquer coisa que não pode ser cortada ou que é indivisível.[110] O conceito de átomo enquanto componente indivisível da matéria foi inicialmente proposto por filósofos gregos e indianos. Só nos séculos XVIII e XIX é que foi estabelecida a explicação física para esta ideia, ao se ter verificado que havia um limite físico a partir do qual não era possível dividir determinadas substâncias através de métodos químicos. Esse limite era muito semelhante àquilo que o conceito filosófico de átomo da antiguidade descrevia. Durante o final do século XIX e início do século XX, foram descobertos vários componentes subatómicos e estruturas no interior do átomo, demonstrando assim que o "átomo químico" podia na realidade ser dividido, embora o nome tenha permanecido até aos nossos dias.[111][112]
Antiguidade
[editar | editar código-fonte]O conceito de que a matéria é constituída por unidades individuais e que não pode ser dividida em quantidades cada vez mais pequenas de forma arbitrária existe desde a Antiguidade. No entanto, este conceito tinha por base noções filosóficas, e não o experimentalismo ou a observação empírica. A natureza dos átomos em filosofia variou consideravelmente ao longo do tempo e entre culturas e escolas de pensamento, tendo muitas vezes associados elementos espirituais. As primeiras referências ao conceito de átomo datam da antiguidade indiana no século VI a.C.[113] As escolas Nyaya e Vaisheshika desenvolveram teorias complexas sobre como os átomos se combinavam entre si para formar objetos mais complexos, primeiro em pares e depois em trios de pares.[114][115] No Ocidente, as primeiras referências aos átomos surgem um século mais tarde com Leucipo, cujo pensamento foi sistematizado pelo seu aluno Demócrito, que por volta 450 a.C. cunhou o termo átomos. Embora nos conceitos indiano e grego os átomos se baseassem exclusivamente na filosofia, a ciência moderna viria a adotar séculos mais tarde o nome proposto por Demócrito.[116]
Primeiras teorias científicas
[editar | editar código-fonte]
Até ao desenvolvimento da química pouco ou nenhum progresso ocorreu no conceito de átomo. No entanto, o conceito básico de átomo explicava de forma precisa as novas descobertas que estavam a acontecer no campo da química.[116] Em 1661, o filósofo naturalista Robert Boyle publicou The Sceptical Chymist, em que argumentava que a matéria era constituída por várias combinações de "corpúsculos" ou átomos, em vez dos elementos clássicos da terra, ar, fogo e água.[117] A obra também forneceu a primeira definição de "elemento químico": um corpo simples e não misturado que não pode ser feito de outro corpo. Embora esta definição tenha sido negligenciada ao longo do século seguinte, o trabalho de Boyle é hoje considerado um marco da história da química por separar a alquimia da química.[118] É uma definição semelhante de elemento químico que consta no Traité Élémentaire de Chimie, escrito em 1789 pelo nobre e investigador científico francês Antoine Lavoisier, e que viria a dominar a química no século seguinte.[119]
Ao longo do século XVIII, foram descobertos diversos elementos químicos, tais como a platina (1735),[120] o níquel (1751),[121] o magnésio (1755)[122] e o oxigénio (1771).[123][124] Porém, ainda não havia sido formulada uma teoria que explicasse uma relação inequívoca entre os átomos e os elementos químicos. Com a sistematização da Lei das proporções definidas por Joseph Louis Proust e a lei da conservação da massa por Antoine Lavoisier, foi consolidado o conhecimento que permitiu ao inglês John Dalton explicar em 1803, a partir do conceito de átomo, o motivo pelo qual os elementos reagem sempre numa pequena razão de números inteiros e o porquê de certos gases se dissolverem melhor na água do que outros. Dalton propôs que cada elemento fosse constituído por átomos de um único tipo e que grupos de átomos diferentes formariam os compostos químicos. Isto possibilitou o cálculo da massa atómica relativa dos átomos e a identificação de uma relação inequívoca entre um dado átomo e o respectivo elemento químico.[125][126] Por esse feito, Dalton é considerado o pioneiro da teoria atómica moderna.[127]
Em 1817 Johann Wolfgang Döbereiner observou que os elementos podiam ser agrupados em grupos de três com propriedades semelhantes, ideia também desenvolvida por Leopold Gmelin que identificou grupos de quatro ou cinco elementos com propriedades semelhantes.[128] A ideia de organizar os elementos conforme as suas propriedades foi mais tarde desenvolvida por outros cientistas como Alexandre-Emile Béguyer de Chancourtois, Julius Lothar Meyer e John Newlands, culminando com a publicação da tabela periódica de Dmitri Mendeleev em 1871. Ao contrário das tabelas anteriores, a tabela proposta por Mendeleev antevia as propriedades de elementos que ainda não tinham sido isolados e dispunha de espaços vazios na sua estrutura para posterior preenchimento.[129]
A teoria das partículas (e, por conseguinte, a teoria atómica) foi validada em 1827, quando o botânico Robert Brown observou ao microscópio partículas de pó a flutuar na água e descobriu que se moviam erraticamente — um fenómeno que veio a ficar conhecido como movimento browniano. Em 1877, J. Desaulx sugeriu que o fenómeno era causado pelo movimento térmico das moléculas de água e, em 1905, Albert Einstein publicou a primeira descrição matemática desse movimento, confirmando assim a hipótese.[130][131][132] O físico francês Jean Perrin utilizou o trabalho de Einstein para determinar experimentalmente a massa e a dimensão dos átomos, o que constituiu uma forte evidência experimental a favor da teoria atómica de Dalton.[133]
Descoberta do eletrão e do núcleo
[editar | editar código-fonte]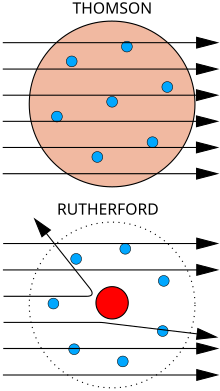
Em cima: os resultados esperados de acordo com o modelo de Thomson; as partículas alfa passariam pelo átomo com desvio irrisório.
Em baixo: os resultados observados, que deram mais tarde origem ao modelo de Rutherford; uma pequena parte das partículas foram desviadas pala concentração de carga positiva do núcleo.
O físico Joseph John Thomson, através do seu trabalho com raios catódicos em tubos de Crookes, descobriu em 1897 o eletrão e a sua natureza subatómica, o que destruiu o conceito de átomos enquanto unidades indivisíveis.[134] O tubo de Crookes consiste numa ampola que contém apenas vácuo e um dispositivo elétrico que faz os eletrões de qualquer material condutor saltar e formar feixes, que são os próprios raios catódicos. Thomson descobriu que os raios catódicos são afetados por campos elétricos e magnéticos, e deduziu que a deflexão dos raios catódicos por estes campos são desvios de trajetória de partículas muito pequenas de carga negativa — os eletrões. Thomson acreditava que os eletrões se encontravam distribuídos pelo átomo, com a respetiva carga elétrica equilibrada pela presença de um mar uniforme de carga positiva — o modelo atómico de Thomson.[135]
No entanto, em 1909, um grupo de investigadores sob a orientação do físico Ernest Rutherford bombardeou uma folha de ouro com iões de hélio e descobriu que uma pequena percentagem era defletida com ângulos muito maiores do que aqueles que eram previsíveis segundo o modelo de Thomson. Rutherford interpretou a experiência da folha de ouro como uma sugestão de que a carga positiva de um átomo e a maioria da sua massa estavam concentradas num núcleo no centro do átomo, enquanto os eletrões orbitavam à sua volta de forma semelhante aos planetas à volta do sol — o modelo atómico de Rutherford. Os iões de hélio com carga positiva perto deste núcleo denso seriam então defletidos em ângulos muito maiores.[136]
Descoberta dos isótopos
[editar | editar código-fonte]Ao fazer experiências com produtos do decaimento radioativo, em 1913 o radioquímico Frederick Soddy descobriu que parecia existir mais do que um tipo de átomo em cada posição da tabela periódica.[137] O termo isótopo foi cunhado por Margaret Todd para descrever os diferentes átomos que pertencessem ao mesmo elemento. Thomson criou uma técnica para separar os tipos de átomo através do seu trabalho com gases ionizados, o que posteriormente levou à descoberta dos isótopos estáveis.[138]
Modelo de Bohr
[editar | editar código-fonte]Em 1913, o físico Niels Bohr propôs um modelo no qual se assumia que os eletrões de um átomo orbitavam o núcleo, mas que só o podiam fazer ao longo de um conjunto finito de órbitas e que podiam saltar entre estas órbitas apenas através de alterações de energia correspondentes à absorção ou radiação de um fotão.[139] Esta quantificação foi usada para explicar porque é que as órbitas dos eletrões são estáveis (dado que, normalmente, as cargas em aceleração perdem energia cinética que é emitida na forma de radiação eletromagnética — ver radiação sincrotrónica) e porque é que os elementos absorvem e emitem radiação eletromagnética em espectros diferentes.[140]
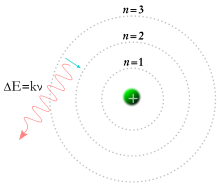
Mais tarde no mesmo ano, Henry Moseley forneceu ainda mais evidências experimentais que sustentavam a teoria de Bohr. Estas evidências reforçavam os modelos de Rutheford e Van den Broek, que propunham que o átomo contém no seu núcleo um número de cargas nucleares positivas igual ao seu número atómico na tabela periódica. Até estas experiências, desconhecia-se que o número atómico fosse uma quantidade física e experimental. Esta equivalência continua a ser o modelo atómico aceite atualmente.[141]
Ligações químicas
[editar | editar código-fonte]As ligações químicas entre átomos foram explicadas por Gilbert Newton Lewis, em 1916, como as interações entre os seus eletrões.[142] Uma vez já se conhecia que as propriedades químicas dos elementos se repetiam de acordo com a lei periódica,[143] em 1919 o químico norte-americano Irving Langmuir sugeriu que isto podia ser explicado se os eletrões de um átomo estivessem de alguma forma ligados. Assim, pensava-se que os grupos de eletrões ocupavam um conjunto de camadas de eletrões à volta do núcleo.[144]
Física quântica
[editar | editar código-fonte]A experiência de Stern-Gerlach de 1922 forneceu mais evidências da natureza quântica do átomo. Quando um feixe de átomos de prata atravessou um campo magnético especialmente concebido, o feixe dividiu-se com base na direção do momento angular do átomo, ou spin. Uma vez que esta direção é aleatória, era espectável que feixe se propagasse numa linha. Em vez disso, o feixe dividiu-se em duas partes, dependendo se o spin atómico estava orientado para cima ou para baixo.[145]
Com base na proposta de Louis de Broglie de 1924 de que as partículas se comportavam até determinado ponto como ondas, em 1926 Erwin Schrödinger desenvolveu um modelo matemático do átomo que descrevia os eletrões como formas de onda tridimensionais, em vez de partículas pontuais. Uma das consequências de usar formas de onda para descrever os eletrões é que é matematicamente impossível obter valores precisos tanto para a posição como para o momento de determinada partícula ao mesmo tempo. Isto veio a ser conhecido por princípio da incerteza. Segundo este conceito, por cada medição de uma posição só é possível obter uma gama de valores prováveis para o momento, e vice-versa. Embora este modelo fosse difícil de conceber visualmente, foi capaz de explicar alguma observações do comportamento dos átomos que os modelos anteriores não conseguiam, tais como determinados padrões estruturais e espectrais de átomos maiores que o hidrogénio. Assim, o modelo planetário do átomo foi depreciado a favor de um que descrevia as zonas orbitais à volta do núcleo em que fosse mais provável existirem eletrões.[146][147]
Descoberta do neutrão
[editar | editar código-fonte]O desenvolvimento do espectómetro de massa tornou possível medir de forma exata a massa dos átomos. O aparelho usa um íman para desviar a trajetória de um feixe de iões, sendo a quantidade de defleção determinada pela proporção da massa atómica em relação à sua carga. O químico Francis William Aston usou um espectómetro para demonstrar que os isótopos tinham diferentes massas. A massa destes isótopos variava conforme quantidades integrais, o que é denominado "regra do número inteiro".[148] A explicação para estes diferentes isótopos atómicos surgiu apenas com a descoberta em 1932 pelo físico James Chadwick do neutrão — uma partícula de carga neutra com uma massa semelhante ao protão. Até então, os isótopos eram explicados como elementos com o mesmo número de protões, mas diferente número de neutrões no interior do núcleo.[149]
Fissão, alta energia e matéria condensada
[editar | editar código-fonte]
Em 1938, o químico alemão Otto Hahn, estudante de Rutherford, direcionou neutrões para átomos de urânio esperando obter elementos transurânicos. Em vez disso, o resultado das suas experiências foi bário.[150] Um ano mais tarde, Lise Meitner e o seu sobrinho Otto Frisch verificaram que os resultados de Hahn foram na realidade a primeira fissão nuclear experimental.[151][152] Em 1944, Hahn recebeu o prémio Nobel de química. No entanto, apesar dos seus esforços nesse sentido, as contribuições de Meitner e Frisch não foram reconhecidos.[153]
Na década de 1950, o desenvolvimento de melhores aceleradores de partículas e detectores de partículas permitiu aos cientistas estudar os impactos dos átomos em movimento a alta energia.[154] Verificou-se que os protões e os neutrões eram hadrões, ou comósitos de partículas ainda mais pequenas denominadas quarks. Foram desenvolvidos modelos padrão de física nuclear que explicavam de forma eficaz as propriedades do núcleo em termos destas partículas sub-atómicas e as forças que governavam as interações entre si.[155]
Por volta de 1985, Steven Chu e a sua equipa nos Bell Labs desenvolveram uma técnica para diminuir a temperatura dos átomos usando lasers. No mesmo ano, uma equipa liderada por William Daniel Phillips conseguiu reter átomos de sódio numa armadilha magnética. A conjugação destas duas técnicas e um método baseado no Efeito Doppler, desenvolvido por Claude Cohen-Tannoudji, permitiu que pequenos grupos de átomos fossem arrefecidos para alguns microkelvins. Isto permitiu que os átomos fossem estudados com elevada precisão, o que mais tarde veio a permitir a descoberta do condensado de Bose-Einstein.[156]
Em termos históricos, os átomos individuais sempre foram proibitivamente pequenos para terem aplicações científicas. No entanto, recentemente têm sido construídos aparelhos que usam um único átomo de metal ligado por ligantes orgânicos para construir um transístor de eletrão único.[157] Têm sido realizadas experiências para reter e abrandar átomos individuais através de arrefecimento a laser, de modo a melhorar a compreensão da matéria.[158]
Ver também
[editar | editar código-fonte]Notas
[editar | editar código-fonte]- ↑ Para atualizações, verificar o Quadro Interativo de Nuclídeos do Laboratório Nacional de Brookhaven.
- ↑ Um quilate são 200 milligramas. Por definição, o carbono-12 pesa 0,012 kg por mole. A constante de Avogadro define 6,022×1023 átomos por mole.
- ↑ Exceto no caso do hidrogénio-1, que é o único nuclídeo estável sem neutrões
- ↑ Um observador que observe os átomos de outra perspectiva, que não inclua o espectro contínuo no plano de fundo, verá em vez disso uma série de linhas espectrais dos fotões emitidas pelos átomos.
Referências
- ↑ Leigh, G. J., ed. (1990). International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry,Nomenclature of Organic Chemistry – Recommendations 1990. Oxford: Blackwell Scientific Publications. p. 35. ISBN 0-08-022369-9.
An atom is the smallest unit quantity of an element that is capable of existence whether alone or in chemical combination with other atoms of the same or other elements.
- ↑ «Radioactive Decays». Stanford Linear Accelerator Center. 15 de junho de 2009. Consultado em 4 de julho de 2009. Cópia arquivada em 7 de Junho de 2009
- ↑ Woan 2000, p. 8.
- ↑ MacGregor 1992, pp. 33–37.
- ↑ a b Particle Data Group (2002). «The Particle Adventure». Lawrence Berkeley Laboratory. Consultado em 3 de janeiro de 2007. Cópia arquivada em 4 de Janeiro de 2007
- ↑ a b Schombert, James (18 de abril de 2006). «Elementary Particles». University of Oregon. Consultado em 3 de janeiro de 2007
- ↑ Jevremovic 2005, p. 63.
- ↑ Pfeffer 2000, pp. 330–336.
- ↑ Wenner, Jennifer M. (10 de outubro de 2007). «How Does Radioactive Decay Work?». Carleton College. Consultado em 9 de janeiro de 2008
- ↑ a b c Raymond, David (7 de abril de 2006). «Nuclear Binding Energies». New Mexico Tech. Consultado em 3 de janeiro de 2007. Arquivado do original em 11 de Dezembro de 2006
- ↑ Mihos, Chris (23 de julho de 2002). «Overcoming the Coulomb Barrier». Case Western Reserve University. Consultado em 13 de fevereiro de 2008
- ↑ Staff (30 de março de 2007). «ABC's of Nuclear Science». Lawrence Berkeley National Laboratory. Consultado em 3 de janeiro de 2007. Cópia arquivada em 5 de Dezembro de 2006
- ↑ Makhijani, Arjun; Saleska, Scott (2 de março de 2001). «Basics of Nuclear Physics and Fission». Institute for Energy and Environmental Research. Consultado em 3 de janeiro de 2007. Cópia arquivada em 16 de Janeiro de 2007
- ↑ Shultis & Faw 2002, pp. 10–17.
- ↑ Fewell, M. P. (1995). «The atomic nuclide with the highest mean binding energy». American Journal of Physics. 63 (7): 653–658. Bibcode:1995AmJPh..63..653F. ISSN 0002-9505. doi:10.1119/1.17828
- ↑ Close 2002, pp. 39-44.
- ↑ Mulliken, Robert S. (1967). «Spectroscopy, Molecular Orbitals, and Chemical Bonding». Science. 157 (3784): 13–24. Bibcode:1967Sci...157...13M. PMID 5338306. doi:10.1126/science.157.3784.13
- ↑ a b Brucat, Philip J. (2008). «The Quantum Atom». Universidade da Flórida. Consultado em 4 de janeiro de 2007. Cópia arquivada em 7 de Dezembro de 2006
- ↑ Manthey, David (2001). «Atomic Orbitals». Orbital Central. Consultado em 21 de janeiro de 2008. Cópia arquivada em 10 de Janeiro de 2008
- ↑ Herter, Terry (2006). «Lecture 8: The Hydrogen Atom». Cornell University. Consultado em 14 de fevereiro de 2008
- ↑ Bell, R. E.; L. G. Elliott (1950). «Gamma-Rays from the Reaction H1(n,γ)D2 and the Binding Energy of the Deuteron». Physical Review. 79 (2): 282–285. Bibcode:1950PhRv...79..282B. doi:10.1103/PhysRev.79.282
- ↑ Smirnov 2003, pp. 249–272.
- ↑ Weiss, Rick (17 de outubro de 2006). «Scientists Announce Creation of Atomic Element, the Heaviest Yet». Washington Post. Consultado em 21 de dezembro de 2007
- ↑ a b Sills 2003, pp. 131–134.
- ↑ Dumé, Belle (23 de abril de 2003). «Bismuth breaks half-life record for alpha decay». Physics World. Consultado em 21 de dezembro de 2007. Cópia arquivada em 14 de Dezembro de 2007
- ↑ Lindsay, Don (30 de julho de 2000). «Radioactives Missing From The Earth». Don Lindsay Archive. Consultado em 23 de maio de 2007. Cópia arquivada em 28 de Abril de 2007
- ↑ Tuli, Jagdish K. (Abril de 2005). «Nuclear Wallet Cards». National Nuclear Data Center, Brookhaven National Laboratory. Consultado em 16 de abril de 2011
- ↑ a b WM Haynes. «CRC Handbook of Chemistry and Physics»
- ↑ Contemporary Physics Education Project (2003). «2—The Atomic Nucleus». Nuclear Science—A Guide to the Nuclear Science Wall Chart (PDF). [S.l.: s.n.] pp. 2–3
- ↑ a b Mills et al. (1993).
- ↑ Chieh, Chung (22 de janeiro de 2001). «Nuclide Stability». Universidade de Waterloo. Consultado em 4 de janeiro de 2007. Arquivado do original em 30 de agosto de 2007
- ↑ «Atomic Weights and Isotopic Compositions for All Elements». National Institute of Standards and Technology. Consultado em 4 de janeiro de 2007. Cópia arquivada em 31 de Dezembro de 2006
- ↑ Audi, G.; Wapstra, A.H.; Thibault, C. (2003). «The Ame2003 atomic mass evaluation (II)». Nuclear Physics A. 729 (1): 337–676. Bibcode:2003NuPhA.729..337A. doi:10.1016/j.nuclphysa.2003.11.003
- ↑ Shannon, R. D. (1976). «Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides». Acta Crystallographica A. 32 (5): 751. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551
- ↑ Dong, Judy (1998). «Diameter of an Atom». The Physics Factbook. Consultado em 19 de novembro de 2007. Cópia arquivada em 4 de Novembro de 2007
- ↑ Zumdahl (2002).
- ↑ Bethe, H. (1929). «Termaufspaltung in Kristallen». Annalen der Physik. 395 (2): 133. Bibcode:1929AnP...395..133B. doi:10.1002/andp.19293950202
- ↑ Birkholz, M.; Rudert, R. (2008). «Interatomic distances in pyrite-structure disulfides – a case for ellipsoidal modeling of súlfur ions» (PDF). Physica Status Solidi (b). 245 (9): 1858. Bibcode:2008PSSBR.245.1858B. doi:10.1002/pssb.200879532
- ↑ «Small Miracles: Harnessing nanotechnology». Oregon State University. 2007. Consultado em 7 de janeiro de 2007
- ↑ Padilla et al. (2002:32)
- ↑ Feynman 1995, p. 5.
- ↑ a b «Radioactivity». Splung.com. Consultado em 19 de dezembro de 2007. Cópia arquivada em 4 de Dezembro de 2007
- ↑ L'Annunziata 2003, pp. 3–56.
- ↑ a b Firestone, Richard B. (22 de maio de 2000). «Radioactive Decay Modes». Berkeley Laboratory. Consultado em 7 de janeiro de 2007. Arquivado do original em 29 de Setembro de 2006
- ↑ Hornak, J. P. (2006). «Chapter 3: Spin Physics». The Basics of NMR. Rochester Institute of Technology. Consultado em 7 de janeiro de 2007. Cópia arquivada em 3 de Fevereiro de 2007
- ↑ a b Schroeder, Paul A. (25 de fevereiro de 2000). «Magnetic Properties». University of Georgia. Consultado em 7 de janeiro de 2007. Arquivado do original em 29 de Abril de 2007
- ↑ Goebel, Greg (1 de setembro de 2007). «[4.3] Magnetic Properties of the Atom». Elementary Quantum Physics. Consultado em 7 de janeiro de 2007. Arquivado do original em 21 de agosto de 2011
- ↑ Liang & Haacke 1999, pp. 412–426.
- ↑ Yarris, Lynn (Primavera de 1997). «Talking Pictures». Berkeley Lab Research Review. Consultado em 9 de janeiro de 2008. Cópia arquivada em 13 de Janeiro de 2008
- ↑ Zeghbroeck, Bart J. Van (1998). «Energy levels». Shippensburg University. Consultado em 23 de dezembro de 2007. Arquivado do original em 15 de Janeiro de 2005
- ↑ Fowles (1989).
- ↑ Martin, W. C.; Wiese, W. L. (maio de 2007). «Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas». National Institute of Standards and Technology. Consultado em 8 de janeiro de 2007
- ↑ «Atomic Emission Spectra - Origin of Spectral Lines». Avogadro Web Site. Consultado em 10 de agosto de 2006. Arquivado do original em 28 de Fevereiro de 2006
- ↑ Fitzpatrick, Richard (16 de fevereiro de 2007). «Fine structure». University of Texas at Austin. Consultado em 14 de fevereiro de 2008
- ↑ Weiss, Michael (2001). «The Zeeman Effect». University of California-Riverside. Consultado em 6 de fevereiro de 2008
- ↑ Beyer (2003).
- ↑ Watkins, Thayer. «Coherence in Stimulated Emission». San José State University. Consultado em 23 de dezembro de 2007
- ↑ Reusch, William (16 de julho de 2007). «Virtual Textbook of Organic Chemistry». Michigan State University. Consultado em 11 de janeiro de 2008. Arquivado do original em 29 de Outubro de 2007
- ↑ Husted, Robert; et al. (11 de dezembro de 2003). «Periodic Table of the Elements». Los Alamos National Laboratory. Consultado em 11 de janeiro de 2008
- ↑ Baum, Rudy (2003). «It's Elemental: The Periodic Table». Chemical & Engineering News. Consultado em 11 de janeiro de 2008
- ↑ Goodstein (2002).
- ↑ Brazhkin, Vadim V. (2006). «Metastable phases, phase transformations, and phase diagrams in physics and chemistry». Physics-Uspekhi. 49: 719–24. doi:10.1070/PU2006v049n07ABEH006013
- ↑ Myers (2003).
- ↑ Staff (9 de outubro de 2001). «Bose-Einstein Condensate: A New Form of Matter». National Institute of Standards and Technology. Consultado em 16 de janeiro de 2008
- ↑ Colton, Imogen; Fyffe, Jeanette (3 de fevereiro de 1999). «Super Atoms from Bose-Einstein Condensation». The University of Melbourne. Cópia arquivada em 8 de fevereiro de 2007
- ↑ «Density Parameter, Omega». hyperphysics.phy-astr.gsu.edu. Consultado em 13 de dezembro de 2021
- ↑ Gary Hinshaw (10 de fevereiro de 2006). «What is the Universe Made Of?». NASA/WMAP. Consultado em 7 de janeiro de 2008
- ↑ Choppin 2001.
- ↑ Davidsen, Arthur F. (1993). «Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission». Science. 259 (5093): 327–34
- ↑ Lequeux (2005).
- ↑ Smith, Nigel (6 de janeiro de 2000). «The search for dark matter». Physics World. Consultado em 14 de fevereiro de 2008
- ↑ Croswell, Ken (1991). «Boron, bumps and the Big Bang: Was matter spread evenly when the Universe began? Perhaps not; the clues lie in the creation of the lighter elements such as boron and beryllium». New Scientist (1794). 42 páginas. Consultado em 14 de janeiro de 2008
- ↑ Copi, Craig J.; Schramm, David N.; Turner, Michael S (1995). «Big-Bang Nucleosynthesis and the Baryon Density of the Universe» (PDF). Science. 267: 192–99. PMID 7809624
- ↑ Gary Hinshaw (15 de dezembro de 2005). «Tests of the Big Bang: The Light Elements». NASA/WMAP. Consultado em 13 de janeiro de 2008
- ↑ Abbott, Brian (30 de maio de 2007). «Microwave (WMAP) All-Sky Survey». Hayden Planetarium. Consultado em 13 de janeiro de 2008
- ↑ Hoyle, F. (1946). «The synthesis of the elements from hydrogen». Monthly Notices of the Royal Astronomical Society. 106: 343–83
- ↑ Knauth, D. C.; Federman, S. R.; Lambert, David L.; Crane, P. (2000). «Newly synthesized lithium in the interstellar medium». Nature. 405: 656–58. doi:10.1038/35015028
- ↑ Stepan G. Mashnik (agosto de 2000). «On Solar System and Cosmic Rays Nucleosynthesis and Spallation Processes». Cornell University. Consultado em 14 de janeiro de 2008
- ↑ Kansas Geological Survey (4 de maio de 2005). «Age of the Earth». University of Kansas. Consultado em 14 de janeiro de 2008. Arquivado do original em 5 de Julho de 2008
- ↑ Manuel (2001).
- ↑ Dalrymple, G. Brent (2001). «The age of the Earth in the twentieth century: a problem (mostly) solved». Geological Society, London, Special Publications. 190: 205–21. doi:10.1144/GSL.SP.2001.190.01.14. Consultado em 14 de janeiro de 2008
- ↑ Anderson, Don L.; Foulger, G. R.; Meibom, Anders (2 de setembro de 2006). «Helium: Fundamental models». MantlePlumes.org
- ↑ Pennicott, Katie (10 de maio de 2001). «Carbon clock could show the wrong time». PhysicsWeb. Consultado em 14 de janeiro de 2008
- ↑ Yarris, Lynn (27 de julho de 2001). «New Superheavy Elements 118 and 116 Discovered at Berkeley Lab». Berkeley Lab. Consultado em 14 de janeiro de 2008. Arquivado do original em 9 de Janeiro de 2008
- ↑ Diamond, H.; et al. (1960). «Heavy Isotope Abundances in Mike Thermonuclear Device». Physical Review. 119: 2000–04. Consultado em 14 de janeiro de 2008
- ↑ Poston Sr., John W. (23 de março de 1998). «Do transuranic elements such as plutonium ever occur naturally?». Scientific American. Consultado em 15 de janeiro de 2008
- ↑ Keller, C. (1973). «Natural occurrence of lanthanides, actinides, and superheavy elements». Chemiker Zeitung. 97 (10): 522–30. Consultado em 15 de janeiro de 2008
- ↑ Marco 2001.
- ↑ Manuel 2001.
- ↑ «Oklo Fossil Reactors». Curtin University of Technology. Consultado em 15 de janeiro de 2008. Arquivado do original em 18 de Dezembro de 2007
- ↑ Weisenberger, Drew. «How many atoms are there in the world?». Jefferson Lab. Consultado em 16 de janeiro de 2008
- ↑ Pidwirny, Michael. «Fundamentals of Physical Geography». University of British Columbia Okanagan. Consultado em 16 de janeiro de 2008
- ↑ Anderson, Don L. (2002). «The inner inner core of Earth». Proceedings of the National Academy of Science. 99 (22): 13966–68. doi:10.1073/pnas.232565899
- ↑ Anónimo (2 de outubro de 2001). «Second postcard from the island of stability». CERN Courier. Consultado em 14 de janeiro de 2008
- ↑ Jacoby, Mitch (2006). «As-yet-unsynthesized superheavy atom should form a stable diatomic molecule with fluorine». Chemical & Engineering News. 84 (10). 19 páginas
- ↑ Koppes, Steve (1 de março de 1999). «Fermilab Physicists Find New Matter-Antimatter Asymmetry». University of Chicago. Consultado em 14 de janeiro de 2008
- ↑ Cromie, William J. (16 de agosto de 2001). «A lifetime of trillionths of a second: Scientists explore antimatter». Harvard University Gazette. Consultado em 14 de janeiro de 2008. Arquivado do original em 28 de agosto de 2008
- ↑ Hijmans, Tom W. (2002). «Particle physics: Cold antihydrogen». Nature. 419: 439–40. doi:10.1038/419439a
- ↑ Staff (30 de outubro de 2002). «Researchers 'look inside' antimatter». BBC News. Consultado em 14 de janeiro de 2008
- ↑ Barrett, Roger; Jackson, Daphne; Mweene, Habatwa (1990). «The Strange World of the Exotic Atom». New Scientist (1728): 77–115. Consultado em 4 de janeiro de 2008. Arquivado do original em 21 de Dezembro de 2007
- ↑ Indelicato, Paul (2004). «Exotic Atoms». Physica Scripta. T112: 20–26. doi:10.1238/Physica.Topical.112a00020
- ↑ Ripin, Barrett H. (julho de 1998). «Recent Experiments on Exotic Atoms». American Physical Society. Consultado em 15 de fevereiro de 2008
- ↑ Jacox, Marilyn; Gadzuk, J. William (novembro de 1997). «Scanning Tunneling Microscope». National Institute of Standards and Technology. Consultado em 11 de janeiro de 2008. Cópia arquivada em 7 de Janeiro de 2008
- ↑ «The Nobel Prize in Physics 1986». The Nobel Foundation. Consultado em 11 de janeiro de 2008
- ↑ Jakubowskia, N.; Moensb, L.; Vanhaeckeb, F (1998). «Sector field mass spectrometers in ICP-MS». Spectrochimica Acta Part B: Atomic Spectroscopy. 53 (13): 1739–63. doi:10.1016/S0584-8547(98)00222-5
- ↑ Müller, Erwin W.; Panitz, J. A.; McLane, S. Brooks (1968). «The Atom-Probe Field Ion Microscope». Review of Scientific Instruments. 39 (1): 83–86. ISSN 0034-6748. doi:10.1063/1.1683116
- ↑ Lochner, Jim; Gibb, Meredith; Newman, Phil (30 de abril de 2007). «What Do Spectra Tell Us?». NASA/Goddard Space Flight Center. Consultado em 3 de janeiro de 2008
- ↑ Winter, Mark (2007). «Helium». WebElements. Consultado em 3 de janeiro de 2008
- ↑ Liddell, Henry George; Scott, Robert. «A Greek-English Lexicon». Perseus Digital Library
- ↑ Liddell, Henry George; Scott, Robert. «ἄτομος». A Greek-English Lexicon. Perseus Digital Library. Consultado em 21 de junho de 2010
- ↑ Haubold, Hans; A.M. Mathai (1998). «Microcosmos: From Leucippus to Yukawa». Structure of the Universe. Consultado em 17 de janeiro de 2008
- ↑ Harrison 2003, pp. 123–139.
- ↑ McEvilley 2002, p. 317.
- ↑ King 1999, pp. 105–107.
- ↑ Teresi 2003, pp. 213–214.
- ↑ a b Ponomarev 1993, pp. 14–15.
- ↑ Siegfried 2002.
- ↑ Rouvray 2004.
- ↑ Giunta 1996.
- ↑ «78 Platinum». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ «28 Nickel». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ «12 Magnesium». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ «08 Oxygen». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ Cook, Gerhard A.; Lauer, Carol M. (1968). «Oxygen». In: Clifford A. Hampel. The Encyclopedia of the Chemical Elements. Nova Iorque: Reinhold Book Corporation. pp. 499–500. LCCN 68-29938
- ↑ Wurtz 1881, pp. 1–2.
- ↑ Tolentino, Mario; Rocha-Filho, Romeu C.; Chagas, Aécio Pereira (1997). «Alguns aspectos históricos da classificação periódica dos elementos químicos» (PDF) 1 ed. Química Nova. 20: 103-117. ISSN 0100-4042
- ↑ Roscoe 1895, pp. 129.
- ↑ Horvitz, Leslie (2002). Eureka!: Scientific Breakthroughs That Changed The World. Nova Iorque: John Wiley. p. 43. ISBN 978-0-471-23341-1. OCLC 50766822
- ↑ Venable, F P (1896). The development of the periodic law. Easton: Chemical Publishing Company. pp. 96–97, 100–102
- ↑ Mazo 2002, pp. 1–7.
- ↑ Einstein, Albert (1905). «Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen» (PDF). Annalen der Physik (em alemão). 322 (8): 549–560. Bibcode:1905AnP...322..549E. doi:10.1002/andp.19053220806. Consultado em 4 de fevereiro de 2007
- ↑ Lee, Y.K.; Hoon, K. (1995). «Brownian Motion». Imperial College. Consultado em 18 de dezembro de 2007. Arquivado do original em 18 de dezembro de 2007
- ↑ Patterson, G. (2007). «Jean Perrin and the triumph of the atomic doctrine». Endeavour. 31 (2): 50–53. PMID 17602746. doi:10.1016/j.endeavour.2007.05.003
- ↑ The Nobel Foundation. «J.J. Thomson». Consultado em 19 de agosto de 2015
- ↑ The Columbia Electronic Encyclopedia, 6ª ed. (2012). «Crookes tube». Consultado em 31 de março de 2014
- ↑ Rutherford, E. (1911). «The Scattering of α and β Particles by Matter and the Structure of the Atom». Philosophical Magazine. 21: 669–88
- ↑ Nobel Foundation. «Frederick Soddy, The Nobel Prize in Chemistry 1921». Consultado em 18 de agosto de 2015
- ↑ Thomson, Joseph John (1913). «Rays of positive electricity». Proceedings of the Royal Society. A 89: 1–20
- ↑ Stern 2005.
- ↑ Bohr 1922.
- ↑ Pais, Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. Nova Iorque: Oxford University Press. pp. 228–230. ISBN 0-19-851971-0
- ↑ Lewis 1916.
- ↑ Scerri, Eric R. (2007). The periodic table: its story and its significance. [S.l.]: Oxford University Press US. pp. 205–226. ISBN 0-19-530573-6
- ↑ Langmuir 1919.
- ↑ Scully 1987.
- ↑ Brown, Kevin (2007). «The Hydrogen Atom». MathPages. Consultado em 21 de dezembro de 2007
- ↑ Harrison, David M. (Março de 2000). «The Development of Quantum Mechanics». University of Toronto. Consultado em 21 de dezembro de 2007
- ↑ Aston, Francis W. (1920). «The constitution of atmospheric neon». Philosophical Magazine. 39 (6): 449–55
- ↑ Chadwick, James. «Nobel Lecture: The Neutron and Its Properties». Nobel Foundation. Consultado em 21 de dezembro de 2007
- ↑ Chemical Heritage Foundation 2009.
- ↑ Meitner 1939.
- ↑ Schroeder 2003.
- ↑ Crawford 1997.
- ↑ Kullander, Sven. «Accelerators and Nobel Laureates». The Nobel Foundation. Consultado em 31 de janeiro de 2008
- ↑ The Nobel Foundation. «The Nobel Prize in Physics 1990». Consultado em 31 de janeiro de 2008
- ↑ Nobel Foundation. «The Nobel Prize in Physics 1997». Consultado em 10 de fevereiro de 2008
- ↑ Park, Jiwoong; et al. (2002). «Coulomb blockade and the Kondo effect in single-atom transistors». Nature. 417 (6890): 722–25. doi:10.1038/nature00791
- ↑ Domokos, P.; Janszky, J.; Adam, P. (1994). «Single-atom interference method for generating Fock states». Physical Review A. 50: 3340–44. doi:10.1103/PhysRevA.50.3340
Bibliografia
[editar | editar código-fonte]- L'Annunziata, Michael F. (2003). Handbook of Radioactivity Analysis. [S.l.]: Academic Press. ISBN 0-12-436603-1. OCLC 16212955
- Beyer, H. F.; Shevelko, V. P. (2003). Introduction to the Physics of Highly Charged Ions. [S.l.]: CRC Press. ISBN 0-7503-0481-2. OCLC 47150433
- Choppin, Gregory R.; Liljenzin, Jan-Olov; Rydberg, Jan (2001). Radiochemistry and Nuclear Chemistry. [S.l.]: Elsevier. ISBN 0-7506-7463-6. OCLC 162592180
- Close, FE; Marten, Michael; Sutton, Christine (2002). The Particle Odyssey: A Journey to the Heart of Matter. [S.l.]: Oxford University Press. ISBN 978-0198504863
- Crawford, E.; Sime, Ruth Lewin; Walker, Mark (1997). «A Nobel tale of postwar injustice». Physics Today. 50 (9): 26–32. Bibcode:1997PhT....50i..26C. doi:10.1063/1.881933
- Dalton, J. (1808). A New System of Chemical Philosophy, Part 1. London and Manchester: S. Russell
- Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics 1st ed. [S.l.]: Springer. ISBN 3-540-20631-0. OCLC 181435713
- Feynman, Richard (1995). Six Easy Pieces. [S.l.]: The Penguin Group. ISBN 978-0-14-027666-4. OCLC 40499574
- Fowles, Grant R. (1989). Introduction to Modern Optics. [S.l.]: Courier Dover Publications. ISBN 0-486-65957-7. OCLC 18834711
- Gangopadhyaya, Mrinalkanti (1981). Indian Atomism: History and Sources. Atlantic Highlands, New Jersey: Humanities Press. ISBN 0-391-02177-X. OCLC 10916778
- Goodstein, David L. (2002). States of Matter. [S.l.]: Courier Dover Publications. ISBN 0-13-843557-X
- Harrison, Edward Robert (2003). Masks of the Universe: Changing Ideas on the Nature of the Cosmos. [S.l.]: Cambridge University Press. ISBN 0-521-77351-2. OCLC 50441595
- Iannone, A. Pablo (2001). Dictionary of World Philosophy. [S.l.]: Routledge. ISBN 0-415-17995-5. OCLC 44541769
- Jevremovic, Tatjana (2005). Nuclear Principles in Engineering. [S.l.]: Springer. ISBN 0-387-23284-2. OCLC 228384008
- King, Richard (1999). Indian philosophy: an introduction to Hindu and Buddhist thought. [S.l.]: Edinburgh University Press. ISBN 0-7486-0954-7
- Langmuir, Irving (1919). «The Arrangement of Electrons in Atoms and Molecules». Journal of the American Chemical Society. 41 (6): 868–934. doi:10.1021/ja02227a002
- Lequeux, James (2005). The Interstellar Medium. [S.l.]: Springer. ISBN 3-540-21326-0. OCLC 133157789
- Levere, Trevor, H. (2001). Transforming Matter – A History of Chemistry for Alchemy to the Buckyball. [S.l.]: The Johns Hopkins University Press. ISBN 0-8018-6610-3
- Lewis, Gilbert N. (1916). «The Atom and the Molecule». Journal of the American Chemical Society. 38 (4): 762–786. doi:10.1021/ja02261a002
- Liang, Z.-P.; Haacke, E. M. (1999). Webster, J. G., ed. Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging. vol. 2. [S.l.]: John Wiley & Sons. pp. 412–26. ISBN 0-471-13946-7. doi:10.1109/SSBI.2002.1233976
- McEvilley, Thomas (2002). The shape of ancient thought: comparative studies in Greek and Indian philosophies. [S.l.]: Allworth Press. ISBN 1-58115-203-5
- MacGregor, Malcolm H. (1992). The Enigmatic Electron. [S.l.]: Oxford University Press. ISBN 0-19-521833-7. OCLC 223372888
- Meitner, Lise; Frisch, Otto Robert (1939). «Disintegration of uranium by neutrons: a new type of nuclear reaction». Nature. 143 (3615): 239–240. Bibcode:1939Natur.143..239M. doi:10.1038/143239a0
- Manuel, Oliver (2001). Origin of Elements in the Solar System: Implications of Post-1957 Observations. [S.l.]: Springer. ISBN 0-306-46562-0. OCLC 228374906
- Mazo, Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. [S.l.]: Oxford University Press. ISBN 0-19-851567-7. OCLC 48753074
- Mills, Ian; Cvitaš, Tomislav; Homann, Klaus; Kallay, Nikola; Kuchitsu, Kozo (1993). Quantities, Units and Symbols in Physical Chemistry 2nd ed. Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. ISBN 0-632-03583-8. OCLC 27011505
- Moran, Bruce T. (2005). Distilling Knowledge: Alchemy, Chemistry, and the Scientific Revolution. [S.l.]: Harvard University Press. ISBN 0-674-01495-2
- Myers, Richard (2003). The Basics of Chemistry. [S.l.]: Greenwood Press. ISBN 0-313-31664-3. OCLC 50164580
- Padilla, Michael J.; Miaoulis, Ioannis; Cyr, Martha (2002). Prentice Hall Science Explorer: Chemical Building Blocks. Upper Saddle River, New Jersey USA: Prentice-Hall, Inc. ISBN 0-13-054091-9. OCLC 47925884
- Pais, Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. ISBN 0-19-851971-0
- Pauling, Linus (1960). The Nature of the Chemical Bond. [S.l.]: Cornell University Press. ISBN 0-8014-0333-2. OCLC 17518275
- Pfeffer, Jeremy I.; Nir, Shlomo (2000). Modern Physics: An Introductory Text. [S.l.]: Imperial College Press. ISBN 1-86094-250-4. OCLC 45900880
- Ponomarev, Leonid Ivanovich (1993). The Quantum Dice. [S.l.]: CRC Press. ISBN 0-7503-0251-8. OCLC 26853108
- Roscoe, Henry Enfield (1895). John Dalton and the Rise of Modern Chemistry. Col: Century science series. New York: Macmillan. Consultado em 3 de abril de 2011
- Rouvray, Dennis H. (2004). «Elements in the history of the Periodic Table» 2 ed. Endeavour. 28: 69-74. ISSN 0160-9327. doi:10.1016/j.endeavour.2004.04.006
- Scerri, Eric R. (2007). The periodic table: its story and its significance. [S.l.]: Oxford University Press US. ISBN 0-19-530573-6
- Scully, Marlan O.; Lamb, Willis E.; Barut, Asim (1987). «On the theory of the Stern-Gerlach apparatus». Foundations of Physics. 17 (6): 575–583. Bibcode:1987FoPh...17..575S. doi:10.1007/BF01882788
- Shultis, J. Kenneth; Faw, Richard E. (2002). Fundamentals of Nuclear Science and Engineering. [S.l.]: CRC Press. ISBN 0-8247-0834-2. OCLC 123346507
- Siegfried, Robert (2002). From Elements to Atoms: A History of Chemical Composition. [S.l.]: DIANE. ISBN 0-87169-924-9. OCLC 186607849
- Sills, Alan D. (2003). Earth Science the Easy Way. [S.l.]: Barron's Educational Series. ISBN 0-7641-2146-4. OCLC 51543743
- Smirnov, Boris M. (2003). Physics of Atoms and Ions. [S.l.]: Springer. ISBN 0-387-95550-X
- Teresi, Dick (2003). Lost Discoveries: The Ancient Roots of Modern Science. [S.l.]: Simon & Schuster. pp. 213–214. ISBN 0-7432-4379-X
- Various (2002). Lide, David R., ed. Handbook of Chemistry & Physics 88th ed. [S.l.]: CRC. ISBN 0-8493-0486-5. OCLC 179976746. Consultado em 23 de maio de 2008. Cópia arquivada em 23 de Maio de 2008
- Woan, Graham (2000). The Cambridge Handbook of Physics. [S.l.]: Cambridge University Press. ISBN 0-521-57507-9. OCLC 224032426
- Wurtz, Charles Adolphe (1881). The Atomic Theory. New York: D. Appleton and company. ISBN 0-559-43636-X
- Zaider, Marco; Rossi, Harald H. (2001). Radiation Science for Physicians and Public Health Workers. [S.l.]: Springer. ISBN 0-306-46403-9. OCLC 44110319
- Zumdahl, Steven S. (2002). Introductory Chemistry: A Foundation 5th ed. [S.l.]: Houghton Mifflin. ISBN 0-618-34342-3. OCLC 173081482. Consultado em 5 de fevereiro de 2008. Cópia arquivada em 4 de Março de 2008
- Giunta, Carmen (1996). «Lavoisier's Elements of Chemistry». Le Moyne College. Consultado em 18 de agosto de 2015
- Stern, David P. (2005). «The Atomic Nucleus and Bohr's Early Model of the Atom». NASA/Goddard Space Flight Center. Consultado em 20 de dezembro de 2007
- Bohr, Niels (1922). «Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture». Nobel Foundation. Consultado em 16 de fevereiro de 2008
- Chemical Heritage Foundation (2009). «Otto Hahn, Lise Meitner and Fritz Strassmann». Chemical Achievers: The Human Face of the Chemical Sciences. Consultado em 15 de setembro de 2009. Cópia arquivada em 24 de Outubro de 2009
- Schroeder, M. (2003). «Lise Meitner – Zur 125. Wiederkehr Ihres Geburtstages». Consultado em 4 de junho de 2009. Arquivado do original em 19 de Julho de 2011
Ligações externas
[editar | editar código-fonte]

