Eletroquímica

Eletroquímica (AO 1945: electroquímica)[1] é um dos ramos da físico-química que estuda as reações que envolvem transferência de elétrons para a transformação de energia química em energia elétrica e vice-versa; isto é, estuda reações de oxirredução ou redox.[2] Tal interconversão energética é de grande importância por ser a base do funcionamento de dispositivos como a pilha comum, em que há uma reação química espontânea que gera corrente elétrica. Além disso, é possível fazer o processo inverso: forçar reações químicas não espontâneas a ocorrerem aplicando uma corrente elétrica. Esse processo é denominado eletrólise.[3][4][5][6][7][8]
A história da eletroquímica está extremamente ligada à invenção da pilha por Alessandro Volta, em 1800, ao empilhar[nota 1] discos de cobre e zinco alternadamente. Também está diretamente relacionada ao desenvolvimento da teoria eletromagnética e da própria química, já que o entendimento do comportamento do elétron é essencial para formular os conceitos modernos de corrente elétrica e ligação química.
A eletroquímica tem grande presença no cotidiano, já que é usada em pilhas, um sistema que, espontaneamente, converte energia química em energia elétrica, por intermédio de um processo de oxirredução, onde a troca de elétrons se dá de maneira indireta, e baterias que, por sua vez, são utilizadas em aparelhos eletrônicos como telefone celular, controle remoto, lanterna, câmera de vídeo, calculadora, rádio, computador e outros.[9] Para além, a utilização de processos eletroquímicos como a galvanização em indústrias protege superfícies metálicas, evitando a corrosão de instalações e máquinas.[10]
História[editar | editar código-fonte]
Idade antiga[editar | editar código-fonte]
Já na antiguidade, o filósofo grego Tales de Mileto percebeu que, ao se esfregar um pedaço de âmbar em pele de carneiro, pedaços de palha eram atraídos pela pedra.[11][12] A palavra elétron (ἤλεκτρον) significa âmbar em grego.[13]
Arqueologicamente, especula-se que objetos encontrados no Iraque, datados de 250 a.C., seriam uma espécie de bateria, havendo debate quanto ao seu uso. Dentre as principais hipóteses estão o uso medicinal ou para a galvanoplastia de metais, a adição de uma pequena camada metálica de algum metal precioso à superfície de um menos precioso.[12][14]
Séculos XVI a XVIII[editar | editar código-fonte]

A partir do século XVI, foram feitos estudos mais aprofundados a respeito da natureza e das propriedades da eletricidade. O matemático e físico Girolamo Cardano tratou das diferenças entre fenômenos associados ao magnetismo e à eletrostática em seu livro De Subtilitate, publicado em 1550. No século seguinte, William Gilbert trouxe conceitos que se assemelham a concepções atuais do assunto com a publicação de sua obra De Magnete em 1600. Entre outras conclusões, Gilbert observou que alguns objetos, quando friccionados com outros, tinham a propriedade de atrair outros corpos, exercendo uma força sobre eles, designada força elétrica. Além disso, em sua obra, enunciava noções primitivas do que se concebe atualmente como carga elétrica e campo elétrico.[12] Em 1663, o físico alemão Otto von Guericke criou o primeiro gerador elétrico, que produzia eletricidade estática ao aplicar fricção à máquina. O gerador foi feito de uma grande bola de enxofre dentro de um globo de gás. A bola foi rotacionada através de uma manivela e uma centelha elétrica foi produzida quando uma almofada foi esfregada na bola enquanto ela rotacionava. O globo poderia ser removido e usado como fonte para outros experimentos com eletricidade.[15]
Charles Augustin de Coulomb desenvolveu sua lei de atração eletrostática,[16] em 1785, expandindo a atuação da lei de repulsão proposta por Joseph Priestley na Inglaterra, que enunciava a dependência da força elétrica com o inverso do quadrado da distância.[17] Em 1786, o médico italiano Luigi Galvani descobriu que os músculos e nervos na perna de uma rã sofriam contração ou espasmo causados por corrente elétrica produzida a partir de um gerador de eletricidade estática. Publicou suas descobertas em De Viribus Electricitatis in Motu Musculari Commentarius (do latim, Comentários sobre a força elétrica nos movimentos musculares), em 1791. Em sua obra, Galvani erroneamente atribuiu o fenômeno observado ao conceito que denominou "eletricidade animal", e não aos metais em contato com as pernas do animal, acreditando que tal forma de eletricidade era diferente das formas já conhecidas: as "naturais", como raios em uma tempestade; e as "artificiais", como a eletricidade estática produzida por fricção.[12][18][19] Na virada do século XVIII, em 1800, o físico Alessandro Volta construiu sua famosa pilha ao empilhar, alternadamente, discos de cobre e zinco, separados por pedaços de tecido embebidos em solução de ácido sulfúrico. Tal dispositivo era capaz de espontaneamente produzir corrente elétrica simplesmente pela conexão de suas extremidades por um fio condutor elétrico. Ele demonstrou sua invenção, em 1801, para o então cônsul francês Napoleão Bonaparte.[18][20] Ao analisar o experimento de Galvani, Volta concluiu que a perna da rã era simplesmente um condutor de eletricidade que se contraía quando entrava em contato com dois metais diferentes.[18]
Século XIX[editar | editar código-fonte]

|

|

| ||
Humphry Davy
Retrato do século XIX |
Michael Faraday
Foto de cerca de 1861 |
Svante Arrhenius
Foto dos anos 1880 |
Em 1800, William Nicholson e Johann Wilhelm Ritter conseguiram decompôr, através de eletrólise, água pura em hidrogênio e oxigênio.[21] Após esse experimento, Ritter descobriu o processo de galvanoplastia.[22] Ele também observou que a quantidade de metal depositado e de oxigênio produzido durante uma eletrólise dependiam da distância entre os eletrodos.[23] Já em 1801, Ritter observou correntes decorrentes da transferência de calor, antecipando a descoberta da termeletricidade por Thomas Johann Seebeck.[24] No mesmo ano, Sir Humphry Davy promoveu a eletrólise de várias soluções com sais diversos através de corrente elétrica proveniente de uma pilha. Desse modo, isolou elementos químicos até então desconhecidos, como o sódio e o potássio, a partir de seus hidróxidos. Usando esse método, também investigou a natureza das seguintes substâncias: enxofre, nitrogênio e carbono; determinando que tais substâncias eram simples.[25]
A descoberta dos efeitos magnéticos em correntes elétricas por Hans Christian Ørsted, em 1820, foi imediatamente reconhecido como um marco no avanço científico de sua época, acarretando pesquisas mais aprofundadas na relação entre eletricidade e magnetismo. André-Marie Ampère prontamente repetiu o experimento de Ørsted, formulando e fundamentando-os matematicamente.[26] Em 1827, o cientista alemão Georg Ohm publicou sua lei que relaciona correntes elétricas e tensões em seu famoso livro Die galvanische Kette, mathematisch bearbeitet (O Circuito Galvânico Investigado Matematicamente, em português), e no qual ele detalhava completamente sua teoria da eletricidade.[27] O físico e químico britânico Michael Faraday realizou pesquisas e elaborou teorias que constituíram os fundamentos do eletromagnetismo, destacando-se a sua concepção de linhas de força para campos elétricos[28] e a sua descoberta, em 1831,[29] da indução magnética, ao produzir uma força eletromotriz em uma bobina pela variação de um campo magnético próximo a ela.[30] Além de tais descobertas que atualmente são fundamentais para compreender, por exemplo, as forças sofridas por elétrons devido a campos elétricos e magnéticos, Faraday contribuiu diretamente para a eletroquímica ao estudar a eletrólise de soluções de sais, ácidos e bases, que o levou a enunciar as leis básicas que regem esse processo em 1834, ao relacionar a ação química produzida pela corrente elétrica à quantidade de eletricidade.[31]
Josiah Willard Gibbs demonstrou, em 1875, que a possibilidade de uma reação química ocorrer poderia ser avaliada pela diferença de potencial em uma célula galvânica. Walther Nernst estudou sistemas em equilíbrio e relacionou o potencial da célula com a concentração das substâncias químicas utilizadas em 1889.
Svante Arrhenius, em 1887, explicou a condutância elétrica de soluções em termos de migração de íons e equilíbrio entre íons e moléculas.
Século XX[editar | editar código-fonte]
Em 1902, a Sociedade Eletroquímica (ECS) é fundada.[32]
Em 1909, Robert Andrews Millikan e Harvey Fletcher determinaram a carga elétrica do elétron após a experiência da gota de óleo.[33]
Em 1923, Peter Debye (Prêmio Nobel em Química em 1936) e Erich Hückel explicaram a condutância, o potencial eletroquímico e outras propriedades de soluções iônicas.
No mesmo ano, Johannes Nicolaus Brønsted e Thomas Martin Lowry publicaram, independentemente, teorias similares sobre o comportamento de ácidos e bases, usando princípios da eletroquímica.[34]
Em 1937, Arne Tiselius desenvolveu o primeiro aparelho sofisticado de eletroforese. Anos depois, ele foi agraciado com o prêmio Nobel de Química de 1948 por seu trabalho na eletroforese de proteínas.[35]
Um ano depois, em 1949, a Sociedade Internacional de Eletroquímica (ISE) foi fundada.[36]
Nos anos 60 e 70, a eletroquímica quântica foi desenvolvida por Revaz Dogonadze e seus discípulos.
Princípios[editar | editar código-fonte]
 |
| Princípios da Química |
|---|
Oxidação e redução[editar | editar código-fonte]
O termo "redox" significa oxirredução e se refere ao processo eletroquímico que envolve a transferência de elétrons de ou para uma molécula ou íon, mudando seu estado de oxidação ou nox. Essa reação pode ocorrer através da aplicação de uma diferença de potencial externa ou da liberação de energia química. Oxidação e redução descrevem a mudança do estado de oxidação que ocorre em átomos, íons ou moléculas envolvidas na reação eletroquímica.[37] Em termos formais, o estado de oxidação equivale a uma carga hipotética que um átomo teria se todas as ligações que fizesse com outros átomos de diferentes elementos químicos fossem 100% iônicas. Um átomo ou íon que doa um elétron para outro átomo ou íon aumenta seu estado de oxidação, enquanto o receptor de elétrons diminui seu estado de oxidação.
Por exemplo, quando o sódio atômico reage com o cloro atômico, o sódio doa um elétron e adquire um estado de oxidação igual a +1. O átomo de cloro aceita o elétron e seu estado de oxidação é reduzido, tornando-se −1. O sinal do estado de oxidação (positivo ou negativo) corresponde ao valor da carga elétrica de cada íon. A atração entre íons de cargas opostas é a razão de o sódio e o cloro formarem uma ligação iônica.[38]
A perda de elétrons de um átomo ou molécula é chamada de oxidação e o ganho de elétrons é chamado de redução. Oxidação e redução sempre ocorrem conjuntamente, de modo que uma espécie seja oxidada enquanto a outra for reduzida.[37][38] Para o caso de uma ligação covalente, em que os elétrons são compartilhados entre átomos com grande diferença de eletronegatividade, associa-se o elétron ao átomo de maior eletronegatividade para determinar o estado de oxidação.
O átomo ou molécula que perde elétrons é conhecido como o agente redutor, já que reduz aquele que receberá esses elétrons; e a substância que aceita elétrons é denominada de agente oxidante, já que oxida aquele que perdeu os elétrons. Portanto, o agente oxidante sempre se reduz em uma reação e o agente redutor sempre se oxida.[37] O oxigênio é um dos mais comuns agentes oxidantes, mas não é o único. Apesar do nome, uma reação de oxidação não necessariamente contém oxigênio. De fato, combustões podem ser alimentadas por oxidantes que não o oxigênio: fogo alimentado por flúor é normalmente inextinguível, já que o flúor é um oxidante ainda mais forte que o oxigênio pela sua alta eletronegatividade.
Para reações que envolvam oxigênio, o ganho de oxigênio provoca a oxidação do átomo ou da molécula a que o oxigênio é adicionado, enquanto o próprio oxigênio é reduzido. Em compostos orgânicos, como o butano ou o etanol, a perda de hidrogênio acarreta a oxidação da molécula da qual ele foi perdido e redução do hidrogênio. Isso ocorre porque o hidrogênio compartilha o seu elétron em ligações covalentes com não-metais mas o leva consigo quando se desprende da molécula. Por outro lado, a perda de oxigênio ou ganho de hidrogênio implica redução da molécula.[37]
Balanceamento de equações redox[editar | editar código-fonte]
Assim como em qualquer equação química, em uma reação redox deve-se balancear os produtos e os reagentes através de coeficientes estequiométricos, como enunciado pela lei de Lavoisier. Contudo, há também o aspecto da transferência de elétrons intrínseco à oxirredução. Portanto, ao realizar o balanceamento de equações desse tipo, deve-se também igualar o número de elétrons que foram perdidos e recebidos. Para isso, é necessário determinar os números de oxidação de todos os elementos das substâncias nos reagentes e nos produtos, e, desse modo, descobrir quantos elétrons foram transferidos e quais espécies sofreram redução e oxidação.[39]
Exemplo[39] A seguir tem-se equação não-balanceada da reação de oxirredução entre o cobre metálico e o ácido nítrico, com produção de nitrato de cobre (II), monóxido de nitrogênio e água:
Nesse exemplo, todos as substâncias são neutras, com número de oxidação igual a zero. Para isso, a soma dos números de oxidação de cada átomo em uma substância deve também ser nulo. Considerando os valores padrão de Nox de +1 para o H e -2 para o O, obtém-se os números de oxidação dos demais elementos:
- Nos reagentes;
- Em , o nox de é 0;
- Em , o nox de é +5;
- Nos produtos;
- Em , o nox de é +2, já que nox de é -1;
- Em , o nox de é +2.
Observe que o teve seu nox aumentado de 0 para +2, o que significa que ele é a espécie que sofreu oxidação. Já o sofreu redução, pois o seu número de oxidação diminuiu de +5 para +2. Portanto, diz-se que nessa reação o cobre metálico () é a agente redutor e que o ácido nítrico () é o agente oxidante.
O próximo passo para balancear a equação é determinar a variação do Nox () para verificar o número de elétrons transferidos:
Os valores encontrados para os ΔNox permanecem estes porque nas substâncias existem apenas um átomo de nitrogênio e de cobre. Mas, se houvesse mais de dois átomos teríamos que levar isso em consideração.
O próximo passo é inverter os valores de ΔNox pelos coeficientes das substâncias. Visto que o ΔNox do Cu deu 2, então esse será o coeficiente da substância que contém o N, que no primeiro membro é o HNO3 e no segundo membro da equação é o NO. E visto que ΔNox do N deu 3, então esse será o coeficiente da substância que contém o Cu, que no primeiro membro é o Cu e no segundo membro da equação é o Cu(NO3)2.
Dessa maneira, o número total de elétrons perdidos é igual ao número total de elétrons recebidos:
Elétrons perdidos Elétrons recebidos = = = = Portanto dois coeficientes estequiométricos estão fixados:
Conhecidos esses coeficientes, o último passo agora consiste na conservação do número de átomos de cada elemento pela lei de Lavoisier. Isso implica que a equação final com os outros coeficientes estequiométricos fica:
Potencial de redução[editar | editar código-fonte]
Para determinar a espontaneidade ou não de uma reação eletroquímica, precisa-se conhecer o potencial de redução ou de oxidação das substâncias envolvidas no processo em relação a uma reação individual de cada uma delas com uma terceira substância, tomada como padrão. Por convenção, a comunidade científica adotou o eletrodo de hidrogênio como referência, determinando que seu potencial padrão de oxidação e de redução são [40] nas seguintes condições padrão:[41]
- Temperatura de 25 °C;
- Pressão de uma atmosfera (1,0 atm);
- Concentração de um mol por litro (1,0 mol/L) da solução em que o metal está mergulhado.
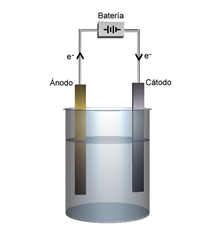
Reação eletroquímica[editar | editar código-fonte]
Os elementos envolvidos em uma reação eletroquímica são caracterizados pelo seu número de oxidação ou nox, isto é, pelo número de elétrons que possuem a mais ou a menos que seu estado neutro. Um átomo em seu estado neutro possui número de oxidação igual a zero. Se um átomo ou íon doa elétrons em uma reação, seu número de oxidação aumenta; se aceita um elétron, seu número diminui. Da mesma forma, a perda de elétrons de uma substância é chamada de oxidação, enquanto o ganho de elétrons é dito como redução. Elementos que sofrem oxidação são ditos agentes redutores, pois reduzem outros elementos químicos ao se oxidarem. Simetricamente, agentes oxidantes são aqueles que sofrem redução para provocar oxidação em outros elementos.[42]
Uma reação na qual ocorrem oxidação e redução é chamada de reação redox. Uma reação eletroquímica é uma reação redox que ocorre com a simultânea passagem de corrente entre dois eletrodos, em que ocorre passagem de corrente elétrica em uma distância finita maior que a distância interatômica, isto é, em que os elétrons são transmitidos avulsamente de um elemento químico para outro.
Tanto em uma célula galvânica quanto em uma célula eletrolítica, há sempre dois tipos de eletrodo:[43]
- Ânodo: O ânodo é o eletrodo para onde se dirigem os ânions e se formam cátions. Nesse eletrodo, sempre ocorre oxidação de espécies, acarretando corrosão do material e consequente perda de massa.[43]
- Cátodo: O cátodo é o eletrodo para onde se dirigem os cátions. Nesse eletrodo ocorre sempre depósito e redução de elementos químicos.[43]
No estudo dos células eletroquímicas (pilhas ou células eletrolíticas) mediante a termodinâmica, faz-se uso de uma abordagem de equilíbrio - a corrente que passa pela célula é infinitesimal, a reação ocorre mediante pequenas passagens de carga pelos elétrodos (pela lei da conservação da carga a carga que entra por um elétrodo é a mesma que sai pelo outro). Dessa forma, a célula é caracterizada por uma força eletromotriz, ou f.e.m. (). Na prática, pode-se dizer que consiste em uma diferença de potencial aplicada a um circuito aberto. Essa diferença de potencial é função de fatores tais como a concentração dos reagentes, o solvente, a temperatura e, ainda que em contribuição bem menor, a pressão.
Cinética da reação eletroquímica[editar | editar código-fonte]
No meio reacional, os íons possuem diferentes velocidades, normalmente baixas devido à viscosidade desse meio, composto por um solvente que dificulta a passagem dos íons. Para medir tais velocidades, define-se a mobilidade de um íon. A mobilidade iônica () de um íon consiste em sua velocidade na direção do campo elétrico de intensidade unitária, e tem unidades . Por outro lado, em regiões próximas aos elétrodos, a cinética química toma outras feições, já que então depende de fenômenos de superfície, o que forçosamente envolve a noção de energia superficial.
A solvatação do íon é determinada, em grande parte, por dois fatores: sua carga e seu raio. Como a rede de interações múltiplas entre os íons é muito complexa, faz-se uso de simplificações, principalmente quando se admitem grandes diluições.
De outro modo, a noção de concentração não é inteiramente útil, no sentido de que não mede diretamente o que acontece. Como sofrem múltiplas interações, elas se somam de forma complexa, em grandes concentrações. Então é mais conveniente usar o conceito de atividade.
No caso de uma célula eletroquímica, em função da complexidade dessas interações, não segue necessariamente a lei de Ohm. Ou seja, a corrente elétrica não é proporcional à tensão elétrica aplicada à célula.
Uma pilha útil é aquela na qual o potencial gerado tem alguma vantagem sobre o custo da pilha. Para obter-se um bom potencial, é necessário que a diferença entre os potências do ânodo e do cátion seja grande: o agente redutor deve ter potencial negativo e o oxidante deve ter potencial positivo.
Células eletroquímicas[editar | editar código-fonte]
Célula galvânica[editar | editar código-fonte]

Uma célula galvânica, célula voltaica ou pilha caracteriza-se quando a reação eletroquímica ocorre de forma espontânea, obtendo-se energia elétrica a partir de energia química. Esse processo é usado em dispositivos como baterias e células de combustível para gerar energia elétrica.[9][44]
Em uma pilha de Daniell com ânodo de zinco e cátodo de cobre, o processo de oxirredução é espontâneo devido à diferença de potencial positiva existente na reação redox global.[40] No ânodo, o eletrodo negativo, o zinco oxida, perdendo elétrons e formando corrente elétrica. Já no cátodo, eletrodo positivo, o cobre sofre redução, recebendo os elétrons cedidos pelo zinco e adquirindo seu estado metálico.[9] Esse processo pode ser sintetizado nas equações de semi-reação que ocorrem em cada eletrodo:[44]
Na primeira equação, o íon cobre (Cu2+) da solução é reduzido pelos dois elétrons (e-), providos pela corrente elétrica. Já na segunda, o zinco metálico é oxidado, formando íon zinco (Zn2+) e há a liberação de dois elétrons. Esses elétrons liberados serão os responsáveis pela geração da corrente elétrica do sistema (no caso, a pilha). Com o prosseguimento da reação, ocorrerá formação de cobre metálico, que se deposita no eletrodo de cobre, em sua superfície, enquanto o eletrodo de zinco é corroído, pois o zinco estará se transformando em íons que passarão para a solução de sulfato de zinco.[9][44]
Por sua vez, as duas equações podem ser sintetizadas na equação global da reação através de sua soma algébrica, que resulta na seguinte equação:[9][44]
- .
Não é obrigatório que o cátodo da célula galvânica seja de cobre. Esse cátodo pode ser de qualquer material inerte que conduza eletricidade, como a platina ou o grafite. Este eletrodo será de qualquer forma um eletrodo de cobre, pois sendo iniciada a reação ele é recoberto com cobre, passando a ser um eletrodo de cobre. Da mesma forma, tem se a solução de compartimento anódico (onde tem-se a imersão da chapa de zinco), não é necessário conter íons zinco no início. Esses íons serão fornecidos ao iniciar a reação.[45]
A pilha de Volta pode ser escrita, de forma mais esquemática, da seguinte maneira:
- Zn | Zn2+ || Cu2+ | Cu;
em que, || representa a ponte salina.[9]
Célula eletrolítica[editar | editar código-fonte]
Uma célula eletrolítica é caracterizada por usar corrente elétrica para separar compostos químicos. Assim, a eletrólise converte energia elétrica em energia química, caracterizando uma reação não espontânea. Tal processo é utilizado para a produção de, por exemplo, alumínio metálico, a partir de seu minério (bauxita);[46] cloro e hidrogênio simples, etc..[8]
Para ocorrer eletrólise, é necessário que haja um gerador que forneça tensão para o sistema, como uma pilha ou bateria.[8] Há dois tipos principais de eletrólise, portanto duas maneiras de montar uma célula eletrolítica: por eletrólise ígnea ou por eletrólise em solução aquosa.[46]
Eletrólise ígnea[editar | editar código-fonte]

É chamada de eletrólise ígnea aquela realizada com o eletrólito fundido. Por exemplo, uma célula de composta por cloreto de sódio a 808 °C possui esse eletrólito fundido, possibilitando a mobilidade dos íons Na+ e Cl-. Ao fornecer uma corrente elétrica para a célula eletrolítica, os cátions Na+ são atraídos pelo polo negativo (cátodo), onde ganham elétrons e são descarregados. Já no polo positivo (ânodo), são atraídos e oxidados os ânions Cl-. Tais processos são sintetizados pelas seguintes semi-reações:[43]
Ambas as equações podem então ser unidas em uma única equação:
Eletrólise aquosa[editar | editar código-fonte]
Um exemplo de eletrólise aquosa é o que ocorre, por exemplo, em uma célula eletrolítica com sal de cozinha (NaCl) dissolvido em água. Nessa reação o gerador atrai os elétrons do polo positivo, que neste caso é o ânodo, e os transfere para o polo negativo, neste caso o cátodo. Portanto, a reação que ocorre no ânodo ainda é de oxidação e a que ocorre no cátodo ainda é de redução.[46] No momento da dissolução de NaCl em H2O, há quatro íons coexistindo na solução aquosa: os ânions Cl- e OH-; e os cátions Na+ e H+. A princípio poderia ocorrer a oxidação ou redução de qualquer um desses íons durante a reação eletroquímica. No entanto, verifica-se que o íon H+ sofre redução produzindo gás hidrogênio (H2) e que o íon Cl- sofre oxidação produzindo gás cloro (Cl2), resultando na produção de soda cáustica (NaOH) dentro da cuba eletrolítica, devido à sobra dos outros dois íons.[46] As reações de oxirredução são, pois, as seguintes:[43]
A reação global da eletrólise, portanto, fica da seguinte maneira:[43]
Tal processo, portanto, pode ser utilizado para produzir o hidróxido de sódio ou soda cáustica, uma importante commodity industrial.[43] Além disso, ele produz substâncias simples não encontradas no planeta Terra: o gás hidrogênio e o gás cloro, ambos de grande importância para estudos das propriedades químicas e físicas dos átomos de hidrogênio e cloro, assim como para a produção de outras substâncias químicas compostas por esses elementos.
Aplicações[editar | editar código-fonte]
Pilhas eletroquímicas[editar | editar código-fonte]
Desde a invenção da pilha por Alessandro Volta, foram criados diversos tipos de células para gerar eletricidade a partir de reações químicas. Algumas das mais comuns são utilizadas atualmente em eletroeletrônicos e automóveis.
- Pilhas eletroquímicas
Metalurgia[editar | editar código-fonte]

O processo de eletrorrefinamento, ou eletrorrefino, é usado na metalurgia para a purificação de metais como o cobre, o zinco e o chumbo.[43] No refino do cobre, por exemplo, há uma célula eletrolítica aquosa de sulfato de cobre, em que o cobre a ser purificado é utilizado como ânodo e um cátodo de outro metal é utilizado para depositar o cobre metálico. A diferença de potencial aplicada à célula faz com que o cobre do ânodo seja dissolvido como íon na solução aquosa, juntamente com as impurezas do ânodo (metais menos nobres, por exemplo). Essa diferença de potencial é então controlada no cátodo, de modo que seu valor fique acima do potencial de equilíbrio das impurezas, impedindo sua redução e consequente deposição no cátodo. Dessa forma, as impurezas permanecem dissolvidas na solução ou precipitam, depositando-se no fundo do recipiente da solução e constituindo a chamada lama anódica.[47][48][49]
Usinagem[editar | editar código-fonte]

A usinagem é o processo de produção de algum tipo de ferramenta a partir de uma matéria-prima, normalmente feita através da alteração física do objeto por choques mecânicos. Já a usinagem por processo eletroquímico (ECM, Electrochemical Machining, em inglês)[50] ou eletrolítica é semelhante ao polimento eletrolítico, em que o metal a ser alterado é polarizado negativamente em uma célula eletrolítica. Ou seja, trata-se de um processo de dissolução dos ânions que compõem o metal na solução da célula. A diferença principal entre o polimento e a usinagem é a finalidade de cada processo: no polimento eletrolítico, a finalidade principal é obter um excelente estado de superfície do material; na usinagem eletrolítica, o objetivo é a remoção de material de acordo com o perfil necessário para fabricar uma ferramenta. Esse processo também é conhecido como erosão eletroquímica.[51]
Para maior precisão, é comum utilizar uma ferramenta de corte que sirva de cátodo e então seja aplicada a uma peça (ânodo). O eletrólito é injetado sob pressão a uma temperatura definida para a área a ser cortada. A taxa de alimentação é a mesma que a taxa de liquefação do material. A distância entre a ferramenta e a peça varia de 8 a 80 micrômetros. Quando os elétrons chegam ao material, ele é dissolvido da forma desejada. A ferramenta de corte é então guiada ao longo da peça, em toda a região a ser trabalhada, mas sem tocá-la diretamente. O processo ECM é frequentemente usado para produzir formas complexas como a turbina de pás com bom acabamento superficial em materiais mais duros. Também é amplamente utilizado em processos de rebarbação, em que a técnica de usinagem eletroquímica remove o metal excedente e embota bordas afiadas. Esse processo é rápido e muitas vezes mais conveniente do que os métodos convencionais de rebarbação feitos de forma manual ou com uso de processos de usinagem tradicionais.[50]
Atualmente, muitas fabricantes de máquinas de usinagem produzem máquinas para usinagem eletroquímica. Para obter um alto desempenho de fabricação, tais máquinas necessitam de manutenção e lubrificação constantes, evitando quebras e falhas e garantindo que não haja atritos entre as peças, o que provoca o desgaste dos componentes.[50]
Painéis solares[editar | editar código-fonte]

Painéis solares fotovoltaicos são dispositivos que convertem a energia luminosa provinda do Sol em energia elétrica, a ser utilizada para uma diversidade de tarefas. A parte mais importante de um painel solar são as células fotovoltaicas, normalmente feitas de silício devido à sua semicondutividade. Os átomos de silício formam uma rede cristalina e compõem as duas partes de uma célula solar: a parte negativa, em que há excesso de elétrons; e a parte positiva, em que há carência de elétrons. Para criar essa diferença de carga, a parte negativa é composta de silício e boro, enquanto a parte positiva é feita de uma combinação de silício e fósforo. As duas partes são colocadas em contato entre outras duas camadas, metálicas e condutoras. Quando a luz solar, composta por fótons, atinge a célula, alguns elétrons são arrancados dos átomos de silício. Devido à polarização, os elétrons arrancados migrarão para a placa condutora em contato com a parte negativa, enquanto se criam "buracos", devido aos elétrons ausentes, que "migrarão" para o condutor em contato com a parte positiva. Como os condutores formam um circuito com aparelhos elétricos, os elétrons irão fluir constantemente, deixando átomos e preenchendo lacunas em átomos diferentes. Este fluxo produz então uma corrente elétrica. O fenômeno do fluxo de elétrons arrancados por fótons é denominado efeito fotovoltaico.[52][53]
Esta explicação é uma forma simples de mostrar o efeito fotovoltaico, já que existem outros materiais além do silício utilizados para a fabricação de células fotovoltaicas e outras formas de se fabricar uma placa solar. A tecnologia explicada acima é a mais utilizada mundialmente, representando da ordem de 90% do mercado de painéis solares no mundo.[52]
Produção de Commodities[editar | editar código-fonte]

Commodities são produtos comerciais indiferenciados e universais, cuja qualidade independe de quem os produziu. Células eletrolíticas como a formada por sal comum e água produzem o hidróxido de sódio, comumente conhecido como soda cáustica, importante produto para a limpeza de encanamentos domésticos por poder dissolver gorduras.[47]
Outras aplicações[editar | editar código-fonte]
- Na eletrônica, na produção de placas eletrônicas;
- Na biologia, na produção de inúmeras enzimas;[54]
- Na geologia, com alguns tipos de movimentação na Terra, com a integração das substâncias com polos positivos e negativos.[55]
Ver também[editar | editar código-fonte]
Notas
- ↑ O nome pilha tem como origem a própria palavra empilhamento, referente à organização das unidades de zinco e cobre utilizadas por Volta.
Referências
- ↑ «Vocabulário de Mudança». Portal da Língua Portuguesa. Consultado em 1 de novembro de 2018
- ↑ Feltre 2004, p. 282
- ↑ Vargas Fogaça, Jennifer Rocha. «Eletroquímica. Introdução ao estudo da Eletroquímica». Mundo Educação
- ↑ «Eletroquímica». SOQ
- ↑ Aroeira, Gustavo José Ribeiro. «Eletroquímica - conceitos fundamentais». Infoescola
- ↑ Fogaça, Jennifer. «Introdução ao estudo da Eletroquímica. O que é eletroquímica!». Manual da Química, UOL
- ↑ Feltre 2004, p. 334
- ↑ a b c «Eletrólise. Conceitos e tipos de Eletrólise». Mundo Educação
- ↑ a b c d e f Fogaça, Jennifer Rocha Vargas. «Pilhas ou Células Eletroquímicas». Mundo Educação
- ↑ «Conheça as principais aplicações da Eletroquímica». Senai
- ↑ «Tales de Mileto e a Eletricidade». Portal Educação
- ↑ a b c d «Eletricidade - Eletromagnetismo»
- ↑ «elétron - etimologia». Wikcionário
- ↑ «Riddle of 'Baghdad's batteries'». BBC News. 27 de fevereiro de 2003
- ↑ R. Hellborg Electrostatic accelerators: fundamentals and applications (2005) ISBN 3540239839 p. 52
- ↑ «Lei de Coulomb». Só Física
- ↑ J. A. M. Bleeker, Johannes Geiss, M. Huber The century of space science, Volume 1, Springer (2001) ISBN 0-7923-7196-8 p. 227
- ↑ a b c Feltre 2004, p. 298
- ↑ Rafael, Pablo. «Projeto Física e Cidadania - Luigi Galvani». UFJF
- ↑ Fogaça, Jennifer Rocha Vargas. «Alessandro Volta e a Invenção da Pilha». BrasilEscola
- ↑ «William Nicholson». Escuelapedia
- ↑ «Johann Wilhelm Ritter». Molecular Expressions. Consultado em 12 de abril de 2019
- ↑ Keith James Laidler The world of physical chemistry, Oxford University Press (1995) ISBN 0-19-855919-4 pp. 219–220
- ↑ The New Encyclopædia Britannica: Micropædia, Vol. 10 (1991) ISBN 0-85229-529-4, p. 90
- ↑ Albino, Leonardo Vieira. «A história de Sir Humphry Davy, o Químico Romântico». Conselho Regional de Química - IV Região
- ↑ William Berkson (1974) Fields of force: the development of a world view from Faraday to Einstein, Routledge. ISBN 0-7100-7626-6 pp. 34 ff
- ↑ Baigrie 2007, p. 73
- ↑ Halliday 2012, p. 23
- ↑ Souza, Líria Alves de. «Michael Faraday». Mundo Educação. Consultado em 12 de abril de 2019
- ↑ Halliday 2012, p. 249
- ↑ «Leis da eletrólise». SOQ
- ↑ «History of ECS». ECS
- ↑ dos Santos, C.A. «Experimento da gota de óleo de Millikan». IF - UFRGS
- ↑ Fogaça, Jennifer Rocha Vargas. «Teoria ácido-base de Brönsted-Lowry». Mundo Educação
- ↑ The Nobel Prize in Chemistry 1948 Arne Tiselius, nobelprize.org
- ↑ «International Society of Electrochemistry-Yearbook Profile». Union of International Associations
- ↑ a b c d Souza, Líria Alves de. «Oxidação e Redução». Brasil Escola
- ↑ a b Fogaça, Jennifer Rocha Vargas. «Definições de oxidação e redução». Mundo Educação
- ↑ a b Fogaça, Jennifer. «Balanceamento das equações de oxirredução». Manual da Química
- ↑ a b Correia, Paulo Rogerio Miranda. «Para que serve o potencial de redução padrão?». Youtube
- ↑ Fogaça, Jennifer Rocha Vargas. «Medição dos potenciais eletroquímicos». Brasil Escola
- ↑ Feltre 2004, p. 283
- ↑ a b c d e f g h Feltre, Ricardo. «Química Vol. 2». Consultado em 30 de setembro de 2018
- ↑ a b c d Correia, Paulo Rogerio Miranda. «O que são células galvânicas?». Youtube
- ↑ Feltre 2004, p. 294 - 297
- ↑ a b c d Gomes Neto, João. «Eletrólise». InfoEscola. Consultado em 1º de setembro de 2018
- ↑ a b Feltre 2004, p. 351
- ↑ «Processos eletroquímicos em metalurgia» (PDF). Consultado em 15 de setembro de 2018
- ↑ «Metais e metalurgia» (PDF). USP. Consultado em 15 de setembro de 2018
- ↑ a b c «Usinagem eletroquímica na indústria metal mecânica». 14 de maio de 2018. Consultado em 10 de novembro de 2018
- ↑ «Cursos» (pdf)
- ↑ a b «Como Funciona o Painel Solar Fotovoltaico – Placas Fotovoltaicas». Portal Solar. Consultado em 14 de dezembro de 2018
- ↑ Komp, Richard. «How do solar panels work?». Youtube - TED-Ed. 5 de janeiro de 2016. Consultado em 14 de dezembro de 2018
- ↑ J. Koryta; J. Dvorán; L. Kava. Principles of Eletrochemistry 2 ed. [S.l.: s.n.]
- ↑ Jonh O. M. Bockris; Amulya K. N. Reddy. Modern Electrochemistry 2 ed. [S.l.: s.n.] p. 19
Bibliografia[editar | editar código-fonte]
- Baigrie, Brian (2007). Electricity and Magnetism: A Historical Perspective. [S.l.]: Greenwood Publishing Group
- Feltre, Ricardo (2004). Química Volume 2 - Físico-Química (6ª ed). São Paulo: Moderna
- Halliday, David (2012). Fundamentos de Física Volume 3 - Eletromagnetismo (9ª ed). Rio de Janeiro, RJ: LTC - Livros Técnicos e Científicos













































