Bateria de lítio-enxofre
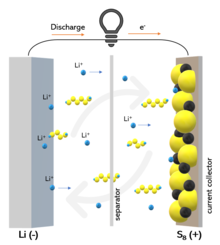
A bateria de lítio-enxofre (Li-S) é um tipo de bateria recarregável, notável por sua alta energia específica.[1] O baixo peso atômico do lítio e o peso atômico moderado do enxofre significa que as baterias Li-S são relativamente leves (aproximadamente a densidade da água). Elas foram usados no mais longo e de maior altitude vôo de avião movido a energia solar em agosto de 2008.[2] As baterias de lítio-enxofre têm menos impacto ambiental e são muito mais baratas, em comparação com as baterias de íon-lítio que atualmente alimentam telefones, tablets e laptops.[3]
Química[editar | editar código-fonte]
Os processos químicos na célula Li-S incluem dissolução de lítio da superfície ânodo (e incorporação em sais de polissulfeto de metal alcalino) durante a descarga e inverção da galvanoplastia de lítio no ânodo durante o carregamento.[4]
Ânodo[editar | editar código-fonte]
Na superfície anódica, ocorre a dissolução do lítio metálico, com a produção de elétrons e íons de lítio durante a descarga e a eletrodeposição durante a carga.
A semi-reação é expressa como:[5]
Em analogia com as baterias de lítio, a reação de dissolução / eletrodeposição causa, com o tempo, problemas de crescimento instável da interface sólido-eletrólito (SEI), gerando locais ativos para a nucleação e crescimento dendrítico do lítio. Dendritic growth is responsible for the internal short circuit in lithium batteries and leads to the death of the battery itself.[6]
Cátodo[editar | editar código-fonte]
Nas baterias Li-S, a energia é armazenada no eletrodo de enxofre (S 8 ). Durante a descarga, os íons de lítio no eletrólito migram para o cátodo, onde o enxofre é reduzido a sulfeto de lítio (Li 2 S). O enxofre é reoxidado para S8 durante a fase de recarga. A semi-reação é, portanto, expressa como:
(E ° ≈ 2.15 V vs Li / Li + )
Na verdade, a reação de redução de enxofre ao sulfeto de lítio é muito mais complexa e envolve a formação de polissulfetos de lítio (Li 2 S x , 8 <x <1 ) ao diminuir o comprimento da corrente de acordo com a ordem:[7]
O produto final é na verdade uma mistura de Li 2 S 2 e Li 2 S ao invés de Li 2 S puro, devido à redução cinética lenta em Li 2 S.[8] Isso contrasta com as células convencionais de íons de lítio, onde os íons de lítio são intercalados no ânodo e nos catodos. Cada átomo de enxofre pode hospedar dois íons de lítio. Normalmente, as baterias de íon-lítio acomodam apenas 0,5-0,7 íons de lítio por átomo hospedeiro.[9] Consequentemente, o Li-S permite uma densidade de armazenamento de lítio muito maior. Os polissulfetos são reduzidos na superfície do cátodo em sequência enquanto a célula está descarregando:
- S8 → Li2S8 → Li2S6 → Li2S4 → Li2S3
Através de um separador de difusão porosa, polímeros de enxofre se formam no cátodo enquanto a célula carrega:
- Li2S → Li2S2 → Li2S3 → Li2S4 → Li2S6 → Li2S8 → S8
Essas reações são análogas às da bateria de sódio e enxofre.
Os principais desafios das baterias Li-S são a baixa condutividade do enxofre e sua enorme mudança de volume ao descarregar e encontrar um cátodo adequado é o primeiro passo para a comercialização de baterias Li-S.[10] Portanto, a maioria dos pesquisadores usa um cátodo de carbono/enxofre e um ânodo de lítio.[11] O enxofre é muito barato, mas praticamente não tem eletrocondutividade, 5×10−30 S⋅cm−1 em 25 °C.[12] Um revestimento de carbono fornece a eletrocondutividade ausente. As nanofibras de carbono fornecem um caminho eficaz de condução de elétrons e integridade estrutural, com a desvantagem do custo mais alto.[13]
Um problema com o projeto lítio-enxofre é que, quando o enxofre no cátodo absorve lítio, a expansão do volume das composições do LixS acontece, e expansão de volume prevista de Li2S é quase 80% do volume do enxofre original.[14] Isso causa grandes tensões mecânicas no cátodo, que é uma das principais causas de degradação rápida. Esse processo reduz o contato entre o carbono e o enxofre e evita o fluxo de íons de lítio para a superfície do carbono.[15]
As propriedades mecânicas dos compostos de enxofre litiado são fortemente dependentes do teor de lítio e, com o aumento do teor de lítio, a resistência dos compostos de enxofre litiado melhora, embora esse incremento não seja linear com a litiação.[16]
Uma das principais deficiências da maioria das células Li-S são as reações indesejadas com os eletrólitos. Enquanto S e Li2S são relativamente insolúveis na maioria dos eletrólitos, muitos polissulfetos intermediários não são. Dissolvendo Li2Sn em eletrólitos causa perda irreversível de enxofre ativo.[17] O uso de lítio altamente reativo como eletrodo negativo causa dissociação da maioria dos eletrólitos de outro tipo comumente usados. O uso de uma camada protetora na superfície do ânodo foi estudado para melhorar a segurança das células, ou seja, o uso de revestimento de Teflon mostrou melhora na estabilidade do eletrólito,[18] LIPON, Li3N também exibiu desempenho promissor.
Pesquisas[editar | editar código-fonte]
Pesquisadores australianos desenvolveram o que eles afirmam ser a "bateria de lítio-enxofre mais eficiente” disponível para 2020. Esse dispositivo pode estender a autonomia do seu telefone por cinco dias consecutivos sem recarga. Seu uso em carros elétricos, onde poderia oferecer um alcance de mais de 1000 km sem reabastecimento e faz o telefone celular funcionar por cinco dias contínuos.[3]
Referências
- ↑ Zhang, Sheng S (2013). «Liquid electrolyte lithium/sulfur battery: Fundamental chemistry, problems, and solutions». Journal of Power Sources. 231: 153–162. doi:10.1016/j.jpowsour.2012.12.102
- ↑ Amos, J. (24 de agosto de 2008) "Solar plane makes record flight" BBC News
- ↑ a b «The cell phone battery that lasts up to 5 days is coming». Tech Explorist (em inglês). 10 de janeiro de 2020. Consultado em 10 de janeiro de 2020
- ↑ Tudron, F.B., Akridge, J.R., and Puglisi, V.J. (2004) "Lithium-Sulfur Rechargeable Batteries: Characteristics, State of Development, and Applicability to Powering Portable Electronics" (Tucson, AZ: Sion Power)
- ↑ Kumar, Rudra; Liu, Jie; Hwang, Jang-Yeon (2018). «Recent research trends in Li–S batteries». Journal of Materials Chemistry A (em inglês). 6 (25): 11582–11605. doi:10.1039/C8TA01483C. Consultado em 4 de julho de 2019
- ↑ Ould Ely, Teyeb; Kamzabek, Dana; Chakraborty, Dhritiman (29 de maio de 2018). «Lithium–Sulfur Batteries: State of the Art and Future Directions». ACS Applied Energy Materials (em inglês). 1 (5): 1783–1814. doi:10.1021/acsaem.7b00153. Consultado em 4 de julho de 2019
- ↑ Lin, Zhan; Liang, Chengdu (2015). «Lithium–sulfur batteries: from liquid to solid cells». Journal of Materials Chemistry A (em inglês). 3 (3): 936–958. doi:10.1039/C4TA04727C. Consultado em 4 de julho de 2019
- ↑ Song, Min-Kyu; Cairns, Elton J.; Zhang, Yuegang (2013). «Lithium/sulfur batteries with high specific energy: old challenges and new opportunities». Nanoscale (em inglês). 5 (6). 2186 páginas. doi:10.1039/c2nr33044j. Consultado em 4 de julho de 2019
- ↑ Bullis, Kevin (22 de maio de 2009). «Revisiting Lithium-Sulfur Batteries». Technology Review. Consultado em 12 de agosto de 2016
- ↑ Eftekhari, A. (2017). «Cathode Materials for Lithium–Sulfur Batteries: A Practical Perspective». Journal of Materials Chemistry A. 5 (34): 17734–17776. doi:10.1039/C7TA00799J
- ↑ Choi, Y.J.; Kim, K.W. (2008). «Improvement of cycle property of sulfur electrode for lithium/sulfur battery». Journal of Alloys and Compounds. 449 (1–2): 313–316. doi:10.1016/j.jallcom.2006.02.098
- ↑ J.A. Dean, ed. (1985). Lange's Handbook of Chemistry
 third ed. New York: McGraw-Hill. pp. 3–5
third ed. New York: McGraw-Hill. pp. 3–5
- ↑ Choi, Y. J.; Chung, Y. D.; Baek, C. Y.; Kim, K. W.; Ahn, J. H. (4 de março de 2008). «Effects of carbon coating on the electrochemical properties of sulfur cathode for lithium/sulfur cell». J. Power Sources. 184 (2): 548–552. Bibcode:2008JPS...184..548C. doi:10.1016/j.jpowsour.2008.02.053
- ↑ Islam, Md Mahbubul; Ostadhossein, Alireza; Borodin, Oleg; Yeates, A. Todd; Tipton, William W.; Hennig, Richard G.; Kumar, Nitin; Duin, Adri C. T. van (21 de janeiro de 2015). «ReaxFF molecular dynamics simulations on lithiated sulfur cathode materials». Phys. Chem. Chem. Phys. (em inglês). 17 (5): 3383–3393. Bibcode:2015PCCP...17.3383I. PMID 25529209. doi:10.1039/c4cp04532g
- ↑ Brian Dodson, "New lithium/sulfur battery doubles energy density of lithium-ion", NewAtlas, 1 December 2013
- ↑ Islam; et al. (2015). «ReaxFF molecular dynamics simulations on lithiated sulfur cathode materials». Phys. Chem. Chem. Phys. 17 (5): 3383–3393. Bibcode:2015PCCP...17.3383I. PMID 25529209. doi:10.1039/C4CP04532G
- ↑ Jeong, S. S.; Lim, Y.; Choi, Y. T.; Kim, K. W.; Ahn, H. J.; Cho, K. K. (2006). «Electrochemical properties of lithium sulfur cells using PEO polymer electrolytes prepared under three different mixing conditions». J. Power Sources. 174 (2): 745–750. Bibcode:2007JPS...174..745J. doi:10.1016/j.jpowsour.2007.06.108
- ↑ Islam, Md Mahbubul; Bryantsev, Vyacheslav S.; van Duin, Adri CT (2014). «ReaxFF Reactive Force Field Simulations on the Influence of Teflon on Electrolyte Decomposition during Li/SWCNT Anode Discharge in Lithium-Sulfur Batteries» (PDF). Journal of the Electrochemical Society. 161 (8): E3009–E3014. doi:10.1149/2.005408jes



