Terpenoides

Os terpenoides ou terpenos, por vezes designados por isoprenoides, são compostos que integram uma diversificada classe de substâncias naturais, ou metabólitos secundários de origem vegetal, especialmente das coníferas, de fórmula química geral (C5H8)n.[1]
Tradicionalmente eram considerados como derivados do 2-metil-butadieno, mais conhecido como isopreno, uma molécula com 5 átomos de carbono ou unidade C5.[2] A utilização da então chamada regra do isopreno permitiu classificá-los e estudá-los num primeiro momento, quando inúmeros terpenos foram isolados a partir de plantas superiores, muitos deles com valor comercial. Atualmente sabe-se que terpenos com aroma agradável são extraídos de essências de plantas, outros são a base de medicamentos convencionais ou as plantas que os contém são fitoterápicos, alguns são precursores de vitaminas e outros inseticidas.[3]
Estes compostos encontram-se em sementes, flores, folhas, raízes e madeira de plantas superiores assim como em musgos, algas e líquens, enquanto que alguns são encontrados em mamíferos.
História e terminologia
[editar | editar código-fonte]O termo terpeno foi cunhado em 1866 pelo químico alemão August Kekulé para denotar todos os hidrocarbonetos com a fórmula empírica C 10 H 16, dos quais o canfeno era um. Anteriormente, muitos hidrocarbonetos com a fórmula empírica C 10 H 16 eram chamados de "canfeno", mas muitos outros hidrocarbonetos da mesma composição tinham nomes diferentes. Kekulé cunhou o termo "terpeno" para reduzir a confusão.[4][5] O nome "terpeno" é uma forma abreviada de "terebintina", uma ortografia obsoleta de "terebintina".[6]
Embora às vezes usados de forma intercambiável com "terpenos", os terpenóides (ou isoprenóides ) são terpenos modificados que contêm grupos funcionais adicionais, geralmente contendo oxigênio.[7] Os termos terpenos e terpenóides são frequentemente usados de forma intercambiável, no entanto. Além disso, os terpenos são produzidos a partir de terpenóides e muitos terpenóides são produzidos a partir de terpenos. Ambos têm odores fortes e frequentemente agradáveis, que podem proteger seus hospedeiros ou atrair polinizadores. O inventário de terpenos e terpenóides é estimado em 55.000 entidades químicas.[8]
O Prêmio Nobel de Química de 1939 foi concedido a Leopold Ružička "por seu trabalho sobre polimetilenos e terpenos superiores",[9][10] "incluindo a primeira síntese química de hormônios sexuais masculinos ." [11]
Biossíntese
[editar | editar código-fonte]Após estudos de biossíntese, concluiu-se que os terpenos são derivados do isopreno. O verdadeiro precursor dos terpenos foi caracterizado como ácido mevalónico (em inglês: MVA, de mevalonic acid), ou mevalonato, proveniente da união de unidades de acetil coenzima A (ou acetil-CoA). Recentemente, através de estudos biossínteticos mais detalhados, descobriu-se que, em alguns organismos, como as plantas, alguns terpenos são, na verdade, provenientes do metileritritol fosfato (MEP), oriundo de unidades de piruvato e gliceraldeído-3P. Os mamíferos possuem apenas a via do MVA, enquanto que plantas biossintetizam terpenos através do MVA e do MEP.[12] Em todo caso, MEP e/ou MVA irão originar duas importantes unidades C5 que são os precursores imediatos dos terpenos: pirofosfato de isopentenila (IPP) e pirofosfato de dimetilalila (DMAP). Em muitos casos o IPP e o DMAP ligam-se entre si através do famoso modelo "cabeça-cauda" para formar unidades maiores. Em qualquer caso, a divisão das estruturas químicas dos terpenos em unidades de isopreno (C5) é muito útil e se utiliza com bastante frequência por ser bastante didática
Aplicações
[editar | editar código-fonte]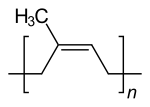
O único terpeno que tem aplicações importantes é a borracha natural (ou seja, poliisopreno). A possibilidade de outros terpenos poderem ser usados como precursores para produzir polímeros sintéticos tem sido investigada como uma alternativa ao uso de matérias-primas à base de petróleo. No entanto, poucos desses aplicativos foram comercializados.[13] Muitos outros terpenos, no entanto, têm aplicações comerciais e industriais em menor escala. Por exemplo, a terebintina, uma mistura de terpenos (por exemplo, pineno ), obtida a partir da destilação da resina do pinheiro, é utilizada como solvente orgânico e como matéria-prima química (principalmente para a produção de outros terpenóides).[6] A resina, outro subproduto da resina de coníferas, é amplamente utilizada como ingrediente em uma variedade de produtos industriais, como tintas, vernizes e adesivos . A resina também é usada por violinistas (e músicos de instrumentos de arco semelhantes) para aumentar o atrito na crina do arco .[14] Os terpenos são amplamente utilizados como fragrâncias e sabores em produtos de consumo, como perfumes, cosméticos e produtos de limpeza, bem como produtos alimentícios e bebidas. Por exemplo, o aroma e o sabor do lúpulo vêm, em parte, dos sesquiterpenos (principalmente α-humuleno e β-cariofileno ), que afetam a qualidade da cerveja .[15] Alguns formam hidroperóxidos que são valorizados como catalisadores na produção de polímeros.
Muitos terpenos demonstraram ter efeitos farmacológicos, embora a maioria dos estudos seja de pesquisa de laboratório e a pesquisa clínica em humanos seja preliminar.[16] Os terpenos também são componentes de alguns medicamentos tradicionais, como a aromaterapia .[17]
Refletindo seu papel defensivo nas plantas, os terpenos são usados como ingredientes ativos de pesticidas na agricultura.[18]
Estrutura química e propriedades
[editar | editar código-fonte]Do ponto de vista químico, alguns terpenos podem ser classificados como hidrocarbonetos, compostos apenas por carbono e hidrogénio, como por exemplo o limoneno e o β-pineno, encontrados respectivamente nas essências de limão (Citrus) e do pinheiro (Pinus). Entretanto, a medida que ligações duplas presentes nas estruturas químicas destas substâncias passam a ser funcionalizadas, diversas funções orgânicas podem surgir, como por exemplo álcool (mentol), cetona (cânfora), aldeído (citral), etc.
Os terpenos podem ser acíclicos, monocíclicos, bicíclicos, tricíclicos, tetracíclicos e pentacíclicos, como também aromáticos. Suas propriedades químicas, físicas e biológicas dependerão do tamanho de suas estruturas, bem como dos grupos funcionais nelas presentes.
Subtipos estruturais
[editar | editar código-fonte]De acordo com o número de unidades de isopreno, ou unidades C5 presentes, os terpenos são classificados como:[2]
- C5: hemiterpenos;
- C10: monoterpenos;
- C15: sesquiterpenos;
- C20: diterpenos;
- C30: triterpenos;
- C40: tetraterpenos ou carotenoides;
- unidades maiores: politerpenos.
A menor unidade terpenoídica, ou seja, unidades C5 ou hemiterpenos, geralmente está presente em diversas classes de metabólitos secundários, muitas vezes como alquilantes (prenilantes), e raramente livres. Uma classe especial de terpenos altamente modificados que contém unidades C5 são as piretrinas, substâncias com propriedade inseticida encontradas em espécies de crisântemo (Chrysanthemum cinerariaefolium, Asteraceae).
A grande maioria dos monoterpenos é volátil e constituinte básico de azeites aromáticos (óleos essenciais ou essências), como o mentol, linalol e citral, presentes na hortelã (Mentha x piperita, Lamiaceae), alfazema (Lavandula angustifolia L., Lamiaceae) e no capim-limão (Cymbopogon citratus, Poaceae). Alguns são precursores de uma classe especial de substâncias, os iridóides e seco-iridóides, encontrados por exemplo nas raízes de valeriana (Valeriana officinalis L., Valerianaceae) ou como unidades presentes nas estruturas de alguns tipos de alcalóides complexos.
Alguns sesquiterpenos estão presentes em diversos óleos essenciais, como o α-humuleno, β-cariofileno, β-farneseno e α-bisabolol, este último constituinte principal da essência de camomila (Matricaria chamomilla L., Asteraceae). Já o α-humuleno e o β-cariofileno estão no óleo essencial da erva baleeira (Cordia verbenacea, Boraginaceae), matéria-prima para a produção do fitoterápico Acheflan® da empresa farmacêutica Aché. Outros sesquiterpenos mais complexos e mais funcionalizados possuem função ecológica ou são componentes ativos de algumas plantas medicinais, como as lactonas sesquiterpênicas, presentes por exemplo na arnica (Arnica montana, Asteraceae) e no tanaceto (Tanacetum parthenium, Asteraceae), e um tipo especial, a artemisinina, importante antimalárico encontrado em Artemisia annua (Asteraceae), planta de origem chinesa denominada "qinghaosu".
Os diterpenos, em especial aqueles policíclicos com grupamento carboxila, estão presentes em várias resinas, como a de copaíba (Copaifera langsdorfii, Fabaceae) e do pinheiro (espécies de Pinus). Outros são tóxicos, como os ésteres de forbol de algumas espécies da família Euphorbiaceae, ou importantes para a medicina, como os ginkgolidos de Ginkgo biloba. Um diterpeno especial, o esteviosídeo, é isolado de espécies de estévia (Stevia rebaudiana, Asteraceae), sendo o que lhe confere o sabor doce. Já o paclitaxel, isolado de Taxus brevifolia ou T. baccata (Taxaceae), é atualmente um importante medicamento para o tratamento de câncer de mama e carcinoma metastático de ovário, comercializado como Taxol®.
Triterpenos livres também ocorrem em certas resinas e outros possuem atividades biológicas importantes. Ainda são precursores de fitoesteróis, como o estigmasterol, o α- e o β-sitosterol. Os fitoesteróis possuem 28 ou 29 átomos de carbono, ao contrário daqueles esteróides animais, com 27. Outros triterpenos e fitoesteróis, quando ligados a pequenas cadeias de açúcar (oses), são denominados saponinas, e possuem ações biológicas interessantes, além da propriedade espumante de alguns. Alguns fitoesteróis podem ainda originar alcalóides esteroidais, como aqueles presentes em espécies do gênero Solanum (Solanaceae), como o tomate e a jurubeba. Triterpenos ainda podem originar heterosídeos cardiotônicos, uma classe especial de substância empregada na medicina, como a digoxina, empregada no tratamento de insuficiência cardíaca congestiva. Finalmente, triterpenos em animais ainda podem originar ácidos biliares e vitamina D, além dos hormônios esteroidais.
Os tetraterpenos ou carotenoides são pigmentos importantes para diversas espécies vegetais, ocorrendo em flores e também em frutos. Estão presentes no mamão, tomate, cenoura e laranja, como o licopeno e o α- e β-caroteno.
Alguns destes terpenos de maior peso molecular, como os tetraterpenos, são os precursores de certas vitaminas, como a A, sendo que unidades terpenoídicas estão presentes nas vitaminas E e K. Outros terpenos, como o diterpeno fitol, formam parte da clorofila de plantas.
Com relação aos politerpenos, o representante mais significativo é a borracha, látex extraído da seringueira (Hevea brasiliensis, Euphorbiaceae).
Referências
[editar | editar código-fonte]- ↑ Merriam-Webster Online Dictionary
- ↑ a b Victor Gold, IUPAC Gold Book, terpenes
- ↑ Simões, C.M.O. et al. (org.). Farmacognosia: da planta ao medicamento. Porto Alegre/Florianópolis, Ed. Universidade UFRGS/Ed. da UFSC, 1999.
- ↑ Kekulé, August (1866). Lehrbuch der organischen Chemie (em alemão). 2. Erlangen, (Germany): Ferdinand Enke. pp. 464–465
- ↑ Dev, Sukh (1989). «Chapter 8. Isoprenoids: 8.1. Terpenoids.». In: Rowe. Natural Products of Woody Plants: Chemicals Extraneous to the Lignocellulosic Cell Wall. Berlin and Heidelberg, Germany: Springer-Verlag. pp. 691–807 ; see p. 691.
- ↑ a b Predefinição:Ullmann
- ↑ «IUPAC Gold Book - terpenoids». doi:10.1351/goldbook.T06279
- ↑ Chen, Ke; Baran, Phil S. (junho 2009). «Total synthesis of eudesmane terpenes by site-selective C–H oxidations». Nature. 459 (7248): 824–828. Bibcode:2009Natur.459..824C. PMID 19440196. doi:10.1038/nature08043
- ↑ Grandin, ed. (1966). «Leopold Ružička». Nobel Lectures, Chemistry: 1922-1941. Amsterdam: Elsevier Publishing CompanyNow available from «Leopold Ružička Biography». nobelprize.org. Nobel Foundation. 1939. Consultado em 6 julho de 2017
- ↑ «The Nobel Prize in Chemistry 1939»
- ↑ Hillier, Stephen G.; Lathe, Richard (2019). «Terpenes, hormones and life: Isoprene rule revisited». Journal of Endocrinology. 242 (2): R9–R22. PMID 31051473. doi:10.1530/JOE-19-0084

- ↑ Dewik, P.M. Medicinal Natural Products. A Biosynthetic Approach. 2nd ed., Chichester, John Wiley & Sons, 2002. ISBN 0471496405 (capa dura); ISBN 0471496413 (formato de bolso)
- ↑ Silvestre, Armando J.D.; Gandini, Alessandro (2008). «Terpenes: Major Sources, Properties and Applications». Monomers, Polymers and Composites from Renewable Resources. [S.l.: s.n.] pp. 17–38. ISBN 9780080453163. doi:10.1016/B978-0-08-045316-3.00002-8
- ↑ Roberts, Maddy Shaw. «What the heck is rosin – and why do violinists need it?». Classic FM. Consultado em 22 julho de 2022
- ↑ Steenackers, B.; De Cooman, L.; De Vos, D. (2015). «Chemical transformations of characteristic hop secondary metabolites in relation to beer properties and the brewing process: A review». Food Chemistry. 172: 742–756. PMID 25442616. doi:10.1016/j.foodchem.2014.09.139
- ↑ Koziol, Agata; Stryjewska, Agnieszka; Librowski, Tadeusz; Salat, Kinga; Gawel, Magdalena; Moniczewski, Andrzej; Lochynski, Stanislaw (2014). «An Overview of the Pharmacological Properties and Potential Applications of Natural Monoterpenes». Mini-Reviews in Medicinal Chemistry. 14 (14): 1156–1168. PMID 25429661. doi:10.2174/1389557514666141127145820
- ↑ Koyama, Sachiko; Heinbockel, Thomas (2020). «The Effects of Essential Oils and Terpenes in Relation to Their Routes of Intake and Application». International Journal of Molecular Sciences. 21 (5): 1558. PMC 7084246
 . PMID 32106479. doi:10.3390/ijms21051558
. PMID 32106479. doi:10.3390/ijms21051558
- ↑ Isman, M. B. (2000). «Plant essential oils for pest and disease management». Crop Protection. 21 (8–10): 603–608. doi:10.1016/S0261-2194(00)00079-X
