Neurooncologia
Este artigo ou secção contém uma lista de referências no fim do texto, mas as suas fontes não são claras porque não são citadas no corpo do artigo, o que compromete a confiabilidade das informações. (Julho de 2022) |
Este artigo carece de caixa informativa ou a usada não é a mais adequada. |

Neurooncologia é um foco de medicina que combina neurologia e oncologia.
A neurooncologia lida principalmente com o diagnóstico, terapia e pesquisa de doenças tumorais do sistema nervoso, que inclui os seguintes tipos de tum
- tumores primários do sistema nervoso central (tumores cerebrais e tumores da medula espinhal)
- tumores secundários do sistema nervoso central (metástases cerebrais e metástases da medula espinhal)
- linfomas malignos do sistema nervoso central
- Tumores do sistema nervoso periférico
Essa lista já mostra que essa é uma área ampla e difícil de definir. Enquanto o tratamento dos linfomas do sistema nervoso central também segue as diretrizes do tratamento hematológico e as metástases cerebrais não são tratadas separadamente da terapia básica do tumor primário, os tumores dos nervos periféricos são benignos, como os neurinomas, e como outros tumores de tecidos moles são frequentemente localizados na ortopedia área.
Informação geral[editar | editar código-fonte]
Tumores primários do sistema nervoso central[editar | editar código-fonte]
Os tumores cerebrais primários podem ocorrer em qualquer idade, desde a infância até o final da vida. Fatores como idade, localização do tumor e apresentação clínica são úteis no diagnóstico diferencial. A maioria dos tipos de tumores cerebrais primários é mais comum em homens, com exceção dos meningiomas, que são mais comuns em mulheres.
Tumores metastáticos do sistema nervoso central[editar | editar código-fonte]
A invasão ou compressão direta de tecidos contínuos está relacionada à proximidade do sistema nervoso com outras estruturas.
Metástase intracraniana[editar | editar código-fonte]
Existem três tipos de metástases intracranianas: metástases cerebrais, metástases durais e metástases meníngeo-leptomeníngeas. A metástase cerebral pode ser única ou múltipla e afetar qualquer parte do cérebro. A metástase para estruturas durais geralmente ocorre por disseminação hematogênica ou invasão direta de um osso adjacente. As metástases durais podem invadir o cérebro subjacente e causar edema focal e sintomas neurológicos associados. Devido à sua localização cortical, esses processos tendem a causar convulsões no início do curso. A metástase leptomeníngea é um fenômeno clínico raro, mas bem reconhecido em pacientes com câncer. As metástases leptomeníngeas são mais comumente causadas por tumores primários de mama, pulmão ou melanoma.
Metástases cranianas[editar | editar código-fonte]
As metástases para o crânio são divididas em duas categorias: Calvário e base do crânio.
Tumores primários do sistema nervoso central[editar | editar código-fonte]
Uma primeira subdivisão dos tumores do sistema nervoso central (SNC) ocorre entre tumores primários (originados diretamente do SNC) e metastáticos (originados de outro órgão). Estes últimos têm uma incidência aproximadamente dez vezes maior do que os primeiros. Os tumores cerebrais são neoplasias que se desenvolvem no cérebro. Tumores como o meningioma, que devido à sua massa comprimir, mas não penetra no cérebro, e os tumores hipofisários e epifisários, que estão localizados no tronco encefálico, são muitas vezes incorretamente referidos como tumores cerebrais. O termo tumores intracranianos os resume com mais precisão.
Os tumores primários do SNC compreendem uma variedade de entidades patológicas, cada uma com sua própria história natural. Devido ao fato de que os tumores gliais sozinhos representam quase 40 Por cento desses tumores, primeiro pode ser feita uma distinção entre tumores gliais (gliomas) e tumores não gliais. Os gliomas mais comuns são os astrocitomas (originados de células astrócitos gliais), oligodendrogliomas (originados de células oligodendrogliais) e ependimomas (originados de células ependimárias).
Epidemiologia[editar | editar código-fonte]
Tumores primários malignos do sistema nervoso central são relativamente raros e representam cerca de 2 por cento de todas as neoplasias malignas. As doenças tumorais do sistema nervoso central estão distribuídas em 95 por cento no cérebro e para 5 Porcentagem em meninges, nervos cranianos e medula espinhal. Eles podem ocorrer em qualquer idade, e o risco de desenvolver a doença aumenta com a idade. Em adultos, gliomas podem ser encontrados histologicamente originários do tecido de sustentação das células nervosas, das quais cerca de 75 porcentagem de glioblastomas Astrocitomas IV. graus com prognóstico desfavorável. Os tumores embrionários predominam em lactentes e crianças pequenas. Em média, as taxas de sobrevivência são 21 por cento para homens e 24 por cento para as mulheres. As estatísticas também raramente incluem tumores do SNC histologicamente benignos, que ocorrem em cerca de 6.000 novos casos por mentira do ano. Cerca de 65 Por cento vem das meninges. As mulheres são afetadas com muito mais frequência. Se não forem tratados com cirurgia ou radioterapia, mesmo os tumores benignos podem ser fatais devido ao crescimento progressivo no espaço craniano fechado. O tumor maligno intracraniano mais comum do SNC é o glioblastoma, o benigno mais comum é o meningioma.
Etiologia[editar | editar código-fonte]
A predisposição genética para neoplasias do sistema nervoso central é relativamente incomum, embora alguns gliomas possam ocorrer como complicações de vários distúrbios familiares. A mutação de alguns genes supressores de tumor caracteriza várias síndromes hereditárias que mostram uma maior suscetibilidade ao desenvolvimento de tumores cerebrais. As seguintes mutações e suas síndromes estão associadas a um maior risco de desenvolver tumores cerebrais: mutação do gene NF1 com neurofibromatose tipo 1, mutação APC com síndrome de Turcot, mutação PTCH com síndrome de Gorlin e TP53 ou CHEK2 -Mutação com síndrome de Li-Fraumeni.
Fatores ambientais associados a tumores cerebrais primários são difíceis de identificar. Em alguns estudos, a exposição ao cloreto de vinila foi associada a um aumento da incidência de glioma de alto grau. A única causa rara, mas bem identificada, de um tumor cerebral primário é a radiação ionizante. Em particular, a radioterapia de crianças com tinea capitis e de pacientes com leucemia linfática aguda, craniofaringioma ou linfoma não Hodgkin está associada a um risco aumentado de glioma. Existe um risco aumentado de linfoma cerebral primário em pacientes com AIDS.
Consultório[editar | editar código-fonte]
Sinais e sintomas[editar | editar código-fonte]
Os sintomas da neoplasia do cerebral são caracterizados por deslocamento ou Destruição do tecido circundante e infiltração das mesmas causas.
O sintoma mais comum, relatado por 35% dos pacientes, é a dor de cabeça. A ocorrência de dores de cabeça severas em pacientes que raramente sofrem delas é frequentemente característica, especialmente se as crises de dor de cabeça ou enxaquecas forem mais graves pela manhã e forem acompanhadas de náuseas, vômitos e déficits neurológicos. Em pacientes que sofrem de dores de cabeça com mais frequência, uma mudança na forma, um aumento na frequência ou intensidade dos ataques pode ser um sintoma do desenvolvimento de um tumor cerebral . Convulsões ocorrem em cerca de um terço dos pacientes com glioma, particularmente com tumores de baixo grau ou do SNC. Os déficits neurológicos focais estão relacionados à localização do tumor. Alterações do estado mental também ocorrem em 15 a 20 por cento dos pacientes com glioma.
Diagnóstico por imagem[editar | editar código-fonte]

A tomografia computadorizada (TC) e a ressonância magnética (RM) podem detectar efetivamente uma neoplasia no cérebro. A RM é mais sensível que a TC para identificar lesões, mas contraindicações para pacientes com marcapasso cardíaco, próteses incompatíveis, clipes metálicos e outros. A TC continua sendo o método de escolha para detectar calcificações dentro de lesões ou erosões ósseas da calota craniana ou da base. A utilização de agentes de contraste, que são iodados no caso da TC e paramagnéticos ( gadolínio ) no caso da RM, permite a aquisição de informações sobre a vascularização e integridade da barreira hematoencefálica, uma melhor definição do tumor tumoral comparado ao edema circundante e à geração de hipóteses sobre o grau de malignidade . O exame radiológico também permite avaliar os efeitos mecânicos e consequentes alterações nas estruturas cerebrais decorrentes do tumor, como hidrocefalia e hérnias, cujos efeitos podem ser fatais. Finalmente, na preparação para a cirurgia, esse diagnóstico pode ser usado para determinar a localização da lesão ou a infiltração do tumor em áreas vitais do cérebro. Para isso, a RM é mais eficiente que a TC, pois pode fornecer imagens tridimensionais.

As ferramentas de diagnóstico por imagem radiológica destacam a mudança no tecido neoplásico em comparação com o parênquima cerebral normal (através de alterações na densidade do tecido fotografado eletronicamente na TC e na intensidade do sinal na RM). Como a maioria dos tecidos patológicos, os tumores também são reconhecidos por um acúmulo aumentado de água intracelular. Na tomografia computadorizada aparecem hipodensa, ou seja, de menor densidade que o parênquima cerebral, na tomografia de ressonância magnética nuclear com relaxamento spin-lattice T 1 hipointenso e em relaxamento spin-spin T 2 bem como a ponderação de prótons (PD) hiperintensa.
A área saudável do cérebro não deve mostrar nenhuma luminescência específica em uma imagem radiológica. Portanto, nem é preciso dizer que é dada atenção a faixas de sinal de contraste maiores.
No tecido tumoral, em geral, a maior proporção de realce pelo contraste se deve à barreira hemato-tumor particular que permite a passagem de iodo (TC) e gadolínio (RM) para o espaço intersticial extravascular intratumoral. Isso aumenta o sinal (densidade ou intensidade) do tumor. No entanto, deve-se ter cuidado para garantir que o realce do contraste não diferencie definitivamente a neoplasia do edema periferida. De fato, o achado anátomo-patológico no tecido tumoral de glioma infiltrante maligno, como no glioblastoma e no astrocitoma anaplásico, também mostra além do edema vasogênico causado pela destruição da barreira hematoencefálica pelo tumor. Esta última condição clínica é pouco detectável pelo diagnóstico por imagem.
A tomografia computadorizada do cérebro normalmente mostra uma massa de tecido que pode ser realçada por qualquer contraste. Na TC, os gliomas de baixo grau geralmente parecem isodensos ao parênquima normal e, portanto, podem não apresentar realce pelo contraste. Da mesma forma, lesões na fossa posterior do crânio são difíceis de identificar na TC. Consequentemente, os resultados dessa tomografia isoladamente nem sempre são suficientes para fins diagnósticos. Em casos duvidosos, o uso da ressonância magnética mais sensível é essencial.
Na ressonância magnética, um tumor intracraniano aparece como uma lesão maciça que pode se tornar mais luminescente após o uso do agente de contraste. No entanto, há sempre uma anomalia de sinal na ressonância magnética, que indica a presença de neoplasia ou edema vasogênico. Normalmente, o aumento da luminescência (realce pelo contraste) é indicativo de um tumor de grau mais alto de malignidade. Um anel contrastante é característico do glioblastoma, com a porção luminescente correspondendo à parte vital do tumor maligno e a área mais escura-hipointense à necrose tecidual.
Determinação de etapa[editar | editar código-fonte]
A maioria dos tumores intracranianos primários permanece localizada no crânio, portanto, procedimentos de estadiamento sistêmico não são necessários.
Em contraste, tumores neuroectodérmicos primários, meduloblastomas, tumores de células germinativas do SNC e linfomas primários do SNC geralmente se espalham através do espaço subaracnóideo para as leptomeninges. Uma ressonância magnética espinhal ou uma punção lombar também é necessária para todos os pacientes com esses diagnósticos.
Tipos de tumor[editar | editar código-fonte]
Gliomas[editar | editar código-fonte]
Os tumores primários do sistema nervoso central (SNC) envolvem uma variedade de tecidos patológicos, cada um com sua própria história natural. Devido ao fato de que os gliomas sozinhos representam quase 40% de todos os tumores do SNC, é comum na literatura distinguir entre tumores gliais e não gliais.
Astrocitomas[editar | editar código-fonte]
Vários sistemas de categorias foram propostos na literatura ao longo do tempo para classificar a malignidade dos astrocitomas. Desde 1993, o sistema de classificação de quatro níveis proposto pela Organização Mundial da Saúde (WHO) tem sido o mais utilizado e aplicado. Baseia-se em quatro características histológicas: aumento da densidade celular, mitose, proliferação endotelial e necrose. Posteriormente, astrocitomas de grau I, como astrocitomas pilocíticos, são tipicamente de histologia benigna. Astrocitomas II. Os graus (difusos) mostram o aumento da densidade celular como única característica histológica e são neoplasias com menor grau de infiltração. Astrocitomas III mostram uma mitose significativa. grau (anaplástico). E proliferação endotelial ou necrose são vistas em astrocitomas IV. graus, os chamados glioblastomas.
Astrocitomas de baixo grau[editar | editar código-fonte]



Astrocitomas pilocíticos (incluindo o astrocitoma pilomixóide ), astrocitomas subependimários de células gigantes e xantastrocitomas pleomórficos estão entre os tumores circunscritos. Estas são neoplasias um pouco mais raras de histologia benigna que muitas vezes só podem ser curadas por cirurgia. Se a excisão for incompleta, o tecido tumoral remanescente pode ser tratado com sucesso com radioterapia. Em raros casos em que o tratamento local não funciona, a quimioterapia sistêmica pode ser bem-sucedida, que deve ser ajustada individualmente. As crianças respondem a uma combinação de carboplatina e vincristina.
Astrocitomas difusos II aparecem na tomografia computadorizada. Graus do que lesões menos intensas. Na ressonância magnética preferida, os agentes de contraste podem não ser capazes de destacar essas neoplasias, sua luminescência pode ser mais fina e mais fraca. Um mais intenso pode indicar tecidos de anaplasia aumentada. Sempre que possível, sugere-se a realização de biópsia para obtenção de amostras da porção anaplásica do tumor.
Na maioria dos casos, os pacientes com astrocitomas difusos têm entre 20 e 40 anos. A ocorrência de crises epilépticas é típica para eles. Condições para um prognóstico favorável são idade jovem, tamanho do tumor abaixo de 50 milímetros e a ressecção cirúrgica mais extensa possível do tumor. As recorrências tardias são relativamente comuns, razão pela qual os pacientes precisam ser acompanhados por 15 anos após a remoção do tumor.
Apesar de seu curso relativamente lento, a maioria dos astrocitomas evoluem para lesões caracterizadas por extensa anaplasia, geralmente refratárias à cirurgia e radioterapia. No entanto, a terapia para pacientes com astrocitomas difusos de baixo grau não apresenta consenso unânime na literatura. O papel da ressecção completa é discutido em contextos profissionais. Os resultados de alguns estudos mostram que a remoção máxima do tumor dá os melhores resultados. De fato, tumores pequenos e unilaterais podem ser completamente removidos se nenhuma estrutura crítica do cérebro estiver envolvida. Uma abordagem pragmática geralmente aceitável para a generalidade dos casos é remover a neoplasia o máximo possível para evitar déficits neurológicos significativos.
Estudos mostraram que a radioterapia administrada imediatamente após o diagnóstico prolongou o tempo em que o paciente está livre da doença antes da recorrência do tumor em comparação com a situação em que o curso da radioterapia é adiado até o momento da progressão. No entanto, atualmente não há consenso de que a radioterapia logo após o diagnóstico melhore a “sobrevida geral” do paciente.
Em pacientes com sintomas mais leves ou sem sintomas, ou com convulsões que podem ser controladas com anticonvulsivantes, é possível retardar a radioterapia até que o crescimento do tumor atinja uma fase crítica. Muitas vezes há um desejo de reduzir o risco de danos neurológicos causados pela própria radioterapia.
Dois ensaios clínicos randomizados prospectivos não mostraram maior benefício da radioterapia de alta dose do que da radioterapia de baixa dose. Normalmente a dosagem total está entre 45 e 54 Gray com um fracionamento de 1,8 a 2 Gray.
O efeito da quimioterapia adjuvante em pacientes com astrocitomas de baixo grau ainda está sob investigação. Resultados preliminares de um ensaio clínico comparando radioterapia isolada com radioterapia seguida de quimioterapia contendo procarbazina, lomustina e vincristina (PCV) mostraram um período mais longo de "sobrevida livre de doença" com a combinação, mas não uma "sobrevida geral" prolongada. Devido à toxicidade associada ao protocolo de PCV, o uso de temozolomida é recomendado tanto como terapia inicial quanto pós-recuperação.
Astrocitoma anaplásico[editar | editar código-fonte]
Astrocitoma anaplásico é um tumor cerebral maligno caracterizado por crescimento difuso, aumento da densidade celular e figuras de divisão nuclear. Ele surge de uma população de células específicas do sistema nervoso central, os astrócitos. De acordo com a classificação da WHO de tumores do sistema nervoso central, o tumor corresponde a um tumor de grau III. Normalmente, os pacientes com astrocitoma anaplásico apresentam crises epilépticas, déficits neurológicos focais, dores de cabeça e alterações de personalidade. A idade média dos pacientes é de 45 anos. A ressonância magnética geralmente mostra uma lesão maciça com sinal de contraste aumentado, que também pode ser mais fraco. O diagnóstico é feito pelo exame histológico da lesão por biópsia ou ressecção cirúrgica.
Um pior prognóstico pode estar associado à idade avançada, má condição física e danos neurológicos significativos. Em geral, o resultado terapêutico é melhor com ressecção cirúrgica completa (tratamento padrão) sem aumentar os déficits neurológicos. A radioterapia é padrão porque demonstrou aumentar o tempo de sobrevida. O papel da quimioterapia é controverso.
Glioblastoma[editar | editar código-fonte]

Os tumores de células gliais mais comuns e malignos são os glioblastomas. Consistem em uma massa heterogênea de células de astrocitoma pouco diferenciadas principalmente em adultos. Geralmente ocorrem nos hemisférios cerebrais, mais raramente no tronco cerebral ou na medula espinhal. Exceto em casos muito raros, como todos os tumores cerebrais, eles não se estendem além das estruturas do sistema nervoso central.
O glioblastoma pode surgir de uma forma difusa (II. grau) ou um astrocitoma anaplásico (III. grau) se desenvolvem. Neste último caso, é chamado de secundário. No entanto, quando ocorre sem antecedentes ou evidência de malignidade prévia, é referido como primário. Os glioblastomas são tratados com cirurgia, radioterapia e quimioterapia. Eles são difíceis de curar e há poucos casos que sobrevivem além de três anos.
Oligodendrogliomas[editar | editar código-fonte]
O oligodendroglioma é um tumor cerebral glial incomum que surge a partir de oligodendrócitos. Ocorre principalmente em adultos entre 40 e 45 anos, preferencialmente no córtex cerebral e na substância branca dos hemisférios cerebrais.
Os oligodendrogliomas são relativamente incomuns, representando menos de 5% de todos os tumores cerebrais primários e não mais que cerca de 10 a 15% de todos os gliomas. Esses tumores são divididos em lesões de baixo grau e anaplásicas. O oligodendroglioma anaplásico é caracterizado por aumento da densidade celular, mitose, proliferação endotelial e polimorfismo nuclear, além de necrose.
Oligodendrogliomas e oligoastrocitomas de baixo grau[editar | editar código-fonte]
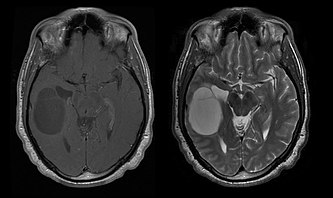
A sobrevida média para pacientes com oligodendroglioma puro é de cerca de 10 anos, com oligoastrocitoma cerca de 8 anos. O alongamento em relação aos astrocitomas puros é devido a uma [[]] ou translocação do par 1p/19q no tumor.
A idade média dos pacientes ao diagnóstico é de 35 anos. Os sintomas típicos são crises epilépticas, mas déficits neurológicos focais, alterações de personalidade ou outros sintomas de pressão intracraniana, como cefaléia e vômitos, também podem ser relatados. Esses tumores geralmente não são visíveis na tomografia computadorizada, portanto, a ressonância magnética é o método de escolha para diagnóstico por imagem. No
Esses tumores progridem mais lentamente do que os astrocitomas de baixo grau e não há consenso na literatura quanto ao tratamento ideal. O tratamento inicial envolve o controle dos sintomas com medicamentos anticonvulsivantes, radioterapia, quimioterapia ou uma combinação dos dois últimos. Cirurgia, radioterapia e quimioterapia desempenham um papel importante nas recaídas. As ressecções podem aliviar os sintomas. Em temozolomida mostrou 50 Porcentagem de pacientes que recidivam após radioterapia têm uma reação positiva.
Oligodendrogliomas e oligoastrocitomas anaplásicos[editar | editar código-fonte]
Os oligodendrogliomas anaplásicos apresentam sintomas típicos decorrentes do efeito de massa e crises epilépticas. Apesar de sua quimiossensibilidade, a sobrevida média é de apenas 3 . até 5 Anos. O tratamento envolve a excisão máxima, seguida de radioterapia. Em relação à quimioterapia, deve-se notar que dois ensaios clínicos recentes de fase III compararam os resultados da radioterapia com os da radioterapia combinada e quimioterapia procarbazina, lomustina, vincristina. Embora a sobrevida sem sintomas relevantes tenha sido maior com a terapia combinada, a sobrevida global foi a mesma para ambas as terapias. Pacientes com [[]] 1p/19q obtiveram os melhores resultados de tratamento, enquanto pacientes sem 1p/19q foram capazes de melhorar seus resultados com quimioterapia PCV.
Estudos clínicos prospectivos mostraram que cerca de 50 até 70 Porcentagem de pacientes com oligodendroglioma anaplásico recorrente após radioterapia respondem positivamente à quimioterapia com PCV ou temozolomida. Embora a eficácia superior da terapia com temozolomida e PCV não tenha sido estabelecida, a falta de mielossupressão cumulativa com temozolomida sugere seu uso no início do tratamento de recaída.
Ependimomas[editar | editar código-fonte]


Ependimoma é uma neoplasia que se desenvolve a partir de células ependimárias que revestem os ventrículos cerebrais, plexo coróide, filum terminale e canal central da medula espinhal. As células ependimárias também estão presentes no parênquima cerebral como resultado da migração embrionária das áreas periventriculares para o córtex cerebral.
Esses tumores bastante raros podem aparecer em qualquer idade, mas apresentam dois picos característicos, de 0 a 10 e de 40 a 50 anos. As lesões intracranianas, que geralmente ocorrem na fossa posterior, são mais comuns na primeira faixa etária, enquanto as lesões na coluna vertebral são mais comuns na segunda faixa etária.
Os ependimomas são divididos em lesões de baixo grau (I. e II. grau na escala da WHO) e lesões anaplásicas (III. graus) subdivididos. I. grau são, em particular, subependimomas e ependimomas mixopapilares, III. Ependimoma anaplásico. Pacientes com ependimomas de baixo grau na coluna que podem ser completamente removidos não são submetidos à radioterapia posteriormente. O papel da radioterapia pós-operatória em ependimomas intracranianos de baixo grau é controverso, mas o tratamento com radioterapia geralmente é indicado para tumores anaplásicos ou de baixo grau que não podem ser completamente ressecados.
Estudos clínicos mostraram que os ependimomas respondem à quimioterapia, principalmente os à base de platina. O benefício da quimioterapia à base de platina é de 67 Por cento, por outro lado 25 para nitrosoureias Por cento. O prognóstico para ependimomas II. As notas são sobrevida livre de doença em 6 anos de 68 por cento e com sobrevida global de 87 Por cento. Nos ependimomas anaplásicos, esses valores caem para 29 por cento ou para 37 Por cento.
Tumores não gliais[editar | editar código-fonte]
Meduloblastomas[editar | editar código-fonte]
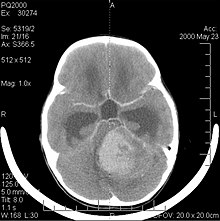
meduloblastomas O meduloblastoma é o tumor cerebral maligno mais comum em crianças. A maior incidência ocorre em crianças entre as idades de 2 e 7 anos. O maior risco de doença permanece na infância, pois o meduloblastoma é muito raro em pessoas com mais de 21 anos.
Este tumor é típico da fossa posterior, onde se localiza em ambos os hemisférios do cerebelo ou no vermis cerebelar. Por ser invasivo e de crescimento rápido, geralmente se espalha para outras partes do sistema nervoso central (SNC) através do LCR e pode se infiltrar no assoalho do quarto ventrículo próximo e nas meninges. Mais raramente, podem ocorrer metástases adicionais no SNC. Quando a malignidade ocorre, os sintomas incluem perda de equilíbrio, incoordenação, diplopia, disartria e devido ao envolvimento do quarto ventrículo, que muitas vezes resulta em hidrocefalia obstrutiva, cefaleia, náuseas e vômitos e marcha instável.
A ressonância magnética geralmente mostra uma lesão maciça com realce de contraste envolvendo o cerebelo. Como mencionado acima, o meduloblastoma tem alta propensão a infiltrar localmente as leptomeninges, bem como a se espalhar pelo espaço subaracnóideo, envolvendo os ventrículos, a convexidade cerebral e as superfícies leptomeníngeas da coluna. Consequentemente, é necessário trazer todo o eixo cranioespinhal em ressonância.
O objetivo da cirurgia é remover o máximo possível da massa apresentada pela lesão. De fato, os tumores residuais pós-operatórios resultam em pior prognóstico. Também um prenúncio de um prognóstico desfavorável é a presença de células tumorais no líquido cefalorraquidiano ou a detecção por ressonância de metástases leptomeníngeas. A cirurgia por si só geralmente não é curativa. Em alguns casos, no entanto, pode ocorrer irradiação terapêutica do eixo cranioespinhal, focada no local do tumor primário. A adição de quimioterapia após a radioterapia aumenta a taxa de cura. Medicamentos à base de platina (cisplatina ou carboplatina), etoposídeo e um agente alquilante (ciclofosfamida ou lomustina) são usados com vincristina. Com tratamento adequado, casos de longa sobrevida de mais de 3 anos em pacientes com meduloblastoma variam de 60 a 60 anos e 80 Por cento.
Meningiomas[editar | editar código-fonte]
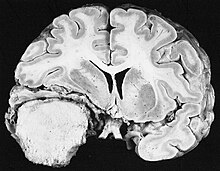

Os meningiomas são os tumores cerebrais extrínsecos ou extra-axiais intracranianos mais comuns que surgem das células da aracnóide, a membrana que reveste o cérebro e a medula espinhal. A incidência desta neoplasia é de cerca de 2 casos por ano por 100.000 Residente. São mais comuns em mulheres na sexta e sétima décadas. Sua frequência é maior em pacientes com neurofibromatose tipo 2. A perda do cromossomo 22 é característico de meningiomas, embora o significado prognóstico desse achado ainda não esteja claro.
Os pacientes com meningioma podem apresentar sintomas típicos de uma lesão craniana maciça, incluindo convulsões e déficits neurológicos focais. Como o meningioma também pode ser assintomático, às vezes eles são detectados na tomografia computadorizada e na ressonância magnética por outros motivos. Este tumor de ressonância tem uma aparência característica, geralmente consistindo em realce uniforme de contraste ao longo da dura-máter com separação clara do parênquima cerebral. Outra característica, embora não presente em todos os casos, é a chamada "cauda dural", representada por uma protuberância que se estende além da lesão e indica o ponto de ancoragem na dura-máter.
Muitos meningiomas descobertos incidentalmente não requerem tratamento no momento do diagnóstico inicial. Se o paciente apresentar um efeito de massa significativo, com ou sem sintomas, o tratamento de escolha geralmente é a ressecção completa. Em um estúdio da Mayo Clinics comparando as taxas de controle do tumor após ressecção cirúrgica e radiocirurgia em pacientes com meningioma intracraniano pequeno a moderado e sem sintomas de efeito de massa, a radiocirurgia resultou em melhor controle (98 contra 88 por cento) e com menos complicações (10 contra 22 por cento) em comparação com a remoção cirúrgica.
Linfomas primários do SNC[editar | editar código-fonte]

O linfoma primário do sistema nervoso central é responsável por cerca de 2 por cento para 3 por cento de todos os tumores cerebrais em pacientes com um sistema imunológico normal. Ocorrem mais frequentemente em homens com mais de 55 anos até 60 anos acima. Quase metade de todos os linfomas ocorrem em pacientes com mais de 60 anos e cerca de um quarto em pacientes com mais de 70 anos. anos acima. A incidência parece aumentar com a idade, mas a razão ainda não é clara. Pacientes com sistema imunológico enfraquecido correm maior risco de desenvolver linfoma do SNC, portanto, aqueles que tiveram um transplante de órgão têm uma imunodeficiência congênita ou doença autoimune ou estão infectados com o vírus da imunodeficiência humana. Os linfomas cerebrais associados ao HIV estão associados ao vírus Epstein-Barr, particularmente em pacientes com contagens de linfócitos CD4 abaixo de 500 células por milímetros cúbicos no sangue. A maioria dos linfomas do SNC são linfomas difusos de grandes células B.
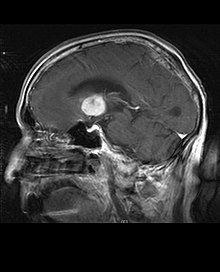
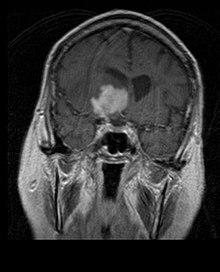
Os pacientes sofrem de uma variedade de sintomas característicos de uma lesão maciça focal ou multifocal. A RM geralmente mostra tumores com realce homogêneo de contraste dentro da substância branca periventricular profunda. Multifocalidade e realce não homogêneo são típicos para pacientes com sistema imunológico enfraquecido. A análise do linfoma do SNC é extremamente importante no diagnóstico diferencial das neoplasias cerebrais. Ressalta-se que a administração de corticosteróides pode levar ao desaparecimento completo do realce, dificultando o diagnóstico das lesões. Consequentemente, se o linfoma do SNC for considerado no diagnóstico diferencial, os corticosteróides devem ser evitados, a menos que o efeito de massa cause um problema sério e imediato no paciente.
A biópsia da lesão suspeita é crucial. Ao contrário do linfoma sistêmico de grandes células B, no qual tanto a quimioterapia quanto a radioterapia são eficazes e o tratamento de lesões localizadas é curativo, o linfoma do sistema nervoso central geralmente responde à terapia inicial, mas depois recorre. Assim como no linfoma sistêmico, o papel da cirurgia limita-se principalmente à obtenção de amostras de tecido apropriadas para o diagnóstico.
No passado, a radioterapia era administrada em todo o cérebro (panencefálico). A sobrevida mediana é de cerca de 12, mesmo com lesões localizadas Meses. A recorrência geralmente afeta o local da lesão anterior, bem como outras regiões. As respostas à quimioterapia são mais promissoras. Ensaios clínicos nos quais o metotrexato em altas doses foi usado como primeiro tratamento e a radioterapia foi adiada até o momento da recidiva ou progressão mostraram melhor sobrevida global do que a radioterapia isolada. Ainda mais eficaz foi a combinação de metotrexato, vincristina, procarbazina, metotrexato intratecal, citarabina e radioterapia panencefálica e citarabina, ou o uso de quimioterapia intra-arterial com metotrexato intra-arterial, ciclofosfamida injetada por via intravenosa e etoposídeo após modificação do sangue- barreira cerebral com manitol. A sobrevida mediana na terapia com metotrexato foi de 24 até 40 meses muito maior do que com radioterapia isolada (intervalo de 24 até 40 meses). Em alguns casos, a radioterapia é utilizada apenas para recidivas quando há uma regressão inicial com a quimioterapia. Casos de longa sobrevida também foram relatados sem radioterapia.
A radioterapia panencefálica está associada a um alto risco de desenvolver demência ou leucoencefalopatia. Esse risco pode ser reduzido desenvolvendo estratégias eficazes de controle do tumor que evitem a radioterapia panencefálica. A terapia inicial para pacientes com sistema imunológico comprometido é reduzir as causas da imunossupressão. O prognóstico para esses pacientes geralmente é pior do que para pacientes que têm um sistema imunológico normal. Devido a infecções tumorais concomitantes e uma condição física geralmente abaixo do ideal, a quimioterapia muitas vezes não pode ser realizada nesses pacientes imunossuprimidos. Tal como acontece com outros tumores cerebrais, a resposta aos tratamentos depende da idade e da condição física.
Tumores metastáticos do sistema nervoso central[editar | editar código-fonte]
Metástases cerebrais[editar | editar código-fonte]
As metástases cerebrais são as neoplasias intracranianas mais comuns em adultos, sendo dez vezes mais comuns que os tumores cerebrais primários. Eles pisam em 20 até 40 por cento dos adultos com câncer e estão associados principalmente ao câncer de pulmão e mama e melanoma . Essas lesões resultam da disseminação de células cancerígenas pela corrente sanguínea e ocorrem mais comumente na junção da substância cinzenta e branca, onde a seção transversal dos vasos sanguíneos se altera, aprisionando embolias de células tumorais . 80 por cento das lesões ocorrem nos hemisférios cerebrais, 15 por cento no cerebelo e 5 por cento no tronco cerebral. Cerca de 80 por cento dos pacientes têm história de câncer sistêmico e 70 por cento têm múltiplas metástases cerebrais.

Avanços significativos foram feitos recentemente no diagnóstico e tratamento dessas lesões, resultando em melhora da sobrevida e controle dos sintomas. O início dos sinais e sintomas é semelhante ao de outras lesões maciças no cérebro. O método diagnóstico de escolha é a ressonância magnética com meio de contraste.
A literatura mostra resultados equivalentes para cirurgia e radiocirurgia. Este último parece ser mais conveniente, eficaz e seguro para lesões pequenas ou em regiões inacessíveis à cirurgia. A radiocirurgia é uma alternativa sensata para pacientes que não podem ser operados por razões médicas. No entanto, a cirurgia é claramente o método ideal para obter tecidos para diagnóstico e remover as lesões que causam efeito de massa. Portanto, a radiocirurgia e a cirurgia devem ser melhor consideradas como dois métodos complementares, mas diferentes a serem aplicados, dependendo da situação diferente do paciente. Por quase 50 por cento dos pacientes com uma ou duas metástases cerebrais não são candidatos à remoção cirúrgica devido à inacessibilidade das lesões, extensão da doença sistêmica ou outros fatores. Esses e outros pacientes com metástases múltiplas geralmente recebem radioterapia panencefálica como padrão de tratamento. Na verdade, chegar até quase 50 por cento deles com esta terapia uma melhora nos sintomas neurológicos e 50 até 70 por cento uma reação perceptível. A quimioterapia raramente é usada principalmente para metástases cerebrais.
Para a maioria dos pacientes com metástases cerebrais, a sobrevida média é de apenas quatro a seis meses após a radioterapia panencefálica. No entanto, pacientes com menos de 60 anos com lesões discretas e doença sistêmica controlada podem alcançar maior sobrevida porque podem tolerar uma abordagem de tratamento mais agressiva.
Metástases meníngeas[editar | editar código-fonte]

Por volta das 5 por cento dos pacientes com tumor podem ser diagnosticados com metástases das meninges moles (leptomeninges encephali). Na maioria das vezes eles ocorrem em melanoma, câncer de mama e de pulmão como resultado da disseminação de células tumorais pela corrente sanguínea. As células malignas são então espalhadas por todo o sistema nervoso central (SNC), geralmente através do líquido cefalorraquidiano, comumente conhecido como líquido cerebral.
Um ou mais dos seguintes sinais e sintomas podem ser causados por metástases meníngeas, entre outros:
- lesão nervosa local, como paralisia do nervo craniano, fraqueza motora e radiculopatias, parestesia e dor,
- invasão direta do cérebro ou do tecido espinhal,
- Distúrbio dos vasos sanguíneos no cérebro e na coluna vertebral com déficits neurológicos focais e/ou convulsões,
- Impedimentos ao fluxo normal do líquido cefalorraquidiano com cefaleia e aumento da pressão intracraniana,
- Distúrbios da função cerebral normal, como encefalopatia e/ou
- infiltração perivascular por células tumorais com sintomas de isquemia e apoplexia resultantes.
O diagnóstico pode ser feito por exame do líquido cefalorraquidiano ou ressonância magnética do cérebro e da medula espinhal. A presença de células malignas pode ser medida a 50 por cento dos pacientes podem ser identificados. Pelo menos 10 por cento dos pacientes com envolvimento leptomeníngeo, o exame citológico permanece negativo. Ao aumentar o número de punções lombares para seis e a quantidade de volume de fluido removido para 10 Mililitro por punção pode aumentar a possibilidade de um diagnóstico positivo. No líquido cefalorraquidiano, a concentração de proteínas costuma ser alta, a de glicose pode ser baixa na presença de pleocitose. O estudo radiográfico pode mostrar hidrocefalia sem lesão maciça ou aumento difuso das leptomeninges.
Sem terapia, a sobrevida média é de 4 até 6 semanas, com óbito por deterioração neurológica progressiva. As metástases leptomeníngeas são frequentemente uma manifestação do estágio final da doença principal, e a terapia sintomática pode ser a solução mais adequada. Corticosteróides e analgésicos proporcionam alívio temporário. O tratamento pode ser oferecido a pacientes com doença sistêmica mínima e condição física geral aceitável para aliviar os sintomas e prolongar a sobrevida.
A sobrevida mediana pode ser melhorada pela radioterapia em locais sintomáticos e áreas doentes mais volumosas identificadas por raio-x, e pela terapia intratecal com metotrexato, citarabina e tiotepa, realizada com punção lombar ou cateter de Ommaya, a partir de 3 em 6 meses são aumentados.
A principal complicação da terapia intratecal à base de metotrexato é a leucoencefalopatia necrosante, que pode se desenvolver após meses de terapia naqueles poucos pacientes que podem desfrutar de sobrevida prolongada. Este efeito tóxico devastador é particularmente comum em pacientes que receberam radioterapia prévia ou concomitante com terapia com metotrexato intratecal.
Dor e cuidados terminais[editar | editar código-fonte]
Os cuidados paliativos são uma forma especial de cuidado destinada a melhorar a qualidade de vida dos pacientes que sofrem de uma doença grave ou com risco de vida, como o câncer. O objetivo dos cuidados paliativos não é curar, mas prevenir ou tratar o mais precocemente possível os sintomas e efeitos colaterais da doença e seu tratamento, bem como os problemas psicológicos, sociais e espirituais a ela associados. Os cuidados paliativos também são conhecidos como cuidados de conforto, cuidados de suporte e gerenciamento de sintomas.
Os cuidados paliativos são fornecidos durante toda a experiência de câncer do paciente. Geralmente começa com o diagnóstico e continua durante o tratamento, cuidados de acompanhamento e o fim da vida.
Weblinks[editar | editar código-fonte]
- www.cochrane.org/pt/evidence – COCHRANE - Neuro-Oncology Group
- www.eano.eu – European Association of Neuro-Oncology
- https://www.eortc.org/research_field/brain/ – The European Organisation for Research and Treatment of Cancer (EORTC)
Literatura[editar | editar código-fonte]
- Jan C. Buckner et al., Central Nervous System Tumors, Mayo Clinic Proceedings, Jg. 82, 2007, lado 1271-1286
- Lisa M. DeAngelis et al., Intracranial Tumors. Diagnosis and Treatment, Dunitz London, 2002, ISBN 1-901865-37-1
- D. N. Louis et al., WHO Classification of Tumours of the Central Nervous System, Genf, 2007, ISBN 978-92-832-2430-3
- Richard Pazdur et al., Cancer management. A multidisciplinary approach. Medical, surgical, & radiation oncology, UBM Medica, 2010, ISBN 978-0-615-41824-7
- Jerome B. Posner, Neurologic Complications of Cancer, Davis, Philadelphia, 1995, ISBN 0-8036-0006-2
- Rüdiger Schenk, Neuroonkologische Therapiekonzepte zur Behandlung von Astrozytomen höheren Malignitätsgrades und Rezidivlokalisation, Regensburg, 2019
- Uwe Schlegel et al., Neuroonkologie, 2. erw., Thieme, Stuttgart, 2003, ISBN 3-13-109062-6
- Jörg-Christian Tonn et al., Oncology of CNS Tumors, Springer, Berlin, 2010, ISBN 978-3-642-02873-1



