Vacina
Jonas Salk em 1955 segurando
dois frascos de cultura para a
vacina contra a poliomielite.
Vacina é uma preparação biológica que fornece imunidade adquirida ativa para uma doença particular. Uma vacina tipicamente contém um agente que se assemelha a um microrganismo causador de doenças e é muitas vezes feita de formas enfraquecidas ou mortas do micróbio, das suas toxinas ou de uma das suas proteínas de superfície. O agente estimula o sistema imunológico do corpo a reconhecê-lo como uma ameaça, destruí-lo e a manter um registro seu (memória imunológica) para que possa mais facilmente reconhecer e destruir qualquer um desses microrganismos que mais tarde encontre. As vacinas podem ser profilácticas (exemplo: para prevenir ou melhorar os efeitos de uma futura infecção por qualquer patógeno natural ou "selvagem"), ou terapêuticas (por exemplo, vacinas contra o câncer estão a ser pesquisadas).
A administração de vacinas é chamada vacinação e sua eficácia tem sido amplamente estudada e verificada; por exemplo, a vacina contra a gripe,[1] a vacina contra o HPV[2] e a vacina contra a varicela.[3] A vacinação é o método mais eficaz de prevenção de doenças infecciosas,[4] e a imunidade generalizada devido à vacinação é amplamente responsável pela erradicação mundial da varíola e pela restrição de doenças como poliomielite, sarampo e tétano em grande parte do mundo. A Organização Mundial de Saúde (OMS) relata que vacinas licenciadas estão atualmente disponíveis para prevenir ou contribuir para a prevenção e controle de 25 infecções.[5]
Os termos "vacina" e "vacinação" são derivados de Variolae vaccinae (varíola da vaca), o termo inventado por Edward Jenner para denotar a varíola bovina.[6] Em 1881, para homenagear Jenner, Louis Pasteur propôs que os termos fossem estendidos para cobrir as novas inoculações protetoras então em desenvolvimento.[7]
História
[editar | editar código-fonte]
Antes da introdução da vacinação com material de casos de varíola bovina (vacinação heterotípica), a varíola poderia ser prevenida pela inoculação deliberada do vírus da varíola, processo posteriormente referido como "variolação" para distingui-lo da vacinação contra a varíola. As primeiras sugestões da prática de inoculação para a varíola vêm da China durante o século X.[8] Os chineses também praticaram o mais antigo uso documentado da variolação, que remonta ao século XV. Eles implementaram um método de "insuflação nasal" administrado por sopro de material de varíola em pó até as narinas. Várias técnicas de insuflação foram registradas ao longo dos séculos XVI e XVII na China.[9] Dois relatórios sobre a prática chinesa de inoculação foram recebidos pela Royal Society em Londres em 1700; um pelo Dr. Martin Lister, que recebeu um relatório de um empregado da Companhia das Índias Orientais estacionada na China e outro pelo Dr. Clopton Havers.[10]
Em algum momento durante o final da década de 1760, enquanto servia de aprendiz de cirurgião/boticário, Edward Jenner soube da história, comum nas áreas rurais, de que os trabalhadores de laticínios nunca teriam a doença, muitas vezes fatal ou desfigurante, porque já haviam tido varíola bovina, que tem um efeito muito suave em seres humanos. Em 1796, Jenner coletou pus da mão de uma ordenhadora com varíola bovina, raspou-a no braço de um menino de 8 anos e, seis semanas mais tarde, inoculou o menino com varíola, observando depois que ele não pegava a doença.[11][12] Jenner estendeu seus estudos e em 1798 relatou que sua vacina era segura em crianças e adultos e poderia ser transferida de braço a braço, reduzindo a dependência de suprimentos incertos de vacas infectadas. Uma vez que a vacinação a partir da varíola bovina era muito mais segura do que a inoculação da varíola,[13] esta última, embora ainda amplamente praticada na Inglaterra, foi proibida em 1840.[14] A segunda geração de vacinas foi introduzida na década de 1880 por Louis Pasteur, que desenvolveu vacinas contra o cólera e o antraz.[7] As vacinas do final do século XIX eram consideradas uma questão de prestígio nacional, com leis de vacinação obrigatória.[11]
O século XX viu a introdução de várias vacinas bem-sucedidas, incluindo as contra a difteria, sarampo, caxumba e rubéola. As principais realizações incluíram o desenvolvimento da vacina contra a pólio na década de 1950 e a erradicação da varíola durante os anos 1960 e 1970. Maurice Hilleman foi o mais prolífico dos desenvolvedores das vacinas no século XX. À medida que as vacinas se tornaram mais comuns, muitas pessoas começaram a tomá-las como garantias. No entanto, as vacinas permanecem indescritíveis para muitas doenças importantes, como herpes, malária, gonorreia e HIV/AIDS.[11][15]
Eficácia
[editar | editar código-fonte]Vacinas são, historicamente, o meio mais efetivo e seguro para se combater e erradicar doenças infecciosas.[16] Limitações para sua eficácia, porém, existem.[17] Algumas vezes, a proteção oferecida pela vacina falha porque o sistema imune humano não consegue responder adequadamente ou não responde. A falta de resposta imune envolve muitos fatores, como diabetes, uso de esteroides sintéticos ou HIV.[18] Pode também haver um fator genético para a falha da vacina, se o sistema imune não possuir linhas de células B capazes de gerar anticorpos específicos para se ligar a um determinado patógeno. Mesmo que o organismo desenvolva os anticorpos, a proteção ainda pode não ser adequada, pois a imunidade pode se desenvolver muito devagar para ser efetiva a tempo, os anticorpos podem não destruir o patógeno completamente ou pode haver muitas cepas diferentes de patógenos, nem todos suscetíveis a uma resposta imune. Porém, até mesmo a imunidade parcial, tardia ou fraca pode mitigar a infecção, resultando em uma baixa taxa de mortalidade, baixa morbidade e total recuperação.[18]
Adjuvantes imunológicos são normalmente usados para aumentar a resposta imune, particularmente para pessoas mais velhas, na faixa de 50 a 75 anos em diante, cuja resposta imune a vacinas possa ter enfraquecido devido à idade.[19]

Sua eficiência ou performance depende de vários fatores:
- a doença em si (algumas vacinas se apresentam de melhor maneira que outras dependendo da enfermidade);
- a cepa da vacina (algumas vacinas são específicas ou mais eficazes contra determinadas cepas de doenças, como no caso da gripe[21]);
- se o calendário de vacinação foi seguido e aplicado corretamente;
- resposta idiossincrática da vacina; alguns indivíduos não respondem a certas vacinas, o que significa que eles não geraram anticorpos mesmo depois de vacinados;
- fatores externos como etnia, predisposição genética e idade.
Se o indivíduo vacinado ainda assim desenvolver a doença contra a qual foi vacinado em uma epidemia, a doença será menos virulenta para ele do que para uma vítima não vacinada.[22] Existem importantes considerações a respeito da eficiência dos programas de vacinação:
- cuidadoso mapeamento para antecipar o impacto que a campanha de imunização terá na epidemiologia de uma doença a médio e longo prazo;
- supervisão prolongada para doenças relevantes seguindo a introdução da nova vacina na população;
- manutenção de altos índices de imunização, mesmo que a doença esteja virtualmente erradicada.
Em 1958, existiam cerca de 763 094 casos de sarampo nos Estados Unidos, resultando em 552 mortes.[23][24] Após a introdução de novas vacinas, os casos caíram para pouco mais de 150 ao ano, com média de 56 casos de sarampo anuais. No começo de 2008, havia 64 casos suspeitos de sarampo, sendo que 54 deles estavam associados com viagens ao exterior. Sessenta e três dos sessenta e quatro infectados nunca tinham sido vacinados contra o sarampo ou não tinham certeza se tinham sido vacinados.[24]
No Brasil, o último diagnóstico de poliomielite foi em 1990. O último caso endêmico aconteceu no Peru, em 1991. A Organização Mundial da Saúde declarou a pólio erradicada das Américas em 1994 e da Europa em 1999, depois de um programa regional ter sido iniciado em 1985, com a criação dos dias nacionais de vacinação de crianças com menos de 5 anos de idade e supervisão médica de todos os casos de paralisia em menores de 15 anos de idade, para poder identificar novos surtos. Em 1988, a OMS lançou um programa global de erradicação da pólio, cujo objetivo era a total erradicação até o ano 2000.[25] Até 2020, a pólio transmitida apenas entre humanos, estava restrita a algumas partes no interior da Nigéria, Paquistão e Afeganistão.[26] Em 25 de agosto de 2020 a Organização Mundial da Saúde anunciou a erradicação da poliomielite na África.[27][28] Infelizmente, barreiras culturais e a dificuldade de alcançar todas as crianças nesses locais estão impedindo a completa erradicação das doenças.
Vacinas têm contribuído para a erradicação não apenas da varíola e da pólio, como também da caxumba, febre tifoide, sarampo e catapora, que era estão hoje muito menos comuns do que eram 100 anos atrás. Contanto que a população se vacine, é pouco provável que uma epidemia ocorra, muito menos que se espalhe. Este é o efeito da imunidade herdada.
Tipos
[editar | editar código-fonte]
Vacinas são feitas com microrganismos mortos ou inativos, ou substâncias purificadas derivadas dos mesmos. Existem vários tipos de vacinas em uso atualmente. Cada uma representa uma estratégia diferente para reduzir o risco de doenças enquanto induz uma resposta imune benéfica para o organismo vacinado.[29][30]
Inativada
[editar | editar código-fonte]Algumas vacinas contém micro-organismos inativos, porém anteriormente virulentos, que foram destruídos por agentes químicos, calor, radiação[31] ou antibióticos. Exemplos de vacinas inativadas são a de gripe, cólera, peste bubônica, pólio, hepatite A e raiva.[32]
Atenuada
[editar | editar código-fonte]Algumas vacinas contêm micro-organismos vivos e atenuados. Muitos destes são vírus ativos que foram cultivados sob condições que desativam suas propriedades virulentas, ou que usam organismos estreitamente relacionados, mas menos perigosos, para produzir uma ampla resposta imune. Embora a maioria das vacinas atenuadas sejam virais, algumas são de natureza bacteriana. Exemplos incluem as doenças virais febre amarela, sarampo, catapora, caxumba e rubéola e a doença bacteriana tifo. Vacinas atenuadas têm vantagens e desvantagens. Elas normalmente provocam uma resposta imunológica duradoura e são as preferíveis para vacinar adultos. Mas podem não ser seguras para indivíduos com imunidade comprometida e raramente podem sofrer mutação para a forma virulenta e causar a doença.[33]
Toxoide
[editar | editar código-fonte]São vacinas feitas de compostos tóxicos inativos que causam doenças e não o micro-organismo. Vacinas desses tipos incluem a de tétano e difteria. Conhecidas por sua eficácia, nem todos os toxoides são de micro-organismos. O veneno da cascavel, por exemplo, é utilizado em vacinas para cães contra picadas de cobras.[34]
Subunidade
[editar | editar código-fonte]Diferente da introdução de micro-organismos atenuados ou inativos para gerar uma resposta do sistema imune, um fragmento dele, como uma subunidade proteica, pode gerar uma resposta do sistema imunológico. Exemplos incluem a vacina contra hepatite B, composta de proteínas da superfície do vírus previamente extraídas do soro sanguíneo de pacientes cronicamente infectados. Hoje produz-se através de recombinação de DNA de agentes virais através de levedura, que é então purificada. Vacinas como do HPV é composta basicamente por capsídeos de proteínas do vírus e subunidades de neuraminidase e hemaglutinina de vírus da gripe.
Conjugada
[editar | editar código-fonte]Algumas bactérias têm revestimentos externos de polissacarídeos que são pouco imunogênicos. Ligando estes revestimentos exteriores a proteínas (por exemplo, toxinas), o sistema imune pode ser levado a reconhecer o polissacárido como se fosse um antígeno de proteína. Esta abordagem é utilizada na vacina "Haemophilus influenzae" tipo B. São vacinas seguras, porém possuem baixa imunogenicidade natural, para o qual é necessária a adição de adjuvantes.[34]
RNA
[editar | editar código-fonte]Uma vacina de ARN ativa o sistema imune adaptativo por meio de ARN mensageiro [36]
Este tipo de vacina tem algumas vantagens sobre vacinas de ADN do ponto de vista da fabricação, do método de administração aos pacientes, da segurança do uso [37] e foi capaz de mostrar efeitos promissores quando foram feitos ensaios clínicos em humanos.[38] As vacinas de ARN também podem ser de interesse contra certos tipos de câncer.[39] Vários laboratórios farmacêuticos como CureVac e Moderna Therapeutics desenvolvem tais vacinas, várias das quais desde o início de 2020 contra a COVID-19. A vacina Tozinameran, desenvolvida por BioNTech e Pfizer, recebeu em 2 Dezembro 2020 no Reino Unido a primeira autorização para a utilização pública geral de uma vacina de ARN por um organismo regulador nacional de medicamento.[40]
Em outubro de 2023, Katalin Karikó e Drew Weissman ganharam o Prémio Nobel de Fisiologia ou Medicina por suas descobertas que levaram ao desenvolvimento de vacinas de ARN eficazes contra Covid-19.[41]
Experimental
[editar | editar código-fonte]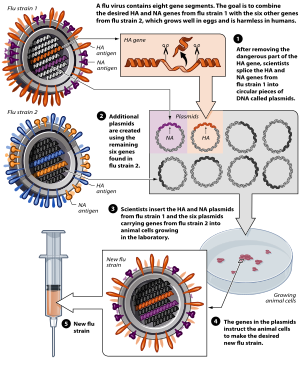
Vacinas inovadoras estão atualmente em desenvolvimento e uso experimental.
- Vacinas com células dendríticas combinam tais células com antígenos de forma a apresentar os antígenos para as células brancas (leucócitos) presentes no sangue, para estimular uma resposta imune. Estas vacinas têm se mostrado eficazes em testes para tratar tumores cerebrais[42] e em melanomas malignos.[43]
- Vetor recombinante - ao se combinar a fisiologia de um micro-organismo com o DNA de outro, imunidade pode ser criada contra doenças que possuam complexos processos infecciosos.
- Vacina de DNA - é uma técnica alternativa e altamente experimental criada a partir do DNA de um agente infeccioso sob desenvolvimento. O mecanismo proposto é a inserção e expressão de um gene (melhorado através de eletroporação, tendo como alvo o reconhecimento do sistema imune) extraído do DNA viral ou bacteriano de células humanas ou animais. Algumas células do sistema imunológico que reconhecem as proteínas expressas se organizarão para atacar as proteínas e células que as expressam. Como essas células vivem por um longo tempo, se o patógeno que normalmente expressa essas proteínas é encontrado algum tempo depois, ele será imediatamente atacar pelo sistema imunológico. Uma vantagem da vacina de DNA é que ela é fácil de produzir e de estocar. Porém, ela ainda é experimental e não foi aprovada para ser testada em humanos.
- Receptor de células T - vacinas que contenham peptídeos oriundos de receptores de célula T estão em pesquisa e desenvolvimento para várias doenças como dermatite atópica, estomatite e Febre do vale Rift. Verificou-se que estes péptidos modulam a produção de citocinas e melhoram a imunidade mediada pelas células.
Valência
[editar | editar código-fonte]Vacinas podem ser monovalentes (também chamadas de "univalentes") ou multivalentes (também chamadas de "polivalentes"). A monovalente imuniza contra um único antígeno ou micro-organismo. A vacina multivalente imuniza contra duas ou mais cepas de um mesmo micro-organismo ou até mesmo contra dois ou mais deles.[44]
A valência de uma vacina multivalente pode ser denotada a partir do prefixo em grego ou latim, como no caso das vacinas tetravalente ou quadrivalente. Em alguns casos, a vacina monovalente pode ser preferível por sua rápida resposta no sistema imunológico.[45]
Heterotípica
[editar | editar código-fonte]Também conhecida como vacina heteróloga ou "vacinas de jennerianas", são aquelas em que os patógenos são oriundos de outros animais, que não causam a doença ou causam apenas sintomas leves que podem ser tratados. Um exemplo clássico foi o uso da varíola bovina por Jenner quando testou sua hipótese sobre a imunização das ordenhadeiras.[34]
Um exemplo mais recente, é a vacina BCG, feita a partir da bactéria bovina Mycobacterium bovis que protege o corpo humano contra a tuberculose.[46]
Produção
[editar | editar código-fonte]A produção de vacinas possui vários estágios. Primeiro, o antígeno em si precisa ser produzido. Vírus são cultivados em células primárias, como em ovos de galinhas ou em linhagens contínuas de células, como aquelas em cultura.[47] Bactérias são cultivadas em um biorreator.

Igualmente, uma proteína recombinante derivada dos vírus ou bactérias pode ser gerada em culturas de leveduras, bactérias ou células. Após a geração do antígeno, ele é isolado das células utilizadas para gerá-lo. Um vírus pode ser inativado, possivelmente sem precisar de purificação. As proteínas recombinantes precisam de vários processos, envolvendo ultrafiltração e cromatografia em coluna. Finalmente, a vacina é formulada pela adição de adjuvante, estabilizantes e conservantes, conforme necessário. O adjuvante aumenta a resposta imune do antígeno, os estabilizadores aumentam a vida de armazenamento e os conservantes permitem a utilização de frascos multidose.[48]
As vacinas combinadas são mais difíceis de desenvolver e produzir, devido a potenciais incompatibilidades e interações desconhecidas entre os antígenos e outros ingredientes envolvidos.[49]
As técnicas de produção estão em constante evolução. Espera-se que as células de mamíferos cultivadas se tornem cada vez mais importantes, comparadas com as opções convencionais, como os ovos de galinha, devido à maior produtividade e baixa incidência de problemas com a contaminação. Acredita-se que a tecnologia de recombinação que produz a vacina geneticamente destoxificada cresça em popularidade para a produção de vacinas bacterianas que usam toxoides e que as vacinas de combinação reduzam as quantidades de antigénios que contêm e, deste modo, diminuem as interacções indesejáveis, utilizando padrões moleculares associados a patógenos.[49]
Em 2010, a Índia produziu cerca de 60% de todas as vacinas do mundo, num total de 900 milhões de dólares.[50]
Sociedade e cultura
[editar | editar código-fonte]Oposição
[editar | editar código-fonte]A oposição à vacinação, de uma ampla gama de críticos de vacinas, existe desde as primeiras campanhas de vacinação.[51] Embora os benefícios da prevenção de doenças infecciosas graves superem largamente os riscos de efeitos adversos raros após a imunização,[52] disputas surgiram sobre a moralidade, ética, eficácia e segurança da vacinação. Alguns críticos de vacinação dizem que as vacinas são ineficazes contra a doença[53] ou que os estudos de segurança são inadequados.[53] Alguns grupos religiosos não permitem a vacinação[54] e alguns grupos políticos se opõem à vacinação obrigatória com base na liberdade individual.[51]

Em resposta, a comunidade científica tem levantado a preocupação de que a divulgação de informações infundadas sobre os riscos médicos das vacinas aumente as taxas de infecções que ameaçam a vida, não só nas crianças cujos pais recusaram a vacinação, mas também naqueles que não podem ser vacinados devido à idade ou imunodeficiência, que poderiam contrair infecções de portadores não vacinados (ver imunidade de grupo).[55] Alguns pais acreditam que as vacinas, em particular a tríplice, causam autismo, embora não haja evidências científicas para apoiar essa ideia.[56] Em 2011 descobriu-se que Andrew Wakefield, cujo estudo de 1998[57] supunha uma ligação entre o autismo e vacinas, era financeiramente motivado a falsificar dados de pesquisa e foi posteriormente despojado de sua licença médica, e o estudo foi recolhido.[58] Em 2019, um estudo em grande escala concluiu que a vacina tríplice não aumenta o risco de autismo, mesmo em crianças suscetíveis.[59] Nos Estados Unidos, as pessoas que recusam vacinas por razões não médicas constituíram uma grande percentagem dos casos de sarampo e subsequentes casos de perda auditiva permanente e morte causada pela doença.[60]
Em novembro de 1904, em resposta a anos de saneamento inadequado, seguidos por uma mal explicada campanha de saúde pública liderada pelo renomado funcionário de saúde pública Oswaldo Cruz, cidadãos e cadetes militares no Rio de Janeiro começaram um levante conhecido como Revolta da Vacina. Os tumultos irromperam no dia em que a lei de vacinação entrou em vigor; a vacinação simbolizava o aspecto mais temido e mais tangível de um plano de saúde pública que incluía outras características, como a renovação urbana, que muitos haviam se oposto durante anos.[61]
Ver também
[editar | editar código-fonte]Referências
- ↑ Fiore AE, Bridges CB, Cox NJ (2009). «Seasonal influenza vaccines». Curr. Top. Microbiol. Immunol. Current Topics in Microbiology and Immunology. 333: 43–82. ISBN 978-3-540-92164-6. PMID 19768400. doi:10.1007/978-3-540-92165-3_3
- ↑ Chang Y, Brewer NT, Rinas AC, Schmitt K, Smith JS (Julho de 2009). «Evaluating the impact of human papillomavirus vaccines». Vaccine. 27 (32): 4355–62. PMID 19515467. doi:10.1016/j.vaccine.2009.03.008
- ↑ Liesegang TJ (Agosto de 2009). «Varicella zoster virus vaccines: effective, but concerns linger». Can. J. Ophthalmol. 44 (4): 379–84. PMID 19606157. doi:10.3129/i09-126
- ↑ *United States Centers for Disease Control and Prevention (2011). A CDC framework for preventing infectious diseases. Acessado em 11 de setembro de 2012. "Vaccines are our most effective and cost-saving tools for disease prevention, preventing untold suffering and saving tens of thousands of lives and billions of dollars in healthcare costs each year."
- American Medical Association (2000). Vaccines and infectious diseases: putting risk into perspective. Arquivado em 5 de fevereiro de 2015, no Wayback Machine. Acessado em 11 de setembro de 2012. "Vaccines are the most effective public health tool ever created."
- Public Health Agency of Canada. Vaccine-preventable diseases. Acessado em 11 de setembro de 2012. "Vaccines still provide the most effective, longest-lasting method of preventing infectious diseases in all age groups."
- United States National Institute of Allergy and Infectious Diseases (NIAID). NIAID Biodefense Research Agenda for Category B and C Priority Pathogens. Arquivado em 4 de março de 2016, no Wayback Machine. Acessado em 11 de setembro de 2012. "Vaccines are the most effective method of protecting the public against infectious diseases."
- ↑ Organização Mundial de Saúde , Global Vaccine Action Plan 2011-2020. Genebra, 2012.
- ↑ Baxby, Derrick (1999). «Edward Jenner's Inquiry; a bicentenary analysis». Vaccine. 17 (4): 301–7. PMID 9987167. doi:10.1016/s0264-410x(98)00207-2
- ↑ a b Pasteur, Louis (1881). «Address on the Germ Theory». Lancet. 118 (3024): 271–2. doi:10.1016/s0140-6736(02)35739-8
- ↑ Needham, Joseph. (2000). Science and Civilization in China: Volume 6, Biology and Biological Technology, Part 6, Medicine. Cambridge: Cambridge University Press. p.154
- ↑ Williams, Gareth (2010). Angel of Death. Basingstoke: Palgrave Macmillan. ISBN 978-0230274716
- ↑ Silverstein, Arthur M. (2009). A History of Immunology 2nd ed. [S.l.]: Academic Press. p. 293.
- ↑ a b c Stern AM, Markel H (2005). «The history of vaccines and immunization: familiar patterns, new challenges». Health Aff. 24 (3): 611–21. PMID 15886151. doi:10.1377/hlthaff.24.3.611
- ↑ Dunn PM (Janeiro de 1996). «Dr Edward Jenner (1749–1823) of Berkeley, and vaccination against smallpox» (PDF). Arch. Dis. Child. Fetal Neonatal Ed. 74 (1): F77–8. PMC 2528332
 . PMID 8653442. doi:10.1136/fn.74.1.F77. Consultado em 22 de maio de 2017. Arquivado do original (PDF) em 8 de julho de 2011
. PMID 8653442. doi:10.1136/fn.74.1.F77. Consultado em 22 de maio de 2017. Arquivado do original (PDF) em 8 de julho de 2011
- ↑ Van Sant JE (2008). «The Vaccinators: Smallpox, Medical Knowledge, and the 'Opening' of Japan». J Hist Med Allied Sci. 63 (2): 276–9. doi:10.1093/jhmas/jrn014
- ↑ Dudgeon JA (1963). «Development of smallpox vaccine in England in the eighteenth and nineteenth centuries». BMJ (5342): 1367–72. PMC 2124036
 . PMID 20789814. doi:10.1136/bmj.1.5342.1367
. PMID 20789814. doi:10.1136/bmj.1.5342.1367
- ↑ Baarda, Benjamin I.; Sikora, Aleksandra E. (2015). «Proteomics of Neisseria gonorrhoeae: the treasure hunt for countermeasures against an old disease». Frontiers in Microbiology. 6. ISSN 1664-302X. doi:10.3389/fmicb.2015.01190; Access provided by the Universidade de Pittsburgh.
- ↑ Alex Matos (ed.). «Eficácia da vacina». News Medical. Consultado em 22 de maio de 2017
- ↑ Grammatikos, Alexandros P.; Mantadakis, Elpis; Falagas, Matthew E. (junho de 2009). «Meta-analyses on Pediatric Infections and Vaccines». Infectious Disease Clinics of North America. 23 (2): 431–57. PMID 19393917. doi:10.1016/j.idc.2009.01.008
- ↑ a b Elizabeth Halloran e Claudio J. Struchiner (ed.). «Avaliação dos efeitos de vacinas» (PDF). Scielo Books. Consultado em 22 de maio de 2017
- ↑ Neighmond, Patti (7 de fevereiro de 2010). «Adapting Vaccines For Our Aging Immune Systems». Morning Edition. NPR. Consultado em 9 de janeiro de 2014

- ↑ Sullivan, Patricia (13 de abril de 2005). «Maurice R. Hilleman dies; created vaccines». Wash. Post. Consultado em 22 de maio de 2017
- ↑ Schlegel; et al. (agosto de 1999). «Comparative efficacy of three mumps vaccines during disease outbreak in eastern Switzerland: cohort study». BMJ. 319 (7206): 352. PMC 32261
 . PMID 10435956. doi:10.1136/bmj.319.7206.352. Consultado em 22 de maio de 2017
. PMID 10435956. doi:10.1136/bmj.319.7206.352. Consultado em 22 de maio de 2017
- ↑ Préziosi, M.; Halloran, M.E. (2003). «Effects of Pertussis Vaccination on Disease: Vaccine Efficacy in Reducing Clinical Severity». Oxford Journals. Clinical Infectious Diseases. 37 (6): 772–779. doi:10.1086/377270
- ↑ Orenstein WA, Papania MJ, Wharton ME (2004). «Measles elimination in the United States». J Infect Dis. 189 (Suppl 1): S1–3. PMID 15106120. doi:10.1086/377693
- ↑ a b «Measles—United States, January 1 – April 25, 2008». Morb. Mortal. Wkly. Rep. 57 (18): 494–8. Maio de 2008. PMID 18463608

- ↑ Drauzio Varella (ed.). «Erradicação da poliomielite». Dr. Drauzio. Consultado em 22 de maio de 2017
- ↑ «WHO South-East Asia Region certified polio-free». WHO. 27 de março de 2014. Consultado em 22 de maio de 2017
- ↑ «OMS anuncia erradicação da poliomielite na África». noticias.uol.com.br. Consultado em 25 de junho de 2021
- ↑ «Africa eradicates wild poliovirus» (em inglês). World Health Organization. 25 de agosto de 2020. Consultado em 29 de junho de 2021
- ↑ Portal Imuniza (ed.). «Tipos de vacinas». Portal Imuniza. Consultado em 22 de maio de 2017
- ↑ «Vaccine Types». National Institute of Allergy and Infectious Diseases. 3 de março de 2012. Consultado em 22 de maio de 2017
- ↑ «Types of Vaccines». Consultado em 19 de outubro de 2017. Arquivado do original em 29 de julho de 2017
- ↑ «Different Types of Vaccines | History of Vaccines». www.historyofvaccines.org. Consultado em 14 de junho de 2019. Arquivado do original em 26 de janeiro de 2019
- ↑ J.K. Sinha; S. Bhattacharya. A Text Book of Immunology (Google Book Preview). [S.l.]: Academic Publishers. p. 318. ISBN 978-81-89781-09-5. Consultado em 22 de maio de 2017
- ↑ a b c Departamento de Imunologia - ICB-USP (ed.). «Tipos de Vacinas» (PDF). Departamento de Imunologia - ICB-USP. Consultado em 22 de maio de 2017
- ↑ «mRNA-Impfstoffe». naturwissenschaften.ch (em alemão). Akademie der Naturwissenschaften. Consultado em 11 de outubro de 2024
- ↑ Rein Verbeke, Ine Lentacker, Stefaan C. De Smedt, Heleen Dewitte (outubro de 2019). «Three decades of messenger RNA vaccine development». sciencedirect.com (em inglês). Consultado em 11 de outubro de 2024
- ↑ Annette B. Vogel, Laura Lambert, Ekaterina Kinnear, David Busse, Stephanie Erbar, Kerstin C. Reuter, Lena Wicke, Mario Perkovic, Tim Beissert, Heinrich Haas, Stephen T. Reece, Ugur Sahin e John S. Tregonar. «Self-Amplifying RNA Vaccines Give Equivalent Protection against Influenza to mRNA Vaccines but at Much Lower Doses». www.cell.com (em inglês). Molecular Therapy. Consultado em 11 de outubro de 2024
- ↑ Nicole Armbruster, Edith Jasny, Benjamin Petsch. «Advances in RNA Vaccines for Preventive Indications: A Case Study of a Vaccine against Rabies». www.mdpi.com (em inglês). Vaccines. Consultado em 11 de outubro de 2024
- ↑ Megan A. McNamara, Smita K. Nair, Eda K. Holl (19 de novembro de 2015). «RNA-Based Vaccines in Cancer Immunotherapy». onlinelibrary.wiley.com. Journal of Immunology Research. Consultado em 11 de outubro de 2024
- ↑ «ARCHIVE: Conditions of Authorisation for COVID-19 Vaccine Pfizer/BioNTech (Regulation 174)». www.gov.uk (em inglês). Medicines and Healthcare products Regulatory Agency. Consultado em 11 de outubro de 2024
- ↑ «Nobel da Medicina de 2023 para cientistas que desenvolveram vacinas de ARNm contra covid-19». https://www.publico.pt/. publico.pt. Consultado em 2 de outubro de 2023
- ↑ Kim W, Liau LM (2010). «Dendritic cell vaccines for brain tumors». Neurosurg Clin N Am. 21 (1): 139–57. PMC 2810429
 . PMID 19944973. doi:10.1016/j.nec.2009.09.005
. PMID 19944973. doi:10.1016/j.nec.2009.09.005
- ↑ Anguille, S; Smits, EL; Lion, E; van Tendeloo, VF; Berneman, ZN (junho de 2014). «Clinical use of dendritic cells for cancer therapy.». The Lancet. Oncology. 15 (7): e257-67. PMID 24872109. doi:10.1016/s1470-2045(13)70585-0
- ↑ types-of-vaccine (ed.). «Types of vaccine». Organização Mundial da Saúde. Consultado em 22 de maio de 2017
- ↑ «Questions And Answers On Monovalent Oral Polio Vaccine Type 1 (mOPV1)'Issued Jointly By WHO and UNICEF'». Pediatric Oncall. 2 (8). 3. What advantages does mOPV1 have over trivalent oral polio vaccine (tOPV)?. 8 de janeiro de 2005. Cópia arquivada em 29 de fevereiro de 2012
- ↑ Scott (abril de 2004). «Classifying Vaccines» (PDF). BioProcesses International: 14–23. Consultado em 22 de maio de 2017
- ↑ «Three ways to make a vaccine» (infographic). Consultado em 5 de agosto de 2015 , in Stein, Rob (24 de novembro de 2009). «Vaccine system remains antiquated». The Washington Post. Consultado em 22 de maio de 2017
- ↑ Muzumdar JM, Cline RR (2009). «Vaccine supply, demand, and policy: a primer». J Am Pharm Assoc. 49 (4): e87–99. PMID 19589753. doi:10.1331/JAPhA.2009.09007
- ↑ a b Bae K, Choi J, Jang Y, Ahn S, Hur B (2009). «Innovative vaccine production technologies: the evolution and value of vaccine production technologies». Arch Pharm Res. 32 (4): 465–80. PMID 19407962. doi:10.1007/s12272-009-1400-1
- ↑ Staff (15 de novembro de 2011). «India produces 60 percent of world`s vaccines». Indonesia. Antara. Consultado em 22 de maio de 2017
- ↑ a b Wolfe R, Sharp L (2002). «Anti-vaccinationists past and present». BMJ. 325 (7361): 430–2. PMC 1123944
 . PMID 12193361. doi:10.1136/bmj.325.7361.430
. PMID 12193361. doi:10.1136/bmj.325.7361.430
- ↑ Bonhoeffer J, Heininger U (2007). «Adverse events following immunization: perception and evidence». Curr Opin Infect Dis. 20 (3): 237–46. PMID 17471032. doi:10.1097/QCO.0b013e32811ebfb0
- ↑ a b Halvorsen R (2007). The Truth about Vaccines. [S.l.]: Gibson Square. ISBN 978-1-903933-92-3
- ↑ Sinal SH, Cabinum-Foeller E, Socolar R (2008). «Religion and medical neglect». South Med J. 101 (7): 703–6. PMID 18580731. doi:10.1097/SMJ.0b013e31817997c9
- ↑ Omer, SB; Salmon, DA; Orenstein, WA; deHart, MP; Halsey, N (maio de 2009). «Vaccine Refusal, Mandatory Immunization, and the Risks of Vaccine-Preventable Diseases» (PDF). New England Journal of Medicine. 360 (19): 1981–8. PMID 19420367. doi:10.1056/NEJMsa0806477
- ↑ Gross L. A broken trust: lessons from the vaccine–autism wars. PLoS Biol. 2009;7(5):e1000114. doi:10.1371/journal.pbio.1000114. PMID 19478850. PMC 2682483.
- ↑ Wakefield, Andrew (28 de fevereiro de 2018). «RETRACTED: Ileal-lymphoid-nodular hyperplasia, non-specific colitis, and pervasive developmental disorder in children». Lancet. Consultado em 9 de março de 2019
- ↑ the CNN Wire Staff (6 de janeiro de 2011). «Retracted autism study an 'elaborate fraud,' British journal finds». CNN.com. Consultado em 26 de abril de 2013
- ↑ Hviid, Anders (5 de março de 2019). «Measles, Mumps, Rubella Vaccination and Autism: A Nationwide Cohort Study». Annals of Internal Medicine. Consultado em 9 de março de 2019
- ↑ Phadke, Varun K.; Bednarczyk, Robert A.; Salmon, Daniel A.; Omer, Saad B. (15 de março de 2016). «Association Between Vaccine Refusal and Vaccine-Preventable Diseases in the United States». JAMA. 315 (11): 1149–58. PMC 5007135
 . PMID 26978210. doi:10.1001/jama.2016.1353
. PMID 26978210. doi:10.1001/jama.2016.1353
- ↑ Meade T (1989). «'Living worse and costing more': resistance and riot in Rio de Janeiro, 1890–1917». J Lat Am Stud. 21 (2): 241–66. doi:10.1017/S0022216X00014784
Ligações externas
[editar | editar código-fonte]- Portal de vacinação e imunização da Organização Mundial da Saúde
- Artigos sobre vacinas da Organização Mundial da Saúde
- «Sivac». Sistema Web de Vacinação. Monitoramento efetivo da cobertura vacinal (Brasil).
- «PenseSUS». Site brasileiro sobre vacinas no SUS.
- «SUS». Normas do Sistema Único de Saúde do Brasil.
- «Vacinas.com.pt». Site português sobre vacinas

