Reação aldólica
A reação aldólica é uma reação importante da formação de ligação carbono-carbono em química orgânica.[1][2][3] Foi descoberta de forma independente pelo químico russo Alexander Borodin em 1869[4] e pelo químico francês Charles-Adolphe Wurtz em 1872.[5][6][7]
A reação consiste no ataque nucleofílico envolvendo dois compostos contendo carbonilo, um enolato de um aldeído ou cetona sobre o carbonilo de outra molécula de aldeído ou cetona para formar um novo composto β-hidroxialdeído (um composto β-hidróxi carbonilo), ou, como estes compostos são conhecidos, "aldol" (de aldeído + álcool), ou uma β-hidroxicetona (os experimentos originais usavam aldeídos).[8][9][10][11] Por exemplo, a reação aldólica tem sido usada na produção em larga escala da commodity química pentaeritritol[12] Se o produto da adição aldólica perde uma molécula de água (desidrata) o produto final é um aldeído ou cetona α,β-insaturada. Isto se conhece como condensação aldólica.

O aldol (a) é o produto de uma reação aldólica quando se leva a cabo a baixa temperatura. Se a temperatura é elevada se obtem o aldeído α,β-insaturado (b) resultado da eliminação de uma molécula de água.
Um aldol é um elemento estrutural molecular visto em muitos produtos, sendo que tais unidades estruturais são encontradas em muitas moléculas importantes, sejam elas naturais ou sintéticas, como na síntese do medicamento contra a doença cardíaca Lipitor (atorvastatina, sal de cálcio).[13][14]
A reação aldólica une duas moléculas relativamente simples em uma mais complexa. A complexidade crescente surge devido a dois novos centros estereogênicos serem formados(no carbono α e β do aduto aldol, marcado com asteriscos no esquema abaixo). A metodologia moderna é capaz não só permitir que as reações de aldol prossigam em alto rendimento mas também controlando tanto a configuração absoluta como a relativa destes estereocentros.[15] Esta habilidade em sintetizar seletivamente um estereoisômero particular é importante porque diferentes estereoisômeros podem ter propriedades químicas e biológicas muito diferentes.
Por exemplo, unidades estereogênicas aldol são especialmente comuns em policetídeos, uma classe de moléculas encontradas em organismos biológicos. Na natureza, policetídeos são sintetizadas por enzimas através do efeito iterativo da condensações de Claisen. Os produtos 1,3-dicarbonilo destas reações podem então ser derivados de diversas formas para produzir uma ampla variedade de estruturas interessantes. Frequentemente, tal derivação envolve a redução de um dos grupos carbonilo, produzindo a subunidade aldol. Algumas dessas estruturas possuem potenciais propriedades biológicas: o imunossupressor FK506 (Tacrolimo), o agente antitumor discodermolida, ou o agente antifúngico anfotericina B, por exemplo. Embora a síntese de muitos desses compostos tenha sido considerada quase impossível, a metodologia aldol permitiu sua síntese eficiente em muitos casos.[16]

Um reação de adição aldólica moderna típica, mostrada acima, pode envolver a adição nucleofílica de um enolato de cetona a um aldeído. Uma vez formado, o produto aldol pode algumas vezes perder uma molécula de água formando um composto carbonilo α,β-insaturado. Isto é chamado condensação aldólica. Uma variedade de nucleófilos podem ser empregados na reação aldólica, incluindo os enóis, enolatos, e éteres de enol com cetonas e/ou aldeídos, e muitos outros compostos carbonilo. O parceiro eletrofílico é usualmente um aldeído ou cetona (muitas variações, tal como a reação de Mannich, existem). Quando o nucleófilo e eletrófilo são diferentes, a reação é chamada uma reação aldólica cruzada; no inverso, quando o nucleófilo e eletrófilo são os mesmos, a reação é chamada uma dimerização aldólica.

O frasco à direita é uma solução de di-isopropilamida de lítio (LDA, do inglês lithium diisopropylamide) em tetraidrofurano (THF). O frasco à esquerda é uma solução do enolato de lítio de propionato de tert-butila (formado por adição de LDA a propionato de tert-butila). Um aldeído pode ser adicionado ao frasco de enolato para iniciar uma reação de adição aldólica.
Ambos os frascos estão submersos em um banho refrigerante gelo seco/acetona (−78 °C), com a temperatura sendo monitorada por um termopar (o fio à esquerda).
Mecanismos[editar | editar código-fonte]
A reação aldólica pode prosseguir através de dois mecanismos fundamentalmente diferentes. Os compostos de carbonilo, como aldeídos e cetonas, podem ser convertidos em enóis ou éteres de enol. Essas espécies, sendo nucleofílicas no carbono α, podem atacar especialmente carbonilos protonados reativos tais como aldeídos protonados. Esse é o 'mecanismo enol'. Compostos carbonilos, sendo carbonos ácidos, podem também ser deprotonados formando enolatos, os quais são muito nucleofílicos que enóis ou éteres de enol e podem atacar eletrófilos diretamente. O eletrófilo usual é um aldeído, dado que cetonas são muito menos reativas. Esse é o 'mecanismo enolato'.
Se as condições são particularmente rigorosas (e.g.: NaOMe/MeOH/refluxo), pode ocorrer condensação, mas isso geralmente pode ser evitado com reagentes suaves e baixas temperaturas (e.g., LDA (uma base forte), THF, −78 °C). Embora a adição aldólica geralmente continue até a conclusão em condições irreversíveis, os adutos de aldol isolados são sensíveis à clivagem retro-aldólica induzida por base para retornar materiais iniciais. Em contraste, as condensações retro-aldólicas são raras, mas possíveis.[17]

Mecanismo enol[editar | editar código-fonte]
Quando um catalisador ácido é usado, a etapa inicial no mecanismo de reação envolve tautomerizaçãoi catalisada por ácido do composto de carbonilo para o enol. O ácido também serve para ativar o grupo carbonilo de "outra molécula" por protonação, tornando-o altamente eletrofílico. O enol é nucleofílico no carbono α, permitindo que ele ataque o composto carbonilo protonado, conduzindo ao aldol após a deprotonação. Isto usualmente o desidrata, levando ao composto carbonilo insaturado. O esquema mostra uma típica auto-condensação catalisada por ácido de um aldeído.
Mecanismo de aldol catalisado por ácido

Desidratação catalisada por ácido

Mecanismo enolato[editar | editar código-fonte]
Se o catalisador é uma base moderada tal como íon hidróxido ou um alcóxido, a reação aldólica ocorre via ataque nucleofílico pelo enolato estabilizado por ressonância no grupo carbonilo de outra molécula. O produto é o sal alcóxido do produto aldol. O próprio aldol é então formado, e então pode ser submetido a desidratação para dar o composto carbonílico insaturado. O esquema mostra um mecanismo simples para a reação de aldol catalisada por base de um aldeído consigo mesmo.
Reação aldólica catalisada por base (mostrada usando −OCH3 como base)

Desidratação catalisada por base (descrita frequentemente incorretamente como um único passo, ver reação de eliminação E1cB)

Embora apenas uma quantidade catalítica de base seja necessária em alguns casos, o procedimento mais usual é usar uma quantidade estequiométrica de uma base forte tal como LDA ou NaHMDS. Neste caso, a formação de enolato é irreversível, d o produto aldol não é formado até o alcóxido metálico do produto aldol ser protonado em uma etapa de trabalho separada.
Modelo Zimmerman–Traxler[editar | editar código-fonte]
Formas mais refinadas do mecanismo são conhecidas. Em 1957, Zimmerman e Traxler propuseram que algumas reação aldólicas tem "estados de transição de seis membros tendo uma conformação “em cadeira”."[18] Isto é agora conhecido como o modelo Zimmerman–Traxler. Enolatos E resultam em anti-produtos, enquanto queenolatos Z resultam em produtos sin. Os fatores que controlam a seletividade são a preferência pela colocação de substituintes equatorialmente em estados de transição de seis membros e evitar interações sin-pentano, respectivamente.[19] E e Z referem-se à relação estereoquímica cis-trans entre o oxigênio do enolato tendo o contraón positivo e o grupo de maior prioridade no carbono alfa. Na realidade, apenas alguns metais como o lítio e o boro seguem de forma confiável o modelo Zimmerman–Traxler. Assim, em alguns casos, o resultado estereoquímico da reação pode ser imprevisível.

Controle de reagente aldol cruzado[editar | editar código-fonte]
O problema de "controle" na adição aldólica é melhor demonstrado por um exemplo. Considere-se o resultado desta reação hipotética:

Nesta reação, duas cetonas assimétricas estão sendo condensadas usando-se etóxido de sódio. A basicidade do etóxido de sódio é tal que não pode desprotonar completamente nenhuma das cetonas, mas pode produzir pequenas quantidades de enolato de sódio de ambas as cetonas. Isso significa que, além de serem potenciais aldóis eletrofílicos, ambas as cetonas também podem atuar como nucleófilos através do seu enolato de sódio. Dois eletrófilos e dois nucleófilos, então, tem potencial para resultar em quatro possíveis produtos:

Assim, se alguém deseja obter apenas um dos produtos cruzados, deve controlar qual carbonilo se torna o enol/enolato nucleofílico e que permanece na sua forma de carbonilo eletrofílico.
Acidez[editar | editar código-fonte]
O controle mais simples é se apenas um dos reagentes tenha prótons ácidos, e somente essa molécula forma o enolato. Por exemplo, a adição de malonato de dietila a benzaldeído produziria apenas um produto. Apenas o malonato tem hidrogênios α, por isso é o parceiro nucleofílico, enquanto o benzaldeído não-enolizável só pode ser o eletrofilo:

O malonato é particularmente fácil de desprotonar porque a posição α é flanqueado por mais de um carbonilo. A ativação dupla torna o enolato mais estável, portanto, não é tão forte a base para formá-lo. Uma extensão deste efeito pode permitir o controle sobre qual dos dois reagentes de carbonilo tornam-se o enolate, mesmo que ambos tenham hidrogênio α. Se um parceiro é consideravelmente mais ácido do que o outro, o próton mais ácido é abstraído pela base e um enolato é formado no carbonilo, enquanto o carbonilo que é menos ácido não é afetado pela base. Este tipo de controle funciona somente se a diferença de acidez for grande o suficiente e nenhum excesso de base for usado para a reação. Um substrato típico para esta situação é quando a posição deprotonável é ativada por mais de um grupo semelhante a um grupo carbonilo. Exemplos comuns incluem um grupo CH2 flanqueado por dois carbonilos ou nitrilas (ver para exemplo a condensação de Knoevenagel e os primeiras etapas da síntese de éster malônico).
Ordem de adição[editar | editar código-fonte]
Uma solução comum é formar o enolato de um parceiro primeiro e, em seguida, adicionar o outro parceiro sob controle cinético.[20] Controle cinético significa que a reação de adição de aldol para a frente deve ser significativamente mais rápida do que a reação reversa retro-aldol. Para que esta abordagem seja bem sucedida, outras duas condições também devem ser satisfeitas; deve ser possível formar quantitativamente o enolato de um parceiro, e a reação de aldol avante deve ser significativamente mais rápida do que a transferência do enolato de um parceiro para outro. As condições de controle cinético comuns envolvem a formação do enolato de uma cetona com LDA a −78 °C, seguido pela adição lenta de um aldeído.
Enolatos[editar | editar código-fonte]
Formação[editar | editar código-fonte]
O enolato pode ser formado pelo uso de uma base forte ("condições rigorosas") ou pelo uso de um ácido de Lewis e uma base fraca ("condições suaves"):
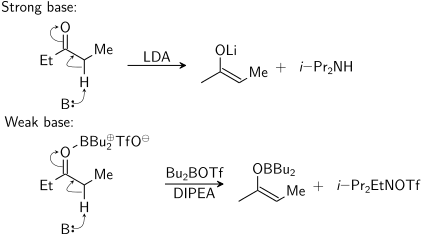
Neste diagrama, B: representa a base que toma o próton. O triflato de dibutilboro realmente se liga ao oxigênio apenas durante a reação. O segundo produto à direita (formado da N,N-di-isopropiletilamina) seria i-Pr2EtNH+ OTf −.
Para deprotonação ocorrer, o requisito estereoelectrônico é que a ligação sigma alfa-C-H deve ser hábil em sobrepor-se com o orbital pi* orbital do carbonilo:

Geometria[editar | editar código-fonte]
Estudos extensivos foram realizados na formação de enolatos sob muitas condições diferentes. Agora é possível gerar, na maioria dos casos, a geometria de enolato desejada:[21]

Para cetonas, a maioria das condições de enolização resulta em enolatos Z. Para ésteres, a maioria das condições de enolização resulta em enolatos E. A adição de HMPA é conhecida como capaz de reverter a estereosseletividade da deprotonação.

A formação estereosseletiva de enolatos tem sido racionalizada com o modelo de Ireland,[22][23][24][25] embora sua validade seja um pouco questionável. Na maioria dos casos, não se sabe quais, se houverem, intermediários são monoméricos ou oligoméricos na natureza; no entanto, o modelo de Ireland continua a ser uma ferramenta útil para a compreensão de enolatos.

No modelo de Irelandl, a deprotonação é considerada como se processando por um composto de seis membros ou cíclico[26] estado de transição monomérico. O maior dos dois substituintes no eletrófilo (no caso acima, o metilo é maior que o próton) adota uma disposição equatorial no estado de transição favorecido, levando a uma preferência por enolatos E. O modelo claramente falha em muitos casos; por exemplo, se a mistura de solventes for alterada de THF a 23% HMPA-THF (como visto acima), a geometria do enolato é revertida, o que é inconsistente com este modelo e seu estado de transição cíclica.
Regioquímica[editar | editar código-fonte]
Se uma cetona não simétrica é submetida à base, tem potencial para formar dois enolatos regioisoméricos (ignorando a geometria do enolato). Por exemplo:

O enolato trissubstituído é considerado o enolato cinético, enquanto o enolato tetrasubstituído é considerado o enolato termodinâmico. O hidrogênio alfa deprotonado formando o enolato cinético é menos impedido e, portanto, deprotonado mais rapidamente. Em geral, olefinas tetrasubstituídas são mais estáveis que olefinas trisubstituídas devido a estabilização hiperconjugativa. A razão de enolatos regioisômeros é pesadamente influenciada pela escolha da base. Para o exemplo acima, controle cinético pode ser estabilizado com LDA a −78 °C, resultando em 99:1 de seletividade de cinético: enolato termodinâmico, enquanto o controle termodinâmico pode ser estabilizado com trifenilmetil-lítio a temperatura ambiente, resultando em 10:90 de seletividade.
Em geral, enolatos cinéticos são favorecidos por temperaturas frias, condições que proporcionam ligações ferro-oxigênio relativamente iônicas e deprotonação rápida usando um ligeiro excesso de uma base forte, estericamente impedida. A base grande apenas desprotona o hidrogênio mais acessível e as baixas temperaturas e o excesso de base ajudam a evitar o equilíbrio no enolato alternativo mais estável após a formação inicial de enolato. Enolatos termodinâmicos são favorecidos por tempos de equilíbrio mais longos e temperaturas mais altas, condições que proporcionam ligação metal-oxigênio relativamente covalente, de uso de uma leve quantidade sub-estequiométrica de base forte. Pelo uso de base insuficiente para deprotonar todas as moléculas de carbonilo, os enolatos e carbonilos pode trocar prótons um com o outro e equilibram a seu isômero mais estável. O uso de vários metais e solventes permite controle sobre a quantidade de caráter iônico na ligação metal-oxigênio.
Estereosseletividade[editar | editar código-fonte]
A reação aldólica é particularmente útil porque dois novos centros estereogênicos são gerados em uma reação. Pesquisas extensas foram realizadas para entender o mecanismo de reação e melhorar a seletividade observada em muitas condições diferentes. A convenção sin/anti é é comumente usado para denotar a estereoquímica relativa no carbono α e β.

A convenção é aplicada quando nucleófilos propionato (ou de ordem mais alta) são adicionados a aldeídos. O grupo R da cetona e o grupo R' do aldeído são alinhados em um padrão "zig zag" no plano do papel (ou tela), e a disposição dos estereocentros sin ou anti formados, dependendo se estão dos mesmos ou opostos lados da cadeia principal.
Artigos mais antigos usam a nomenclatura eritro/treo, familiar à química de carboidratos.
Geometria de enolato[editar | editar código-fonte]
Não há diferença significativa entre o nível de estereoindução observada com enolatos E e Z. Cada geometria de alqueno conduz primariamente a uma estereoquímica relativa específica no produto, E resultando em anti e Z resultando em sin:[21]


Íon metálico[editar | editar código-fonte]
O cátion metálico enolato pode desempenhar um papel importante na determinação do nível de estereosseletividade na reação aldólica. Boro é frequentemente usado[27][28][29] porque seus comprimentos de ligação são significativamente mais curtos do que os outros metais, como lítio, alumínio ou magnésio.

Por exemplo, ligações boro–carbono e boro–oxigênio são 1.4–1.5 Å e 1.5–1.6 Å em comprimento, respectivamente, enquanto ligações metal-carbono e metal-oxigênio típicas apresentam 1.9–2.2 Å e 2.0–2.2 Å em comprimento, respectivamente. O uso de boro em vez de um metal "estreita" o estado de transição e resulta maior estereosseletividade na reação.[30] Assim, a reação acima resulta numa razão sin:anti de 80:20 usando-se um enolato de lítio comparado a 97:3 usando-se um enolato de bibutilboro.
Estereocentro alfa no enolato[editar | editar código-fonte]
A reação aldólica pode exibir "estereocontrole baseado em substrato", na qual existe quiralidade em qualquer reagente que influencie a estereoquímica resultado da reação. Isso tem sido amplamente estudado e, em muitos casos, pode-se prever o sentido de indução assimétrica, se não o nível absoluto de diastereosseletividade. Se o enolato contém um estereocentro na posição alfa, estereocontrole excelente pode ser realizado.

No caso de um enolato E, o elemento de controle dominante é tensão alílica 1,3 enquanto que no caso de um enolato Z, o elemento de controle dominante é o evitar de interações 1,3-diaxial O modelo geral é apresentado abaixo:

Para clareza, o estereocentro no enolato teria sido epimerizado; na realidade, a diastereoface oposta do aldeído teria sido atacada. Em ambos os casos teria sido atacado..Em ambos os casos, o diastereômero 1,3-sin é favorecido. Existem muitos exemplos deste tipo de estereocontrole:[31]

O uso de protetor cíclico de acetonídeo e relação trans entre os centros quirais em reações aldólicas com o enolato de boro da metilcetona, conduzem à obtenção de adutos de aldol com variados níveis de seletividade em favor do isômero 1,5-anti. Quando envolvendo enolatos de boro da metilcetona, com protetor cíclico de acetonídeo e relação cis entre os centros quirais, levam à formação de adutos de aldol com níveis de seletividade excelentes em favor do isômero 1,5-anti. Com enolato de boro da metilcetona, com protetor cíclico de silício e relação trans entre os centros quirais, levam à formação de adutos de aldol com níveis de seletividade em favor do isômero 1,5-anti. Quando o protetor é um composto cíclico de silício e relação cis entre os centros quirais, e pivalaldeído (2,2-dimetilpropanal, (CH3)3C-CHO) leva à formação de adutos de aldol em bom nível de seletividade em favor isômero 1,5-anti.[32]
Estereocentro alfa no eletrófilo[editar | editar código-fonte]
Quando enolatos atacam aldeídos com um estereocentro alfa, excelente estereocontrole é também possível. A observação geral é que enolatos E exibem seleção de diastereoface Felkin, enquanto enolatos Z exibem seletividade anti-Felkin. O modelo geral[33][34] é apresentado abaixo:

Dado que enolatos Z deve reagir através de um estado de transição que contenha uma interação pentano sin desestabilizante ou um rotâmero anti-Felkin, enolatos Z exibem níveis mais baixos de diastereosseletividade neste caso. Alguns exemplos são apresentados abaixo:[35][36]
Modelo unificado de estereoindução[editar | editar código-fonte]
Se tanto o enolato como o aldeído contém quiralidade preexistente, então o resultado de uma "estereodiferenciação dupla" da eação aldólica pode ser previsto usando um modelo estereoquímico mesclado que leva em consideração o viés facial do enolato, geometria de enolato, e viés facial do aldeído.[37] Vários exemplos da aplicação deste modelo são apresentados abaixo:[36]


Química de oxazolidinona de Evans[editar | editar código-fonte]
As sínteses orgânicas modernas agora requerem a síntese de compostos em forma enantiopura. Dado que a reação aldólica cria dois novos estereocentros, podem resultar até quatro estereoisômeros.

Muitos métodos que controlam a estereoquímica relativa (i.e., sin ou anti, como discutido acima) e estereoquímica absoluta (i.e., R ou S) tem sido desenvolvida.

Um método amplamente utilizado é o método oxazolidinona acilal de Evans.[38][39] Desenvolvido no final dos anos 1970 e 1980 por David A. Evans e colaboradores, o método opera por temporariamente criar um enolato quiral por anexar um auxiliar quiral. A quiralidade preexistente do auxiliar é então transferido para o aduto aldol realizando uma reação aldólica diastereoseletiva. Após a remoção subsequente do auxiliar, o estereoisômero aldol desejado é revelado.

No caso do método de Evans, o auxiliar quiral anexado é uma oxazolidinona, e o composto carbonilo resultante é uma imida. Uma variedade de oxazolidinonas agora estão disponíveis em ambas as formas enantioméricas. Estas podem custar aproximadamente US$ 10–20 por grama, tornando-as relativamente caras. No entanto, oxazolidinonas enantiopuras são derivadas em duas etapas sintéticas de aminoácidos comparativamente baratos, o que significa que as sínteses em larga escala podem ser mais econômicas por meio da preparação interna às fábricas. Isso geralmente envolve redução mediada por boroidreto da fração ácida da molécula, seguida por condensação/ciclização do amino-álcool resultante com um éster carbonato simples tal como dietilcarbonato.

A acilação de uma oxazolidinona é um procedimento conveniente, e é informalmente referido na terminologia da indústria em língua inglesa como "loading done" (“carregamento feito”). Enolatos Z, conduzindo a adutos aldol sin, podem ser formados de forma confiável usando enolização suave mediada por boro:[40]

Frequentemente, um diastereômero único pode ser obtido por uma cristalização do aduto aldol. No entanto, adutos anti-aldol não pode ser obtido confiavelmente com o método de Evans. Apesar do custo e da limitação resultandor apenas em adutos sin, a confiabilidade, a facilidade de uso e a versatilidade do método o tornam o método de escolha em muitas situação. Muitos métodos estão disponíveis para a clivagem do auxiliar:[41]

Após a construção da imida, tanto reações de adição aldólica sin- e anti-seletivas podem ser realizadas, permitindo a montagem de três das quatro possíveis estereoconformações: sin-seletivas:[42] e seletiva anti:[43]

Nas reações seletivas sin, ambos os métodos de enolização resultam no enolato Z, como esperado; no entanto, o resultado estereoquímico da reação é controlado pelo metil estereocentro, em vez de quiralidade da oxazolidinona.[44][45] Os métodos descritos permitem a montagem estereosseletiva de policetídeos, uma classe de produtos naturais que muitas vezes apresentam a estrutura básica de aldol.
Reação intramolecular[editar | editar código-fonte]

Reação aldólica intramolecular ´a reação de condensação de doi grupos aldeído ou cetona em uma mesma molécula. Cetona ou aldeído de cinco ou seis membros α β insaturado é formado como produto. Esta reação é uma importante abordagem para a formação de ligação carbono-carbono em moléculas orgânicas contendo sistemas em anel. Por exemplo, sob condições básicas fortes (e.g. hidróxido de sódio), hexano-2,5-diona (composto A na Figura 1) pode ciclizar via reação aldólica intramolecular para formar a 3-metilciclopent-2-en-1-ona (composto B).
O mecanismo da reação aldólica intramolecular envolve a formação de um intermediário enolato chave e um processo de adição nucleofílica intramolecular. Primeiro, o hidróxido remove o hidrogênio α no carbono 6 para formar o enolato. A seguir, ataque nucleofílico ao carbono 2 da cetona pelo enolato forma a ligação carbono-carbono entre carbonos 2 e 6. Finalmente, geralmente sob condições de aquecimento, a eliminação de moléculas de água forma a cetona α,β-insaturada.

Reação aldólica intramolecular tem sido amplamente utilizada na síntese total de vários produtos naturais, especialmente alcaloides e esteroides. Um exemplo é a aplicação de reação aldólica intramolecular na etapa de fechamento de anel para a síntese total de (+)-wortmanina por Shigehisa, et al.[46] (Figura 2).
Variações e métodos modernos[editar | editar código-fonte]
Metodologias mais recentes, a partir do final dos anos 1990, permitem uma variedade muito maior de reações aldólicas serem conduzidas, frequentemente vezes com uma quantidade catalítica de ligando quiral. Quando reações empregam pequenas quantidades de ligandos enantiomericamente puros induzindo a formação de produtos enantiomericamente puros, as reações são tipicamente denominadas "catalíticas, assimétricas"; por exemplo, muitas reações aldólicas assimétricas catalíticas diferentes estão agora disponíveis.[47][48][49][50][51][52]
Reações aldólicas de acetato[editar | editar código-fonte]
Uma limitação chave para a abordagem com auxiliar quiral descrita anteriormente é o fracasso de N-acetil imidas em reagir seletivamente. Uma abordagem primordial foi usar um grupo tioéter temporário:[41][nota 1]

Reação aldólica de Mukaiyama[editar | editar código-fonte]
A reação aldólica de Mukaiyama[53] é a adição nucleofílica de éteres silícicos de enóis a aldeídos catalisada por um ácido de Lewis tal como trifluoreto de boro (as eterato de trifluoreto de boro) ou tetracloreto de titânio.[54][55] A reação aldólica de Mukaiyama não segue o modelo Zimmerman-Traxler. Carreira tem descrito metodologia assimétrica particularmente útil com acetal de silil ceteno notável por seus altos níveis de enantiosseletividade e amplo escopo de substratos.[56]
O método funciona baseado em aldeídos alifáticos não ramificados, os quais são frequentemente eletrófilos pobres para processos assimétricos catalíticos. Isso pode ser devido a diferenciação eletrônico e estérico pobre entre suas enantiofaces.

O análogo vilílico do processo aldólico de Mukaiyama pode também ser tornado catalítico e assimétrico. O exemplo mostrado abaixo funciona eficientemente para aldeídos aromáticos (mas não alifáticos) e o mecanismo acredita-se envolver um dienolato ligado a metal quiral,.[57][58]

Tiazolidinetiona aldólica de Crimmins[editar | editar código-fonte]
Uma versão do auxiliar de Evans, apresentada em 1997 é a tiazolidinetiona de Crimmins.[59][60] Os rendimentos, diastereosseletividades, e enantiosseletividades da reação são, em geral, altos, embora não tão altos como em casos de Evans comparáveis. Ao contrário do auxiliar de Evans, a tiazoldinetiona pode realizar reações aldólicas de acetato e pode produzir os adutos "Evans sin" ou "não-Evans sin" simplesmente pela variação da quantidade de (−)-esparteína.[61] Acredita-se que a reação proceda via estados de transição ligados a titânio de seis membros, análogos aos propostos estados de transição para o auxiliar de Evans.Note-se que a estrutura da esparteína mostrada abaixo apresenta a falta de um átomo de nitrogênio (N).

Derivados de tiazolidinas quirais, partindo da L-cisteína, em reação do grupo ácido com várias aminas, formando amidas, permitem a introdução de diversas funcionalizações, como tioureias e sulfonamidas, assim como grupos de diferentes volumes que permitem controlar o efeito estéreo de diferentes catalisadores. Obtem-se conversões de 50% até 89% com diversos organocatalisadores em reações aldólicas intramoleculares entre a acetona e o p-nitrobenzaldeído.[62]
Organocatálise[editar | editar código-fonte]
Um desenvolvimento datado de 2006 é o uso de catalisadores amina secundárias quirais. Essas aminas secundárias formam enaminas transientes quando expostas à cetonas, as quais podem reagir enantiosseletivamente[63] com eletrófilos aldeídos adequados. A amina reage com o carbonilo para formar uma enamina, a enamina atua como um nucleófilo do tipo enol, e então a amina é liberada de todo o produto — a própria amina é um catalisador. Este método de enamina como catalisador é um tipo de organocatálise, dado que o catalisador é inteiramente baseado sobre uma pequena molécula orgânica. Num exemplo seminal, prolina catalisou eficientemente a ciclização de uma tricetona:

A reação é conhecida como a reação de Hajos-Parrish[64][65] (também conhecida como a reação de Hajos-Parrish-Eder-Sauer-Wiechert, referindo-se a um relatório contemporâneo de Schering da reação em condições mais severas).[66] Sob as condições Hajos-Parrish somente uma quantidade catalítica de prolina é necessária (3 mol%). Não há perigo de uma reação de fundo aquiral porque os intermediários enaminas transientes são muito mais nucleofílicos que seus enóis cetonas paternos. Esta estratégia oferece uma maneira simples de gerar enantiosseletividade em reações sem o uso de metais de transição, os quais tem as possíveis desvantagens de serem tóxicos ou caros.
É interessante notar-se que reações aldólicas catalisadas por prolina não mostram quaisquer efeitos não-lineares (a enantiosseletividade dos produtos é diretamente proporcional à enantiopureza do catalisador). Combinado com evidência de marcação isotópica e estudos computacionais, o mecanismo de reação proposto para reações aldólicas catalisadas por prolina é o seguinte:[67]

Esta estratégia permite o que de outra forma desafia reação aldólica cruzada entre dois aldeídos. Em geral, reações aldólicas cruzadas entre aldeídos são tipicamente desafiantes porque elas podem polimerizar facilmente ou reagir não seletivamente resultando em uma mistura estatística de produtos. O primeiro exemplo é mostrado abaixxo:[68]

Em contraste com a preferência por adutos sin tipicamente observados em adições aldólicas baseadas em enolato, estas adições aldólicas organocatalisadas são anti-seletivas. Em muitos casos, as condições organocatalíticas são suaves o suficiente para evitar polimerização. Contudo, a seletividade requer lenta adição controlada, por exemplo, com uma seringa, do parceiro eletrofílico desejado, pois ambos os parceiros reactantes tipicamente tem prótons enolizáveis. Se um aldeído tem prótons não enolizáveis ou ramificação alfa ou beta, controle adicional pode ser obtido.
Uma elegante demonstração do poder das reações aldólicas organocatalíticas assimétricas foi apresentado por MacMillan e colaboradores em 2004 em suas sínteses de carboidratos diferencialmente protegidos. Enquanto métodos sintéticos tradicionais realizam a síntese de hexoses usando variações de estratégias proteção-desproteção interativas, requerendo 8 –14 etapas, organocatálise pode acessar muitos dos mesmos substratos usando um eficiente protocolo de duas etapas envolvendo a dimerização catalisada por prolina de alfa-oxialdeídos seguido por ciclização aldólica de Mukaiyama em “tandem” (em cascata).

A dimerização aldólica de alfa-oxialdeídos requer que o aduto aldol, ele próprio um aldeído, seja inerte para continuar reações aldólicas.[69]
Estudos anteriores revelaram que os aldeídos que apresentam substituintes alfa-alquilóxi ou alfa-sililóxi eram adequados para esta reação, enquanto aldeídos possuindo grupo de retirada de elétrons tal como acetóxi eram não reativos. O produto protegido eritrose poderia então ser convertido a quatro possíveis açúcares via adição aldólica de Mukaiyama seguida por formação de lactol. Isso requer diastereocontrole apropriado na adição aldólica de Mukaiyama e o produto sililíon oxicarbênium a preferencialmente sofrer uma ciclização, em vez de sofrer mais reação aldólica. No fim, glicose, manose, e alose foram sintetizadas:

Adições aldólicas "diretas"[editar | editar código-fonte]
Na adição aldólica usual, um composto carbonilo é deprotonado para formar o enolato. O enolato é adicionado a um aldeído ou cetona, o qual forma um alcóxido, que por sua vez é então protonado na operação. Um método superior, a princípio, evitaria a necessidade de uma sequência multietapas em favor de uma reação "direta" que poderia ser feita em um processo de passo único. Uma ideia é gerar-se o enolato usando um catalisador metálico que é liberado após o mecanismo da adição aldólica. O problema geral é que a adição gera um alcóxido, o qual é muito mais básico do que os materiais de partida. Este produto liga-se firmemente ao metal, prevenindo que ele reaja com reagentes carbonilo adicionais.

Uma abordagem, demonstrada por Evans, é produzir o sililato do aduto aldol.[70][71] Um reagente de silício tal como TMSCl é adicionado na reação, o qual substitui o metal no alcóxido, permitindo renovação do catalisador metálico. A minimização do número de etapas da reação e a quantidade de reativos químicos usados leva a um custo-benefício e reação industrialmente útil.

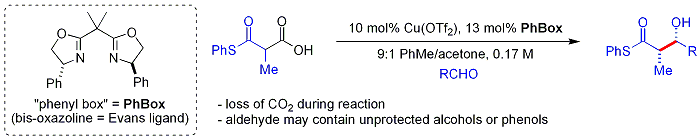
Em desenvolvimento apresentado no ano de 2005, uma abordagem biomimética por Shair usa beta-tiocetoácidos como nucleófilo.[72] A estrutura cetoácido é decarboxilada in situ. O processo é similar à rota malonil-CoA é usado por policétido sintases. O ligando quiral é no caso uma bisoxazolina. Curiosamente, aldeídos alifáticos aromático e ramificado são tipicamente substratos pobres.
Reações aldólicas biológicas[editar | editar código-fonte]
Exemplos de reações aldólicas em bioquímica incluem a divisão de frutose-1,6-bisfosfato em di-hidroxiacetona e gliceraldeído-3-fosfato no quarto estágio de glicólise, o qual é um exemplo de uma reação aldólica reversa ("retro") catalisada pela enzima aldolase A (também conhecida como frutose-1,6-bisfosfato aldolase).
No ciclo do glioxilato de planta e alguns procariontes, isocitrato liase produz glioxilato e succinato de isocitrato. Seguindo deprotonação do grupo OH, a isocitrato liase faz a clivagem de isocitrato no succinato de quatro carbonos e o glioxilato de dois carbonos via uma reação de clivagem de aldol. Esta clivagem é muito similar mecanicamente a reação aldolase A da glicólise.
Notas
- ↑ Nesta reação o nucleófilo é um enolato de boro derivado da reação com triflato de dibutilboro (nBu2BOTf), a base é N,N-di-isopropiletilamina. O tioéter é removido na etapa 2 por níquel de Raney / redução do hidrogênio.
Referências
- ↑ Wade, L. G. (2005). Organic Chemistry 6th ed. Upper Saddle River, New Jersey: Prentice Hall. pp. 1056–66. ISBN 0-13-236731-9
- ↑ Smith, M. B.; March, J. (2001). Advanced Organic Chemistry 5th ed. New York: Wiley Interscience. pp. 1218–23. ISBN 0-471-58589-0
- ↑ Mahrwald, R. (2004). Modern Aldol Reactions, Volumes 1 and 2. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. pp. 1218–23. ISBN 3-527-30714-1
- ↑ Ver:
- Borodin relatou a condensação de pentanal (Valerianaldeído) com heptanal (Oenantaldeído) em: von Richter, V. (1869) "V. von Richter, aus St. Petersburg am 17. October 1869" (V. von Richter [reporting] from St. Petersburg on 17. October 1869), Berichte der deutschen chemischen Gesellschaft, 2 : 552-553.
- English version of Richter's report: (Staff) (December 10, 1869) "Chemical notices from foreign sources: Berichte der Deutschen Chemischen Gesellschaft zu Berlin, no. 16, 1869: Valerian aldehyde and Oenanth aldehyde – M. Borodin," The Chemical News and Journal of Industrial Science, 20 : 286.
- Garner, Susan Amy (2007) "Hydrogen-mediated carbon-carbon bond formations: Applied to reductive aldol and Mannich reactions," Ph.D. dissertation, University of Texas (Austin), pp. 4 e 51.
- Borodin, A. (1873) "Ueber einen neuen Abkömmling des Valerals" (On a new derivative of valerian aldehyde [i.e., pentanal]), Berichte der deutschen chemischen Gesellschaft, 6 : 982–985.
- ↑ Wurtz, C. A. (1872). «Sur un aldéhyde-alcool». Bulletin de la Société chimique de Paris. 2nd series. 17: 436–442
- ↑ Wurtz, C. A. (1872). «Ueber einen Aldehyd-Alkohol». Journal für Praktische Chemie. 2nd series. 5 (1): 457–464. doi:10.1002/prac.18720050148
- ↑ Wurtz, C. A. (1872). «Sur un aldéhyde-alcool». Comptes rendus de l'Académie des sciences (em French). 74. 1361 páginas
- ↑ Heathcock, C. H. (1991). «The Aldol Reaction: Acid and General Base Catalysis». In: Trost, B. M.; Fleming, I. Comprehensive Organic Synthesis. 2. [S.l.]: Elsevier Science. pp. 133–179. ISBN 978-0-08-052349-1. doi:10.1016/B978-0-08-052349-1.00027-5
- ↑ Mukaiyama T. (1982). «The Directed Aldol Reaction». Org. React. 28: 203–331. ISBN 0471264180. doi:10.1002/0471264180.or028.03
- ↑ Paterson, I. (1988). «New Asymmetric Aldol Methodology Using Boron Enolates». Chem. Ind. 12: 390–394
- ↑ Martins, Daniela de L./ Reações Aldólicas; Rev. Virtual Quim., 2009, 1 (3), 186-211. Data de publicação na Web: 28 de Julho de 2009
- ↑ Mestres R. (2004). «A green look at the aldol reaction». Green Chemistry. 6 (12): 583–603. doi:10.1039/b409143b
- ↑ M. Braun; R. Devant (1984). «(R) and (S)-2-acetoxy-1,1,2-triphenylethanol – effective synthetic equivalents of a chiral acetate enolate». Tetrahedron Letters. 25 (44): 5031–4. doi:10.1016/S0040-4039(01)91110-4
- ↑ Jie Jack Li; et al. (2004). Contemporary Drug Synthesis. [S.l.]: Wiley-Interscience. pp. 118–. ISBN 0-471-21480-9
- ↑ Wulff W. D.; Andersson B. A (1994). «Stereoselective aldol addition reactions of Fischer carbene complexes via electronic tuning of the metal center for enolate reactivity». Inorganica Chimica Acta. 220 (1-2): 215–231. doi:10.1016/0020-1693(94)03874-0
- ↑ Schetter, B.; Mahrwald, R. (2006). «Modern Aldol Methods for the Total Synthesis of Polyketides». Angew. Chem. Int. Ed. 45 (45): 7506–7525. PMID 17103481. doi:10.1002/anie.200602780
- ↑ Guthrie, J.P.; Cooper, K.J.; Cossar, J.; Dawson, B.A.; Taylor, K.F. (1984). «The retroaldol reaction of cinnamaldehyde». Can. J. Chem. 62 (8): 1441–1445. doi:10.1139/v84-243
- ↑ Zimmerman, H. E.; Traxler, M. D. (1957). «The Stereochemistry of the Ivanov and Reformatsky Reactions. I». Journal of the American Chemical Society. 79 (8): 1920–1923. doi:10.1021/ja01565a041
- ↑ Heathcock, C. H.; Buse, C. T.; Kleschnick, W. A.; Pirrung, M. C.; Sohn, J. E.; Lampe, J. (1980). «Acyclic stereoselection. 7. Stereoselective synthesis of 2-alkyl-3-hydroxy carbonyl compounds by aldol condensation». Journal of Organic Chemistry. 45 (6): 1066–1081. doi:10.1021/jo01294a030
- ↑ Bal, B.; Buse, C. T.; Smith, K.; Heathcock, C. H., (2SR,3RS)-2,4-Dimethyl-3-Hydroxypentanoic Acid, Org. Syn., Coll. Vol. 7, p.185 (1990); Vol. 63, p.89 (1985).
- ↑ a b Brown, H. C.; Dhar, R. K.; Bakshi, R. K.; Pandiarajan, P. K.; Singaram, B. (1989). «Major effect of the leaving group in dialkylboron chlorides and triflates in controlling the stereospecific conversion of ketones into either E- or Z-enol borinates». Journal of the American Chemical Society. 111 (9): 3441–3442. doi:10.1021/ja00191a058
- ↑ Ireland, R. E.; Willard, A. K. (1975). «The stereoselective generation of ester enolates». Tetrahedron Letters. 16 (46): 3975–3978. doi:10.1016/S0040-4039(00)91213-9
- ↑ Narula, A. S. (1981). «An analysis of the diastereomeric transition state interactions for the kinetic deprotonation of acyclic carbonyl derivatives with lithium diisopropylamide». Tetrahedron Letters. 22 (41): 4119–4122. doi:10.1016/S0040-4039(01)82081-5
- ↑ Ireland, RE; Wipf, P; Armstrong, JD (1991). «Stereochemical control in the ester enolate Claisen rearrangement. 1. Stereoselectivity in silyl ketene acetal formation». Journal of Organic Chemistry. 56 (2): 650–657. doi:10.1021/jo00002a030
- ↑ Xie, L; Isenberger, KM; Held, G; Dahl, LM (outubro de 1997). «Highly Stereoselective Kinetic Enolate Formation: Steric vs Electronic Effects». Journal of Organic Chemistry. 62 (21): 7516–7519. PMID 11671880. doi:10.1021/jo971260a
- ↑ Directed Aldol Synthesis – Formation of E-enolate and Z-enolate - pharmaxchange.info
- ↑ Cowden, C. J.; Paterson, I. Org. React. 1997, 51, 1.
- ↑ Cowden, C. J.; Paterson, I. (2004). Organic Reactions. [S.l.]: John Wiley & Sons, Inc. ISBN 9780471264187. doi:10.1002/0471264180.or051.01
- ↑ Cergol KM, Coster MJ.; Asymmetric aldol reaction using boron enolates. Nat Protoc. 2007; 2(10):2568-73. PMID 17947999 DOI: 10.1038/nprot.2007.372
- ↑ Evans, D. A.; Nelson J. V.; Vogel E.; Taber T. R. (1981). «Stereoselective aldol condensations via boron enolates». Journal of the American Chemical Society. 103 (11): 3099–3111. doi:10.1021/ja00401a031
- ↑ Evans, D. A.; Rieger D. L.; Bilodeau M. T.; Urpi F. (1991). «Stereoselective aldol reactions of chlorotitanium enolates. An efficient method for the assemblage of polypropionate-related synthons». Journal of the American Chemical Society. 113 (3): 1047–1049. doi:10.1021/ja00003a051
- ↑ Polo, Ellen Christine; Controle da estereoquímica remota 1,5 em adições de enolatos em boros de metilcetonas a aldeídos; Tese de Mestrado - Universidade Estadual de Campinas, Instituto de Química, Campinas, SP, Brasil, 2011.
- ↑ Evans D. A. et al. Top. Stereochem. 1982, 13, 1–115. (Review)
- ↑ Roush W. R. (1991). «Concerning the diastereofacial selectivity of the aldol reactions of .alpha.-methyl chiral aldehydes and lithium and boron propionate enolates». Journal of Organic Chemistry. 56 (13): 4151–4157. doi:10.1021/jo00013a015
- ↑ Masamune S.; Ellingboe J. W.; Choy W. (1982). «Aldol strategy: coordination of the lithium cation with an alkoxy substituent». Journal of the American Chemical Society. 104 (20): 1047–1049. doi:10.1021/ja00384a062
- ↑ a b Evans, D. A.; Dart M. J.; Duffy J. L.; Rieger D. L. (1995). «Double Stereodifferentiating Aldol Reactions. The Documentation of "Partially Matched" Aldol Bond Constructions in the Assemblage of Polypropionate Systems». Journal of the American Chemical Society. 117 (35): 9073–9074. doi:10.1021/ja00140a027
- ↑ Masamune S.; Choy W.; Petersen J. S.; Sita L. R. (1985). «Double Asymmetric Synthesis and a New Strategy for Stereochemical Control in Organic Synthesis». Angew. Chem. Int. Ed. Engl. 24: 1–30. doi:10.1002/anie.198500013
- ↑ Evans D. A. Aldrichimica Acta 1982, 15, 23. (Review)
- ↑ Gage J. R.; Evans D. A., Diastereoselective Aldol Condensation Using A Chiral Oxazolidinone Auxiliary: (2S*,3S*)-3-Hydroxy-3-Phenyl-2-Methylpropanoic Acid, Organic Syntheses, Coll. Vol. 8, p.339 (1993); Vol. 68, p.83 (1990).
- ↑ Evans, D. A.; Bartroli J.; Shih T. L. (1981). «Enantioselective aldol condensations. 2. Erythro-selective chiral aldol condensations via boron enolates». Journal of the American Chemical Society. 103 (8): 2127–2129. doi:10.1021/ja00398a058
- ↑ a b Evans, D. A.; Bender S. L.; Morris J. (1988). «The total synthesis of the polyether antibiotic X-206». Journal of the American Chemical Society. 110 (8): 2506–2526. doi:10.1021/ja00216a026
- ↑ Evans, D. A.; Clark J.S.; Metternich R.; Sheppard G.S. (1990). «Diastereoselective aldol reactions using .beta.-keto imide derived enolates. A versatile approach to the assemblage of polypropionate systems». Journal of the American Chemical Society. 112 (2): 866–868. doi:10.1021/ja00158a056
- ↑ Evans, D. A.; Ng, H.P.; Clark, J.S.; Rieger, D.L. (1992). «Diastereoselective anti aldol reactions of chiral ethyl ketones. Enantioselective processes for the synthesis of polypropionate natural products». Tetrahedron. 48 (11): 2127–2142. doi:10.1016/S0040-4020(01)88879-7
- ↑ Evans, D. A.; Clark, J. S.; Metternich, R.; Novack, V. J.; Sheppard, G. S.; Diastereoselective Aldol Reactions Using b-Keto Imide-Derived Enolates: A Versatile Approach to Polypropionate Systems, J. Am. Chem. Soc., 1990, 112, 866-868 - na página do autor: evans.rc.fas.harvard.edu/cgi-bin
- ↑ Myers Stereoselective, Directed Aldol Reaction, Chem 115 - faculty.chemistry.harvard.edu
- ↑ Shigehisa, H.; Mizutani, T.; Tosaki, S. Y.; Ohshima, T.; Shibasaki, M, Tetrahedron 2005, 61, 5057-5065.
- ↑ Gröger H, Vogl EM, Shibasaki M. New Catalytic Concepts for the Asymmetric Aldol Reaction. Chem. Eur. J. 1998;4:1137-1141. Abstract - PDF
- ↑ Naoki Yoshikawa, Yoichi M. A. Yamada, Jagattaran Das, Hiroaki Sasai and Masakatsu Shibasaki; Direct Catalytic Asymmetric Aldol Reaction; J. Am. Chem. Soc., 1999, 121 (17), pp 4168–4178 - DOI: 10.1021/ja990031y
- ↑ Machajewski TD, Wong CH. The Catalytic Asymmetric Aldol Reaction. Angew Chem Int Ed Engl. 2000 Apr;39(8):1352-1375.
- ↑ Barry M. Trost and Cheyenne S. Brindle; The Direct Catalytic Asymmetric Aldol Reaction; Chem Soc Rev. 2010 May; 39(5): 1600–1632.
- ↑ Jacek Mlynarski and Sebastian Baś; Catalytic asymmetric aldol reactions in aqueous media – a 5 year update; Chem. Soc. Rev., 2014,43, 577-587 - DOI:10.1039/C3CS60202H
- ↑ Corrêa Jr., Ivan R., & Pilli, Ronaldo A.. (2003). Reações aldólicas assimétricas catalíticas - REVISÃO Química Nova, 26(4), 531-541.
- ↑ S. B. Jennifer Kan; Kenneth K.-H. Ng; Ian Paterson (2013). «The Impact of the Mukaiyama Aldol Reaction in Total Synthesis». Angewandte Chemie International Edition. 52 (35): 9097–9108. doi:10.1002/anie.201303914
- ↑ Teruaki Mukaiyama; Kazuo Banno; Koichi Narasaka (1974). «Reactions of silyl enol ethers with carbonyl compounds activated by titanium tetrachloride». Journal of the American Chemical Society. 96 (24): 7503–7509. doi:10.1021/ja00831a019
- ↑ 3-Hydroxy-3-Methyl-1-Phenyl-1-Butanone by Crossed Aldol Reaction Teruaki Mukaiyama and Koichi Narasaka Organic Syntheses, Coll. Vol. 8, p.323 (1993); Vol. 65, p.6 (1987)
- ↑ Carreira E.M.; Singer R.A.; Lee W.S. (1994). «Catalytic, enantioselective aldol additions with methyl and ethyl acetate O-silyl enolates — a chira; tridentate chelate as a ligand for titanium(IV)». Journal of the American Chemical Society. 116 (19): 8837–8. doi:10.1021/ja00098a065
- ↑ Kruger J.; Carreira E.M. (1998). «Apparent catalytic generation of chiral metal enolates: Enantioselective dienolate additions to aldehydes mediated by Tol-BINAP center Cu(II) fluoride complexes». Journal of the American Chemical Society. 120 (4): 837–8. doi:10.1021/ja973331t
- ↑ Pagenkopf B.L.; Kruger J.; Stojanovic A.; Carreira E.M. (1998). «Mechanistic insights into Cu-catalyzed asymmetric aldol reactions: Chemical and spectroscopic evidence for a metalloenolate intermediate». Angew. Chem. Int. Ed. 37 (22): 3124–6. doi:10.1002/(SICI)1521-3773(19981204)37:22<3124::AID-ANIE3124>3.0.CO;2-1
- ↑ Crimmins M. T.; King B. W.; Tabet A. E. (1997). «Asymmetric Aldol Additions with Titanium Enolates of Acyloxazolidinethiones: Dependence of Selectivity on Amine Base and Lewis Acid Stoichiometry». Journal of the American Chemical Society. 119 (33): 7883–7884. doi:10.1021/ja9716721
- ↑ Crimmins M. T.; Chaudhary K. (2000). «Titanium enolates of thiazolidinethione chiral auxiliaries: Versatile tools for asymmetric aldol additions». Organic Letters. 2 (6): 775–777. PMID 10754681. doi:10.1021/ol9913901
- ↑ Michael T. Crimmins and Mariam Shamszad; Highly Selective Acetate Aldol Additions Using Mesityl-Substituted Chiral Auxiliaries; Org. Lett., 2007, 9 (1), pp 149–152 - DOI: 10.1021/ol062688b
- ↑ Simões, Pedro Rafael Dias; Síntese de tiazolidinas quirais para reações aldólicas assimétricas; Universidade de Coimbra, 2016.
- ↑ Carreira, E. M.; Fettes, A.; Martl, C. (2006). «Catalytic Enantioselective Aldol Addition Reactions». Org. React. 67: 1–216. ISBN 0471264180. doi:10.1002/0471264180.or067.01
- ↑ Z. G. Hajos, D. R. Parrish, German Patent DE 2102623 1971
- ↑ Hajos, Zoltan G.; Parrish, David R. (1974). «Asymmetric synthesis of bicyclic intermediates of natural product chemistry». Journal of Organic Chemistry. 39 (12): 1615–1621. doi:10.1021/jo00925a003
- ↑ Eder, Ulrich; Sauer, Gerhard; Wiechert, Rudolf (1971). «New Type of Asymmetric Cyclization to Optically Active Steroid CD Partial Structures». Angewandte Chemie International Edition in English. 10 (7): 1615–1621. doi:10.1002/anie.197104961
- ↑ List, Benjamin (2006). «The ying and yang of asymmetric aminocatalysis». Chemical Communications (8): 819–824. PMID 16479280. doi:10.1039/b514296m
- ↑ Northrup, Alan B.; MacMillan David W. C. (2002). «The First Direct and Enantioselective Cross-Aldol Reaction of Aldehydes». Journal of the American Chemical Society. 124 (24): 6798–6799. PMID 12059180. doi:10.1021/ja0262378
- ↑ Northrup A. B.; Mangion I. K.; Hettche F.; MacMillan D. W. C. (2004). «Enantioselective Organocatalytic Direct Aldol Reactions of -Oxyaldehydes: Step One in a Two-Step Synthesis of Carbohydrates». Angewandte Chemie International Edition in English. 43 (16): 2152–2154. PMID 15083470. doi:10.1002/anie.200453716
- ↑ Evans, D. A.; Tedrow, J. S.; Shaw, J. T.; Downey, C. W. (2002). «Diastereoselective Magnesium Halide-Catalyzed anti-Aldol Reactions of Chiral N-Acyloxazolidinones». Journal of the American Chemical Society. 124 (3): 392–393. PMID 11792206. doi:10.1021/ja0119548
- ↑ Evans, David A.; Downey, C. Wade; Shaw, Jared T.; Tedrow, Jason S. (2002). «Magnesium Halide-Catalyzed Anti-Aldol Reactions of Chiral N-Acylthiazolidinethiones». Organic Letters. 4 (7): 1127–1130. PMID 11922799. doi:10.1021/ol025553o
- ↑ Magdziak, D.; Lalic, G.; Lee, H. M.; Fortner, K. C.; Aloise, A. D.; Shair, M. D. (2005). «Catalytic Enantioselective Thioester Aldol Reactions That Are Compatible with Protic Functional Groups». Journal of the American Chemical Society. 127 (20): 7284–7285. PMID 15898756. doi:10.1021/ja051759j
Ligações externas[editar | editar código-fonte]
- D. A. Evans et al.; Chem 206 Lecture Notes (Fall 2003); Harvard University (pp. 345–372)
