Câncer cervical
| Cancro do colo do útero | |
|---|---|
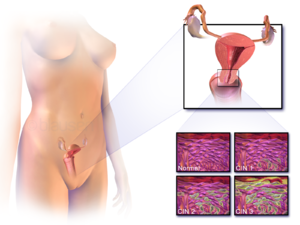
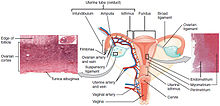
| Localização do cancro do colo do útero e exemplo de células normais e anormais | |
| Especialidade | Oncologia |
| Sintomas | Iniciais: nenhum[1] Tardios: hemorragia vaginal, dor pélvica, dor durante as relações sexuais[1] |
| Início habitual | Ao longo de 10 a 20 anos[2] |
| Tipos | Carcinoma espinocelular, adenocarcinoma, outros[3] |
| Causas | Infeção por vírus do papiloma humano (VPH)[4][5] |
| Fatores de risco | Fumar, sistema imunitário debilitado, pílula contracetiva oral, iniciação sexual em idade precoce, múltiplos parceiros sexuais ou parceiro sexual com múltiplos parceiros sexuais[1][3][6] |
| Método de diagnóstico | Rastreio cervical seguido por biópsia[1] |
| Prevenção | Rastreio cervical regular, vacina contra o VPH, preservativos[7][8] |
| Tratamento | Cirurgia, quimioterapia, radioterapia[1] |
| Prognóstico | Taxa de sobrevivência a 5 anos: 68% (EUA)[9] |
| Frequência | 570 000 novos casos (2018)[10] |
| Mortes | 311 000 (2018)[10] |
| Classificação e recursos externos | |
| CID-10 | C53 |
| CID-9 | 180 |
| CID-11 | 1256072522 |
| OMIM | 603956 |
| DiseasesDB | 2278 |
| MedlinePlus | 000893 |
| eMedicine | med/324 radio/140 |
| MeSH | D002583 |
Cancro do colo do útero, cancro cervical (português europeu) ou câncer do colo de útero (português brasileiro) é o cancro que tem origem no colo do útero, ou cérvix.[1] Caracteriza-se pelo crescimento anormal de células que têm a capacidade de invadir ou de se espalhar para outras partes do corpo.[11] Na fase inicial geralmente não se observam sintomas. À medida que a doença avança podem-se manifestar sintomas como hemorragia vaginal, dores na pelve ou dores durante o ato sexual.[1] Embora a hemorragia após o ato sexual possa não ser grave, pode também ser um indicador da presença de cancro do colo do útero.[12]
Em mais de 90% dos casos da doença, a causa aparenta ser a infeção pelo vírus do papiloma humano (VPH ou HPV, do inglês human papiloma virus).[4][5] No entanto, a maioria das pessoas que é infetada pelo vírus não desenvolve cancro.[2][13] Entre outros fatores de risco estão o tabagismo, um sistema imunitário comprometido, a pílula contracetiva, a iniciação sexual precoce e múltiplos parceiros sexuais, embora estes fatores sejam menos relevantes.[1][3] O cancro do colo do útero geralmente desenvolve-se a partir de alterações pré-malignas que ocorrem ao longo de 10–20 anos.[2][3] Cerca de 90% dos casos são carcinomas de células escamosas, 10% são adenocarcinomas e um pequeno número são de outros tipos.[3] O diagnóstico é feito pela observação do colo do útero, seguida de biópsia. Posteriormente é usada imagiologia médica para determinar se o cancro se espalhou ou não.[1]
As vacinas contra o vírus do papiloma humano protegem contra duas a sete estirpes de elevado risco da família do vírus e são capazes de prevenir até 90% dos cancros do colo do útero.[14][8][15] Como continua a existir um pequeno risco de cancro, as recomendações incentivam a realização regular de testes de Papanicolau.[8] Entre outros métodos de prevenção estão a diminuição do número de parceiros sexuais e o uso de preservativos.[7] O rastreio do cancro do colo do útero através de Papanicolau ou ácido acético permite identificar eventuais alterações pré-malignas cujo tratamento pode prevenir o desenvolvimento de cancro.[16] O tratamento do cancro do colo do útero pode consistir numa combinação de cirurgia, quimioterapia e radioterapia.[1] A taxa de sobrevivência a cinco anos nos Estados Unidos é de 68%.[17] No entanto, o prognóstico depende significativamente de quão cedo é detetado o cancro.[3]
Em todo o mundo, o cancro do colo do útero é a quarta causa mais comum de cancro e de morte por cancro entre mulheres.[2] Em 2012, estima-se que tenham ocorrido 528 000 casos da doença em todo o mundo, a qual provocou a morte a 266 000 pessoas.[2] Isto corresponde a 8% do número total de casos e de mortes por cancro.[18] Cerca de 70% dos casos ocorrem nos países em vias de desenvolvimento.[2] Nos países de baixa renda é a causa mais comum de morte por cancro.[16] Em países desenvolvidos, a adoção de programas de rastreio diminuiu drasticamente a prevalência do cancro do colo do útero.[19]
Sinais e sintomas[editar | editar código-fonte]
Os primeiros estágios do câncer do colo do útero podem ser completamente livres de sintomas.[4][19] O sangramento vaginal, sangramento de contato (uma das formas mais comuns de sangramento após a relação sexual) ou, raramente, uma massa vaginal podem ser indicativos da presença de doença maligna. Além disso, dor moderada durante a relação sexual e corrimento vaginal também podem ser sintomas do câncer do colo do útero. Na doença já avançada, pode haver metástases para o abdome, pulmões e outros órgãos.
Os sintomas do câncer do colo do útero avançado incluem: perda do apetite, emagrecimento, fadiga, dor pélvica, dor lombar, dores e inchaço nas pernas, sangramento vaginal de grande volume, fraturas e, mais raramente, perda de urina e fezes pela vagina.[20] Sangramento após ducha vaginal ou após o exame ginecológico é um sintoma comum do câncer do colo do útero.[21]
Causas[editar | editar código-fonte]

A infecção por alguns tipos de HPV é o maior fator de risco para o câncer do colo do útero, seguida do tabagismo.[22] Outros fatores de risco incluem o vírus da imunodeficiência humana (HIV).[22] Entretanto, nem todas as causas de câncer do colo do útero são conhecidas e vários outros fatores podem estar implicados no desenvolvimento deste câncer.[23] Existe uma correlação entre a composição de três genes de micro-RNA (miR146, miR196a2 e miR499) no DNA e o risco de uma pessoa desenvolver câncer cervical. Eles se ligam ao RNA de uma determinada classe de genes. Desta forma, um micro-RNA regula a expressão de vários genes e processos em um indivíduo.[24]
Vírus do papiloma humano[editar | editar código-fonte]
Os tipos 16 e 18 do vírus do papiloma humano (HPV) causam 75% dos cânceres do colo do útero em todo o mundo, enquanto os tipos 31 e 45 são a causa de mais 10% dos casos.[25]
Mulheres com múltiplos parceiros sexuais (ou que tenham relações sexuais com homens que têm ou tiveram muitos outros parceiros) estão em maior risco de desenvolver o câncer.[26][27]
Dos 150-200 tipos de HPV conhecidos,[28][29] 15 foram classificados como tipos de alto risco (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 e 82), três como provável alto risco (26, 53 e 66) e 12 como de baixo risco (6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81 e CP6108).[30]
As verrugas genitais, que são uma forma de tumor benigno das células epiteliais, são causadas por vários tipos de HPV. Entretanto, estes sorotipos geralmente não estão relacionados ao câncer do colo do útero. É comum haver a infecção por múltiplos tipos ao mesmo tempo, incluindo aqueles que podem causar o câncer e os que provocam verrugas.
Acredita-se que a infecção pelo HPV seja uma condição necessária para o desenvolvimento do câncer do colo do útero.[31]
Tabagismo[editar | editar código-fonte]
O hábito de fumar, tanto o tabagismo ativo como passivo, aumenta o risco de desenvolver o câncer do colo do útero. Entre as mulheres infectadas pelo HPV, as fumantes atuais ou ex-fumantes têm uma incidência de câncer invasivo cerca de duas a três vezes maior. O tabagismo passivo também está associado ao aumento do risco, mas em uma menor proporção.[32]
Contraceptivos orais[editar | editar código-fonte]
O uso prolongado de contraceptivos orais está associado ao aumento do risco de câncer do colo do útero. Mulheres que utilizaram contraceptivos orais por 5 a 9 anos apresentaram uma incidência três vezes maior de desenvolver o câncer invasivo, enquanto aquelas que fizeram uso por 10 anos ou mais tiveram um risco cerca de quatro vezes maior.[32]
Múltiplas gestações[editar | editar código-fonte]
Ter uma história de muitas gestações também está associado ao aumento do risco de câncer do colo do útero. Entre as mulheres infectadas com HPV, aquelas que tiveram sete ou mais gestações concluídas apresentaram um risco quase quatro vezes maior de desenvolver o câncer quando comparadas com mulheres que nunca engravidaram e duas a três vezes maior em relação às mulheres que tiveram apenas uma ou duas gestações concluídas.[32]
Diagnóstico[editar | editar código-fonte]

Biópsia[editar | editar código-fonte]
O exame citológico do colo do útero (Papanicolau) pode ser usado como teste de rastreio, mas pode apresentar resultado falso negativo em mais de 50% dos casos de câncer do colo do útero.[33][34] A confirmação do diagnóstico de câncer do colo do útero ou de lesões pré-malignas requer uma biópsia do colo. Esta é geralmente realizada através da colposcopia, uma inspeção visual aumentada do colo do útero, na qual é aplicada solução de ácido acético que evidencia células anormais na superfície do colo.[4] A impressão colposcópica, a estimativa da gravidade da lesão baseada na inspeção visual do colo, também é parte do diagnóstico.
Procedimentos diagnósticos e terapêuticos adicionais incluem a exérese da zona de transformação (EZT) e a conização, nas quais a camada interna do colo do útero é removida para ser examinada pelo patologista. Estes procedimentos são realizados se a biópsia confirmar neoplasia intraepitelial cervical grave.

Frequentemente, antes da biópsia, o médico solicita exames de imagem para descartar outras causas para os sintomas da paciente. Algumas modalidades de imagem incluem a ultrassonografia, a tomografia computadorizada e a ressonância nuclear magnética, que têm sido usadas na busca por outras doenças, para identificar extensão do tumor e seu efeito sobre estruturas adjacentes. Tipicamente, o tumor se apresenta como uma massa heterogênea no colo.[35]
Lesões pré-malignas[editar | editar código-fonte]
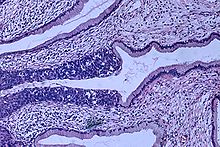
Neoplasia intraepitelial cervical, uma lesão com potencial precursor do câncer do colo do útero, é diagnosticada com frequência na biópsia do colo, examinada por um patologista. A nomenclatura neoplasia intraepitelial cervical é utilizada para alterações displásicas pré-malignas.
O nome e a classificação histológica das lesões precursoras do carcinoma do colo do útero foram muito modificadas ao longo do século XX. A classificação da Organização Mundial da Saúde[36][37] era baseada na descrição das lesões, classificando-as em displasia leve, moderada e grave ou carcinoma in situ (CIS). O termo neoplasia intraepitelial cervical (NIC) foi desenvolvido para enfatizar a gama de anormalidades dessas lesões e para ajudar a padronizar o tratamento.[37] Classifica-se a displasia leve como NIC I, displasia moderada como NIC II e displasia grave e carcinoma in situ como NIC III. Mais recentemente, NIC II e NIC III foram combinadas em NIC II/III. Estes são os resultados que devem ser relatados pelo patologista que analisar a biópsia.
Este sistema não deve ser confundido com o Bethesda que serve para os resultados do exame citológico. As classificações do sistema Bethesda são: lesão intraepitelial escamosa de baixo grau (LSIL), lesão intraepitelial escamosa de alto grau (HSIL) e outras. Um resultado LSIL deve corresponder a um NIC I e um HSIL a um NIC II ou III,[37] porém, trata-se de resultados de exames diferentes e os achados do exame citológico podem não corresponder aos da análise histológica.
Subtipos de câncer[editar | editar código-fonte]
Os subtipos histológicos do carcinoma invasivo do colo do útero são:[38][39]
- carcinoma de células escamosas
- adenocarcinoma (cerca de 15% dos cânceres do colo do útero no Reino Unido)[36]
- adenocarcinoma
- carcinoma de pequenas células
- tumor neuroendócrino
- carcinoma de células caliciformes
- adenocarcinoma viloglandular
Embora o carcinoma de células escamosas seja o tipo mais comum, a incidência do adenocarcinoma do colo do útero tem aumentado nas últimas décadas.[4]
Outros tipos de malignidade diferentes do carcinoma que podem ocorrer no colo do útero são o melanoma e o linfoma.
Estadiamento[editar | editar código-fonte]
O câncer do colo do útero é estadiado a partir do sistema estabelecido pela Federação Internacional de Ginecologia e Obstetrícia (FIGO), que se baseia mais no exame clínico do que nos achados cirúrgicos. Apenas os testes a seguir podem ser usados no estadiamento da doença, quando se utiliza o sistema FIGO: palpação, inspeção, colposcopia, curetagem endocervical, histeroscopia, cistoscopia, proctoscopia, urografia intravenosa, conização e radiografia do tórax e do esqueleto.
-
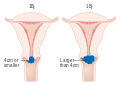
Estádio 1A
-
Estádio 1B
-
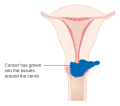
Estádio 2A
-
Estádio 2B
-
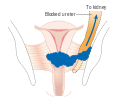
Estádio 3B
-
Estádio 4A
-
Estádio 4B
Prevenção[editar | editar código-fonte]
A prevenção pode ser feita através da vacina contra o HPV entre a idade de 9 e 20 anos e pelo uso de preservativo em todas relações sexuais.[40] A vacina (Gardasil) reduz o risco de desenvolver o câncer cervical em 93% e também protege contra o câncer de vagina, câncer de vulva, Câncer retal, câncer de faringe e câncer de boca, que também associados ao HPV. Geralmente só é distribuída gratuitamente a meninas antes dos 20 anos por seu elevado custo, mas vacinar homens também previne cânceres masculinos como o câncer de pênis e a transmissão do HPV para mulheres.[41]
Através do exame de Papanicolau e da colposcopia é possível realizar a monitorização das mulheres saudáveis para detectar lesões intracervicais (CIL). O exame deve ser repetido a cada 5 anos em mulheres sem fatores de risco, a cada 3 anos com baixo risco e anualmente quando há alto risco. O primeiro exame normalmente é feito entre os 20 e os 30 anos.[42]
Uma dieta rica em vitaminas A, B, C e E reduz o risco desse câncer. Não fumar previne cânceres em todo o corpo.[43]
Tratamento[editar | editar código-fonte]
O tratamento geralmente é por cirurgia, radioterapia e quimioterapia, e depende das condições do paciente, do tipo de tumor e da sua procedência.[44]
No estágios iniciais (in situ ou IA) a conização (remover biópsia em forma de cone com bisturi, laser ou LEEP) para diagnóstico já pode remover todo o câncer. O câncer micro-invasor (estágio IA) já indica a remoção de todo o útero (histerectomia total). Remover apenas o cérvix (traquelectomia) permite manter a fertilidade, mas o risco de aborto espontâneo por cérvix incompetente é elevado, esse risco pode ser reduzido com cerclagem. Os estágios IIA e IB indicam remoção dos gânglios linfáticos pélvicos (linfadenectomia), uma cirurgia bastante agressiva e com muito risco de complicações. Quando é maior que 3cm (estágio B) pode-se fazer quimioterapia ou radioterapia antes da cirurgia para reduzir o tamanho do tumor (terapia neoadjuvante). Quando invade vagina, bexiga, cólon, reto, corpo do útero ou peritônio as partes invadidas também podem ser removidos. Em estágios avançados (III ou IV) apenas radioterapia externa e localizada (braquiterapia) e quimioterapia com cisplatina e fluorouracil estão indicados. Imunoterapia também podem ser útil.[45]
Prognóstico[editar | editar código-fonte]
A sobrevivência 5 anos após o diagnóstico é em média de 72%. Nos estágios iniciais é de 92%, caindo 35% nos estágio III e 15% no estágio 15%. Cerca de 35% das mulheres com câncer invasivo voltam a ter esse câncer em menos de 5 anos. Geralmente as metástases são locais, invadindo vagina, bexiga, cólon, reto e peritônio.[46]
Referências
- ↑ a b c d e f g h i j «Cervical Cancer Treatment (PDQ®)». NCI. 14 de março de 2014. Consultado em 24 de junho de 2014
- ↑ a b c d e f World Cancer Report 2014. [S.l.]: World Health Organization. 2014. pp. Chapter 5.12. ISBN 9283204298
- ↑ a b c d e f «Cervical Cancer Treatment (PDQ®)». National Cancer Institute. 14 de março de 2014. Consultado em 25 de junho de 2014
- ↑ a b c d e Kumar V, Abbas AK, Fausto N, Mitchell RN (2007). Robbins Basic Pathology 8th ed. [S.l.]: Saunders Elsevier. pp. 718–721. ISBN 978-1-4160-2973-1
- ↑ a b Kufe, Donald (2009). Holland-Frei cancer medicine. 8th ed. New York: McGraw-Hill Medical. p. 1299. ISBN 9781607950141
- ↑ Bosch, FX; de Sanjosé, S (2007). «The epidemiology of human papillomavirus infection and cervical cancer.». Disease Markers. 23 (4): 213–27. PMC 3850867
 . PMID 17627057. doi:10.1155/2007/914823
. PMID 17627057. doi:10.1155/2007/914823
- ↑ a b «Cervical Cancer Prevention (PDQ®)». National Cancer Institute. 27 de fevereiro de 2014. Consultado em 25 de junho de 2014
- ↑ a b c «Human Papillomavirus (HPV) Vaccines». National Cancer Institute. 29 de dezembro de 2011. Consultado em 25 de junho de 2014
- ↑ «Global Cancer Facts & Figures 3rd Edition» (PDF). 2015. p. 9. Consultado em 29 de agosto de 2017. Cópia arquivada (PDF) em 22 de agosto de 2017
- ↑ a b Bray, Freddie; Ferlay, Jacques; Soerjomataram, Isabelle; Siegel, Rebecca L.; Torre, Lindsey A.; Jemal, Ahmedin (2018). «Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries». CA: A Cancer Journal for Clinicians. ISSN 0007-9235. doi:10.3322/caac.21492
- ↑ «Defining Cancer». National Cancer Institute. Consultado em 10 de junho de 2014
- ↑ Tarney, CM; Han, J (2014). «Postcoital bleeding: a review on etiology, diagnosis, and management.». Obstetrics and Gynecology International. 2014. 192087 páginas. PMID 25045355. doi:10.1155/2014/192087
- ↑ Dunne, EF; Park, IU (dezembro de 2013). «HPV and HPV-associated diseases.». Infectious Disease Clinics of North America. 27 (4): 765–78. PMID 24275269. doi:10.1016/j.idc.2013.09.001
- ↑ «FDA approves Gardasil 9 for prevention of certain cancers caused by five additional types of HPV». U.S. Food and Drug Administration. 10 de dezembro de 2014. Consultado em 8 de março de 2015
- ↑ Tran, NP; Hung, CF; Roden, R; Wu, TC (2014). «Control of HPV infection and related cancer through vaccination.». Recent Results in Cancer Research. 193: 149–71. PMID 24008298. doi:10.1007/978-3-642-38965-8_9
- ↑ a b World Health Organization (fevereiro de 2014). «Fact sheet No. 297: Cancer». Consultado em 24 de junho de 2014
- ↑ «SEER Stat Fact Sheets: Cervix Uteri Cancer». NCI. Consultado em 18 de junho de 2014
- ↑ World Cancer Report 2014. [S.l.]: World Health Organization. 2014. pp. Chapter 1.1. ISBN 9283204298
- ↑ a b Canavan TP, Doshi NR (2000). «Cervical cancer». Am Fam Physician. 61 (5): 1369–76. PMID 10735343
- ↑ Nanda, Rita (9 de junho de 2006). «Cervical cancer». MedlinePlus Medical Encyclopedia. National Institutes of Health. Consultado em 2 de dezembro de 2007
- ↑ «Cervical Cancer Prevention and Early Detection». Cancer
- ↑ a b Gadducci A, Barsotti C, Cosio S, Domenici L, Riccardo Genazzani A (2011). «Smoking habit, immune suppression, oral contraceptive use, and hormone replacement therapy use and cervical carcinogenesis: A review of the literature». Gynecological Endocrinology. 27 (8): 597–604. PMID 21438669. doi:10.3109/09513590.2011.558953
- ↑ Stuart Campbell; Ash Monga (2006). Gynaecology by Ten Teachers 18 ed. [S.l.]: Hodder Education. ISBN 0-340-81662-7
- ↑ Why some women are more prone to develop cervical cancer? Finding this out is essential to develop early diagnostic tests in the future. por Pranjal Mehar (2019)
- ↑ Dillman, edited by Robert K. Oldham, Robert O. (2009). Principles of cancer biotherapy 5th ed. Dordrecht: Springer. p. 149. ISBN 9789048122899
- ↑ «What Causes Cancer of the Cervix?». American Cancer Society. 30 de novembro de 2006. Consultado em 2 de dezembro de 2007. Cópia arquivada em 13 de outubro de 2007
- ↑ Marrazzo JM, Koutsky LA, Kiviat NB, Kuypers JM, Stine K (2001). «Papanicolaou test screening and prevalence of genital human papillomavirus among women who have sex with women». Am J Public Health. 91 (6): 947–52. PMC 1446473
 . PMID 11392939. doi:10.2105/AJPH.91.6.947
. PMID 11392939. doi:10.2105/AJPH.91.6.947
- ↑ «HPV Type-Detect». Medical Diagnostic Laboratories. 30 de outubro de 2007. Consultado em 2 de dezembro de 2007. Cópia arquivada em 27 de setembro de 2007
- ↑ Gottlieb, Nicole (24 de abril de 2002). «A Primer on HPV». Benchmarks. National Cancer Institute. Consultado em 2 de dezembro de 2007. Arquivado do original em 26 de outubro de 2007
- ↑ Muñoz N, Bosch FX, de Sanjosé S, Herrero R, Castellsagué X, Shah KV, Snijders PJ, Meijer CJ (2003). «Epidemiologic classification of human papillomavirus types associated with cervical cancer». N. Engl. J. Med. 348 (6): 518–27. PMID 12571259. doi:10.1056/NEJMoa021641
- ↑ Snijders PJ, Steenbergen RD, Heideman DA, Meijer CJ (2006). «HPV-mediated cervical carcinogenesis: concepts and clinical implications». J. Pathol. 208 (2): 152–64. PMID 16362994. doi:10.1002/path.1866
- ↑ a b c National Institutes of Health, National Cancer Institute: PDQ® Cervical Cancer Prevention. Bethesda, MD: National Cancer Institute. Acessado em 20/05/2015.
- ↑ Cecil Medicine: Expert Consult Premium Edition . ISBN 1437736084, 9781437736083. Page 1317.
- ↑ Berek and Hacker's Gynecologic Oncology. ISBN 0781795125, 9780781795128. Page 342
- ↑ H. K. Pannu, F. M. Corl & E. K. Fishman (setembro–outubro de 2001). «CT evaluation of cervical cancer: spectrum of disease». Radiographics. 21 (5): 1155–1168. PMID 11553823. doi:10.1148/radiographics.21.5.g01se311155
- ↑ a b «Cancer Research UK website». Consultado em 3 de janeiro de 2009. Arquivado do original em 16 de janeiro de 2009
- ↑ a b c DeMay, M (2007). Practical principles of cytopathology. Revised edition. Chicago, IL: American Society for Clinical Pathology Press. ISBN 978-0-89189-549-7
- ↑ Garcia A Hamid O, El-Khoueiry A (6 de julho de 2006). «Cervical Cancer». eMedicine. WebMD. Consultado em 2 de dezembro de 2007
- ↑ Dolinsky, Christopher (17 de julho de 2006). «Cervical Cancer: The Basics». OncoLink. Abramson Cancer Center of the University of Pennsylvania. Consultado em 2 de dezembro de 2007
- ↑ Manhart LE, Koutsky LA (2002). "Do condoms prevent genital HPV infection, external genital warts, or cervical neoplasia? A meta-analysis". Sex Transm Dis. 29 (11): 725–35. doi:10.1097/00007435-200211000-00018. PMID 12438912.
- ↑ Redação. «Homens também devem tomar vacina contra o HPV». Gazeta do Povo. Consultado em 3 de maio de 2021
- ↑ Arbyn M, Anttila A, Jordan J, Ronco G, Schenck U, Segnan N, Wiener H, Herbert A, von Karsa L (Mar 2010). "European Guidelines for Quality Assurance in Cervical Cancer Screening. Second edition—summary document". Annals of Oncology. 21 (3): 448–58. doi:10.1093/annonc/mdp471. PMC 2826099 Freely accessible. PMID 20176693.
- ↑ Myung SK, Ju W, Kim SC, Kim H (2011). "Vitamin or antioxidant intake (or serum level) and risk of cervical neoplasm: A meta-analysis". BJOG. 118 (11): 1285–91. doi:10.1111/j.1471-0528.2011.03032.x. PMID 21749626.
- ↑ «Cervical cancer - Diagnosis and treatment - Mayo Clinic». www.mayoclinic.org. Consultado em 3 de maio de 2021
- ↑ Cancer.org - Cervical cancer
- ↑ "Cervical Cancer". Cervical Cancer: Cancers of the Female Reproductive System: Merck Manual Home Edition. Merck Manual Home Edition. Archived from the original on 2006-12-16.