Usuário(a):KrillUSP2/Testes

|
Esta é uma página de testes de KrillUSP2, uma subpágina da principal. Serve como um local de testes e espaço de desenvolvimento, desta feita não é um artigo enciclopédico. Para uma página de testes sua, crie uma aqui. Como editar: Tutorial • Guia de edição • Livro de estilo • Referência rápida Como criar uma página: Guia passo a passo • Como criar • Verificabilidade • Critérios de notoriedade |
Krill[editar | editar código-fonte]
| Krill | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Classificação científica | |||||||||||||
| |||||||||||||
| Famílias | |||||||||||||
| |||||||||||||
Krill é o nome coletivo dado a um conjunto de espécies de animais invertebrados pertencentes à ordem Euphausiacea.
O termo krill é de origem norueguesa, sendo derivado do neerlandês kriel,[1] que designa peixes acabados de nascer ou em fase juvenil, e originalmente designava o krill antártico (Euphausia superba), mas atualmente é utilizado para todos os indivíduos da ordem[2][3].
Esses animais são crustáceos semelhantes ao camarão, diferindo desses por algumas características tais como apresentar uma carapaça que não recobre as brânquias.[2] São importantes organismos do zooplâncton, especialmente porque servem de alimento a baleias, jamantas, tubarões-baleia, entre outros. Estes crustáceos são ainda designados como eufausídeos, por pertencerem à ordem Euphausiacea.
Os eufausídeos estão presentes em todos os oceanos do planeta. São considerados espécies-chave próximas da base da cadeia alimentar já que se alimentam de fitoplâncton e de algum zooplâncton, convertendo esta fonte de alimento numa forma que pode ser consumida por muitos animais de maiores dimensões, constituindo a maior parte da dieta destes. No Oceano Antártico, uma espécie, o krill antártico (Euphausia superba), perfaz uma biomassa superior a 500 milhões de toneladas,[4] aproximadamente o dobro da biomassa constituída pela totalidade dos seres humanos. Desta biomassa, mais de metade é consumida todos os anos por baleias, focas, pinguins, lulas e peixes, sendo substituída graças ao seu crescimento e reprodução. A maioria das espécies de krill efetuam grandes migrações verticais diárias, alimentando os predadores à superfície, durante a noite, e em águas mais profundas durante o dia.
A pesca comercial de krill é feita no Oceano Antártico e nas águas em redor do Japão. A produção global anual está estimada em 150 000 a 200 000 toneladas, na sua maioria pescadas no Mar de Scotia. Muito do krill pescado é utilizado na aquicultura e como alimento para peixes de aquários, como isca na pesca esportiva ou, ainda, na indústria farmacêutica. No Japão e na Rússia, o krill é também usado para o consumo humano, sendo conhecido no Japão como okiami (オキアミ?).
Taxonomia[editar | editar código-fonte]
A ordem Euphausiacea pertence ao filo Arthropoda, ao subfilo Crustacea, à classe Malacostraca, à subclasse Eumalacostraca e à superordem Eucarida; e divide-se em duas famílias. A família Bentheuphausiidae inclui apenas um gênero (Bentheuphausia), e uma espécie, Bentheuphausia amblyops (uma espécie de krill batipelágico que vive em águas abaixo dos 1 000 metros de profundidade, sendo considerada a mais primitiva das espécies de krill).[5] A outra família, Euphausiidae, é a maior, contendo dez gêneros diferentes (Euphausia, Meganyctiphanes, Nematobrachion, Nematoscelis, Nyctiphanes, Pseudeuphausia, Stylocheiron, Tessarabrachion, Thysanoessa e Thysanopoda),[6] num total de 85 espécies. Destes, o gênero Euphausia é o maior, com 31 espécies.[7]
| Cladograma proposto para a ordem Euphausiacea [6]. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cladograma baseado em Vereshchaka et al (2018) utilizando caracteres morfológicos e moleculares. |
As espécies mais bem conhecidas - sobretudo porque são objeto de pesca comercial - incluem o krill antártico (Euphausia superba), krill do pacífico (Euphausia pacifica) e o krill do norte (Meganyctiphanes norvegica).[8]
A presença de quilhas, espinhos e outras estruturas nas antenas é utilizada para taxonomia, assim como a forma dos olhos e a morfologia e número de pernas torácicas. A forma do petasma (estrutura relacionada à reprodução) no indivíduo adulto também é utilizado como caráter taxonômico.[9]
A identificação a nível de espécie geralmente não é exata, considerando que há poucos taxonomistas especialistas nessa ordem e a identificação geralmente é feita por caracteres morfológicos e distribuição biogeográfica. A identificação por DNA pode ser uma ferramenta para evitar equívocos e ajudar nos estudos de distribuição de populações, no entanto o gene usado deve ser escolhido com cuidado.[10]
Filogenia[editar | editar código-fonte]
Análises filogenéticas recentes baseadas em caracteres morfológicos e marcadores moleculares dão suporte à hipótese de que as famílias Bentheuphausidae e Euphausiidae, e consequentemente a ordem Euphausiacea, são monofiléticas. A distribuição das sinapomorfias nas filogenias mostram que alguns caracteres, tais como fotóforos e topologia dos órgãos copulatórios, são conservativos e apresentam pouca variação dentro dos clados.[6]
Atualmente considera-se que Euphausiacea e Decapoda sejam grupos irmãos pertencentes à superordem Eucarida, entretanto há outras hipóteses. As ordens Mysidacea, Anaspidacea ou Stomatopoda podem ser consideradas grupo irmão de Euphausiacea em certos estudos. Essa incerteza existe pois os estudos realizados até o momento utilizam um número muito pequeno de marcadores, o que os torna inconclusivos.[6]
Não há representantes fósseis que possam ser inseridos em Euphausiacea de maneira inequívoca; na verdade, a classe Malacostraca como um todo é pouco representada no registro fóssil quando comparada a outros grandes grupos de artrópodes. Dessa forma é muito complicado estabelecer a história evolutiva desse grupo com base apenas em fósseis, o que torna ainda mais difícil saber com certeza qual a posição de Euphausiacea em relação a outros grupos de crustáceos em uma filogenia.[11]
Distribuição[editar | editar código-fonte]
A distribuição das espécies de krill é, provavelmente, delimitada pela temperatura da água e pelas correntes oceânicas, mas também existem evidências de que há um impacto de eventos passados de especiação sobre a distribuição atual, principalmente do gênero Euphausia, o mais diversificado.[12]
O krill está presente em todos os oceanos; muitas espécies têm distribuição transoceânica e várias são endêmicas ou com distribuição nerítica restrita. Espécies do gênero Thysanoessa ocorrem tanto no Oceano Atlântico como no Oceano Pacífico, que abriga também Euphausia pacifica. O krill do norte ocorre no Atlântico, desde o norte até ao Mar Mediterrâneo. As quatro espécies do gênero Nyctiphanes são muito abundantes nas zonas de afloramento das correntes da Califórnia, Humboldt, Benguela e Canárias.[13][14][15]
Nas águas antárticas são conhecidas sete espécies:[16] uma do género Thysanoessa (T. macrura) e seis espécies do gênero Euphausia. O krill antártico (Euphausia superba) vive, geralmente, em profundidades acima dos 100 metros,[17] enquanto o krill do gelo (Euphausia crystallorophias) pode ser encontrado até à profundidade de 4 000 metros, vivendo geralmente a profundidades entre os 300 e os 600 metros.[18] Ambas as espécies são encontradas a latitudes mais altas que 55º S - com predominância de E. crystallorophias acima dos 74º S[19] e em bancos de gelo. Outras espécies conhecidas no Oceano Antártico são E. frigida, E. longirostris, E. triacantha, e E. vallentini.[20]

No Brasil, foi registrada uma alta abundância de Euphausia americana e Stylocheiron carinatum em estudos realizados no Rio de Janeiro, Bahia e Pernambuco[21]. Na costa sudeste brasileira, alguns grupos zooplanctônicos são relativamente bem estudados, no entanto, a fauna de grandes profundidades continua desconhecida para muitas regiões. Muitos estudos[22][23] descreveram a riqueza de espécies, distribuição e composição do mesozooplâncton, incluindo a comunidade de krill, da Bacia de Campos (Rio de Janeiro) em cinco massas d’água, desde a superfície até 2.300 metros de profundidade. Observou-se que a riqueza de espécies de krill diminui com o aumento da profundidade, obtendo os maiores valores na Água Central do Atlântico. Observou-se também que a riqueza de espécies no Oceano Atlântico Sudoeste é subestimada. Além disso, foram estudadas as comunidades de krill presentes entre Cabo Frio (Rio de Janeiro) e o Parcel de Abrolhos (Bahia), a partir da superfície até 200 metros de profundidade. Nessa área foi encontradas alta abundância de Euphausia americana, Stylocheiron carinatum e indivíduos em fase larval.[24]
O krill tem distribuição preferencialmente oceânica, e poucas espécies têm a capacidade de tolerar a frequente variação do ambiente costeiro.[25]
A maioria das espécies é epipelágica (vivem a até 200 metros de profundidade), mas há também espécies mesopelágicas (vivem entre 200 e 1000 metros de profundidade) e batipelágicas (vivem entre 1000 e 4000 metros de profundidade). Dentro das zonas anteriormente citadas, cada espécie tem preferência por uma determinada profundidade, e muitas delas realizam migração vertical.[2]
Ocasionalmente alguns indivíduos são encontrados na zona entremarés, o que é intrigante, sugerindo que eles podem se afastar bastante das concentrações populacionais. Um fenômeno que pode ocorrer é o encalhamento de milhões de indivíduos em praias, como registrado em Ramsey Bay na Ilha de Man em 1974.[26]
Anatomia e morfologia[editar | editar código-fonte]
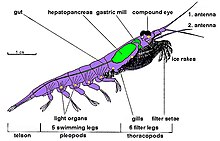
O krill é constituído por crustáceos com exosqueleto quitinoso dividido em três tagmas: a cabeça, o tórax e o abdômen, aparecendo os dois primeiros fundidos num só, formando o cefalotórax. O exosqueleto de muitas espécies de krill é transparente. Apresentam olhos compostos e algumas espécies conseguem adaptar-se a várias condições de luminosidade utilizando pigmentos bloqueadores de luz.[27] Possuem dois pares de antenas, com função sensorial, e oito pares de apêndices torácicos chamadas pereópodes (embora o sétimo e o oitavo par de pereópodes possam ser reduzidos em algumas espécies).[2] Esses apêndices incluem os membros que utilizam para se alimentarem (com o segundo par podendo ser raptorial)[2] e limparem. Adicionalmente, todas as espécies possuem apêndices natatórios designados pleópodes, cujo primeiro par é modificado em um petasma (estrutura reprodutiva relacionada à transferência de espermatóforos) nos machos, tornando fácil a distinção entre os sexos[26] . A maior parte do krill tem entre 1 a 2 cm de comprimento quando adultos, atingindo algumas espécies tamanhos da ordem dos 6 a 15 cm. A maior de entre as espécies de krill é a mesopelágica Thysanopoda spinicauda.[28] O krill pode ser facilmente distinguido de outros crustáceos como os camarões pelas suas guelras visíveis externamente.[29]


Excetuando a espécie Bentheuphausia amblyops, o krill é composto por espécies bioluminescentes, possuindo órgãos chamados fotóforos que são capazes de emitir luz. Há um fotóforo presente na região ventral de cada olho composto; dois pares de fotóforos no tórax (localizados nas bases do segundo e do sétimo par de apêndices); e quatro fotóforos na região ventral do abdômen (posicionados nas bases dos quatro primeiros pares de pleópodes).[26] A luz é produzida por uma reação de quimioluminescência catalisada por uma enzima, em que uma luciferina (um pigmento) é ativado pela enzima luciferase. Os estudos indicam que a luciferina de muitas espécies de krill é um tetrapirrol fluorescente similar, mas não igual à luciferina dos dinoflagelados.[30] Além disto, não é provável que o krill produza a luciferina, antes obtendo-a da sua dieta que contém dinoflagelados.[31] Os fotóforos do krill são órgãos complexos com capacidades de ampliação e focagem, como se fossem lentes, podendo rodar por meio de músculos.[32] A função exata destes órgãos é ainda desconhecida; podem desempenhar um papel no acasalamento, interação social ou na orientação. Alguns investigadores propõem que o krill utiliza a luz como uma forma de camuflagem por contra-iluminação para compensar a sua sombra contra o fundo de luz ambiente vinda de cima, diminuindo a probabilidade de serem vistos pelos predadores mais abaixo.[33][34] Dentro de crustáceos, os táxons que apresentam bioluminescência são Copepoda, Ostracoda e Malacostraca (Mysidacea, Amphipoda, Decapoda e Euphausiacea), sendo que essa característica surgiu independentemente nos diferentes grupos ao longo da evolução. A bioluminescência pode ser induzida por estímulos mecânicos, farmacológicos e luminosos, incluindo a luminescência de indivíduos próximos.[35]
Alimentação[editar | editar código-fonte]

Os eufausídeos são em sua maioria suspensívoros e onívoros, embora cada gênero apresente preferências alimentares, sendo capazes de selecionar a presa de acordo com a quantidade e qualidade de alimento disponível no ambiente,[36][37][38] além de avaliar o grau de competição interespecífica na comunidade. Alimentam-se principalmente de fitoplâncton e zooplâncton, mas existem também espécies que filtram o sedimento[2] e algumas espécies predadoras que consomem zooplâncton e larvas de peixes.[39]
Esses crustáceos possuem peças bucais com implementos para perfurar e moer, de modo que o alimento já chega à boca fragmentado.[26]
Como a maioria dos eufausídeos realiza filtração para captura de alimentos, é necessário que haja uma constante corrente d’água. Essa corrente é gerada pelos apêndices torácicos, que possuem numerosas cerdas formando um “pente” onde as partículas são filtradas. Outra maneira de alimentação é a predação de zooplâncton, formando uma cesta com as pernas torácicas bem próximas à parte ventral do tórax e da cabeça. Nesse caso, eles nadam devagar, movendo os apêndices lateralmente, conduzindo a água a sua frente para a cesta. Não foi registrado comportamento de caça ou de perseguição de presas nesses animais.[26]
Outra maneira combina esses dois métodos para que os animais se alimentem de sedimento na superfície. Nessa estratégia eles se movem para frente e para trás sobre a superfície e se alimentam da suspensão.[26]
Comportamento[editar | editar código-fonte]
A maioria das espécies de krill vive em grupos, com densidades e tamanhos bastante variáveis, dependendo da espécie e da região. No caso de Euphausia superba, existem registos de aglomerados com 10 000 a 30 000 indivíduos por metro cúbico.[40] A formação destes grandes aglomerados funciona como um mecanismo de defesa coletiva, confundindo os predadores menores que prefeririam selecionar as presas individualmente.

O krill segue, de um modo geral, uma migração vertical diurna. Passa o dia a profundidades maiores e ascende em direção à superfície durante a noite. Quanto maior for a profundidade em que se encontre, menor é a sua atividade,[41] aparentemente como forma de reduzir a possibilidade de encontros com predadores e de poupar energia. Algumas espécies (por exemplo, Euphausia superba, E. pacifica, E. hanseni, Pseudeuphausia latifrons, ou Thysanoessa spinifera) também formam aglomerados à superfície durante o dia para se alimentar e reproduzir, apesar de tal comportamento ser perigoso pois torna o krill muito vulnerável aos predadores.

As larvas são essencialmente organismos de superfície, especialmente a noite, sendo que elas podem migrar entre 20 e 60 metros verticalmente na coluna d’água ao longo do dia. Conforme elas se desenvolvem, tendem a ficar mais tempo em maior profundidade. A maior parte da espécies britânicas apresentam uma migração vertical regular, subindo de águas profundas (entre 150 e 200 metros) para a superfície no crepúsculo, onde permanecem até o amanhecer, quando voltam para o fundo.[26] Nas espécies antárticas, há evidências de controle comportamental pelo relógio circadiano, principalmente na primavera e no outono, quando um ciclo regular de noite e dia está presente. Nesse período, a migração vertical é sincronizada de modo a evitar a predação visual, portando os cardumes ficam próximos à superfície somente durante a noite. Nos períodos sem fotoperíodo regulado, o ritmo circadiano é observado em funções vitais para manter a homeostase, mas deixa de ter uma grande influência sobre a migração vertical e os picos diários de atividade.[42] Além do fotoperíodo, um fator que age como regulador do relógio circadiano nos eufausídeos, de forma que esses possam produzir respostas antecipadas à situações ambientais prováveis, é a intensidade luminosa da lua. Em Meganyctiphanes norvegica foi que observado que na noite seguinte a uma noite de lua cheia (onde houve alta intensidade luminosa), esses animais evitam se aproximar da superfície, de modo a não serem facilmente visualizados por predadores.[43]

Os aglomerados densos podem provocar um frenesim alimentar entre os predadores como peixes e pássaros, sobretudo perto da superfície onde as possibilidades de fuga do krill são limitadas. Quando perturbado, um aglomerado de krill dispersa, e já foram observados alguns indivíduos desfazendo-se do exosqueleto instantaneamente, deixando a exúvia para trás como engodo.[44]
O krill nada normalmente a uma velocidade de alguns centímetros por segundo (0,2 a 10 comprimentos corporais por segundo)[45], usando os pleópodes como meio de propulsão. As suas migrações maiores estão sujeitas às correntes oceânicas. Quando em perigo, exibem um comportamento de fuga típico de alguns crustáceos: batendo os apêndices caudais (telson e urópodes), deslocam-se para trás através da água de modo relativamente rápido, atingindo velocidades no intervalo de 10 a 27 comprimentos corporais por segundo[45] o que para um tipo de krill de grandes dimensões como E. superba, significa cerca de 0,8 m/s.[46] A sua capacidade natatória levou muitos investigadores a classificar o krill adulto como forma de vida micro-nectônica, ou seja, pequenos animais capazes de se moverem individualmente contra correntes (fracas). As formas larvares do krill são geralmente consideradas zooplâncton.[47]
Ecologia e ciclo de vida[editar | editar código-fonte]
O krill constitui um importante elemento da cadeia alimentar. O krill antártico alimenta-se diretamente do fitoplâncton, convertendo energia de produção primária numa forma mais apropriada ao consumo por animais maiores que não podem alimentar-se diretamente das minúsculas algas, mas que são capazes de alimentar-se de krill. Algumas espécies como o krill do norte têm menos fitoplâncton à sua disposição e caçam copépodes e zooplâncton de maiores dimensões. São muitos os animais que se alimentam de krill, desde pequenos peixes ou pinguins até focas e mesmo baleias.[48]
As perturbações dos ecossistemas que resultam na diminuição de uma população de krill podem ter efeitos de grande alcance. Durante uma explosão de cocolitóforos no Mar de Bering em 1988,[49] por exemplo, a concentração de diatomáceas diminuiu na área afetada. Porém, o krill não pode alimentar-se dos cocolitóforos (menores) e, consequentemente, a população de krill (sobretudo de E. pacifica) diminuiu drasticamente naquela região. Esta diminuição, por seu lado, afetou outras espécies: as populações de cagarras e pardelas decresceram, pensa-se até que esta teria sido uma das razões que teria levado o salmão a não regressar aos rios do Alasca ocidental nessa temporada.[50]
Existem outros fatores além dos predadores e da disponibilidade de alimento que também podem influenciar a taxa de mortalidade nas populações de krill. Existem vários endoparasitóides ciliados unicelulares do gênero Collinia que podem infectar diferentes espécies de krill, causando mortalidade maciça nas populações afetadas. Tais doenças têm sido relatadas para Thysanoessa inermis no Mar de Bering, mas também para E. pacifica, Thysanoessa spinifera, e T. gregaria ao largo da costa pacífica da América do Norte.[51] Existem também alguns ectoparasitas da família Dajidae (isópodes epicarídeos) que afetam o krill (bem como camarões e misidáceos); um destes parasitas é o Oculophryxus bicaulis encontrado no krill das espécies Stylocheiron affine e Stylocheiron longicorne. Agarra-se ao pedúnculo ocular do animal sugando-lhe o sangue da cabeça; crê-se que iniba a reprodução do hospedeiro, pois apenas se encontrou este parasita em animais imaturos.[52]
O krill também exerce um importante papel no sequestro do carbono orgânico que se concentra nas camadas oceânicas superiores. Já foi demonstrado que as fezes e exúvias que afundam são muito importantes para promover um fluxo descendente do carbono. Por exemplo, o sequestro de carbono por Euphausia superba supera o carbono produzido por 35 milhões de carros, o que é bastante significativo, considerando o papel do carbono nas mudanças climáticas que ocorrem atualmente.[53]
Ciclo de vida[editar | editar código-fonte]

O ciclo de vida geral do krill tem sido objeto de vários estudos, efetuados com várias espécies e é por essa razão relativamente bem compreendido, apesar de existirem pequenas variações de pormenor de espécie para espécie.[54][55] Quando o krill eclode dos ovos, passa por vários estágios larvares sucessivos: náuplio, pseudometanáuplio, metanáuplio, caliptopsis e furcilia. Cada um destes estágios larvares subdivide-se em vários sub-estágios. O estágio pseudometanáuplio é exclusivo das espécies que depositam os ovos em bolsas ovígeras. As larvas crescem e fazem várias mudas durante este processo, substituindo o exosqueleto rígido sempre que necessitam aumentar as dimensões corporais. Até ao estágio de metanáuplio, inclusive, as larvas alimentam-se das reservas do vitelo. É apenas nos estágios de caliptopsis, que se formam a boca e o trato digestivo, começando então a alimentar-se de fitoplâncton, o que implica que por esta altura as larvas já tenham atingido a zona fótica, constituída pelas camadas superiores do oceano em que vivem as algas. Durante os estágios de furcilia, são adicionados segmentos com pares de pleópodes, começando pelos segmentos mais frontais. Cada par torna-se funcional na muda seguinte. O número de segmentos adicionados durante qualquer um dos estágios de furcilia pode variar numa mesma espécie, dependendo das condições ambientais.[56]
Após o último dos estágios de furcilia, o krill apresenta-se já com uma forma similar à de um adulto, mas é ainda imaturo. Eufausídeos tendem a alcançar a maturidade sexual quando chegam à aproximadamente metade do seu tamanho corpóreo total, e tendo alcançado entre 30 e 60% da sua expectativa de vida. Em muitas espécies, a maturidade das fêmeas pode ser retardada, ultrapassando o ponto de 60% da expectativa de vida. Por exemplo, em T. inermis na Islândia, as fêmeas maturam com aproximadamente dois anos, bem próximo do final de sua vida, e uma pequena porcentagem sobrevive o suficiente para se reproduzir uma segunda temporada. A duração da vida e a idade de maturação reprodutiva nem sempre é a mesma para machos e fêmeas. Quando isso ocorre, os machos têm vida mais curta. No caso da população de E. pacifica, as fêmeas vivem cerca de 2 a 3 anos, enquanto os machos vivem menos de dois anos. Voltando ao exemplo de T. inermis, os machos costumam maturar um ano antes das fêmeas, mas também há casos em que eles maturam na mesma idade. A temporada de desova geralmente não coincide entre espécies que coexistem em uma mesma área.[57]
Durante a época de acasalamento, que varia com a espécie e com o clima, o macho deposita um espermatóforo na abertura genital (télico) da fêmea com o auxílio de uma estrutura denominada petasma, uma modificação do primeiro par de pleópodes. O petasma é importante para garantir o correto posicionamento do espermatóforo, pois esses animais geralmente copulam em ambientes turbulentos.[58] As fêmeas podem carregar vários milhares de ovos no ovário, podendo constituir um terço da massa corporal do animal.[59] O krill pode produzir múltiplas ninhadas numa só estação, com períodos entre cada uma da ordem de dias.[60][61]

Há duas formas de produção das ninhadas entre as espécies de krill. As 57 espécies dos gêneros Bentheuphausia, Euphausia, Meganyctiphanes, Thysanoessa e Thysanopoda fazem-no dispersando os ovos. A fêmea liberta os ovos na água, onde geralmente afundam e são dispersos, ficando totalmente desacompanhados. Estas espécies geralmente eclodem no estágio 1 de náuplio, mas descobriu-se recentemente que por vezes o fazem como metanáuplios ou até como caliptopsis.[62] As restantes 29 espécies dos demais gêneros criam as ninhadas numa bolsa que a fêmea carrega consigo agarrada aos pares mais posteriores de pereópodes até à sua eclosão no estágio de metanáuplio, apesar de algumas espécies como Nematoscelis difficilis, poderem eclodir como náuplios ou pseudometanáuplios.[63]
Algumas espécies de krill das latitudes elevadas, podem viver até mais de seis anos (por exemplo, Euphausia superba); outras, como a espécie de latitudes médias Euphausia pacifica, vivem apenas dois anos.[47] A longevidade das espécies tropicais e subtropicais é ainda menor, por exemplo, Nyctiphanes simplex, vive apenas seis a oito meses.[64]
Mudas[editar | editar código-fonte]
As mudas ocorrem sempre que os animais precisam aumentar de tamanho, sendo que o exosqueleto constitui-se numa barreira física para tal. Os animais mais jovens, em crescimento mais rápido, procedem mais frequentemente a mudas que os animais maiores e mais velhos. A frequência das mudas varia muito de espécie para espécie e é, mesmo dentro de uma mesma espécie, sujeita a vários fatores externos como a latitude, temperatura da água ou a disponibilidade de alimento. A espécie subtropical Nyctiphanes simplex, por exemplo, tem um período entre mudas que varia dos dois aos sete dias; as larvas mudam em média a cada três dias enquanto que os juvenis e os adultos o fazem, em média, a cada cinco dias. Para E. superba nos mares antárticos, os períodos entre mudas variam dos 9 aos 28 dias, dependendo da temperatura (-1 °C a 4 °C). No caso de Meganyctiphanes norvegica do Mar do Norte, o período entre mudas varia também entre os 9 e os 28 dias mas a temperaturas entre os 2,5 °C e os 15 °C.[65] Em Euphausia superba, Meganyctiphanes norvegica, Euphausia pacifica e Thysanoessa inermis foi observado que o período entre as mudas é inversamente proporcional à temperatura e diretamente proporcional ao tamanho do indivíduo, indicando que em maiores temperaturas as mudas ocorrem mais frequentemente. [9] A taxa de crescimento não é uniforme ao longo do ano, tendendo a ser maior no final da primavera, verão e outono do que no inverno. Como em muitos crustáceos, as fêmeas tendem a crescer mais rapidamente e atingir maiores tamanhos corpóreos que os machos.[3]
Sabe-se ainda que E. superba é capaz de reduzir o seu tamanho corporal quando o alimento escasseia, pois é mais fácil para esses animais suprir suas necessidades nutricionais quando são menores.[66] Este comportamento também foi observado com E. pacifica como adaptação a temperaturas da água anormalmente altas e é postulado que ocorra com outras espécies de krill de zonas temperadas.[67]
Impacto das atividades humanas[editar | editar código-fonte]

Sendo organismos predominantemente de zonas frias, o aquecimento global pode ter um grande efeito sobre o krill, podendo causar alterações na performance fisiológica, distribuição e comportamento desses.[68] A acidificação dos oceanos pode impactar os estágios larvais e pós-larvais, nos quais a regulação ácido-base influencia o crescimento somático, reprodução, fitness e comportamento. O impacto direto do aumento da incidência de radiação utltravioleta na população de krill pode ocorrer por danos genéticos,[69][70] efeitos fisiológicos[71] [72] ou por meio de reações comportamentais.[73] Efeitos indiretos podem surgir devido a declínios na produtividade primária causada pelo aumento da radiação UV e alterações na estrutura de teias alimentares. Outro problema causado pela atividade humana é a presença de microplásticos nos corpos d’água. Devido à seu tamanho, os microplásticos podem ser ingeridos por diversos organismos planctônicos marinhos, sendo que a ingestão por eufausídeos já foi observada.[74] A ingestão ocorre principalmente por organismos filtradores devido ao uso indiscriminado de partículas em suspensão.[75] Também há evidências de que estes organismos conseguem quebrar os microplásticos ingeridos em partículas menores, sendo esta produção biológica de nanoplásticos de grande efeito, já que essas partículas ficam disponíveis para animais menores e são transmitidos ao longo da cadeia trófica.[76] [77]
O krill como recurso econômico[editar | editar código-fonte]

O krill tem sido capturado para a alimentação humana (okiami) e animal desde o século XIX, ou mesmo mais cedo no Japão. A pesca em grande escala desenvolveu-se apenas no final da década de 1960 e início da de 1970, e atualmente é uma atividade desenvolvida apenas em águas antárticas e nos mares ao redor do Japão. Historicamente, os países com maiores capturas de krill foram o Japão e a União Soviética e, após a dissolução desta, a Ucrânia e a Rússia. O pico das capturas de krill ocorreu em 1983 com mais de 528 000 toneladas apenas no Oceano Antártico (93% das quais pertenceram à União Soviética). Em 1993 ocorreram dois acontecimentos que conduziram à redução drástica da pesca do krill: a Rússia abandonou as suas operações e a Comissão para a Conservação dos Recursos Vivos Marinhos Antárticos (CCRMVA) definiu quotas máximas de captura para uma exploração sustentável do krill antártico. Atualmente, os maiores pescadores de krill do antártico são o Japão, seguido pela Coreia do Sul, Ucrânia e Polônia.[47] A captura anual de krill nas águas antárticas parece ter estabilizado por volta das 100 000 toneladas, o que representa cerca de um quinto da quota estabelecida pela CCRMVA.[78] O principal fator limitante é, provavelmente, o elevado custo das operações nos mares antárticos. As capturas efetuadas próximo do Japão parecem estar estacionárias, com cerca de 70 000 toneladas.[79]
Quanto ao uso do krill na alimentação animal, há muitos estudos atestando seu valor nutricional nas dietas de peixes cultivados. O krill pode ser utilizado como fonte de proteína, energia e carotenoides na aquicultura. Os carotenoides são encontrados em altas quantidades no krill. Estima-se que mais de 50% da pesca japonesa de E. pacifica é usada como ingrediente na alimentação de peixes tais como Pagrus major, Oncorhynchus kisutch, Salmo gairdnerii, Seriola quinqueradiata e outros, para que sua carne e pele adquiram uma coloração avermelhada, bastante apreciada no Japão. Sabe-se também que o krill tem um efeito positivo no estímulo à alimentação de peixes como Pagrurus major, provavelmente pela presença dos aminoácidos prolina, glicina e glicosamina. Igualmente sabe-se que uma dieta baseada no krill promove o crescimento em algumas espécies de peixe, provavelmente pela presença de esteroides. Além dos efeitos anteriormente citados, E. pacifica contribui para o aumento de resistência à doenças em salmões criados em viveiros, o que foi atribuído ao estímulo antecipado do desenvolvimento do sistema imune quando o krill é utilizado como fonte alimentar. O valor nutritivo de Nyctiphanes australis foi recentemente avaliado considerando seu possível uso na aquicultura. Foi analisado que N. australis contém em média 52% de proteínas e mais de 9,5% de lipídios, notáveis pela presença de altas quantidades de ácidos graxos insaturados.[80]
Os eufausídeos têm sido cada vez mais utilizados como suplementos para promover a saúde cardiovascular e aumentar a longevidade.[81][82] Uma empresa espanhola atualmente comercializa um preparado congelado de krill como suplemento alimentar alegando que o krill possui muitas propriedades desejáveis tais como alta concentração de ômega 3, quantidade moderada de calorias, alto valor nutricional e é de fácil digestão. O concentrado de krill antártico têm sido indicado como suplemento alimentar durante a gravidez, lactação, menopausa, durante o crescimento, após a realização de procedimentos cirúrgicos, na prevenção do câncer, durante a radioterapia e quimioterapia, e no tratamento de síndromes de imunodeficiência e vários distúrbios nutricionais.[80]
O krill apresenta um sabor mais forte que o do camarão. As barras de krill foram comercializadas no Chile com razoável sucesso. No entanto, o krill picado não foi bem aceito na Rússia, Polônia e África do Sul.[1] Para o consumo em massa e para elaboração de produtos preparados industrialmente, o krill tem que ser descascado, pois, os exosqueletos contêm fluoretos, que são tóxicos em concentrações elevadas.[83] Por conta dessa toxicidade esforços têm sido feitos para manufaturar produtos com baixa quantidade de fluoretos. A pasta de krill produzida pelas metodologias tradicionais e concentrados de krill processado com ácidos e bases, têm sido produzidos com baixas concentrações de fluoretos pela lavagem com ácidos orgânicos ou simplesmente com água, tornando-os seguros para o consumo humano.[80]
O krill também tem sido promovido como uma possível fonte de quitina e quitosana, de forma que realiza-se uma pesquisa considerável sobre a extração de quitina a partir do krill antártico. Considera-se que entre 2,4 e 2,7% de peso seco do krill antártico seja constituído por quitina. Quitina e quitosana apresentam uma ampla variedade de potenciais de uso, que vão do uso em membranas de alto-falantes à aplicações na redução do colesterol. Dessa forma essa aplicação do krill apresenta um potencial lucrativo no futuro.[80]
Referências
- ↑ a b Lloyd, J & Mitchinson, J (2006). The Book of General Ignorance. [S.l.]: Faber & Faber
- ↑ a b c d e f Ruppert, Edward E.; Barnes, Robert D. (2005). Zoologia dos invertebrados : uma abordagem funcional-evolutiva 7. ed ed. Sao Paulo: Roca. ISBN 8572415718. OCLC 61150684
- ↑ a b Nichols, C. Reid. (2009). Encyclopedia of marine science. New York: Facts on File. ISBN 9781438118819. OCLC 299156884
- ↑ Nicol, S., Endo, Y. (1997). Fisheries Technical Paper 367: Krill Fisheries of the World. [S.l.]: FAO
- ↑ Brinton, E.: The distribution of Pacific euphausiids., Bull. Scripps Inst. Oceanogr. 8(2), pp. 51 – 270; 1962.
- ↑ a b c d Vereshchaka, Alexander L.; Kulagin, Dmitry N.; Lunina, Anastasia A. (10 de maio de 2018). «A phylogenetic study of krill (Crustacea: Euphausiacea) reveals new taxa and co-evolution of morphological characters». Cladistics. 35 (2): 150–172. ISSN 0748-3007. doi:10.1111/cla.12239
- ↑ Taxonomy of Euphausiacea Arquivado em 17 de novembro de 2004, no Wayback Machine. do ITIS.
- ↑ S. Nicol; Y. Endo (1999). «Krill fisheries: Development, management and ecosystem implications». Aquatic Living Resources. 12 (2): 105–120. doi:10.1016/S0990-7440(99)80020-5
- ↑ a b «SEA: Sociedad Entomológica Aragonesa | http://www.sea-entomologia.org». sea-entomologia.org. Consultado em 22 de junho de 2019 Ligação externa em
|titulo=(ajuda) - ↑ Bucklin, Ann; Wiebe, Peter H.; Smolenack, Sara B.; Copley, Nancy J.; Beaudet, Jason G.; Bonner, Kaitlin G.; Färber-Lorda, Jaime; Pierson, James J. (1 de janeiro de 2007). «DNA barcodes for species identification of euphausiids (Euphausiacea, Crustacea)». Journal of Plankton Research. 29 (6): 483–493. ISSN 1464-3774. doi:10.1093/plankt/fbm031
- ↑ «Euphausiacea - an overview | ScienceDirect Topics». www.sciencedirect.com. Consultado em 22 de junho de 2019
- ↑ Jarman, Simon N.; Elliott, Nicholas G.; Nicol, Stephen; McMinn, Andrew (2000). «Molecular phylogenetics of circumglobal Euphausia species (Euphausiacea: Crustacea)». Canadian Journal of Fisheries and Aquatic Sciences. 57 (S3): 51–58. ISSN 1205-7533. doi:10.1139/cjfas-57-s3-51
- ↑ Volker Siegel (2011). V. Siegel, ed. «Nyctiphanes Sars, 1883». World Euphausiacea database. World Register of Marine Species. Consultado em 18 de junho de 2011
- ↑ J. Mauchline; L. R. Fisher (1969). The Biology of Euphausiids. Col: Advances in Marine Biology. 7. [S.l.]: Academic Press. ISBN 978-7-7708-3615-2
- ↑ Jaime Gómez-Gutiérrez; Carlos J. Robinson (2005). «Embryonic, early larval development time, hatching mechanism and interbrood period of the sac-spawning euphausiid Nyctiphanes simplex Hansen». Journal of Plankton Research. 27 (3): 279–295. doi:10.1093/plankt/fbi003
- ↑ Brueggeman, P.: Euphausia crystallorophias Arquivado em 13 de julho de 2007, no Wayback Machine., in Underwater Field Guide to Ross Island & McMurdo Sound, Antarctica.
- ↑ Krill no MarineBio.
- ↑ Kirkwood, J.A.: A Guide to the Euphausiacea of the Southern Ocean. Australian National Antarctic Research Expedition; Australia Dept of Science and Technology, Antarctic Division; 1984.
- ↑ Sala, A.; Azzali, M.; Russo, A.: Krill of the Ross Sea: distribution, abundance and demography of Euphausia superba and Euphausia crystallorophias during the Italian Antarctic Expedition (January-February 2000) Arquivado em 16 de fevereiro de 2005, no Wayback Machine., Scientia Marina 66(2), pp. 123 – 133. 2002.
- ↑ Hosie, G. W.; Fukuchi, M.; Kawaguchi, S.: Development of the Southern Ocean Continuous Plankton Recorder survey Arquivado em 27 de setembro de 2007, no Wayback Machine., Progress in Oceanography 58, pp. 263 – 283, 2003.
- ↑ Universidade Federal de Santa Catarina Freire, Andrea Santarosa Menezes, Barbara Santos (26 de outubro de 2012). Distribuição de euphausiacea (Crustacea) (krill) no Arquipélago de São Pedro e São Paulo. [S.l.]: Florianópolis, SC. OCLC 815923013
- ↑ Lopes, Rubens M. (setembro de 2007). «Marine zooplankton studies in Brazil: a brief evaluation and perspectives». Anais da Academia Brasileira de Ciências. 79 (3): 369–379. ISSN 0001-3765. doi:10.1590/s0001-37652007000300002
- ↑ Bonecker, Sérgio L.C.; Araujo, Adriana V. de; Carvalho, Pedro F. de; Dias, Cristina de O.; Fernandes, Luiz F.L.; Migotto, Alvaro E.; Oliveira, Otto M.P. de (outubro de 2014). «Horizontal and vertical distribution of mesozooplankton species richness and composition down to 2,300 m in the southwest Atlantic Ocean». Zoologia (Curitiba). 31 (5): 445–462. ISSN 1984-4670. doi:10.1590/s1984-46702014000500005
- ↑ Freire, A. S. (1991). «Variação espaço-temporal do zooplâncton e das espécies de Euphausiacea (Crustacea) ao largo da costa Leste do Brasil (18º-23ºS, 38º-41ºW)». Dissertação: Universidade de São Paulo
- ↑ Gibbons, M. J. (1993). «Vertical migration and feeding of Euphausia lucens at two 72 h stations in the southern Benguela upwelling region». Marine Biology. 116 (2): 257–268. ISSN 0025-3162. doi:10.1007/bf00350016
- ↑ a b c d e f g Mauchline, J. (John), 1933-; Estuarine and Brackish-water Sciences Association. (1984). Euphausiid, Stomatopod and Leptostracan crustaceans : keys and notes for the identification of the species. London: Published for the Linnean Society of London and the Estuarine and Brackish-Water Sciences Association by E.J Brill. ISBN 9004074716. OCLC 12093787
- ↑ Gaten, E.: Meganyctiphanes norvegica Arquivado em 3 de setembro de 2007, no Wayback Machine.; acedido em 15 de Junho 2005.
- ↑ Brinton, E.: Thysanopoda spinicauda, a new bathypelagic giant euphausiid crustacean, with comparative notes on T. cornuta and T. egregia. J. Wash. Acad. Sci. 43, pp. 408 – 412; 1953.
- ↑ «Euphausiacea». Tasmanian Aquaculture & Fisheries Institute. Consultado em 6 de junho de 2010. Arquivado do original em 30 de setembro de 2009
- ↑ Shimomura, O.: The roles of the two highly unstable components F and P involved in the bioluminescence of euphausiid shrimps, Jour. Biolumin. Chemilumin. 10(2), pp. 91 – 101, 1995.
- ↑ Dunlap J. C.; Hastings, J. W.; Shimomura, O.: Crossreactivity between the Light-Emitting Systems of Distantly Related Organisms: Novel Type of Light-Emitting Compound, Proc. Natl. Acad. Sci. USA, 77(3), pp. 1394&nbasp;– 1397, March 1980.
- ↑ Herring, P. J.; Widder, E. A.: Bioluminescence in Plankton and Nekton Arquivado em 2012-08-02 na Archive.today; in Steele, J. H., Thorpe, S. A.; Turekian, K. K. (eds.): Encyclopedia of Ocean Science, Vol. 1, pp. 308 – 317. Academic Press, San Diego, 2001.
- ↑ Lindsay, S. M.; Latz, M. I.: Experimental Evidence for Luminescent Countershading by some Euphausiid Crustaceans Arquivado em 23 de outubro de 2005, no Wayback Machine., Apresentação na reunião de ciências aquáticas da American Society of Limnology and Oceanography (ASLO), Santa Fe, 1999.
- ↑ Johnsen, S.: The Red and the Black: Bioluminescence and the Color of Animals in the Deep Sea, Integr. Comp. Biol. 45, pp. 234 – 246, 2005.
- ↑ Forest, Jacques, 1920-2012.; Vaupel Klein, J. C. von.; Chaigneau, J. (2004-<2015>). The Crustacea : treatise on zoology - anatomy, taxonomy, biology : revised and updated from the Traité de zoologie. Leiden: Brill. ISBN 9004129189. OCLC 57366266 Verifique data em:
|data=(ajuda) - ↑ Mauchline, J. (20 de agosto de 2009). «Feeding appendages of the Euphausiacea (Crustacea)». Journal of Zoology. 153 (1): 1–43. ISSN 0952-8369. doi:10.1111/j.1469-7998.1967.tb05029.x
- ↑ Pillar, S. C.; Stuart, V.; Barange, M.; Gibbons, M. J. (junho de 1992). «Community structure and trophic ecology of euphausiids in the Benguela ecosystem». South African Journal of Marine Science. 12 (1): 393–409. ISSN 0257-7615. doi:10.2989/02577619209504714
- ↑ Werner, Thorsten; Buchholz, Friedrich (19 de abril de 2013). «Diel vertical migration behaviour in Euphausiids of the northern Benguela current: seasonal adaptations to food availability and strong gradients of temperature and oxygen». Journal of Plankton Research. 35 (4): 792–812. ISSN 1464-3774. doi:10.1093/plankt/fbt030
- ↑ Olav Saether; Trond Erling Ellingsen; Viggo Mohr (1986). «Lipids of North Atlantic krill» (PDF). Journal of Lipid Research. 27 (3): 274–285. PMID 3734626
- ↑ Kils, U.; Marshall, P.: Der Krill, wie er schwimmt und frisst - neue Einsichten mit neuen Methoden Arquivado em 11 de dezembro de 2008, no Wayback Machine.. In Hempel, I.; Hempel, G.: Biologie der Polarmeere - Erlebnisse und Ergebnisse Fischer 1995; pp. 201–210. ISBN 3-334-60950-2.
- ↑ Jaffe, J.S.; Ohmann, M. D.; De Robertis, A.: Sonar estimates of daytime activity levels of Euphausia pacifica in Saanich Inlet Arquivado em 27 de setembro de 2007, no Wayback Machine., Can. J. Fish. Aquat. Sci. 56, pp. 2000 – 2010; 1999.
- ↑ Universidade Federal de Santa Catarina Freire, Andrea Santarosa Menezes, Barbara Santos (26 de outubro de 2012). Distribuição de euphausiacea (Crustacea) (krill) no Arquipélago de São Pedro e São Paulo. [S.l.]: Florianópolis, SC. OCLC 815923013
- ↑ Tarling, G (1 de agosto de 1999). «The effect of lunar eclipse on the vertical migration behaviour of Meganyctiphanes norvegica (Crustacea: Euphausiacea) in the Ligurian Sea». Journal of Plankton Research. 21 (8): 1475–1488. ISSN 1464-3774. doi:10.1093/plankt/21.8.1475
- ↑ Howard, D.: Krill in Cordell Bank National Marine Sanctuary, NOAA. Acedido em 15 de Junho 2005.
- ↑ a b Ignatyev, S. M.: Functional-Morphological Adaptations of the Krill to Active Swimming Arquivado em 7 de outubro de 2007, no Wayback Machine., Poster on the 2nd International Symposium on Krill, Santa Cruz, Califórnia, EUA; 23 de Agosto–27 de Agosto de 1999.
- ↑ Kils, U.: Swimming behavior, Swimming Performance and Energy Balance of Antarctic Krill Euphausia superba. Arquivado em 11 de dezembro de 2008, no Wayback Machine. BIOMASS Scientific Series 3, BIOMASS Research Series, 1–122; 1982.
- ↑ a b c Nicol, S.; Endo, Y.: Krill Fisheries of the World, FAO Fisheries Technical Paper 367; 1997.
- ↑ M. J. Schramm (10 de outubro de 2007). «Tiny Krill: Giants in Marine Food Chain». NOAA National Marine Sanctuary Program. Consultado em 4 de junho de 2010
- ↑ Weier, J.: Changing Currents color the Bering Sea a new shade of Blue, NOAA Earth Observatory, 1999. Last accessed 15 de Junho de 2005.
- ↑ Brodeur, R.D.; Kruse, G.H.; et al.: Draft Report of the FOCI International Workshop on Recent Conditions in the Bering Sea, pp. 22 – 26; NOAA 1998.
- ↑ Roach, J.: Scientists Discover Mystery Krill Killer, National Geographic News, 17 de Julho de 2003. See also the base article: Gómez-Gutiérrez, J.; Peterson, W. T.; De Robertis, A.; Brodeur, R. D.: Mass Mortality of Krill Caused by Parasitoid Ciliates, Science Vol 301; issue 5631, pp. 339f; 18 de Julho de 2003.
- ↑ Shields, J.D.; Gómez-Gutiérrez, J.: Oculophryxus bicaulis, a new genus and species of dajid isopod parasitic on the euphausiid Stylocheiron affine Hansen, Int'l J. for Parasitology 26(3), pp. 261 – 268; 1996.
- ↑ Tarling, Geraint A.; Johnson, Magnus L. (fevereiro de 2006). «Satiation gives krill that sinking feeling». Current Biology. 16 (3): R83–R84. ISSN 0960-9822. doi:10.1016/j.cub.2006.01.044
- ↑ Gurney, R.: Larvae of decapod crustacea. Royal Society Publ. 129; London 1942.
- ↑ Mauchline, J.; Fisher, L.R.: The biology of euphausiids. Adv. Mar. Biol. 7; 1969.
- ↑ Knight, M. D.: Variation in Larval Morphogenesis within the Southern California Bight Population of Euphausia pacifica from Winter through Summer, 1977–1978 Arquivado em 2 de outubro de 2005, no Wayback Machine., CalCOFI Report Vol. XXV, 1984.
- ↑ Everson, Inigo, Hrsg. (2008). Krill Biology, Ecology and Fisheries. [S.l.]: John Wiley & Sons. ISBN 9780470999486. OCLC 899175373
- ↑ Lunina, Anastasia; Vereshchaka, Alexander (março de 2017). «The role of the male copulatory organs in the colonization of the pelagic by shrimp-like eucarids». Deep Sea Research Part II: Topical Studies in Oceanography. 137: 327–334. ISSN 0967-0645. doi:10.1016/j.dsr2.2016.11.018
- ↑ Gómez-Gutiérrez, J.: Personal communication Arquivado em 9 de setembro de 2007, no Wayback Machine.; 2002.
- ↑ Gómez-Gutiérrez, Jaime; Robinson, Carlos J. (2005). «Embryonic, early larval development time, hatching mechanism and interbrood period of the sac-spawning euphausiid Nyctiphanes simplex Hansen» (PDF). Journal of Plankton Research. 27 (3): 279-295. doi:10.1093/plankt/fbi003
- ↑ Cuzin-Roudy, Janine (2000). «Seasonal reproduction, multiple spawning, and fecundity in northern krill, Meganyctiphanes norvegica, and Antarctic krill, Euphausia superba». Canadian Journal of Fisheries and Aquatic Sciences. 57 (S3): 6-15. doi:10.1139/f00-165
- ↑ Gómez-Gutiérrez, J.: Hatching mechanism and delayed hatching of the eggs of three broadcast spawning euphausiid species under laboratory conditions[ligação inativa], J. of Plankton Research 24(12), pp. 1265 – 1276, 2002. Has many images of the earliest development stages of krill.
- ↑ Brinton, E.; Ohman, M. D.; Townsend, A. W.; Knight, M. D.; Bridgeman, A. L.: Euphausiids of the World Ocean[ligação inativa], World Biodiversity Database CD-ROM Series; Springer Verlag, 2000. ISBN 3-540-14673-3.
- ↑ Gómez-Gutiérrez, J.: Euphausiids; acedido em 16 de Junho 2005.
- ↑ Buchholz, F.: Experiments on the physiology of Southern and Northern krill, Euphausia superba and Meganyctiphanes norvegica, with emphasis on moult and growth – a review, Marine and Freshwater Behaviour and Physiology 36(4), pp. 229 – 247, 2003.
- ↑ Hyoung-Chul Shin; Nicol, S.: Using the relationship between eye diameter and body length to detect the effects of long-term starvation on Antarctic krill Euphausia superba. Mar Ecol Progress Series (MEPS) 239:157–167; 2002.
- ↑ Marinovic, B.; Mangel, M.: Krill can shrink as an ecological adaptation to temporarily unfavourable environments, Ecology Letters 2, pp. 338 – 343; Blackwell Science, 1999.
- ↑ Flores, H; Atkinson, A; Kawaguchi, S; Krafft, Ba; Milinevsky, G; Nicol, S; Reiss, C; Tarling, Ga; Werner, R (3 de julho de 2012). «Impact of climate change on Antarctic krill». Marine Ecology Progress Series (em inglês). 458: 1–19. ISSN 0171-8630. doi:10.3354/meps09831
- ↑ Jarman, Simon; Elliott, Nicholas; Nicol, Stephen; McMinn, Andrew; Newman, Stuart (março de 1999). «The base composition of the krill genome and its potential susceptibility to damage by UV-B». Antarctic Science. 11 (1): 23–26. ISSN 0954-1020. doi:10.1017/s0954102099000048
- ↑ Dahms, Hans-U; Dobretsov, Sergey; Lee, Jae-Seong (maio de 2011). «Effects of UV radiation on marine ectotherms in polar regions». Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology. 153 (4): 363–371. ISSN 1532-0456. doi:10.1016/j.cbpc.2011.01.004
- ↑ Newman, Stuart J.; Nicol, Stephen; Ritz, David; Marchant, Harvey (24 de junho de 1999). «Susceptibility of Antarctic krill ( Euphausia superba Dana) to ultraviolet radiation». Polar Biology. 22 (1): 50–55. ISSN 0722-4060. doi:10.1007/s003000050389
- ↑ Newman, Stuart J; Dunlap, Walter C; Nicol, Stephen; Ritz, David (dezembro de 2000). «Antarctic krill (Euphausia superba) acquire a UV-absorbing mycosporine-like amino acid from dietary algae». Journal of Experimental Marine Biology and Ecology. 255 (1): 93–110. ISSN 0022-0981. doi:10.1016/s0022-0981(00)00293-8
- ↑ Newman, Stuart J.; Ritz, David; Nicol, Stephen (dezembro de 2003). «Behavioural reactions of Antarctic krill (Euphausia superba Dana) to ultraviolet and photosynthetically active radiation». Journal of Experimental Marine Biology and Ecology. 297 (2): 203–217. ISSN 0022-0981. doi:10.1016/j.jembe.2003.07.007
- ↑ Van Cauwenberghe, Lisbeth; Janssen, Colin R. (outubro de 2014). «Microplastics in bivalves cultured for human consumption». Environmental Pollution. 193: 65–70. ISSN 0269-7491. doi:10.1016/j.envpol.2014.06.010
- ↑ Cole, Matthew; Lindeque, Pennie; Fileman, Elaine; Halsband, Claudia; Goodhead, Rhys; Moger, Julian; Galloway, Tamara S. (6 de junho de 2013). «Microplastic Ingestion by Zooplankton». Environmental Science & Technology. 47 (12): 6646–6655. ISSN 0013-936X. doi:10.1021/es400663f
- ↑ Dawson, Amanda L.; Kawaguchi, So; King, Catherine K.; Townsend, Kathy A.; King, Robert; Huston, Wilhelmina M.; Bengtson Nash, Susan M. (8 de março de 2018). «Turning microplastics into nanoplastics through digestive fragmentation by Antarctic krill». Nature Communications. 9 (1). ISSN 2041-1723. doi:10.1038/s41467-018-03465-9
- ↑ Botterell, Zara L.R.; Beaumont, Nicola; Dorrington, Tarquin; Steinke, Michael; Thompson, Richard C.; Lindeque, Penelope K. (fevereiro de 2019). «Bioavailability and effects of microplastics on marine zooplankton: A review». Environmental Pollution. 245: 98–110. ISSN 0269-7491. doi:10.1016/j.envpol.2018.10.065
- ↑ Harvested species: Krill (Eupausia superba) Arquivado em 17 de julho de 2005, no Wayback Machine.. Acedido 20 de Junho 2005.
- ↑ S. Nicol; J. Foster (2003). «Recent trends in the fishery for Antarctic krill». Aquatic Living Resources. 16: 42–45. doi:10.1016/S0990-7440(03)00004-4
- ↑ a b c d «5. PRODUCTS». www.fao.org. Consultado em 23 de junho de 2019
- ↑ Nicol, Stephen; Forster, Ian; Spence, John. «Products Derived from Krill». Oxford, UK: Blackwell Science Ltd: 262–283. ISBN 9780470999493
- ↑ Nicol, S.; Clarke, J.; Romaine, S.J.; Kawaguchi, S.; Williams, G.; Hosie, G.W. (fevereiro de 2008). «Krill (Euphausia superba) abundance and Adélie penguin (Pygoscelis adeliae) breeding performance in the waters off the Béchervaise Island colony, East Antarctica in 2 years with contrasting ecological conditions». Deep Sea Research Part II: Topical Studies in Oceanography. 55 (3-4): 540–557. ISSN 0967-0645. doi:10.1016/j.dsr2.2007.11.013
- ↑ Haberman, K: Answers to miscellaneous questions about krill, 26 de Fevereiro de 1997. Acedido em 17 de Junho 2005.
Bibliografia adicional[editar | editar código-fonte]
- Boden, Brian P.; Johnson, Martin W.; Brinton, Edward: Euphausiacea (Crustacea) of the North Pacific. Bulletin of the Scripps Institution of Oceanography. Volume 6 Number 8, 1955.
- Brinton, Edward: The distribution of Pacific euphausiids. Bulletin of the Scripps Institution of Oceanography, Volume 8, no. 2, pages 51–269. 1962.
- Brinton, Edward: Euphausiids of Southeast Asian waters. Naga Report volume 4, part 5. La Jolla : University of California, Scripps Institution of Oceanography, 1975.
- Conway, D. V. P.; White, R. G.; Hugues-Dit-Ciles, J.; Galienne, C. P.; Robins, D. B.: Guide to the coastal and surface zooplankton of the South-Western Indian Ocean, Order Euphausiacea, Occasional Publication of the Marine Biological Association of the United Kingdom No. 15, Plymouth, UK, 2003.
- Everson, I. (ed.): Krill: biology, ecology and fisheries. Oxford, Blackwell Science; 2000. ISBN 0-632-05565-0.
- Mauchline, J.: Euphausiacea: Adults, Conseil International pour l'Exploration de la Mer, 1971.
- Mauchline, J.: Euphausiacea: Larvae, Conseil International pour l'Exploration de la Mer, 1971.

