Bicarbonato de sódio: diferenças entre revisões
m traduzindo nome/parâmetro de predefinições do inglês para português usando JavaScript |
|||
| Linha 1: | Linha 1: | ||
{{sem-fontes|data=junho de 2009}} |
|||
{{Info/Química |
{{Info/Química |
||
| Name = Bicarbonato de sódio |
| Name = Bicarbonato de sódio |
||
Revisão das 12h41min de 16 de abril de 2017
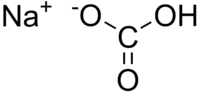
O bicarbonato de sódio (nome comercial) ou hidrogenocarbonato de sódio (IUPAC) ou carbonato ácido de sódio, é composto da fórmula NaHCO3, é um sólido cristalino de cor branca, solúvel em água, com um sabor ligeiramente alcalino.
Aplicações
Usa-se como antiácido, para tratar a acidez do estômago porque ele tem o poder de neutralizar os excessos do ácido clorídrico do suco gástrico. Em algumas formulações farmacêuticas, é misturado aos ácidos cítrico e tartárico, ambos sólidos.[1]
Devido à capacidade do bicarbonato de sódio libertar dióxido de carbono gasoso (CO2), também é muito usado nas receitas de culinária como agente levedante ("fermentos químicos"), para ser utilizado no crescimento das massas de pães, bolos e biscoitos durante o cozimento no forno, em especial quando misturado ao ácido tartárico, e na produção de bebidas gasosas (refrigerantes).
Outras utilizações do bicarbonato de sódio são como reagente de laboratório, na eletrodeposição de ouro e platina, em curtumes, no tratamento da lã e da seda, na nutrição de animais, na cerâmica, para a preservação da manteiga e da madeira e é um dos componentes dos talcos e desodorantes. A forma anidra do composto usa-se para absorver umidade e odores.
É utilizado na fabricação de extintores de incêndio com produção de espuma. No interior destes extintores encontram-se NaHCO3 sólido mantido em compartimento separado de uma solução de ácido sulfúrico (H2SO4). Quando estes extintores são virados, o que causa seu acionamento, o NaHCO3 e o H2SO4 se misturam e reagem, com liberação de CO2, propiciando pressão dentro do vaso, que causa sua ejeção e produzindo a espuma. Esses extintores são inadequados para uso em chamas em equipamentos e instalações elétricas, pois seu meio aquoso e salino conduz corrente elétrica, causando curtos-circuitos.
As reações envolvidas são:
- 2 NaHCO3 + H2SO4 → Na2SO4 + 2 H2CO3
- H2CO3 → H2O + CO2(g)
É um dos componentes da droga chamada crack, onde entra como um aditivo à pasta de cocaína. É utilizado no tratamento radiológico de contaminados por Urânio.
Também é utilizado nas fraudes na produção de leite, pois a substância tem a capacidade de alcalizar o leite observado quando inicia o processo de deterioração. [2]
Reações químicas
Quando o bicarbonato de sódio é misturado com um ácido, liberta dióxido de carbono e água. Exemplos:
Bicarbonato de sódio reage com bases tais como o hidróxido de sódio para formar carbonatos:
- NaHCO3 + NaOH → Na2CO3 + H2O
Quando aquecido, ao atingir a temperatura de 80 °C, decompõe-se de acordo com a reação:[3]
- 2 NaHCO3 → Na2CO3 + H2O + CO2
Ver também
Referências
- ↑ “bicarbonato de sodio“ Revisado.
- ↑ Julio Cezar Foschini Lisbôa e Monique Bossolani, EXPERIÊNCIAS LÁCTEAS (1997), Disponível em: http://qnesc.sbq.org.br/online/qnesc06/exper1.pdf
- ↑ «The Many Practical Uses of Baking Soda in the Kitchen». About.com Food. Consultado em 22 de janeiro de 2017