Tabela periódica: diferenças entre revisões
+correções semiautomáticas (v0.49/3.1.37) |
+tradução do inglês +ajustes +correções semiautomáticas (v0.49/3.1.37) |
||
| Linha 68: | Linha 68: | ||
Regiões específicas da tabela periódica podem ser referidas como '''blocos''' em reconhecimento da sequência na qual as camadas eletrônicas dos elementos são preenchidas. Cada bloco é nomeado de acordo com a subcamada no qual o local fictício do "último" elétron.<ref name="Gray12"/><ref group = "notas">Existe uma inconsistência e algumas irregularidades nesta convenção. Assim, o hélio é mostrando no bloco p ao invés do bloco s, e (por exemplo) a subcamada d no bloco d é na verdade preenchida quando o grupo 11 é alcançado, ao invés do grupo 12.</ref> O bloco s compreende os dois primeiros grupos (metais alcalinos e alcalinos terrosos) assim como o hidrogênio e o hélio. O bloco p comprrende os últimos seis grupos, que são os grupos 13 ao 18 na numeração da IUPAC e contém, entre outros elemento, todos os [[metalóide]]s. O bloco d compreende os grupos 3 ao 12 e contém todos os [[metais de transição]]. O bloco f, às vezes mostrado abaixo do resto da tabela, não tem numeração de grupo e comprrende os lantanídeos e actinídeos.<ref>{{citar livro |ultimo=Jones |primeiro=C. |titulo=d- and f-block chemistry |ano=2002 |publicado=J. Wiley & Sons |location=New York |isbn=978-0-471-22476-1|oclc=300468713 |página=2}}</ref> |
Regiões específicas da tabela periódica podem ser referidas como '''blocos''' em reconhecimento da sequência na qual as camadas eletrônicas dos elementos são preenchidas. Cada bloco é nomeado de acordo com a subcamada no qual o local fictício do "último" elétron.<ref name="Gray12"/><ref group = "notas">Existe uma inconsistência e algumas irregularidades nesta convenção. Assim, o hélio é mostrando no bloco p ao invés do bloco s, e (por exemplo) a subcamada d no bloco d é na verdade preenchida quando o grupo 11 é alcançado, ao invés do grupo 12.</ref> O bloco s compreende os dois primeiros grupos (metais alcalinos e alcalinos terrosos) assim como o hidrogênio e o hélio. O bloco p comprrende os últimos seis grupos, que são os grupos 13 ao 18 na numeração da IUPAC e contém, entre outros elemento, todos os [[metalóide]]s. O bloco d compreende os grupos 3 ao 12 e contém todos os [[metais de transição]]. O bloco f, às vezes mostrado abaixo do resto da tabela, não tem numeração de grupo e comprrende os lantanídeos e actinídeos.<ref>{{citar livro |ultimo=Jones |primeiro=C. |titulo=d- and f-block chemistry |ano=2002 |publicado=J. Wiley & Sons |location=New York |isbn=978-0-471-22476-1|oclc=300468713 |página=2}}</ref> |
||
=== Metais, metalóides e ametais === |
|||
De acordo com as propriedades físicas e químicas, os elementos podem ser classificados em três categorias maiores de [[metal|metais]], [[metalóides]] e [[ametais]]. Os metais são geralmente brilhantes, sólidos altamente condutores que formam ligas com um ou outro sal como compostos iônicos com ametais (exceto os gases nobres). A maioria dos ametais são coloridos e gases isolantes incolores; ametais que formam compostos com outros ametais apresentam ligações covalentes. Entre metais e não metais estão os metalóides, que possuem propriedades mistas ou intermediárias.<ref>{{citar livro |ultimo1=Silberberg|primeiro=M. S.|titulo=Chemistry: The molecular nature of matter and change|ano=2006|página=536|publicado=McGraw-Hill|location=New York|edição=4th|isbn=0-07-111658-3}}</ref> |
|||
O metal e ametal pode ser ainda classificado em subcategorias que demonstram uma graduação da propriedade metálica para a não-metálica, quando indo da esquerda para a direita no período. Os metais são subdivididos em metais alcalinos, metais alcalinos terrosos, lantanídeos e actinídeos, através dos metais de transição, e terminando nos metais pós transição que são fracos quimicamente e fisicamente. Os ametais são simplesmente divididos nos [[Ametal#Ametais poliatômicos|ametais poliatômicos]], que são essencialmente os ametais; e os gases nobres monoatômicos, que são não-metais e praticamente inertes. Também são conhecidos grupos especializados tais como, por exemplo, os [[metais refratários]] e os [[metais nobres]] que são subconjuntos dos metais de transição<ref>{{citar livro |ultimo1=Manson|primeiro1=S. S.|ultimo2=Halford|primeiro2=G. R.|titulo=Fatigue and durability of structural materials|ano=2006|página=376|publicado=ASM International|location=Materials Park, Ohio|isbn=0-87170-825-6}}</ref> e são ocasionalmente destacados.<ref>{{citar livro |ultimo1=Bullinger|primeiro=H-J.|titulo=Technology guide: Principles, applications, trends|ano=2009|página=8|publicado=Springer-Verlag|location=Berlin|isbn=978-3-540-88545-0}}</ref> |
|||
A alocação dos elementos em categorias ou subcategorias baseada nas propriedades compartilhadas é imperfeita. Existe um espectro de propriedades dentro de cada categoria e não é difícil encontrar sobreposições nos limites, conforme acontece com a maioria dos esquemas de classificação.<ref>{{citar livro |ultimo=Jones|primeiro=B. W.|titulo=Pluto: Sentinel of the outer solar system|ano=2010|publicado=Cambridge University Press|location=Cambridge|isbn=978-0-521-19436-5|páginas=169–71}}</ref> O berílio, por exemplo, é classificado como um alcalino terroso embora sua química anfotérica e tendência a formar compostos covalentes seja característica dos metais pós-transição. O radônio ainda é classificado como um ametal e gás nobre embora possua química catiônica que é uma característica metálica. São possíveis outros esquemas de classificação tais como a divisão dos elementos nas [[Classificação de Goldschmidt|categorias de ocorrência mineralógica]] ou nas [[Tabela periódica (estrutura cristalina)|estruturas cristalinas]]. A categorização dos elementos desta maneira iniciou em 1869 quando Hinrichs<ref>{{citar periódico |ultimo=Hinrichs |primeiro=G. D. |titulo=On the classification and the atomic weights of the so-called chemical elements, with particular reference to Stas's determinations|jornal=Proceedings of the American Association for the Advancement of Science |ano=1869|volume=18 |número=5|url=https://books.google.com/books?id=vj1SAAAAcAAJ|páginas=112–124}}</ref> escreveu que uma simples linha de limite poderia ser desenhada na tabela periódica para mostrar elementos que tem propriedades similares tais como os metais e ametais, ou os elementos gasosos. |
|||
== Propriedades periódicas == |
|||
{{VT|Propriedades periódicas}} |
|||
=== Configuração eletrônica === |
|||
{{VT|Configuração eletrônica}} |
|||
[[Imagem:Klechkovski rule.svg|upright=0.9|thumb|esquerda|Ordem aproximada em que as camadas e subcamadas são arranjadas pelo nível de energia de acordo com o [[princípio de Aufbau]]]] |
|||
A configuração eletrônica ou organização dos elétrons orbitando átomos neutros mostra um padrão recorrente ou periodicidade. Os elétrons ocupam uma série de [[níveis eletrônicos]] (numerados nível 1, nível 2, e assim em diante). Cada nível consiste de uma ou mais [[Nível eletrônico#Subnível|subníveis]] (nomeados s, p, d, f e g). Conforme o [[número atômico]] aumenta, os elétrons progressivamente ocupam estes níves e subníveis de acordo com o [[princípio de Aufbau]] ou regra de ordenamento energético, conforme demonstrado no diagrama. A configuração eletrônica para o [[neônio]], por exemplo, é 1s² 2s² 2p<sup>6</sup>. Com o número atômico de dez, o neônio tem dois elétrons no primeiro nível e oito no segundo nível—dois ocupam o subnível s e seis o subnível p. Em termos de tabela periódica, a primeira vez que um elétron ocupa um novo nível corresponde ao início de um novo período, estas posições sendo ocupadas pelo hidrogênio e os metais alcalinos.<ref name=Myers>{{citar livro |ultimo=Myers|primeiro=R.|titulo=The basics of chemistry|ano=2003|páginas=61–67|publicado=Greenwood Publishing Group|location=Westport, CT|isbn=0-313-31664-3}}</ref><ref name=chang2>{{citar livro |ultimo=Chang|primeiro=R.|titulo=Chemistry|ano=2002|publicado=McGraw-Hill|location=New York|edição=7|isbn=0-07-112072-6|páginas=289–310; 340–42}}</ref> |
|||
[[Imagem:Periodic trends.svg|upright=1.35|thumb|direita|Propriedades da tabela periódica (as setas indicam aumento)]] |
|||
Uma vez que as propriedades de um elementos são na maioria das vezes determinada pela configuração eletrônica, da mesma forma as propriedades dos elementos mostram um padrão recorrente ou periódico com alguns mostrados no diagrama abaixo para o raio atômico, energia de ionização e afinidade eletrônica. Foi esta periodicidade das propriedades, manifestação que [[Johann Wolfgang Döbereiner|foi bem observada antes]] da [[Niels Bohr|teoria atual ser estabelecida]], que levou a formulação da lei periódica (as propriedades dos elementos recorrem em intervalos variados) e a formulação das primeiras tabelas periódicas.<ref name=Myers/><ref name=chang2/> |
|||
=== Raio atômico === |
|||
{{VT|Raio atômico}} |
|||
[[Imagem:Empirical atomic radius trends.png|thumb|upright=1.35|esquerda|Número atômico plotado contra o raio atômicos<ref group="notas">Os gases nobres, astatino, frâncio e todos os elementos mais pesados que o [[Amerício]] foram deixados de fora uma vez que não há dados disponíveis para eles.</ref>]] |
|||
O raio atômico varia de um modo previsível e explicável através da tabela periódica. Por exemplo, o raio geralmente diminui ao longo de cada período da tabela, a partir dos metais alcalinos para os gases nobres; e aumenta dentro do grupo de cima para baixo. O raio aumenta significativamente entre o gás nobre no fim de cada período e o metal alcalino no período seguinte. Esta propriedade (e de várias outras propriedades físicas e químicas dos elementos) pode ser explicada pela teoria da configuração eletrônica do átomo; elas fornecem evidências importantes para o desenvolvimento e confirmação da [[teoria quântica]].<ref name="Greenwood27">Greenwood & Earnshaw, p. 27</ref> |
|||
Os elétrons no subnível 4f, que são progressivamente preenchidos a partir do [[Cério]] (elemento 58) até o [[Itérbio]] (elemento 70), não são efetivo na blindagem do aumento da carga nuclear para os subníveis posteriores. Os elementos subsequentes aos lantanídeos têm raio atômico que são menores do que o esperado e são quase idênticos ao raio atômico do elemento imediatamente acima destes.<ref name="Jolly_contract"> |
|||
{{citar livro |
|||
|ultimo1=Jolly |primeiro=W. L. |
|||
|ano=1991 |
|||
|titulo=Modern Inorganic Chemistry |
|||
|página=22 |edição=2nd |
|||
|publicado=[[McGraw-Hill]] |
|||
|isbn=978-0-07-112651-9 |
|||
}}</ref> Deste modo o [[Háfnio]] tem praticamente o raio atômico (e química) do [[zircônio]], e o [[tântalo]] do [[nióbio]] e assim por diante. Este fenômeno é conhecido como [[contração dos lantanídeos]]. O efeito desta contração é visível até a [[platina]] (elemento 78), no qual após este é mascarado por [[efeitos relativísticos]] conhecidos como o [[efeito do par inerte]].<ref name="Greenwood28">Greenwood & Earnshaw, p. 28</ref> A [[contração do bloco d]], que é um efeito similar entre o bloco d e p, é menos pronunciado do que a contração dos lantanídeos mas ocorre pelo mesmo motivo.<ref name="Jolly_contract"/> |
|||
== Ver também == |
== Ver também == |
||
Revisão das 18h49min de 17 de julho de 2016
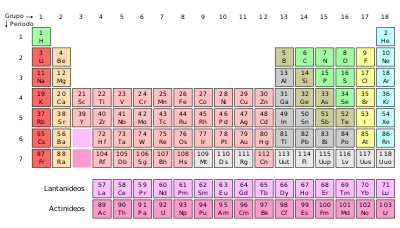
A tabela periódica é uma disposição sistemática dos elementos químicos ordenados por seus números atômicos (número de prótons, configuração eletrônica, e recorrência das propriedades periódicas. Este ordenamento mostra tendências periódicas , tais como elementos com comportamentos similares na mesma coluna. Também mostra quatro blocos retangulares com propriedades químicas similares. Em geral, dentro de uma linha (período) os elementos são metálicos na esquerda e não-metálicos na direita.
As linhas da tabela são denominadas períodos; as colunas são denominadas grupos. Seis grupos têm nomes específicos além de uma numeração: por exemplo o grupo 17 são os halogênios; e o grupo 18 são os gases nobres. A tabela periódica pode ser usada para deduzir as relações entre as propriedades dos elementos, e predizer as propriedades dos novos elementos ainda não descobertos ou sintetizados. A tabela fornece uma estrutura útil para analisar o comportamento químico, e é amplamente utilizada na química e em outras ciências.
O químico Dmitri Mendeleev publicou em 1869 a primeira versão amplamente reconhecida da tabela. Seu trabalho no desenvolvimento da tabela demonstra as tendências periódicas dos elementos até então conhecidos e também prediz algumas propriedades dos elementos ainda não descobertos que iriam preencher espaços vazios em sua tabela. A maioria de suas previsões se mostrou correta quando os elementos em questão foram descobertos posteriormente. Desde então a tabela de Mendeleev tem sido expandida e refinada com a descoberta ou sínteses de novos elementos e o desenvolvimento de modelos teóricos para explicar o comportamento químico.
Todos os elementos do número atômico 1 (hidrogênio) ao 118 (Ununóctio) foram descobertos ou sintetizados, sendo as adições mais recentes (elementos 113, 115, 117 e 118) confirmadas pela IUPAC em dezembro de 2015.[1] Os primeiros 94 elementos existem naturalmente, embora alguns sejam encontrados somente em quantidades de trações e foram sintetizados em laboratório antes de serem encontrados na natureza..[notas 1] Elementos com o número atômico de 95 ao 118 foram somente sintetizados em laboratório ou reatores nucleares.[2] Têm sido buscada a síntese de elementos com números atômicos maiores. Vários elementos radionuclídeos sintéticos ou que ocorrem naturalmente também têm sido produzidos em laboratórios.
Visão geral
Cada elemento químico tem um número atômico único (Z) representando o número de prótons em seu núcleo atômico[notas 2] A maioria dos elementos tem um número diferente de nêutrons entre átomos diferentes, com estas variações sendo referidas como isótopos. Por exemplo, o carbono tem três isótopos naturais: todos têm seis prótons e a maior parte dos átomos existentes do elemento têm seis nêutrons, mas aproximadamente um porcento tem sete nêutrons e uma pequena fração tem oito nêutrons. Os isótopos não são separados na tabela periódica; eles são agrupados sob um único elemento. Elementos sem isótopos estáveis têm a massa atômica de seus isótopos mais estáveis, onde tais massas são mostradas entre parênteses.[3]
Na tabela periódica padrão, os elementos estão listados em ordem crescente do número atômico (o número de prótons no núcleo atômico). Uma nova linha (período) é iniciada quando uma nova camada eletrônica tem o seu primeiro elétron. Colunas (grupo) são determinadas pela configuração eletrônica do átomo; elementos com o mesmo número de elétrons em um subcamada estão na mesma coluna (e.g. oxigênio e selênio são da mesma coluna porque ambos têm quatro elétrons na camada p mais externa). Elementos com propriedades químicas semelhantes normalmente caem no mesmo grupo da tabela periódica, embora no bloco f, e para alguns do bloco d, os elementos no mesmo período também tendem a ter propriedades similares. Assim, é relativamente fácil predizer as propriedades químicas de um elementos se são conhecidas as propriedades dos elementos à sua volta.[4]
Até 2016, a tabela periódica contém 118 elementos confirmados, do elemento 1 (hidrogênio) até o 118 (ununoctium). Os elementos 113, 115, 117 e 118 foram confirmados oficialmente pela União Internacional de Química Pura e Aplicada (IUPAC) em dezembro de 2015. Os nomes propostos, nihônio (Nh), moscóvio (Mc), tennessino (Ts) e oganessono (Og) respectivamente, foram anunciados pela IUPAC em junho de 2016.[5][6][7] Estes nomes não serão aprovados formalmente até o final da consulta pública de cinco meses que termina em novembro de 2016.[8] Até lá, eles são identificados formalmente pelo seu número atômico (e.g., "elemento 113"), ou pelo seu nome sistemático provisório ("unúntrio", symbol "Uut").[9]
Os primeiros 94 elementos ocorrem naturalmente; os 24 remanescentes, do Amerício ao Ununóctio (95-118) ocorrem apenas quando sintetizados em laboratórios. Dos 94 elementos que ocorrem naturalmente, 84 são elementos primordiais e 10 ocorrem somente a partir do decaimento radioativo dos elementos primordiais.[2] Nenhum elemento mais pesado que o Einstênio (elemento 99) foi observado em quantidades macroscópicas na forma pura, e nem o Astatino (elemento 85); o Frâncio (elemento 87) foi somente fotografado na forma de luz emitida em quantidades microscópicas (300.000 átomos).[10]
História

Em 1789, Antoine Lavoisier publicou uma lista de 33 elementos químicos. Embora Lavoisier tenha agrupado os elementos em substâncias simples, metálicas, não metálicas e salificáveis ou terrosas,[11][12] químicos passaram o século seguinte à procura de um esquema de construção mais precisa. Em 1829, Johann Wolfgang Döbereiner observou que muitos dos elementos poderiam ser agrupados em tríades (grupos de três) com base em suas propriedades químicas. Lítio, sódio e potássio, por exemplo, foram agrupados como sendo metais reativos frágeis. Döbereiner observou também que, quando organizados por peso atômico, o segundo membro de cada tríade tinha aproximadamente a média do primeiro e do terceiro.[13] Isso ficou conhecido como a lei das tríades.[14] O químico alemão Leopold Gmelin trabalhou com esse sistema e por volta de 1843 ele tinha identificado dez tríades, três grupos de quatro, e um grupo de cinco. Jean Baptiste Dumas publicou um trabalho em 1857 descrevendo as relações entre os diversos grupos de metais. Embora houvesse diversos químicos capazes de identificar relações entre pequenos grupos de elementos, não havia ainda um esquema capaz de abranger todos eles.[11][13]
Em 1869, o também químico alemão Julius Lothar Meyer publicou uma tabela com os 49 elementos conhecidos organizados pela valência, conceito desenvolvido por August Kekulé seis anos antes. A tabela revelava que os elementos com propriedades semelhantes frequentemente partilhavam a mesma valência.[15] O químico inglês John Newlands publicou uma série de trabalhos em 1863 e 1866 que descreviam sua tentativa de classificar os elementos: quando listados em ordem crescente de peso atômico, semelhantes propriedades físicas e químicas retornavam em intervalos de oito, que ele comparou a oitavas de músicas.[16][17] Esta lei das oitavas, no entanto, foi ridicularizada por seus contemporâneos.[18]

O professor de química russo Dmitri Ivanovich Mendeleiev e Julius Lothar Meyer publicaram de forma independente as suas tabelas periódicas em 1869 e 1870, respectivamente. Ambos construíram suas tabelas de forma semelhante: listando os elementos de uma linha ou coluna em ordem de peso atômico e iniciando uma nova linha ou coluna quando as características dos elementos começavam a se repetir.[19] O sucesso da tabela de Mendeleiev surgiu a partir de duas decisões que ele tomou: a primeira foi a de deixar lacunas na tabela quando parecia que o elemento correspondente ainda não tinha sido descoberto.[20] Mendeleiev não fora o primeiro químico a fazê-lo, mas ele deu um passo adiante ao usar as tendências em sua tabela periódica para predizer as propriedades desses elementos em falta, como o gálio e o germânio.[21] A segunda decisão foi ocasionalmente ignorar a ordem sugerida pelos pesos atômicos e alternar elementos adjacentes, tais como o cobalto e o níquel, para melhor classificá-los em famílias químicas. Com o desenvolvimento das teorias de estrutura atômica, tornou-se aparente que Mendeleiev tinha, inadvertidamente, listado os elementos por ordem crescente de número atômico.[22]
Com o desenvolvimento das modernas teorias mecânica quânticas de configuração de elétrons dentro de átomos, ficou evidente que cada linha (ou período) na tabela correspondia ao preenchimento de um nível quântico de elétrons. Na tabela original de Mendeleiev, cada período tinha o mesmo comprimento. No entanto, como os átomos maiores têm subníveis, tabelas modernas têm períodos cada vez mais longos na parte de baixo.[23]
Em 1913, através do trabalho do físico inglês Henry G. J. Moseley, que mediu as frequências de linhas espectrais específicas de raios X de um número de 40 elementos contra a carga do núcleo (Z), pôde-se identificar algumas inversões na ordem correta da tabela periódica, sendo, portanto, o primeiro dos trabalhos experimentais a ratificar o modelo atômico de Bohr. O trabalho de Moseley serviu para dirimir um erro em que a química se encontrava na época por desconhecimento: até então os elementos eram ordenados pela massa atômica e não pelo número atômico.[12][24]
Nos anos que se seguiram após a publicação da tabela periódica de Mendeleiev, as lacunas que ele deixou foram preenchidas quando os químicos descobriram mais elementos químicos. O último elemento de ocorrência natural a ser descoberto foi o frâncio (referido por Mendeleiev como eka-césio) em 1939.[25] A tabela periódica também cresceu com a adição de elementos sintéticos e transurânicos. O primeiro elemento transurânico a ser descoberto foi o netúnio, que foi formado pelo bombardeamento de urânio com nêutrons num ciclotron em 1939.[26]
Estrutura da tabela periódica
| Grupo # | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Período | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
71 Lu |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | ||
| 7 | 87 Fr |
88 Ra |
103 Lr |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | ||
| 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb | |||||||
| 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No | |||||||
Legenda da tabela
| Metais | Semimetais | Não metais | Desconhecidos | |||||||
| Metais alcalinos2 |
Metais alcalinoterrosos2 | Metal de transição | Metais de transição2 | Metais representativos | Não metais | Halogênios3 | Gases nobres3 | |||
| Lantanídios1, 2 | Actinídios1, 2 | |||||||||
| Cor do número atômico: Estado físico (CNTP): | preto: sólido | verde: líquido | vermelho: gás | cinza: desconhecido |
| Cor e estilo da borda indica incidência na natureza: | elemento primordial | decaimento | elemento sintético |
A tabela periódica relaciona os elementos em linhas denominadas períodos e colunas chamadas grupos ou famílias, em ordem crescente de seus números atômicos (Z).
Grupo
Um grupo ou família é uma coluna vertical na tabela periódica. Os grupos normalmente têm mais tendências periódicas significativas do que os períodos ou blocos, explicados abaixo. A teoria da mecânica quântica moderna da estrutura atômica explica a tendência no grupo pela proposição que elementos dentro do mesmo grupo normalmente têm a mesma configuração eletrônica em sua camada de valência.[27] Consequentemente, elementos do mesmo grupo tendem a ter uma química compartilhada e exibir uma clara tendência em suas propriedades com o aumento do número atômico.[28] Entretanto, em algumas partes da tabela periódica, tais como no bloco d e bloco f, as similaridades horizontais podem ser tão importantes quanto, ou mais pronunciadas do que, as similaridades verticais.[29][30][31]
Sob a convenção internacional de nomenclatura, os grupos são numerados de 1 a 18 a partir da coluna à esquerda (os metais alcalinos) para à direita (os gases nobres).[32] Alguns dos grupos possuem nomes triviais não sistemáticos, conforme na tabela abaixo, embora raramente sejam utilizados. Os grupos do 3 ao 10 não possuem nomes triviais e são referidos simplesmente pelo número do grupo ou pelo nome do primeiro elemento do grupo (e.g. grupo do Escândio para os elementos do Grupo 3, uma vez que eles mostram menos similaridades e/ou tendências verticais.[32]
Elementos no mesmo grupo tendem a mostrar padrões no raio atômico, energia de ionização e eletronegatividade. Do topo para baixo, o raio atômico dos elementos aumenta. Uma vez que existem mais níveis energéticos preenchidos, a camada de valência eletrônica está mais afastada do núcleo. A partir do topo, cada elemento tem uma energia de ionização menor porque é mais fácil remover um elétron pois estão conectados com menos firmeza. De modo similar, a partir do topo, um grupo tem a eletronegatividade menor devido ao aumento da distância entre os elétrons de valência e o núcleo.[33] Porém, existem exceções nestas tendências como por exemplo nos elementos do Grupo 11 no qual a eletronegatividade aumenta a partir do topo dentro do grupo.[34]
Períodos
Um período é uma linha horizontal da tabela periódica. Embora os grupos tenham propriedades periódicas mais significativas, existem regiões onde a tendência horizontal é mais significativa do que a vertical, tais como no bloco f, onde os lantanídeos e actinídeos formam duas séries de grupos de elementos horizontais substanciais.[35]
Os elementos no mesmo período apresentam tendências no raio atômico, energia de ionização, afinidade eletrônica e eletronegatividade. Da esquerda para a direita, através do período, o raio atômico normalmente diminui. Isto acontece porque a cada elemento é adicionado um próton e um elétron, o que trás o elétron para mais perto do núcleo.[36] Esta diminuição do raio atômico também provoca o aumento da energia de ionização quando movendo da esquerda para a direita no período. Quanto mais firmemente conectado aos seus elétrons, mais energia é necessária para removê-los. A eletronegatividade aumenta da mesma maneira que a energia de ionização por causa da atração exercida nos elétrons pelo núcleo.[33] A afinidade eletrônica também possui uma leve tendência ao longo do período. Os metais à esquerda no período normalmente possuem uma afinidade eletrônica menor que os não metais à direita no período, com exceção dos gases nobres.[37]
Blocos

Regiões específicas da tabela periódica podem ser referidas como blocos em reconhecimento da sequência na qual as camadas eletrônicas dos elementos são preenchidas. Cada bloco é nomeado de acordo com a subcamada no qual o local fictício do "último" elétron.[38][notas 3] O bloco s compreende os dois primeiros grupos (metais alcalinos e alcalinos terrosos) assim como o hidrogênio e o hélio. O bloco p comprrende os últimos seis grupos, que são os grupos 13 ao 18 na numeração da IUPAC e contém, entre outros elemento, todos os metalóides. O bloco d compreende os grupos 3 ao 12 e contém todos os metais de transição. O bloco f, às vezes mostrado abaixo do resto da tabela, não tem numeração de grupo e comprrende os lantanídeos e actinídeos.[39]
Metais, metalóides e ametais
De acordo com as propriedades físicas e químicas, os elementos podem ser classificados em três categorias maiores de metais, metalóides e ametais. Os metais são geralmente brilhantes, sólidos altamente condutores que formam ligas com um ou outro sal como compostos iônicos com ametais (exceto os gases nobres). A maioria dos ametais são coloridos e gases isolantes incolores; ametais que formam compostos com outros ametais apresentam ligações covalentes. Entre metais e não metais estão os metalóides, que possuem propriedades mistas ou intermediárias.[40]
O metal e ametal pode ser ainda classificado em subcategorias que demonstram uma graduação da propriedade metálica para a não-metálica, quando indo da esquerda para a direita no período. Os metais são subdivididos em metais alcalinos, metais alcalinos terrosos, lantanídeos e actinídeos, através dos metais de transição, e terminando nos metais pós transição que são fracos quimicamente e fisicamente. Os ametais são simplesmente divididos nos ametais poliatômicos, que são essencialmente os ametais; e os gases nobres monoatômicos, que são não-metais e praticamente inertes. Também são conhecidos grupos especializados tais como, por exemplo, os metais refratários e os metais nobres que são subconjuntos dos metais de transição[41] e são ocasionalmente destacados.[42]
A alocação dos elementos em categorias ou subcategorias baseada nas propriedades compartilhadas é imperfeita. Existe um espectro de propriedades dentro de cada categoria e não é difícil encontrar sobreposições nos limites, conforme acontece com a maioria dos esquemas de classificação.[43] O berílio, por exemplo, é classificado como um alcalino terroso embora sua química anfotérica e tendência a formar compostos covalentes seja característica dos metais pós-transição. O radônio ainda é classificado como um ametal e gás nobre embora possua química catiônica que é uma característica metálica. São possíveis outros esquemas de classificação tais como a divisão dos elementos nas categorias de ocorrência mineralógica ou nas estruturas cristalinas. A categorização dos elementos desta maneira iniciou em 1869 quando Hinrichs[44] escreveu que uma simples linha de limite poderia ser desenhada na tabela periódica para mostrar elementos que tem propriedades similares tais como os metais e ametais, ou os elementos gasosos.
Propriedades periódicas
Configuração eletrônica

A configuração eletrônica ou organização dos elétrons orbitando átomos neutros mostra um padrão recorrente ou periodicidade. Os elétrons ocupam uma série de níveis eletrônicos (numerados nível 1, nível 2, e assim em diante). Cada nível consiste de uma ou mais subníveis (nomeados s, p, d, f e g). Conforme o número atômico aumenta, os elétrons progressivamente ocupam estes níves e subníveis de acordo com o princípio de Aufbau ou regra de ordenamento energético, conforme demonstrado no diagrama. A configuração eletrônica para o neônio, por exemplo, é 1s² 2s² 2p6. Com o número atômico de dez, o neônio tem dois elétrons no primeiro nível e oito no segundo nível—dois ocupam o subnível s e seis o subnível p. Em termos de tabela periódica, a primeira vez que um elétron ocupa um novo nível corresponde ao início de um novo período, estas posições sendo ocupadas pelo hidrogênio e os metais alcalinos.[45][46]

Uma vez que as propriedades de um elementos são na maioria das vezes determinada pela configuração eletrônica, da mesma forma as propriedades dos elementos mostram um padrão recorrente ou periódico com alguns mostrados no diagrama abaixo para o raio atômico, energia de ionização e afinidade eletrônica. Foi esta periodicidade das propriedades, manifestação que foi bem observada antes da teoria atual ser estabelecida, que levou a formulação da lei periódica (as propriedades dos elementos recorrem em intervalos variados) e a formulação das primeiras tabelas periódicas.[45][46]
Raio atômico

O raio atômico varia de um modo previsível e explicável através da tabela periódica. Por exemplo, o raio geralmente diminui ao longo de cada período da tabela, a partir dos metais alcalinos para os gases nobres; e aumenta dentro do grupo de cima para baixo. O raio aumenta significativamente entre o gás nobre no fim de cada período e o metal alcalino no período seguinte. Esta propriedade (e de várias outras propriedades físicas e químicas dos elementos) pode ser explicada pela teoria da configuração eletrônica do átomo; elas fornecem evidências importantes para o desenvolvimento e confirmação da teoria quântica.[47]
Os elétrons no subnível 4f, que são progressivamente preenchidos a partir do Cério (elemento 58) até o Itérbio (elemento 70), não são efetivo na blindagem do aumento da carga nuclear para os subníveis posteriores. Os elementos subsequentes aos lantanídeos têm raio atômico que são menores do que o esperado e são quase idênticos ao raio atômico do elemento imediatamente acima destes.[48] Deste modo o Háfnio tem praticamente o raio atômico (e química) do zircônio, e o tântalo do nióbio e assim por diante. Este fenômeno é conhecido como contração dos lantanídeos. O efeito desta contração é visível até a platina (elemento 78), no qual após este é mascarado por efeitos relativísticos conhecidos como o efeito do par inerte.[49] A contração do bloco d, que é um efeito similar entre o bloco d e p, é menos pronunciado do que a contração dos lantanídeos mas ocorre pelo mesmo motivo.[48]
Ver também
Notas
- ↑ Os elementos descobertos inicialmente por síntese e posteriormente na natureza são o Tecnécio (Z=43), Promécio (61), Astatino (85), Netúnio (93) e o Plutônio (94).
- ↑ Um elemento zero (i.e. uma substância composta puramente de nêutrons), está incluído em algumas representações alternativas como, por exemplo, na galáxia química.
- ↑ Existe uma inconsistência e algumas irregularidades nesta convenção. Assim, o hélio é mostrando no bloco p ao invés do bloco s, e (por exemplo) a subcamada d no bloco d é na verdade preenchida quando o grupo 11 é alcançado, ao invés do grupo 12.
- ↑ Os gases nobres, astatino, frâncio e todos os elementos mais pesados que o Amerício foram deixados de fora uma vez que não há dados disponíveis para eles.
Referências
- ↑ «Chemistry: Four elements added to periodic table». BBC News
- ↑ a b Emsley, J. (2011). Nature's Building Blocks: An A-Z Guide to the Elements New ed. New York, NY: Oxford University Press. ISBN 978-0-19-960563-7
- ↑ Greenwood & Earnshaw, pp. 24–27
- ↑ Gray, p. 6
- ↑ CNN, Ashley Strickland. «New elements on the periodic table are named». CNN. Consultado em 11 de junho de 2016
- ↑ «Discovery and assignment of elements with atomic numbers 113, 115, 117 and 118». International Union of Pure and Applied Chemistry. 30 de dezembro de 2015
- ↑ «Escolhidos os nomes dos novos elementos da tabela periódica». Revista Pesquisa FAPESP. Consultado em 11 de julho de 2016
- ↑ «Hello, Nihonium. Scientists Name 4 New Elements On The Periodic Table». NPR.org. Consultado em 11 de junho de 2016
- ↑ Koppenol, W. H. (2002). «Naming of New Elements (IUPAC Recommendations 2002)» (PDF). Pure and Applied Chemistry. 74 (5): 787–791. doi:10.1351/pac200274050787
- ↑ Silva, Robert J. (2006). «Fermium, Mendelevium, Nobelium and Lawrencium». In: Morss, L.R.; Edelstein, N.M.; Fuger, J. The Chemistry of the Actinide and Transactinide Elements 3rd ed. Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 1-4020-3555-1
- ↑ a b Rouvray, Dennis H. (2004). «Elements in the history of the Periodic Table» 2 ed. Endeavour. 28: pp. 69-74. doi:10.1016/j.endeavour.2004.04.006. ISSN 0160-9327 Parâmetro desconhecido
|lang2=ignorado (|lingua=) sugerido (ajuda) - ↑ a b Tolentino, Mario; ROCHA-FILHO, Romeu C.; CHAGAS, Aécio Pereira (1997). «Alguns aspectos históricos da classificação periódica dos elementos químicos» (PDF) 1 ed. Química Nova. 20: pp. 103-117. ISSN 0100-4042
- ↑ a b Ball, p. 100
- ↑ Horvitz, Leslie (2002). Eureka!: Scientific Breakthroughs That Changed The World. New York: John Wiley. p. 43. ISBN 978-0-471-23341-1. OCLC 50766822
- ↑ Ball, p. 101
- ↑ Newlands, John A. R. (20 de agosto de 1864). «On Relations Among the Equivalents». Chemical News. 10: 94–95
- ↑ Newlands, John A. R. (18 de agosto de 1865). «On the Law of Octaves». Chemical News. 12: 83
- ↑ Bryson, Bill (2004). A Short History of Nearly Everything. London: Black Swan. pp. 141–142. ISBN 9780552151740
- ↑ Ball, pp. 100–102
- ↑ Pullman, p. 227
- ↑ Ball, p. 105
- ↑ Atkins, p. 87
- ↑ Ball, p. 111
- ↑ N.D. Epiotis, D.K. Henze (2003). Encyclopedia of Physical Science and Technology Terceira edição ed. pp. pp. 671–695
- ↑ Adloff, Jean-Pierre; Kaufman, George B. (2005-09-25). Francium (Atomic Number 87), the Last Discovered Natural Element. The Chemical Educator 10 (5). Página acessada em 26-03-2007.
- ↑ Ball, p. 123
- ↑ Scerri 2007, p. 24
- ↑ Messler, R. W. (2010). The essence of materials for engineers. Sudbury, MA: Jones & Bartlett Publishers. p. 32. ISBN 0-7637-7833-8
- ↑ Bagnall, K. W. (1967). «Recent advances in actinide and lanthanide chemistry». In: Fields, P.R.; Moeller, T. Advances in chemistry, Lanthanide/Actinide chemistry. Col: Advances in Chemistry. 71. [S.l.]: American Chemical Society. pp. 1–12. ISBN 0-8412-0072-6. doi:10.1021/ba-1967-0071.
- ↑ Day, M. C., Jr.; Selbin, J. (1969). Theoretical inorganic chemistry 2nd ed. New York: Nostrand-Rienhold Book Corporation. p. 103. ISBN 0-7637-7833-8
- ↑ Holman, J.; Hill, G. C. (2000). Chemistry in context 5th ed. Walton-on-Thames: Nelson Thornes. p. 40. ISBN 0-17-448276-0
- ↑ a b Leigh, G. J. (1990). Nomenclature of Inorganic Chemistry: Recommendations 1990. [S.l.]: Blackwell Science. ISBN 0-632-02494-1
- ↑ a b Moore, p. 111
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeGreenwood30 - ↑ Stoker, S. H. (2007). General, organic, and biological chemistry. New York: Houghton Mifflin. p. 68. ISBN 978-0-618-73063-6. OCLC 52445586
- ↑ Mascetta, J. (2003). Chemistry The Easy Way 4th ed. New York: Hauppauge. p. 50. ISBN 978-0-7641-1978-1. OCLC 52047235
- ↑ Kotz, J.; Treichel, P.; Townsend, John (2009). Chemistry and Chemical Reactivity, Volume 2 7th ed. Belmont: Thomson Brooks/Cole. p. 324. ISBN 978-0-495-38712-1. OCLC 220756597
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeGray12 - ↑ Jones, C. (2002). d- and f-block chemistry. New York: J. Wiley & Sons. p. 2. ISBN 978-0-471-22476-1. OCLC 300468713
- ↑ Silberberg, M. S. (2006). Chemistry: The molecular nature of matter and change 4th ed. New York: McGraw-Hill. p. 536. ISBN 0-07-111658-3
- ↑ Manson, S. S.; Halford, G. R. (2006). Fatigue and durability of structural materials. Materials Park, Ohio: ASM International. p. 376. ISBN 0-87170-825-6
- ↑ Bullinger, H-J. (2009). Technology guide: Principles, applications, trends. Berlin: Springer-Verlag. p. 8. ISBN 978-3-540-88545-0
- ↑ Jones, B. W. (2010). Pluto: Sentinel of the outer solar system. Cambridge: Cambridge University Press. pp. 169–71. ISBN 978-0-521-19436-5
- ↑ Hinrichs, G. D. (1869). «On the classification and the atomic weights of the so-called chemical elements, with particular reference to Stas's determinations». Proceedings of the American Association for the Advancement of Science. 18 (5): 112–124
- ↑ a b Myers, R. (2003). The basics of chemistry. Westport, CT: Greenwood Publishing Group. pp. 61–67. ISBN 0-313-31664-3
- ↑ a b Chang, R. (2002). Chemistry 7 ed. New York: McGraw-Hill. pp. 289–310; 340–42. ISBN 0-07-112072-6
- ↑ Greenwood & Earnshaw, p. 27
- ↑ a b Jolly, W. L. (1991). Modern Inorganic Chemistry 2nd ed. [S.l.]: McGraw-Hill. p. 22. ISBN 978-0-07-112651-9
- ↑ Greenwood & Earnshaw, p. 28
Bibliografia
- Atkins, P. W. (1995). The Periodic Kingdom. [S.l.]: HarperCollins Publishers, Inc. ISBN 0-465-07265-8
- Ball, Philip (2002). The Ingredients: A Guided Tour of the Elements. [S.l.]: Oxford University Press. ISBN 0-19-284100-9
- Brown, Theodore L.; LeMay, H. Eugene; Bursten, Bruce E. (2005). Chemistry:The Central Science 10th ed. [S.l.]: Prentice Hall. ISBN 0-13-109686-9
- Pullman, Bernard (1998). The Atom in the History of Human Thought. Translated by Axel Reisinger. [S.l.]: Oxford University Press. ISBN 0-19-515040-6
Ligações externas
- «Tabela Periódica Online»
- «Tabela Periódica Completa»
- «Tabela periódica dinâmica»
- «TabelaPeriódica.Org - Vídeos e imagens dos elementos»
- «IUPAC - Últimas atualizações e recomendações» (em inglês)
- «Webelements - Site com informações e fotos de todos os elementos» (em inglês)
- «Alguns aspectos históricos da classificação periódica dos elementos» (PDF)
Softwares:
- «Aplicação Gperiodic para GNU/Linux» (em inglês)

