Evolução humana: diferenças entre revisões
| Linha 25: | Linha 25: | ||
Outra teoria acerca do bipedalismo correlaciona o bipedalismo a '''baixos custos energéticos'''. Nesse sentido, Kramer (2009) afirma que o bipedalismo diminuiria a energia dispendida na locomoção em busca de recursos alimentares e aumentaria a disponibilidade de energia para outras funções como a reprodução. Assim, a seleção natural atuaria de modo a diminuir cada vez mais os custos de locomoção. Ainda segundo este autor, a redução de energia poderia ter duas formas: uma seria a eficiência energética (mais atividades realizadas com menos energia) e outra seria a economia de energia (quantidade absoluta de energia utilizada para realizar a atividade).<ref name=":4">{{Citar periódico |url=https://linkinghub.elsevier.com/retrieve/pii/S0047248499903755 |titulo=Locomotor energetics and leg length in hominid bipedality |data=2000-05 |acessodata=2021-07-17 |jornal=Journal of Human Evolution |número=5 |ultimo=Kramer |primeiro=P.A. |ultimo2=Eck |primeiro2=G.G. |paginas=651–666 |lingua=en |doi=10.1006/jhev.1999.0375}}</ref> |
Outra teoria acerca do bipedalismo correlaciona o bipedalismo a '''baixos custos energéticos'''. Nesse sentido, Kramer (2009) afirma que o bipedalismo diminuiria a energia dispendida na locomoção em busca de recursos alimentares e aumentaria a disponibilidade de energia para outras funções como a reprodução. Assim, a seleção natural atuaria de modo a diminuir cada vez mais os custos de locomoção. Ainda segundo este autor, a redução de energia poderia ter duas formas: uma seria a eficiência energética (mais atividades realizadas com menos energia) e outra seria a economia de energia (quantidade absoluta de energia utilizada para realizar a atividade).<ref name=":4">{{Citar periódico |url=https://linkinghub.elsevier.com/retrieve/pii/S0047248499903755 |titulo=Locomotor energetics and leg length in hominid bipedality |data=2000-05 |acessodata=2021-07-17 |jornal=Journal of Human Evolution |número=5 |ultimo=Kramer |primeiro=P.A. |ultimo2=Eck |primeiro2=G.G. |paginas=651–666 |lingua=en |doi=10.1006/jhev.1999.0375}}</ref> |
||
Um estudo comparativo entre humanos e chimpanzés afirma que características anatômicas, como um quadril mais largo e membros inferiores mais longos, teriam proporcionado a maior extensão dos membros inferiores dando mais eficiência energética na caminhada do ancestral comum de chimpanzé e humanos.<ref name=":5" /> A hipótese de Sockol pressupõe que o tamanho do membro influi na eficiência energética envolvida na locomoção contudo, outro estudo que explora o bipedalismo em australopitecíneos, afirma que o tamanho dos membros inferiores (semelhante ao tamanho dos membros inferiores de chimpanzés e possivelmente do ancestral comum chimpanzés e humanos) não implicam em maior ou menor eficiência de energia para locomoção, nem afetam a bipedia ou a eficiência na forma de caminhar destes hominídeos, apenas reduz sua velocidade de caminhada.<ref name=":4" /> A busca por recursos alimentares, geralmente dispersos no ambiente (seja caçando ou coletando), impunha aos primeiros hominídeos percorrer uma dada distância durante o dia, assim, a velocidade da locomoção tornava-se um fator importante na evolução dos caracteres locomotores. Portanto, a seleção atuaria para tornar um bipede tão veloz quanto deveria ser para percorrer as distâncias necessárias para conseguir recursos e, ao mesmo tempo, reduzia a quantidade de energia necessária para esta atividade.<ref name=":6">{{Citar periódico |url=http://dx.doi.org/10.4207/pa.2009.art32 |titulo=Bipedal Form and Locomotor Function: Understanding the Effects of Size and Shape on Velocity and Energetics |data=2009 |acessodata=2021-07-17 |jornal=PaleoAnthropology |ultimo=Kramer |primeiro=Patricia |ultimo2=Sylvester |primeiro2=Adam |doi=10.4207/pa.2009.art32 |issn=1545-0031}}</ref> |
Um estudo comparativo entre humanos e chimpanzés afirma que características anatômicas, como um quadril mais largo e membros inferiores mais longos, teriam proporcionado a maior extensão dos membros inferiores dando mais eficiência energética na caminhada do ancestral comum de chimpanzé e humanos.<ref name=":5">{{citar periódico |titulo=Chimpanzee locomotor energetics and the origin of human bipedalism |data=24 de julho de 2007 |periódico=Proc. Natl. Acad. Sci. U.S.A. |numero=30 |ultimo2=Raichlen |primeiro2=David A. |páginas=12265–12269 |bibcode=2007PNAS..10412265S |doi=10.1073/pnas.0703267104 |issn=0027-8424 |pmc=1941460 |pmid=17636134 |ultimo3=Pontzer |primeiro3=Herman |volume=104 |primeiro1=Michael D. |ultimo1=Sockol}} |
||
* {{citar web |url=http://uanews.org/story/study-identifies-energy-efficiency-reason-evolution-upright-walking |título=Study identifies energy efficiency as reason for evolution of upright walking |data=16 de julho de 2007 |acessodata=2015-04-23 |website=UANews |publicado=The University of Arizona Office of University Communications |autor=<!--Staff writer(s); no by-line.--> |local=Tucson, AZ}}</ref> A hipótese de Sockol pressupõe que o tamanho do membro influi na eficiência energética envolvida na locomoção contudo, outro estudo que explora o bipedalismo em australopitecíneos, afirma que o tamanho dos membros inferiores (semelhante ao tamanho dos membros inferiores de chimpanzés e possivelmente do ancestral comum chimpanzés e humanos) não implicam em maior ou menor eficiência de energia para locomoção, nem afetam a bipedia ou a eficiência na forma de caminhar destes hominídeos, apenas reduz sua velocidade de caminhada.<ref name=":4" /> A busca por recursos alimentares, geralmente dispersos no ambiente (seja caçando ou coletando), impunha aos primeiros hominídeos percorrer uma dada distância durante o dia, assim, a velocidade da locomoção tornava-se um fator importante na evolução dos caracteres locomotores. Portanto, a seleção atuaria para tornar um bipede tão veloz quanto deveria ser para percorrer as distâncias necessárias para conseguir recursos e, ao mesmo tempo, reduzia a quantidade de energia necessária para esta atividade.<ref name=":6">{{Citar periódico |url=http://dx.doi.org/10.4207/pa.2009.art32 |titulo=Bipedal Form and Locomotor Function: Understanding the Effects of Size and Shape on Velocity and Energetics |data=2009 |acessodata=2021-07-17 |jornal=PaleoAnthropology |ultimo=Kramer |primeiro=Patricia |ultimo2=Sylvester |primeiro2=Adam |doi=10.4207/pa.2009.art32 |issn=1545-0031}}</ref> |
|||
A comparação entre hominídeos mostrou que a eficiência energética e a economia de energia está muito relacionada a forma e tamanho, mas esta relação não é totalmente conhecida, uma vez que o gasto energético varia conforme a espécie, dentro da mesma espécie e ao longo do tempo.<ref name=":6" /> |
A comparação entre hominídeos mostrou que a eficiência energética e a economia de energia está muito relacionada a forma e tamanho, mas esta relação não é totalmente conhecida, uma vez que o gasto energético varia conforme a espécie, dentro da mesma espécie e ao longo do tempo.<ref name=":6" /> |
||
A '''[[hipótese da savana]]''' se popularizou com a descoberta do ''Australopithecus africanus'' por Raymond Dart (1925).<ref name=":7">{{Citar periódico |url=http://dx.doi.org/10.1038/115195a0 |titulo=Australopithecus africanus The Man-Ape of South Africa |data=1925-02 |acessodata=2021-07-17 |jornal=Nature |número=2884 |ultimo=DART |primeiro=RAYMOND A. |paginas=195–199 |doi=10.1038/115195a0 |issn=0028-0836}}</ref> Segundo esta hipótese, a expansão de savanas foi um fator importante para a evolução hominínia.<ref>{{Citar periódico |url=http://dx.doi.org/10.1098/rstb.2014.0064 |titulo=A synthesis of the theories and concepts of early human evolution |data=2015-03-05 |acessodata=2021-07-17 |jornal=Philosophical Transactions of the Royal Society B: Biological Sciences |número=1663 |ultimo=Maslin |primeiro=Mark A. |ultimo2=Shultz |primeiro2=Susanne |paginas=20140064 |doi=10.1098/rstb.2014.0064 |issn=0962-8436 |ultimo3=Trauth |primeiro3=Martin H.}}</ref> Ancestrais humanos deixaram as florestas e passaram a ocupar ambientes abertos com algumas regiões florestais e baixa disponibilidade de água <ref name=":7" /> - savanas - onde se adaptaram e desenvolveram a postura ereta e o bipedalismo. Outras hipóteses foram integradas à hipótese da savana, pois também buscavam explicar a origem do bipedalismo neste mesmo cenário.<ref name=":3" /> |
A '''[[hipótese da savana]]''' se popularizou com a descoberta do ''Australopithecus africanus'' por Raymond Dart (1925).<ref name=":7">{{Citar periódico |url=http://dx.doi.org/10.1038/115195a0 |titulo=Australopithecus africanus The Man-Ape of South Africa |data=1925-02 |acessodata=2021-07-17 |jornal=Nature |número=2884 |ultimo=DART |primeiro=RAYMOND A. |paginas=195–199 |doi=10.1038/115195a0 |issn=0028-0836}}</ref> Segundo esta hipótese, a expansão de savanas foi um fator importante para a evolução hominínia.<ref name=":8">{{Citar periódico |url=http://dx.doi.org/10.1098/rstb.2014.0064 |titulo=A synthesis of the theories and concepts of early human evolution |data=2015-03-05 |acessodata=2021-07-17 |jornal=Philosophical Transactions of the Royal Society B: Biological Sciences |número=1663 |ultimo=Maslin |primeiro=Mark A. |ultimo2=Shultz |primeiro2=Susanne |paginas=20140064 |doi=10.1098/rstb.2014.0064 |issn=0962-8436 |ultimo3=Trauth |primeiro3=Martin H.}}</ref> Ancestrais humanos deixaram as florestas e passaram a ocupar ambientes abertos com algumas regiões florestais e baixa disponibilidade de água <ref name=":7" /> - savanas - onde se adaptaram e desenvolveram a postura ereta e o bipedalismo. Outras hipóteses foram integradas à hipótese da savana, pois também buscavam explicar a origem do bipedalismo neste mesmo cenário.<ref name=":3" /> |
||
Uma destas hipóteses é a de '''display''', em que a postura bípede é adotada a fim de tornar o indivíduo o maior possível.<ref name=":3" /> Funciona como uma estratégia de defesa contra predadores, mas também é uma maneira de resolver conflitos dentro do grupo de maneira ritualística e gestual, sem a necessidade de ataques físicos.<ref name=":2" /> |
Uma destas hipóteses é a de '''display''', em que a postura bípede é adotada a fim de tornar o indivíduo o maior possível.<ref name=":3" /> Funciona como uma estratégia de defesa contra predadores, mas também é uma maneira de resolver conflitos dentro do grupo de maneira ritualística e gestual, sem a necessidade de ataques físicos.<ref name=":2" /> |
||
| Linha 35: | Linha 37: | ||
A '''hipótese do comportamento de sentinela''' foi inicialmente proposta por Dart em 1959.<ref name=":2" /> Segundo esta hipótese, a postura bípede consiste em uma vantagem evolutiva pois permite que um indivíduo observe seus arredores e identifique possíveis predadores. Em um estudo sobre o comportamento de babuínos realizado por Rose (1976), observou-se que o comportamento de alerta é a instância de postura bípede mais frequente, logo após a postura bípede durante a alimentação.<ref>{{Citar periódico |url=http://dx.doi.org/10.1002/ajpa.1330440207 |titulo=Bipedal behavior of olive baboons (Papio anubis) and its relevance to an understanding of the evolution of human bipedalism |data=1976-03 |acessodata=2021-07-17 |jornal=American Journal of Physical Anthropology |número=2 |ultimo=Rose |primeiro=M. D. |paginas=247–261 |doi=10.1002/ajpa.1330440207 |issn=0002-9483}}</ref> Rose adota os babuínos como modelo e propõe que a postura bípede seria a base sobre a qual a seleção natural atuaria. |
A '''hipótese do comportamento de sentinela''' foi inicialmente proposta por Dart em 1959.<ref name=":2" /> Segundo esta hipótese, a postura bípede consiste em uma vantagem evolutiva pois permite que um indivíduo observe seus arredores e identifique possíveis predadores. Em um estudo sobre o comportamento de babuínos realizado por Rose (1976), observou-se que o comportamento de alerta é a instância de postura bípede mais frequente, logo após a postura bípede durante a alimentação.<ref>{{Citar periódico |url=http://dx.doi.org/10.1002/ajpa.1330440207 |titulo=Bipedal behavior of olive baboons (Papio anubis) and its relevance to an understanding of the evolution of human bipedalism |data=1976-03 |acessodata=2021-07-17 |jornal=American Journal of Physical Anthropology |número=2 |ultimo=Rose |primeiro=M. D. |paginas=247–261 |doi=10.1002/ajpa.1330440207 |issn=0002-9483}}</ref> Rose adota os babuínos como modelo e propõe que a postura bípede seria a base sobre a qual a seleção natural atuaria. |
||
Assim como Rose, Hunt (1994) <ref>{{Citar periódico |url=http://dx.doi.org/10.1006/jhev.1994.1011 |titulo=The evolution of human bipedality: ecology and functional morphology |data=1994-03 |acessodata=2021-07-17 |jornal=Journal of Human Evolution |número=3 |ultimo=Hunt |primeiro=Kevin D. |paginas=183–202 |doi=10.1006/jhev.1994.1011 |issn=0047-2484}}</ref> investiga contextos que evocam bipedalismo a fim de estudar pressões seletivas e observa que padrões comportamentais bípedes associados à alimentação eram os mais comuns em sua pesquisa com chimpanzés. Ele aponta que o comportamento sentinela era raro e não traria vantagens suficientes que compensassem as desvantagens de um bipedalismo inicial e pouco adaptado. Hunt também indica que ainda não foi demonstrado que a postura bípede aumentaria o campo de visão em ambientes de floresta, habitat onde se hipotetiza que a transição para o bipedalismo ocorreu. |
Assim como Rose, Hunt (1994) <ref name=":9">{{Citar periódico |url=http://dx.doi.org/10.1006/jhev.1994.1011 |titulo=The evolution of human bipedality: ecology and functional morphology |data=1994-03 |acessodata=2021-07-17 |jornal=Journal of Human Evolution |número=3 |ultimo=Hunt |primeiro=Kevin D. |paginas=183–202 |doi=10.1006/jhev.1994.1011 |issn=0047-2484}}</ref> investiga contextos que evocam bipedalismo a fim de estudar pressões seletivas e observa que padrões comportamentais bípedes associados à alimentação eram os mais comuns em sua pesquisa com chimpanzés. Ele aponta que o comportamento sentinela era raro e não traria vantagens suficientes que compensassem as desvantagens de um bipedalismo inicial e pouco adaptado. Hunt também indica que ainda não foi demonstrado que a postura bípede aumentaria o campo de visão em ambientes de floresta, habitat onde se hipotetiza que a transição para o bipedalismo ocorreu. |
||
Outra hipótese, proposta por Cliff Jolly (1970) <ref>{{Citar periódico |url=https://www.jstor.org/stable/2798801?origin=crossref |titulo=The Seed-Eaters: A New Model of Hominid Differentiation Based on a Baboon Analogy |data=1970-03 |acessodata=2021-07-17 |jornal=Man |número=1 |ultimo=Jolly |primeiro=Clifford J. |paginas=5 |doi=10.2307/2798801}}</ref>, é a de coleta de sementes, elaborada a partir de um modelo com babuínos-gelada. Foi observado que assumiam uma posição bípede em cócoras enquanto se alimentavam, o que liberava as mãos para coletar folhas de grama, sementes e rizomas. Jolly propõe que a adaptação à vida terrestre ocorreu também com a transição de uma dieta baseada em frutas ou folhas para cereais, alimentos ricos em calorias. A manutenção da postura bípede teria facilitado a evolução da locomoção bípede, pois alguns elementos do bipedalismo já comporiam o repertório comportamental. |
|||
Wrangham (1980) <ref>{{Citar periódico |url=http://dx.doi.org/10.1016/0047-2484(80)90059-7 |titulo=Bipedal locomotion as a feeding adaptation in gelada baboons, and its implications for hominid evolution |data=1980-05 |acessodata=2021-07-17 |jornal=Journal of Human Evolution |número=4 |ultimo=Wrangham |primeiro=R.W. |paginas=329–331 |doi=10.1016/0047-2484(80)90059-7 |issn=0047-2484}}</ref> apontou que, apesar da pouca eficiência do caminhar em cócoras de babuínos-gelada, este comportamento ainda é frequente. Um possível benefício é que esta postura permite que continuem a se alimentar com as mãos sem interromper o forrageamento. Também sugere que a manutenção desta postura reduz a necessidade de se abaixar e se levantar enquanto alterna entre postura bípede e quadrúpede, o que pode ter tornado o bipedalismo facultativo mais frequente em função da eficiência energética. |
|||
Em 1967, Ward e Underwood <ref>{{Citar periódico |url=http://dx.doi.org/10.1080/00140136708930887 |titulo=The Effect of Posture on the Solar Radiation Area of Man |data=1967-07 |acessodata=2021-07-17 |jornal=Ergonomics |número=4 |ultimo=WARD |primeiro=E. J. |ultimo2=UNDERWOOD |primeiro2=C. R. |paginas=399–409 |doi=10.1080/00140136708930887 |issn=0014-0139}}</ref> realizaram uma pesquisa a respeito do efeito da postura em relação à área de superfície do corpo exposta à radiação solar. Em regiões de baixa latitude, a postura bípede parece ser mais vantajosa. Wheeler, considerando o problema da hipotermia em ambientes de temperaturas elevadas de um cenário de savana, propõe a hipótese de que o bipedalismo foi selecionado por favorecer a '''termorregulação'''. Wheeler se apoia nas pesquisas de Ward e Underwood ao afirmar que uma postura bípede diminui a incidência de radiação solar, o que diminui o ganho de calor. A postura bípede também permitiria acesso a um micro-habitat mais fresco,<ref name=":9" /> com acesso a ventos e temperaturas mais favoráveis ao se distanciar do chão. A vantagem termorreguladora do bipedalismo permitiria, então, melhor exploração de ambientes quentes e favoreceria sua fixação. |
|||
Novas descobertas [[Paleoclimatologia|paleoclimatológicas]], porém, apontam que a transição para o bipedalismo ocorreu em ambientes de floresta e não de floresta, bem como fósseis com os primeiros sinais de bipedalismo ainda apresentavam adaptações ao deslocamento arborícola.<ref name=":9" /><ref name=":3" /><ref name=":8" /><ref name=":10">{{Citar periódico |url=http://dx.doi.org/10.1007/978-0-387-73896-3_18 |titulo=The Behavioral Ecology of our Earliest Hominid Ancestors |acessodata=2021-07-17 |publicado=Springer New York |ultimo=Sussman |primeiro=R. W. |ultimo2=Hart |primeiro2=Donna |local=New York, NY |paginas=259–279 |isbn=978-0-387-73895-6}}</ref> Sussman e Hart (2008)<ref name=":10" /> apontam que, embora o clima do continente africano tenha começado a se tornar mais árido entre 12 e 5 milhões de anos atrás, ainda restavam áreas de transição entre florestas e savana, onde se iniciaram mudanças comportamentais e anatômicas na evolução hominínia. Deste modo, as hipóteses da savana precisam ser repensadas e recontextualizadas dentro da linha do tempo da evolução hominínia. |
|||
A hipótese da locomoção em corpos d’água rasos ou da vadeação (Wading hypothesis, em inglês) foi inicialmente proposta em 1960, por Alister Hardy.<ref name=":11">{{citar periódico |titulo=HARDY, Alister. Was man more aquatic in the past. New scientist, v. 7, n. 642, p. 5, 1960. Disponível em https://web.archive.org/web/20090326175059/http://www.riverapes.com/AAH/Hardy/Hardy1960.pdf |acessodata=15 de junho de 2021 |jornal=New scientist |publicado=New scientist |ultimo=Hardy |primeiro=Alister |pagina=5}}</ref> Ancestrais humanos teriam habitado margens de corpos d’água e adentravam neles em busca de alimento. Deste modo, propõe Hardy: “''Parece provável que o Homem aprendeu a ficar em posição ereta inicialmente na água e, à medida que seu equilíbrio melhorou, ele descobriu que estava mais bem equipado para permanecer em pé nas margens quando saía da água e também para correr''” (tradução dos autores, p.644).<ref name=":11" /> Influenciada por Hardy, surge a [[hipótese do macaco aquático]] segundo a qual a linhagem hominínia passou a habitar temporariamente um ambiente semi-aquático, o que poderia ser a origem, dentre outras adaptações, do bipedalismo.<ref name=":2" /> Esta proposta, porém, foi criticada por suas inconsistências com o registro fóssil e por buscar evidências na anatomia do humano moderno.<ref>{{Citar periódico |url=http://dx.doi.org/10.1006/jhev.1997.0146 |titulo=Umbrella hypotheses and parsimony in human evolution: a critique of the Aquatic Ape Hypothesis |data=1997-10 |acessodata=2021-07-17 |jornal=Journal of Human Evolution |número=4 |ultimo=Langdon |primeiro=John H. |paginas=479–494 |doi=10.1006/jhev.1997.0146 |issn=0047-2484}}</ref> |
|||
Diferentemente das propostas anteriores, há a hipótese de que diversos fatores influenciaram o surgimento do bipedalismo.<ref name=":3" /><ref name=":2" /> Embora muitas propostas busquem encontrar a causa definitiva que levou à adoção de uma postura e deslocamento bípede, esta investigação é dificultada pelo fato de que os efeitos da seleção natural são observados em uma larga escala, dentro da qual diversos fatores podem interferir.<ref name=":3" /> Segundo Niemitz, “''a pergunta que uma hipótese promissora deve responder é qual combinação das pressões seletivas ultrapassou o ponto a partir do qual a adoção habitual de postura ereta e o deslocamento bípede contínuo passou a valer a pena''” (tradução dos autores, p. 250). Se atribuídas ao período adequado na história evolutiva dos hominínios, diversas hipóteses, ou ao menos alguns aspectos, podem contribuir para o entendimento de como o bipedalismo evoluiu para seu modo atual.<ref name=":2" /> As hipóteses da savana, por exemplo, poderiam explicar porque o bipedalismo se tornou cada vez mais dominante, a ponto de substituir o bipedalismo parcial hominínio.<ref name=":3" /> |
|||
Assim, é possível que o bipedalismo tenha sido favorecido porque liberou as mãos para alcançar e transportar alimentos, tornou a locomoção<ref name="Kwang Hyun 2015 929–934">{{citar periódico|título=Origins of Bipedalism|periódico=Brazilian Archives of Biology and Technology|volume=58|arxiv=1508.02739|bibcode=2015arXiv150802739K|doi=10.1590/S1516-89132015060399|pmid=|último =Kwang Hyun|primeiro =Ko|ano=2015|acessodata=|número=6|páginas=929–934}}</ref> mais eficiente do ponto de vista energético, possibilitou caçadas e corridas de longa distância, forneceu um campo de visão aprimorado, além de ajudar a evitar a hipertermia por reduzir a área de superfície do corpo exposta diretamente ao sol. Todos esses são recursos vantajosos para prosperar no novo ambiente de savana e bosque resultantes da elevação do [[Vale do Rift]] na África Oriental ao invés do habitat anterior de floresta fechada.<ref name="DeSalleTattersall2008">{{harvnb|DeSalle|Tattersall|2008|p=[https://books.google.com/books?id=Bf4Sitw7YaIC&pg=PA113 113]}}</ref><ref name="Kwang Hyun 2015 929–934" /><ref name="Curry2008 Child of Earth" /> Um estudo de 2007 embasa a hipótese de que o andar sobre duas pernas - o bipedalismo - evoluiu porque utilizava menos energia que o andar quadrúpede utilizando as articulações dos dedos das mãos como apoio.<ref>{{citar jornal |autor= <!--Staff writer(s); no by-line.--> |data=17 de julho de 2007 |titulo= Study Identifies Energy Efficiency As Reason For Evolution Of Upright Walking |url= https://www.sciencedaily.com/releases/2007/07/070716191140.htm |obra= [[Science Daily|ScienceDaily]] |local= Rockville, MD |editora= ScienceDaily, LLC |acessodata= 2015-04-09}}</ref><ref name=":5">{{citar periódico |titulo= Chimpanzee locomotor energetics and the origin of human bipedalism |periódico= Proc. Natl. Acad. Sci. U.S.A. |volume= 104 |bibcode= 2007PNAS..10412265S |doi= 10.1073/pnas.0703267104 |issn= 0027-8424 |pmc= 1941460 |pmid= 17636134 |ultimo3= Pontzer |primeiro3= Herman |data= 24 de julho de 2007 |primeiro2= David A. |primeiro1= Michael D. |ultimo2= Raichlen |numero= 30 |páginas= 12265–12269 |ultimo1= Sockol}} |
|||
Assim, é possível que o bipedalismo tenha sido favorecido porque liberou as mãos para alcançar e transportar alimentos, tornou a locomoção<ref name="Kwang Hyun 2015 929–934">{{citar periódico|título=Origins of Bipedalism|periódico=Brazilian Archives of Biology and Technology|volume=58|arxiv=1508.02739|bibcode=2015arXiv150802739K|doi=10.1590/S1516-89132015060399|pmid=|último =Kwang Hyun|primeiro =Ko|ano=2015|acessodata=|número=6|páginas=929–934}}</ref> mais eficiente do ponto de vista energético, possibilitou caçadas e corridas de longa distância, forneceu um campo de visão aprimorado, além de ajudar a evitar a hipertermia por reduzir a área de superfície do corpo exposta diretamente ao sol. Todos esses são recursos vantajosos para prosperar no novo ambiente de savana e bosque resultantes da elevação do [[Vale do Rift]] na África Oriental ao invés do habitat anterior de floresta fechada.<ref name="DeSalleTattersall2008">{{harvnb|DeSalle|Tattersall|2008|p=[https://books.google.com/books?id=Bf4Sitw7YaIC&pg=PA113 113]}}</ref><ref name="Kwang Hyun 2015 929–934" /><ref name="Curry2008 Child of Earth" /> No entanto, estudos recentes sugerem que a bipedalidade sem a [[Controle do fogo pelos primeiros humanos|capacidade de usar o fogo]] não teria permitido a dispersão global.<ref>{{citar periódico |titulo= Bipedality and Hair-loss Revisited: The Impact of Altitude and Activity Scheduling |periódico= Journal of Human Evolution |volume= 94 |doi= 10.1016/j.jhevol.2016.02.006 |pmc= 4874949 |pmid= 27178459 |ultimo1= David-Barrett |primeiro1= T. |ultimo2= Dunbar |primeiro2= R.I.M. |ano= 2016 |numero= |páginas= 72–82}}</ref> |
|||
Revisão das 19h31min de 17 de julho de 2021
| Parte de uma série sobre |
| Evolução |
|---|
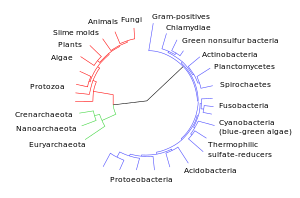 Diagrama da divergência dos grupos taxonómicos modernos em relação aos seus ancestrais comuns. |
|
Tópicos fundamentais |
A evolução humana é a origem e a evolução do Homo sapiens como espécie distinta de outros hominídeos, como dos grandes macacos e mamíferos placentários. O estudo da evolução humana engloba muitas disciplinas científicas, incluindo a antropologia física, primatologia, a arqueologia, linguística e genética.[1]
O termo "humano" no contexto da evolução humana, refere-se ao gênero Homo, mas os estudos da evolução humana usualmente incluem outros hominídeos, como os australopitecos. O gênero Homo se afastou dos Australopitecos entre 2,3 e 2,4 milhões de anos na África.[2][3] Os cientistas estimam que os seres humanos ramificaram-se de seu ancestral comum com os chimpanzés - o único outro hominídeo vivo - entre há 5 e 7 milhões de anos. Diversas espécies de Homo evoluíram e agora estão extintas. Estas incluem o Homo erectus, que habitou a Ásia, e o Homo neanderthalensis, que habitou a Europa. O Homo sapiens arcaico evoluiu entre há 400 000 e 250 000 anos.
A opinião dominante entre os cientistas sobre a origem dos humanos anatomicamente modernos é a "hipótese da origem única",[4][5][6] que argumenta que o Homo sapiens surgiu na África e migrou para fora do continente em torno de há 50 000 a 100 000 anos, substituindo as populações de Homo erectus na Ásia e de Homo neanderthalensis na Europa. Já os cientistas que apoiam a "Hipótese multirregional" argumentam que o Homo sapiens evoluiu em regiões geograficamente separadas.
Mudanças anatômicas
A evolução humana desde a sua separação inicial do último ancestral comum entre humanos e chimpanzés é caracterizada por várias alterações morfológicas, de desenvolvimento, fisiológicas e comportamentais. Destas, as adaptações mais significativas são o bipedalismo, aumento do tamanho do cérebro, a ontogenia prolongada (gestação e infância) e a redução do dimorfismo sexual. A relação entre essas mudanças é objeto de debate constante. Outas alterações morfológicas significativas incluem a evolução da ação de segurar e agarrar com firmeza (força e precisão), uma mudança que ocorreu primeiramente no H. erectus.[7]
Bipedalismo
Definição
A bipedia obrigatória consiste em se locomover exclusivamente sobre os dois membros inferiores, mantendo a coluna ereta e as mãos livres, é a principal característica que define a tribo Hominini a qual inclui a espécie Homo sapiens e seus ancestrais. A bipedia implicou em uma série de adaptações anatômicas, musculares e ósseas que permitiram a nós este tipo de locomoção.[8] Humanos atualmente movimentam os membros inferiores que estão relativamente duros de maneira que o centro de gravidade que no ponto mais baixo que é o calcanhar, ao ser erguido para o maior ponto em distância média do movimento ao qual tem intenção, gere um movimento estilo pêndulo invertido que permite uma mudança efetiva de potencial gravitacional e energia cinética. O mesmo estilo de caminhar foi adotado por outros bípedes muito antes.[9] As diferentes posturas, levam a diferentes ângulos de quadril, joelhos e tornozelos. O quadrupedismo é a base para o bipedismo, conforme pressões ambientais foram selecionando novas posturas, foi assim surgindo esse comportamento.[9]
Hipóteses para a origem do bipedalismo
A principal teoria sobre a origem da bipedia é a adaptação ao ambiente da savana. Essa teoria leva em consideração que uma postura ereta facilitaria a visualização de predadores e presas, diminuiria a área do corpo exposta ao sol evitando hipertermia e pouparia energia no deslocamento visto que o andar sobre duas pernas é menos custoso que correr sobre quatro. O registro fóssil mais antigo de um hominínio com locomoção sobre duas pernas é datado de 7 milhões de anos, o Sahelanthropus tchadensis.[8] Os não bípedes que caminham usando as articulações dos dedos das mãos como apoio - gorilas e chimpanzés - divergiram da linha hominínia neste mesmo período, o que faz do Sahelanthropus ou do Orrorin prováveis candidatos a último ancestral comum. O Ardipithecus, completamente bípede, surgiu há aproximadamente 5,6 milhões de anos.[10]
Em 2001 foi encontrado o fóssil do Sahelanthropus tchadensis e, embora o achado se limitasse ao crânio e dentes, foi possível afirmar, a partir da posição do forame magno, que se tratava do primeiro hominídeo com locomoção sobre duas pernas. Um ano antes desta descoberta, foi descoberto no Quênia o fóssil do Orrorin tugenensis (datado de 6 milhões de anos), eram dentes e dois ossos do fêmur cuja curvatura indicava que aquele indivíduo era bípede.[11] Esses achados mostraram que a forma de locomoção sobre duas pernas é anterior ao surgimento de gorilas, chimpanzés e humanos. A filogenia molecular sugere que por volta de 6,4 ± 1,5 milhões de anos a linhagem de gorilas divergiu da linhagem de chimpanzés e humanos, e que humanos e chimpanzés começaram a divergir por volta de 5.4 ± 1,1 milhões de anos.[12] Registros fósseis de Ardipithecus ramidus são datados de 5.8 a 5.4 milhões de anos, coincidindo com o período em que ocorreu a divergência entre chimpanzés e humanos. Muitos estudos sobre a anatomia Ardipithecus, mostram que se tratava de um hominíneo com características tanto de bipedalismo quanto de arborícola corroborando para o estabelecimento deste como o último ancestral comum entre chimpanzés e humanos. A evolução dividiu esta linhagem em duas: de um lado os primeiros hominínios, os quais tornaram-se bípedes obrigatórios e de outro o chimpanzé e seus ancestrais, que se tornaram grandes escaladores vivendo majoritariamente nas árvores.
Muitas teorias se acumulam sobre o que teria levado ao surgimento e evolução de uma postura ereta e modo de locomoção sobre duas pernas. Um dos modelos teóricos sobre a origem do bipedalismo foi o modelo de Charles Darwin o qual afirma em seu livro "The Descent of Man", and "Selection in Relation to Sex", que: “as mãos e os braços dificilmente poderiam ter se tornado perfeitos o suficiente para ter armas fabricadas, ou para ter atirado pedras e lanças com uma pontaria verdadeira, enquanto fossem habitualmente usados para locomoção e para suportar todo o peso do corpo, ou, como antes comentados, enquanto fossem especialmente adaptados para subir em árvores.”.[13] A afirmação de Darwin implica que a bipedia liberaria as mãos para manuseio de armas e ferramentas associando este fato a diminuição dos dentes caninos. Contudo, a teoria de Darwin sobre o bipedalismo não se sustenta, uma vez que os registros fósseis demostram que o uso de ferramentas e a diminuição dos caninos ocorreram muito tempo após o surgimento da bipedalismo.[14]
Baseado na teoria de Darwin, Owen Lovejoy propõe uma teoria de liberação das mãos relacionada a monogamia e a coleta de alimentos. Ele argumenta que andar sobre duas pernas liberaria as mãos para transportar os alimentos com maior eficiência e argumenta também que as fêmeas se ocupariam de cuidar da prole e os machos eram responsáveis por prover as fêmeas com os alimentos coletados. Em contrapartida, as fêmeas se acasalariam somente com estes machos provedores, melhorando a taxa de sobrevivência da prole. Assim os machos não lutariam mais com outros machos e assim os caninos diminuiriam com o tempo. A teoria de Lovejoy é apoiada por evidências antropológicas que usam chimpanzés como modelos de comportamento.[14]
Outra teoria acerca do bipedalismo correlaciona o bipedalismo a baixos custos energéticos. Nesse sentido, Kramer (2009) afirma que o bipedalismo diminuiria a energia dispendida na locomoção em busca de recursos alimentares e aumentaria a disponibilidade de energia para outras funções como a reprodução. Assim, a seleção natural atuaria de modo a diminuir cada vez mais os custos de locomoção. Ainda segundo este autor, a redução de energia poderia ter duas formas: uma seria a eficiência energética (mais atividades realizadas com menos energia) e outra seria a economia de energia (quantidade absoluta de energia utilizada para realizar a atividade).[15]
Um estudo comparativo entre humanos e chimpanzés afirma que características anatômicas, como um quadril mais largo e membros inferiores mais longos, teriam proporcionado a maior extensão dos membros inferiores dando mais eficiência energética na caminhada do ancestral comum de chimpanzé e humanos.[16] A hipótese de Sockol pressupõe que o tamanho do membro influi na eficiência energética envolvida na locomoção contudo, outro estudo que explora o bipedalismo em australopitecíneos, afirma que o tamanho dos membros inferiores (semelhante ao tamanho dos membros inferiores de chimpanzés e possivelmente do ancestral comum chimpanzés e humanos) não implicam em maior ou menor eficiência de energia para locomoção, nem afetam a bipedia ou a eficiência na forma de caminhar destes hominídeos, apenas reduz sua velocidade de caminhada.[15] A busca por recursos alimentares, geralmente dispersos no ambiente (seja caçando ou coletando), impunha aos primeiros hominídeos percorrer uma dada distância durante o dia, assim, a velocidade da locomoção tornava-se um fator importante na evolução dos caracteres locomotores. Portanto, a seleção atuaria para tornar um bipede tão veloz quanto deveria ser para percorrer as distâncias necessárias para conseguir recursos e, ao mesmo tempo, reduzia a quantidade de energia necessária para esta atividade.[17]
A comparação entre hominídeos mostrou que a eficiência energética e a economia de energia está muito relacionada a forma e tamanho, mas esta relação não é totalmente conhecida, uma vez que o gasto energético varia conforme a espécie, dentro da mesma espécie e ao longo do tempo.[17]
A hipótese da savana se popularizou com a descoberta do Australopithecus africanus por Raymond Dart (1925).[18] Segundo esta hipótese, a expansão de savanas foi um fator importante para a evolução hominínia.[19] Ancestrais humanos deixaram as florestas e passaram a ocupar ambientes abertos com algumas regiões florestais e baixa disponibilidade de água [18] - savanas - onde se adaptaram e desenvolveram a postura ereta e o bipedalismo. Outras hipóteses foram integradas à hipótese da savana, pois também buscavam explicar a origem do bipedalismo neste mesmo cenário.[14]
Uma destas hipóteses é a de display, em que a postura bípede é adotada a fim de tornar o indivíduo o maior possível.[14] Funciona como uma estratégia de defesa contra predadores, mas também é uma maneira de resolver conflitos dentro do grupo de maneira ritualística e gestual, sem a necessidade de ataques físicos.[12]
A hipótese do comportamento de sentinela foi inicialmente proposta por Dart em 1959.[12] Segundo esta hipótese, a postura bípede consiste em uma vantagem evolutiva pois permite que um indivíduo observe seus arredores e identifique possíveis predadores. Em um estudo sobre o comportamento de babuínos realizado por Rose (1976), observou-se que o comportamento de alerta é a instância de postura bípede mais frequente, logo após a postura bípede durante a alimentação.[20] Rose adota os babuínos como modelo e propõe que a postura bípede seria a base sobre a qual a seleção natural atuaria.
Assim como Rose, Hunt (1994) [21] investiga contextos que evocam bipedalismo a fim de estudar pressões seletivas e observa que padrões comportamentais bípedes associados à alimentação eram os mais comuns em sua pesquisa com chimpanzés. Ele aponta que o comportamento sentinela era raro e não traria vantagens suficientes que compensassem as desvantagens de um bipedalismo inicial e pouco adaptado. Hunt também indica que ainda não foi demonstrado que a postura bípede aumentaria o campo de visão em ambientes de floresta, habitat onde se hipotetiza que a transição para o bipedalismo ocorreu.
Outra hipótese, proposta por Cliff Jolly (1970) [22], é a de coleta de sementes, elaborada a partir de um modelo com babuínos-gelada. Foi observado que assumiam uma posição bípede em cócoras enquanto se alimentavam, o que liberava as mãos para coletar folhas de grama, sementes e rizomas. Jolly propõe que a adaptação à vida terrestre ocorreu também com a transição de uma dieta baseada em frutas ou folhas para cereais, alimentos ricos em calorias. A manutenção da postura bípede teria facilitado a evolução da locomoção bípede, pois alguns elementos do bipedalismo já comporiam o repertório comportamental.
Wrangham (1980) [23] apontou que, apesar da pouca eficiência do caminhar em cócoras de babuínos-gelada, este comportamento ainda é frequente. Um possível benefício é que esta postura permite que continuem a se alimentar com as mãos sem interromper o forrageamento. Também sugere que a manutenção desta postura reduz a necessidade de se abaixar e se levantar enquanto alterna entre postura bípede e quadrúpede, o que pode ter tornado o bipedalismo facultativo mais frequente em função da eficiência energética.
Em 1967, Ward e Underwood [24] realizaram uma pesquisa a respeito do efeito da postura em relação à área de superfície do corpo exposta à radiação solar. Em regiões de baixa latitude, a postura bípede parece ser mais vantajosa. Wheeler, considerando o problema da hipotermia em ambientes de temperaturas elevadas de um cenário de savana, propõe a hipótese de que o bipedalismo foi selecionado por favorecer a termorregulação. Wheeler se apoia nas pesquisas de Ward e Underwood ao afirmar que uma postura bípede diminui a incidência de radiação solar, o que diminui o ganho de calor. A postura bípede também permitiria acesso a um micro-habitat mais fresco,[21] com acesso a ventos e temperaturas mais favoráveis ao se distanciar do chão. A vantagem termorreguladora do bipedalismo permitiria, então, melhor exploração de ambientes quentes e favoreceria sua fixação.
Novas descobertas paleoclimatológicas, porém, apontam que a transição para o bipedalismo ocorreu em ambientes de floresta e não de floresta, bem como fósseis com os primeiros sinais de bipedalismo ainda apresentavam adaptações ao deslocamento arborícola.[21][14][19][25] Sussman e Hart (2008)[25] apontam que, embora o clima do continente africano tenha começado a se tornar mais árido entre 12 e 5 milhões de anos atrás, ainda restavam áreas de transição entre florestas e savana, onde se iniciaram mudanças comportamentais e anatômicas na evolução hominínia. Deste modo, as hipóteses da savana precisam ser repensadas e recontextualizadas dentro da linha do tempo da evolução hominínia.
A hipótese da locomoção em corpos d’água rasos ou da vadeação (Wading hypothesis, em inglês) foi inicialmente proposta em 1960, por Alister Hardy.[26] Ancestrais humanos teriam habitado margens de corpos d’água e adentravam neles em busca de alimento. Deste modo, propõe Hardy: “Parece provável que o Homem aprendeu a ficar em posição ereta inicialmente na água e, à medida que seu equilíbrio melhorou, ele descobriu que estava mais bem equipado para permanecer em pé nas margens quando saía da água e também para correr” (tradução dos autores, p.644).[26] Influenciada por Hardy, surge a hipótese do macaco aquático segundo a qual a linhagem hominínia passou a habitar temporariamente um ambiente semi-aquático, o que poderia ser a origem, dentre outras adaptações, do bipedalismo.[12] Esta proposta, porém, foi criticada por suas inconsistências com o registro fóssil e por buscar evidências na anatomia do humano moderno.[27]
Diferentemente das propostas anteriores, há a hipótese de que diversos fatores influenciaram o surgimento do bipedalismo.[14][12] Embora muitas propostas busquem encontrar a causa definitiva que levou à adoção de uma postura e deslocamento bípede, esta investigação é dificultada pelo fato de que os efeitos da seleção natural são observados em uma larga escala, dentro da qual diversos fatores podem interferir.[14] Segundo Niemitz, “a pergunta que uma hipótese promissora deve responder é qual combinação das pressões seletivas ultrapassou o ponto a partir do qual a adoção habitual de postura ereta e o deslocamento bípede contínuo passou a valer a pena” (tradução dos autores, p. 250). Se atribuídas ao período adequado na história evolutiva dos hominínios, diversas hipóteses, ou ao menos alguns aspectos, podem contribuir para o entendimento de como o bipedalismo evoluiu para seu modo atual.[12] As hipóteses da savana, por exemplo, poderiam explicar porque o bipedalismo se tornou cada vez mais dominante, a ponto de substituir o bipedalismo parcial hominínio.[14]
Assim, é possível que o bipedalismo tenha sido favorecido porque liberou as mãos para alcançar e transportar alimentos, tornou a locomoção[28] mais eficiente do ponto de vista energético, possibilitou caçadas e corridas de longa distância, forneceu um campo de visão aprimorado, além de ajudar a evitar a hipertermia por reduzir a área de superfície do corpo exposta diretamente ao sol. Todos esses são recursos vantajosos para prosperar no novo ambiente de savana e bosque resultantes da elevação do Vale do Rift na África Oriental ao invés do habitat anterior de floresta fechada.[29][28][30] No entanto, estudos recentes sugerem que a bipedalidade sem a capacidade de usar o fogo não teria permitido a dispersão global.[31]
Anatomicamente, a evolução do bipedalismo foi acompanhada por várias alterações esqueléticas, não apenas nas pernas e na pelve, mas também na coluna vertebral, pés e tornozelos e no crânio.[32] O fêmur se deslocou para uma posição ligeiramente mais angular para mover o centro de gravidade em direção ao centro geométrico do corpo. As articulações do joelho e do tornozelo tornaram-se cada vez mais robustas para melhor suportar o aumento de peso. E para suportar esse aumento de peso em cada vértebra na posição vertical, a coluna vertebral humana foi se modificando até alcançar a forma de S e as vértebras lombares ficaram mais curtas e amplas. Nos pés, o dedão se alinhou com os outros dedos para ajudar na locomoção. Os braços e antebraços encurtaram em relação às pernas, facilitando a corrida. O forame magno migrou sob o crânio para uma posição mais anterior.[33]
As mudanças mais significativas ocorreram na região pélvica, onde o osso ilíaco voltado para baixo foi encurtado e ampliado como requisito para manter o centro de gravidade estável durante a caminhada;[34] os hominídeos bípedes têm uma pelve mais curta, porém mais larga, em forma de tigela, devido a isso, o que leva a uma desvantagem aos hominídeos não bípedes: o canal de nascimento dos hominídeos bípedes é menor do que nos hominídeos não bípedes, embora tenha havido um alargamento se compararmos os australopitecíneos com os humanos modernos para permitir a passagem de recém-nascidos devido ao aumento do tamanho do crânio, mas isso é limitado à porção superior, pois um aumento adicional poderia dificultar o movimento bipedal normal.[35]
O encurtamento da pelve e o canal de nascimento menor evoluíram como requisitos para o bipedalismo e tiveram efeitos significativos no processo de nascimento humano, que é muito mais difícil nos humanos modernos do que em outros primatas. Durante o nascimento humano, devido à variação no tamanho da região pélvica, a cabeça do feto deve estar em uma posição transversal (em comparação com a mãe) durante a entrada no canal do parto e girar cerca de 90 graus após a saída.[36] O canal de nascimento menor tornou-se um fator limitante para o aumento do tamanho do cérebro nos primeiros humanos e levou a um período de gestação mais curto, levando à imaturidade relativa da prole humana, que não consegue andar muito antes dos 12 meses e têm maior neotenia, comparado com outros primatas, que são ágeis numa idade muito menor.[30] O aumento do crescimento cerebral após o nascimento e o aumento da dependência das crianças em relação às mães tiveram um efeito importante no ciclo reprodutivo feminino,[37] e o surgimento mais frequente de aloparentalidade em humanos quando comparado com outros hominídeos.[38] O atraso na maturidade sexual humana também levou à evolução da menopausa, o que sugere a explicação de que as mulheres idosas poderiam transmitir melhor seus genes cuidando da prole da filha, ao invés de ter mais filhos.[39]
Encefalização

A espécie humana acabou desenvolvendo um cérebro muito maior que o de outros primatas - tipicamente 1 330 cm³ nos humanos modernos, quase três vezes o tamanho do cérebro de um chimpanzé ou gorila.[40] Após um período de estase no Australopithecus anamensis e Ardipithecus, espécies que tinham cérebros menores resultantes de sua locomoção bípede,[41] o padrão de encefalização começou com o Homo habilis, cujo cérebro de 600 cm³ era um pouco maior que o dos chimpanzés. Esta evolução continuou no Homo erectus com cérebros entre 800 e 1 100 cm³, e atingiu o máximo nos neandertais com cérebros entre 1 200 e 1 900 cm³, maiores até mesmo que o cérebro dos modernos Homo sapiens. Este aumento de volume ocorre durante o crescimento do cérebro após o nascimento e é muito superior ao dos outros macacos (heterocronia). Também permitiu um período mais extenso de aprendizado social e aquisição de linguagem nos humanos jovens, começando há cerca de 2 milhões de anos.
Além disso, as mudanças na estrutura dos cérebros humanos podem ser ainda mais significativas que o aumento no tamanho.[42][43][44][45]

Os lobos temporais, que contêm os centros de processamento da linguagem, cresceram desproporcionalmente, assim como o córtex pré-frontal, que é relacionado à tomadas de decisão complexas e à moderação do comportamento social.[46] Atribui-se à encefalização um aumento na dieta de carnes e amido,[47][48][49] e o desenvolvimento do cozimento dos alimentos.[50] Também tem sido proposto que a inteligência aumentou como uma resposta à necessidade crescente de resolver problemas sociais à medida que a sociedade humana se tornou mais complexa.[51] Alterações na morfologia do crânio, como mandíbulas menores e pontos de fixação dos músculos, forneceram mais espaço para o cérebro crescer.[52]
O aumento no volume do neocórtex também inclui um rápido aumento no tamanho do cerebelo. Sua função tem sido tradicionalmente associada ao equilíbrio e ao controle motor fino, mas mais recentemente com a fala e a cognição. Os grandes macacos, incluindo os hominídeos, têm um cerebelo mais pronunciado em relação ao neocórtex do que os outros primatas. Sugere-se que, devido à sua função de controle sensorial-motor e ao aprendizado de ações musculares complexas, o cerebelo deva ter apoiado as adaptações tecnológicas humanas, inclusive as pré-condições para a fala.[53][54][55][56]
A vantagem imediata de sobrevivência da encefalização é difícil de discernir, pois as principais alterações cerebrais do Homo erectus para o Homo heidelbergensis não foram acompanhadas por grandes mudanças na tecnologia. Sugere-se que as alterações foram principalmente sociais e comportamentais, incluindo o aumento das habilidades empáticas,[57][58] do tamanho dos grupos sociais[59][60][61] e da plasticidade comportamental.[62] A encefalização pode também dever-se a uma dependência de alimentos ricos em calorias e difíceis de adquirir.[63]
Dimorfismo sexual
O grau reduzido de dimorfismo sexual nos seres humanos é visível principalmente na diminuição do dente canino masculino em relação a outras espécies de macacos (exceto gibões), das arcadas supraciliares e da robustez geral dos machos. Outra importante mudança fisiológica relacionada à sexualidade em humanos foi a evolução da ovulação oculta. Os humanos são os únicos hominóides em que a fêmea é fértil o ano todo e mesmo assim nenhum sinal especial de fertilidade é produzido pelo corpo (tais como o inchaço genital ou alterações evidentes na proceptividade durante o estro).[64]
No entanto, os seres humanos mantêm um certo grau de dimorfismo sexual na distribuição de pelos corporais e gordura subcutânea; e no tamanho total, os homens são cerca de 15% maiores que as mulheres.[65] Essas mudanças tomadas em conjunto foram interpretadas como resultado de uma ênfase crescente no vínculo do casal, como uma possível solução para a exigência de maior investimento parental devido à prolongada infância dos filhos.[66]
Oposição ulnar
A oposição ulnar - o contato entre o polegar e a ponta do dedo mindinho da mesma mão - é único ao gênero Homo,[67] incluindo os neandertais, os hominínios de Sima de los Huesos e os humanos anatomicamente modernos.[68][69] Em outros primatas, o polegar é curto e incapaz de tocar a ponta do dedo mindinho.[70] A oposição ulnar facilita o agarrar com precisão e força da mão humana, subjacentes a todas as habilidades de manipulação.
Outras mudanças
Várias outras mudanças também caracterizaram a evolução dos seres humanos, entre elas uma maior importância na visão, em vez de no olfato; um período de desenvolvimento juvenil mais longo e maior dependência infantil; um intestino menor; o metabolismo basal mais rápido;[71] perda de pelos do corpo; evolução das glândulas sudoríparas; uma mudança na forma da arcada dentária em formato de U para um formato parabólico; desenvolvimento de um queixo (encontrado apenas no Homo sapiens); desenvolvimento de processos estiloides; e o desenvolvimento de uma laringe descendente.
Paleoantropologia
Este artigo não cita fontes confiáveis. (Outubro de 2015) |

A moderna área da paleoantropologia começou com o descobrimento do Neandertal e evidências de outros "homens das cavernas" no século XIX. A ideia de que os humanos eram similares a certos macacos era óbvia para alguns há algum tempo. Mas, a ideia de evolução biológica das espécies em geral não foi legitimada até à publicação de A Origem das Espécies por Charles Darwin em 24 de novembro de 1859. Apesar do primeiro livro de Darwin sobre evolução não abordar a questão da evolução humana, era claro para leitores contemporâneos o que estava em jogo. Debates entre Thomas Huxley e Richard Owen focaram na ideia de evolução humana, e quando Darwin publicou seu próprio livro sobre o assunto (A descendência do Homem e Seleção em relação ao Sexo), essa já era uma conhecida interpretação da sua teoria — e seu bastante controverso aspecto. Até muitos dos apoiantes originais de Darwin (como Alfred Russel Wallace e Charles Lyell) rejeitaram a ideia de que os seres humanos poderiam ter evoluído sua capacidade mental e senso moral pela seleção natural.
Desde o tempo de Lineu, alguns grandes macacos foram classificados como sendo os animais mais próximos dos seres humanos, baseado na similaridade morfológica. No século XIX, especulava-se que nossos parentes mais próximos eram os chimpanzés e gorilas. E, baseado na distribuição natural dessas espécies, supunha-se que os fósseis dos ancestrais dos humanos seriam encontrados na África e que os humanos compartilhavam um ancestral comum com os outros antropóides africanos.
Foi apenas na década de 1890 que fósseis além dos de Neandertais foram encontrados. Em 1925, Raymond Dart descreveu o Australopithecus africanus. O espécime foi Bebé de Taung, um infante de Australopithecus descoberto em Taung, África do Sul. Os restos constituíam-se de um crânio muito bem preservado e de um molde endocranial do cérebro do indivíduo. Apesar do cérebro ser pequeno (410 cm³), seu formato era redondo, diferentemente daqueles dos chimpanzés e gorilas, sendo mais semelhante ao cérebro do homem moderno. Além disso, o espécime exibia dentes caninos pequenos e a posição do foramen magnum foi uma evidência da locomoção bípede. Todos esses traços convenceram Dart de que o "bebê de Taung" era um ancestral humano bípede. Mais 20 anos passariam até que as reivindicações de Dart fossem levadas em consideração, seguindo a descoberta de mais fósseis que lembravam o achado de Dart. A visão prevalecente naquele tempo era a de que um cérebro grande desenvolveu-se antes da locomoção bípede. Pensava-se que a inteligência presente nos humanos modernos fosse um pré-requisito para o bipedalismo.
Os Australopithecíneos são agora vistos como os ancestrais imediatos do gênero Homo, o grupo ao qual os homens modernos pertencem. Tanto os Australopithecines quanto o Homo pertencem à família Hominidae, mas dados recentes têm levado a questionar a posição do A. africanus como um ancestral direto dos humanos modernos; ele pode muito bem ter sido um primo mais distante. Os Australopithecines foram originalmente classificados em dois tipos: gráceis e robustos. A variedade robusta de Australopithecus tem, desde então, sido reclassificada como Paranthropus. Na década de 1930, quando os espécimes robustos foram descritos pela primeira vez, o gênero Paranthropus foi utilizado. Durante a década de 1960, a variedade robusta foi transformada em Australopithecus. A tendência recente tem-se voltado à classificação original como um gênero separado.
 |
- Evolução humana
-
Homo habilis, o primeiro a usar ferramentas de pedra.
Antes do Homo
Evolução inicial dos primatas
A história evolucionária dos primatas remonta a 65 milhões de anos.[72][73][74][75][76] Uma das mais antigas espécies de mamíferos semelhante a primatas, o Plesiadapis, viveu na América do Norte;[77][78][79][80][81][82] outro, o Archicebus, viveu na China.[83] Outros primatas basais semelhantes eram comuns na Eurásia e na África durante os períodos tropicais do Paleoceno e Eoceno.

David R. Begun[84] concluiu que primatas primitivos se desenvolveram na Eurásia e que uma linhagem que leva aos macacos e humanos africanos, incluindo o Dryopithecus, migrou para o sul a partir da Europa ou da Ásia Ocidental para a África. A população tropical sobrevivente de primatas - que é vista mais completamente no Eoceno Superior e nos estratos fósseis mais antigos do Oligoceno da depressão de Faium a sudoeste do Cairo - deu origem a todas as espécies de primatas existentes, incluindo os lêmures de Madagascar, os lóris do sudeste da Ásia, os gálagos da África, e aos antropoides, que são os Platyrrhini ou macacos do Novo Mundo, os Catarrhini ou macacos do Velho Mundo e os grandes símios, incluindo os humanos e os outros hominídeos.
O mais antigo catarrino conhecido é o Kamoyapithecus do final do Oligoceno encontrado em Eragaleit no norte no Vale do Rift, no Quênia, datado de há 24 milhões de anos.[85] Acredita-se que sua ancestralidade esteja ligada a espécies relacionadas com Aegyptopithecus, Propliopithecus e Parapithecus de Faium, de cerca de há 35 milhões de anos.[86] Em 2010, o Saadanius foi descrito como um parente próximo do último ancestral comum do grupo coroa dos catarrinos e provisoriamente datado entre há 29 e 28 milhões de anos, ajudando a preencher uma lacuna de 11 milhões de anos no registro fóssil.[87]

No Mioceno inferior, a cerca de 22 milhões de anos, os muitos tipos de catarrinos primitivos arborícolas da África Oriental sugerem uma longa história de diversificação prévia. Fósseis de 20 milhões de anos incluem fragmentos atribuídos ao Victoriapithecus, o mais antigo macaco do Velho Mundo. Entre os gêneros que se acredita estar levando à linhagem dos grandes macacos há 13 milhões de anos estão Proconsul, Rangwapithecus, Dendropithecus, Limnopithecus, Nacholapithecus, Equatorius, Nyanzapithecus, Afropithecus, Heliopithecus e Kenyapithecus, todos da África Oriental.
A presença de outros não-cercopitecídeos generalizados do Mioceno médio de locais distantes - Otavipithecus de depósitos de cavernas na Namíbia, e Pierolapithecus e Dryopithecus da França, Espanha e Áustria - é evidência de uma ampla diversidade de formas em toda a África e na bacia do Mediterrâneo durante os regimes climáticos relativamente quentes e uniformes do Mioceno inferior e Médio. O mais antigo dos hominoides do Mioceno, o Oreopithecus, foi encontrado em depósitos de carvão na Itália e datado de cerca de há 9 milhões de anos.
Evidências moleculares indicam que a linhagem dos gibões (família Hylobatidae) divergiu da linha de grandes símios há cerca de 18 a 12 milhões de anos, e a dos orangotangos (subfamília Ponginae) divergiu dos outros grandes macacos há cerca de 12 milhões de anos; não há fósseis que documentem claramente a ancestralidade dos gibões, que podem ter se originado em uma população hominoide do sudeste asiático até então desconhecida, mas os proto-orangotangos fósseis podem ser representados pelo Sivapithecus da Índia e pelo Griphopithecus da Turquia, ambos datados de cerca de há 10 milhões de anos.[88]
Divergência do clado humano de outros grandes macacos
Espécies próximas ao último ancestral comum de gorilas, chimpanzés e humanos podem ser representadas pelos fósseis do Nakalipithecus encontrados no Quênia e do Ouranopithecus encontrados na Grécia. Evidências moleculares sugerem que entre há 8 e 4 milhões de anos, primeiro os gorilas, e depois os chimpanzés (gênero Pan) se separaram da linha que levou aos humanos. O DNA humano é aproximadamente 98,4% idêntico ao dos chimpanzés quando comparados polimorfismos de nucleotídeo único. No entanto, o registro fóssil de gorilas e chimpanzés é limitado; a falta de preservação - os solos das florestas tropicais tendem a ser ácidos e dissolvem os ossos - e o viés de amostragem provavelmente contribuem para esse problema.
Outros hominínios provavelmente se adaptaram a ambientes mais secos fora da faixa equatorial e lá encontraram antílopes, hienas, cães, porcos, elefantes, cavalos e outros animais. A faixa equatorial se contraiu depois de cerca de há 8 milhões de anose há escassas evidências fósseis para a divisão - que se acredita ter ocorrido nessa época - da linhagem hominínia das de gorilas e chimpanzés. Os fósseis mais antigos que alguns argumentam pertencer à linhagem humana são o Sahelanthropus tchadensis (cerca de 7 milhões de anos) e Orrorin tugenensis (cerca de 6 milhões de anos), seguidos pelo Ardipithecus (5,5-4,4 milhões de anos), com as espécies Ar. kadabba e Ar. ramidus.
Argumenta-se em um estudo da história de vida do Ar. ramidus que a espécie fornece evidências para um conjunto de adaptações anatômicas e comportamentais em hominínios muito antigos, diferentes de qualquer espécie de grande macaco existente.[89] Este estudo demonstrou afinidades entre a morfologia craniana do Ar. ramidus e de chimpanzés infantis e juvenis, sugerindo que as espécies desenvolveram uma morfologia craniofacial juvenilizada ou pedomórfica via dissociação heterocrônica de trajetórias de crescimento. Argumenta-se também que a espécie apoia a noção de que hominínios muito antigos, da mesma forma que os bonobos (Pan paniscus), a espécies menos agressiva do gênero Pan, podem ter evoluído através do processo de auto-domesticação. Consequentemente, argumentando contra o chamado "modelo referencial do chimpanzé", os autores sugerem que não é mais recomendável usar comportamentos sociais e de acasalamento de chimpanzés (Pan troglodytes) em modelos de evolução social inicial dos hominínios. Ao comentar sobre a ausência de morfologia canina agressiva no Ar. ramidus e as implicações que isso tem para a evolução da psicologia social hominínia, eles escreveram:
É obvio que o Ar. ramidus difere significativamente dos bonobos, porque os bonobos mantiveram caninos funcionais afiados. No entanto, o fato de que o Ar. ramidus compartilha com os bonobos o dimorfismo sexual reduzido e uma forma mais pedomórfica em relação aos chimpanzés, sugere que as adaptações de desenvolvimento e sociais evidentes nos bonobos podem ajudar nas futuras reconstruções da psicologia social e sexual inicial dos hominínios. De fato, a tendência para o aumento do cuidado materno, seleção de parceiras femininas e autodomesticação pode ter sido mais forte e mais refinada no Ar. ramidus do que vemos nos bonobos.[90]
Os autores argumentam que muitas das adaptações humanas básicas evoluíram nos antigos ecossistemas arborizados e florestais do final do Mioceno e do início do Plioceno na África. Consequentemente, eles argumentam que os humanos podem não representar a evolução de um ancestral semelhante ao chimpanzé, como tradicionalmente se supunha. Isso sugere que muitas adaptações humanas modernas representam traços filogeneticamente profundos e que o comportamento e a morfologia dos chimpanzés podem ter evoluído após sua separação do ancestral comum que eles compartilham com os humanos.
Este artigo ou seção pode conter informações desatualizadas. |
Gênero Homo
Na taxonomia moderna, o Homo sapiens é a única espécie existente desse gênero, Homo. Do mesmo modo, o estudo recente das origens do Homo sapiens geralmente demonstra que existiram outras espécies de Homo, todas as quais estão agora extintas. Enquanto algumas dessas outras espécies poderiam ter sido ancestrais do H. sapiens, muitas foram provavelmente nossos "primos", tendo especificado a partir de nossa linhagem ancestral.
Ainda não há nenhum consenso a respeito de quais desses grupos deveriam ser considerados como espécies em separado e sobre quais deveriam ser subespécies de outras espécies. Em alguns casos, isso é devido à escassez de fósseis, em outros, devido a diferenças mínimas usadas para distinguir espécies no gênero Homo.
A palavra homo vem do Latim e significa "pessoa", escolhido originalmente por Carolus Linnaeus em seu sistema de classificação. É geralmente traduzido como "homem", apesar disso causar confusão, dado que a palavra "homem" pode ser genérica como homo, mas pode também referir-se especificamente aos indivíduos do sexo masculino.

H. habilis
Viveu entre cerca de há 2,4 a 1,8 milhões de anos. H. habilis, a primeira espécie do gênero Homo, evoluiu no sul e no leste da África no final do Plioceno ou início do Pleistoceno, há 2,5 a 2,0 milhões de anos, quando divergiu do Australopithecines. H. habilis tinha molares menores e cérebro maior que os Australopithecines, e faziam ferramentas de pedra e talvez de ossos de animais.

H. erectus
Viveu entre cerca de há 1,8 (incluindo o ergaster) ou de 1,25 (excluindo o ergaster) a 0,70 milhões de anos. No Pleistoceno Inferior, entre há 1,5 e 1 milhão de anos, na África, Ásia, e Europa, provavelmente Homo habilis possuía um cérebro maior e fabricou ferramentas de pedra mais elaboradas; essas e outras diferenças são suficientes para que os antropólogos possam classificá-los como uma nova espécie, H. erectus. Um exemplo famoso de Homo erectus é o Homem de Pequim; outros foram encontrados na Ásia (notadamente na Indonésia), África, e Europa. Muitos paleoantropólogos estão atualmente utilizando o termo Homo ergaster para as formas não asiáticas desse grupo, e reservando a denominação H. erectus apenas para os fósseis encontrados na região da Ásia e que possuam certas exigências esqueléticas e dentárias que diferem levemente das do ergaster.
H.ergaster
Viveu entre cerca de 1,8 a 1,25 Milhões de anos. Também conhecido como Homo erectus ergaster.
H. heidelbergensis
O Homem de Heidelberg viveu entre cerca de há 800000 a 300000 anos. Também conhecido como Homo sapiens heidelbergensis e Homo sapiens paleohungaricus.
H. floresiensis
Viveu há cerca de 12 mil anos (anunciado em 28 de Outubro de 2004 no periódico científico Nature). Apelidado de hobbit por causa de seu pequeno tamanho.

H. neanderthalensis
Viveu entre há 250 000 e 30 000 anos. Também conhecido como Homo sapiens neanderthalensis. Há um debate recente sobre se o "Homem de Neanderthal" foi uma espécie separada, Homo neanderthalensis, ou uma subespécie de H. sapiens. Enquanto o debate continua, a maioria das evidências, adquiridas através da análise do DNA mitocondrial e do Y-cromosomal DNA, atualmente indica que não houve nenhum fluxo genético entre o H. neanderthalensis e o H. sapiens, e, consequentemente, eram duas espécies diferentes. Em 1997 o Dr. Mark Stoneking, então um professor associado de antropologia da Universidade de Penn State, disse: "Esses resultados [baseados no DNA mitocondrial extraído dos ossos do Neanderthal] indicam que os Neanderthais não contribuíram com o DNA mitocondrial com os humanos modernos … os Neanderthais não são nossos ancestrais."[91] Investigações subsequentes de uma segunda fonte de DNA de Neanderthal confirmaram esses achados.[92]
Estudos pareciam indicar que pouco (ou nada) do património genético dos neandertais subsistira no DNA do homem atual. Mas, em 7 de Maio de 2010 um estudo do Projecto do Genoma do Neandertal[93] foi publicado na revista Science.[94] Tal estudo afirma que realmente ocorrera cruzamento entre as duas espécies.[95] Um estudo, em 2016, utilizando os registros médicos eletrônicos e dados de ADN associados de mais de 28 000 indivíduos, mostra que o DNA Neanderthal produziu efeitos pequenos, mas significativos, sobre os riscos de desenvolvimento de depressão, lesões de pele e coagulação sanguínea excessiva.[96]
Homo sapiens
Surgiu há cerca de 300 mil anos.[97][98][99][100][101][102] No período interglacial do Pleistoceno Médio entre a Glaciação Riss e a Glaciação Wisconsin, há cerca de 250 mil anos, a tendência de expansão craniana e a tecnologia na elaboração de ferramentas de pedra desenvolveu-se, fornecendo evidências da transição do H. erectus ao H. sapiens. As evidências sugerem que houve uma migração do H. erectus para fora da África, então uma subsequente especiação para o H. sapiens na África. (Há poucas evidências de que essa especiação ocorreu em algum lugar). Então, uma subsequente migração dentro e fora da África eventualmente substituiu o anteriormente disperso H. erectus. Entretanto, a evidência atual não impossibilita a especiação multiregional. Essa é uma área calorosamente debatida da paleoantropologia.
Um estudo genético de um grande número de populações humanas atuais, feito desde 2003 por Sarah A. Tishkoff da Universidade da Pensilvânia[103] sugere que o "berço da humanidade" ficaria na região dos Khoisan (antes chamados de Hotentotes), mais exatamente na área do Kalahari mais próxima do litoral da Fronteira Angola-Namíbia. Aí foi encontrada a maior diversidade genética, baseada num gene traçador que, comparado com a de outras populações, indica a possível migração das populações ancestrais para o norte e fora da África, há cerca de 250 gerações.
Em uma série de análises genéticas sem precedentes, publicadas no jornal Nature, em setembro de 2016, três times de pesquisadores concluíram que todos os não africanos descendem de uma única população que emergiu na África entre há 50 e 80 milhares de anos.[104]
Ver também
Referências
- ↑ Heng HH (2009). «The genome-centric concept: resynthesis of evolutionary theory». Bioessays. 31 (5): 512–25. PMID 19334004. doi:10.1002/bies.200800182
- ↑ Stringer, C.B. (1994). «Evolution of early humans». In: Steve Jones, Robert Martin & David Pilbeam (eds.). The Cambridge Encyclopedia of Human Evolution. Cambridge: Cambridge University Press. p. 242. ISBN 0-521-32370-3 Also ISBN 0-521-46786-1 (paperback)
- ↑ McHenry, H.M (2009). «Human Evolution». In: Michael Ruse & Joseph Travis. Evolution: The First Four Billion Years. Cambridge, Massachusetts: The Belknap Press of Harvard University Press. p. 265. ISBN 978-0-674-03175-3
- ↑ «Out of Africa Revisited». Science. 13 de maio de 2005. Consultado em 9 de março de 2017
- ↑ Chris Stringer (12 de junho de 2003). «Human evolution: Out of Ethiopia». Nature. Consultado em 9 de março de 2017
- ↑ «Origins of Modern Humans: Multiregional or Out of Africa?». actionbioscience. Maio de 2001. Consultado em 9 de março de 2017
- ↑ Brues & Snow 1965, pp. 1–39
- ↑ a b Da Silva, Sergio Francisco Serafim Monteiro (1 de fevereiro de 2020). «ASSIM CAMINHOU A HUMANIDADE». CLIO Arqueológica (3). 171 páginas. ISSN 2448-2331. doi:10.20891/clio.v34n3p171-193. Consultado em 17 de julho de 2021
- ↑ a b Schmitt, Daniel (1 de maio de 2003). «Insights into the evolution of human bipedalism from experimental studies of humans and other primates». Journal of Experimental Biology (9): 1437–1448. ISSN 1477-9145. doi:10.1242/jeb.00279. Consultado em 17 de julho de 2021
- ↑ White, T. D.; Asfaw, B.; Beyene, Y.; Haile-Selassie, Y.; Lovejoy, C. O.; Suwa, G.; Woldegabriel, G. (2009). «Ardipithecus ramidus and the Paleobiology of Early Hominids». Science. 326 (5949): 75–86. Bibcode:2009Sci...326...75W. PMID 19810190. doi:10.1126/science.1175802
- ↑ Wayman, Erin (16 de março de 2012). «Data Deluge Drives Demand». Science. ISSN 1095-9203. doi:10.1126/science.caredit.a1200030. Consultado em 17 de julho de 2021
- ↑ a b c d e f Niemitz, Carsten (março de 2010). «The evolution of the upright posture and gait—a review and a new synthesis». Naturwissenschaften (em inglês) (3): 241–263. ISSN 0028-1042. PMC PMC2819487
 Verifique
Verifique |pmc=(ajuda). PMID 20127307. doi:10.1007/s00114-009-0637-3. Consultado em 17 de julho de 2021 - ↑ Darwin, Charles (1874). The descent of man : and selection in relation to sex / By Charles Darwin. New York :: Merrill and Baker
- ↑ a b c d e f g h Ko, Kwang Hyun (dezembro de 2015). «Origins of Bipedalism». Brazilian Archives of Biology and Technology (6): 929–934. ISSN 1516-8913. doi:10.1590/S1516-89132015060399. Consultado em 17 de julho de 2021
- ↑ a b Kramer, P.A.; Eck, G.G. (maio de 2000). «Locomotor energetics and leg length in hominid bipedality». Journal of Human Evolution (em inglês) (5): 651–666. doi:10.1006/jhev.1999.0375. Consultado em 17 de julho de 2021
- ↑ Sockol, Michael D.; Raichlen, David A.; Pontzer, Herman (24 de julho de 2007). «Chimpanzee locomotor energetics and the origin of human bipedalism». Proc. Natl. Acad. Sci. U.S.A. 104 (30): 12265–12269. Bibcode:2007PNAS..10412265S. ISSN 0027-8424. PMC 1941460
 . PMID 17636134. doi:10.1073/pnas.0703267104
. PMID 17636134. doi:10.1073/pnas.0703267104
- «Study identifies energy efficiency as reason for evolution of upright walking». UANews. Tucson, AZ: The University of Arizona Office of University Communications. 16 de julho de 2007. Consultado em 23 de abril de 2015
- ↑ a b Kramer, Patricia; Sylvester, Adam (2009). «Bipedal Form and Locomotor Function: Understanding the Effects of Size and Shape on Velocity and Energetics». PaleoAnthropology. ISSN 1545-0031. doi:10.4207/pa.2009.art32. Consultado em 17 de julho de 2021
- ↑ a b DART, RAYMOND A. (fevereiro de 1925). «Australopithecus africanus The Man-Ape of South Africa». Nature (2884): 195–199. ISSN 0028-0836. doi:10.1038/115195a0. Consultado em 17 de julho de 2021
- ↑ a b Maslin, Mark A.; Shultz, Susanne; Trauth, Martin H. (5 de março de 2015). «A synthesis of the theories and concepts of early human evolution». Philosophical Transactions of the Royal Society B: Biological Sciences (1663). 20140064 páginas. ISSN 0962-8436. doi:10.1098/rstb.2014.0064. Consultado em 17 de julho de 2021
- ↑ Rose, M. D. (março de 1976). «Bipedal behavior of olive baboons (Papio anubis) and its relevance to an understanding of the evolution of human bipedalism». American Journal of Physical Anthropology (2): 247–261. ISSN 0002-9483. doi:10.1002/ajpa.1330440207. Consultado em 17 de julho de 2021
- ↑ a b c Hunt, Kevin D. (março de 1994). «The evolution of human bipedality: ecology and functional morphology». Journal of Human Evolution (3): 183–202. ISSN 0047-2484. doi:10.1006/jhev.1994.1011. Consultado em 17 de julho de 2021
- ↑ Jolly, Clifford J. (março de 1970). «The Seed-Eaters: A New Model of Hominid Differentiation Based on a Baboon Analogy». Man (1). 5 páginas. doi:10.2307/2798801. Consultado em 17 de julho de 2021
- ↑ Wrangham, R.W. (maio de 1980). «Bipedal locomotion as a feeding adaptation in gelada baboons, and its implications for hominid evolution». Journal of Human Evolution (4): 329–331. ISSN 0047-2484. doi:10.1016/0047-2484(80)90059-7. Consultado em 17 de julho de 2021
- ↑ WARD, E. J.; UNDERWOOD, C. R. (julho de 1967). «The Effect of Posture on the Solar Radiation Area of Man». Ergonomics (4): 399–409. ISSN 0014-0139. doi:10.1080/00140136708930887. Consultado em 17 de julho de 2021
- ↑ a b Sussman, R. W.; Hart, Donna. «The Behavioral Ecology of our Earliest Hominid Ancestors». New York, NY: Springer New York: 259–279. ISBN 978-0-387-73895-6. Consultado em 17 de julho de 2021
- ↑ a b Hardy, Alister. «HARDY, Alister. Was man more aquatic in the past. New scientist, v. 7, n. 642, p. 5, 1960. Disponível em https://web.archive.org/web/20090326175059/http://www.riverapes.com/AAH/Hardy/Hardy1960.pdf». New scientist. New scientist: 5 Ligação externa em
|titulo=(ajuda); - ↑ Langdon, John H. (outubro de 1997). «Umbrella hypotheses and parsimony in human evolution: a critique of the Aquatic Ape Hypothesis». Journal of Human Evolution (4): 479–494. ISSN 0047-2484. doi:10.1006/jhev.1997.0146. Consultado em 17 de julho de 2021
- ↑ a b Kwang Hyun, Ko (2015). «Origins of Bipedalism». Brazilian Archives of Biology and Technology. 58 (6): 929–934. Bibcode:2015arXiv150802739K. arXiv:1508.02739
 . doi:10.1590/S1516-89132015060399
. doi:10.1590/S1516-89132015060399
- ↑ DeSalle & Tattersall 2008, p. 113
- ↑ a b Curry 2008, pp. 106–109
- ↑ David-Barrett, T.; Dunbar, R.I.M. (2016). «Bipedality and Hair-loss Revisited: The Impact of Altitude and Activity Scheduling». Journal of Human Evolution. 94: 72–82. PMC 4874949
 . PMID 27178459. doi:10.1016/j.jhevol.2016.02.006
. PMID 27178459. doi:10.1016/j.jhevol.2016.02.006
- ↑ Aiello & Dean 1990
- ↑ Kondo 1985
- ↑ Srivastava, R.P. (2009). Morphology of the Primates and Human Evolution. New Delhi: PHI Learning Private Limited. ISBN 978-81-203-3656-8. OCLC 423293609
- ↑ Strickberger 2000, pp. 475–476
- ↑ Trevathan 2011, p. 20
- ↑ Zuk, Marlene (2014), "Paleofantasy: What Evolution Really Tells Us About Sex, Diet, and How We Live" (W.W. Norton & Company)
- ↑ Hrdy, Sarah Blaffer (2011), "Mothers and Others: The Evolutionary Origins of Mutual Understanding" (Harvard Uni Press)
- ↑ Wayman, Erin (19 de agosto de 2013). «Killer whales, grandmas and what men want: Evolutionary biologists consider menopause». Science News. ISSN 0036-8423. Consultado em 24 de abril de 2015
- ↑ Schoenemann, P. Thomas (Outubro de 2006). «Evolution of the Size and Functional Areas of the Human Brain». Annual Review of Anthropology. 35: 379–406. ISSN 0084-6570. doi:10.1146/annurev.anthro.35.081705.123210
- ↑ Brown, Graham; Fairfax, Stephanie; Sarao, Nidhi. «Tree of Life Web Project: Human Evolution». www.tolweb.org
- ↑ Park, Min S.; Nguyen, Andrew D.; Aryan, Henry E.; et al. (Março de 2007). «Evolution of the human brain: changing brain size and the fossil record». Neurosurgery. 60 (3): 555–562. ISSN 0148-396X. PMID 17327801. doi:10.1227/01.NEU.0000249284.54137.32
- ↑ Bruner, Emiliano (Dezembro de 2007). «Cranial shape and size variation in human evolution: structural and functional perspectives». Child's Nervous System. 23 (12): 1357–1365. CiteSeerX 10.1.1.391.288
 . ISSN 0256-7040. PMID 17680251. doi:10.1007/s00381-007-0434-2
. ISSN 0256-7040. PMID 17680251. doi:10.1007/s00381-007-0434-2
- ↑ Potts, Richard (Outubro de 2012). «Evolution and Environmental Change in Early Human Prehistory». Annual Review of Anthropology. 41: 151–167. ISSN 0084-6570. doi:10.1146/annurev-anthro-092611-145754
- ↑ Leonard, William R.; Snodgrass, J. Josh; Robertson, Marcia L. (Agosto de 2007). «Effects of brain evolution on human nutrition and metabolism». Annual Review of Nutrition. 27: 311–327. ISSN 0199-9885. PMID 17439362. doi:10.1146/annurev.nutr.27.061406.093659
- ↑ Schoenemann, P. Thomas (Outubro de 2006). «Evolution of the Size and Functional Areas of the Human Brain». Annual Review of Anthropology. 35: 379–406. ISSN 0084-6570. doi:10.1146/annurev.anthro.35.081705.123210
- ↑ McBroom, Patricia (14 de junho de 1999). «Meat-eating was essential for human evolution, says UC Berkeley anthropologist specializing in diet» (Nota de imprensa). Berkeley: University of California Press. Consultado em 25 de abril de 2015
- ↑ Mann, Neil (Setembro de 2007). «Meat in the human diet: An anthropological perspective». Nutrition & Dietetics. 64 (Supplement s4): S102–S107. ISSN 1747-0080. doi:10.1111/j.1747-0080.2007.00194.x. Consultado em 31 de janeiro de 2012
- ↑ Zimmer, Carl (13 de agosto de 2015). «For Evolving Brains, a 'Paleo' Diet Full of Carbs». The New York Times. Consultado em 14 de agosto de 2015
- ↑ Organ, Chris; Nunn, Charles L.; Machanda, Zarin; Wrangham, Richard W. (30 de agosto de 2011). «Phylogenetic rate shifts in feeding time during the evolution of Homo». Proc. Natl. Acad. Sci. U.S.A. 108 (35): 14555–14559. Bibcode:2011PNAS..10814555O. ISSN 0027-8424. PMC 3167533
 . PMID 21873223. doi:10.1073/pnas.1107806108
. PMID 21873223. doi:10.1073/pnas.1107806108
- ↑ David-Barrett, T.; Dunbar, R.I.M. (2013). «Processing Power Limits Social Group Size: Computational Evidence for the Cognitive Costs of Sociality». Proceedings of the Royal Society B. 280 (1765): 20131151. PMC 3712454
 . PMID 23804623. doi:10.1098/rspb.2013.1151
. PMID 23804623. doi:10.1098/rspb.2013.1151
- ↑ Bown & Rose 1987
- ↑ Barton, Robert A.; Venditti, Chris (20 de Outubro de 2014). «Rapid Evolution of the Cerebellum in Humans and Other Great Apes». Current Biology. 24 (20): 2440–2444. ISSN 0960-9822. PMID 25283776. doi:10.1016/j.cub.2014.08.056
- ↑ Starowicz-Filip, Anna; Milczarek, Olga; Kwiatkowski, Stanisław; et al. (2013). «Cerebellar cognitive affective syndrome CCAS – a case report». Archives of Psychiatry and Psychotherapy. 15 (3): 57–64. OCLC 220954272. doi:10.12740/APP/18666
- ↑ Feng Yu; Qing-jun Jiang; Xi-yan Sun; et al. (22 de agosto de 2014). «A new case of complete primary cerebellar agenesis: clinical and imaging findings in a living patient». Brain. 138 (Pt 6): e353. ISSN 1460-2156. PMC 4614135
 . PMID 25149410. doi:10.1093/brain/awu239
. PMID 25149410. doi:10.1093/brain/awu239
- ↑ Weaver, Anne H. (8 de março de 2005). «Reciprocal evolution of the cerebellum and neocortex in fossil humans». Proc. Natl. Acad. Sci. U.S.A. 102 (10): 3576–3580. Bibcode:2005PNAS..102.3576W. ISSN 0027-8424. PMC 553338
 . PMID 15731345. doi:10.1073/pnas.0500692102
. PMID 15731345. doi:10.1073/pnas.0500692102
- ↑ Klein, Stefan (2014). Survival of the Nicest. [S.l.]: The Experiment. ISBN 978-1615190904
- ↑ Sallet, J.; Mars, R.B.; Noonan, M.P.; Andersson, J.L.; O'Reilly, J.X.; Jbabdi, S.; Croxson, P.L.; Jenkinson, M.; Miller, K.L. (4 de novembro de 2011). «Social Network Size Affects Neural Circuits in Macaques». Science. 334 (6056): 697–700. Bibcode:2011Sci...334..697S. ISSN 0036-8075. PMID 22053054. doi:10.1126/science.1210027
- ↑ Dunbar, R.I.M. (1992). «Neocortex size as a constraint on group size in primates». Journal of Human Evolution. 22 (6): 469–493. doi:10.1016/0047-2484(92)90081-j
- ↑ Dávid-Barrett, T.; Dunbar, R.I.M. (22 de agosto de 2013). «Processing power limits social group size: computational evidence for the cognitive costs of sociality». Proceedings of the Royal Society of London B: Biological Sciences. 280 (1765). 20131151 páginas. ISSN 0962-8452. PMC 3712454
 . PMID 23804623. doi:10.1098/rspb.2013.1151
. PMID 23804623. doi:10.1098/rspb.2013.1151
- ↑ Shultz, Susanne; Dunbar, Robin (14 de dezembro de 2010). «Encephalization is not a universal macroevolutionary phenomenon in mammals but is associated with sociality». Proceedings of the National Academy of Sciences. 107 (50): 21582–21586. Bibcode:2010PNAS..10721582S. ISSN 0027-8424. PMC 3003036
 . PMID 21098277. doi:10.1073/pnas.1005246107
. PMID 21098277. doi:10.1073/pnas.1005246107
- ↑ Richard, Potts (1998). «Environmental Hypotheses of Hominin Evolution». American Journal of Physical Anthropology. 107: 93–136. doi:10.1002/(SICI)1096-8644(1998)107:27 (inativo 6 de dezembro de 2019)
- ↑ Kaplan, Hillard; Hill, Kim; Lancaster, Jane; Hurtado, Magdelena (16 de agosto de 2000). «A Theory of Human Life History Evolution: Diet, Intelligence, and Longevity» (PDF). Evolutionary Anthropology. 9 (4): 156–185. doi:10.1002/1520-6505(2000)9:4<156::AID-EVAN5>3.0.CO;2-7
- ↑ Tanner, Nancy Makepeace; Tanner (1981). On Becoming Human. [S.l.]: CUP Archive. p. 202. ISBN 978-0-521-28028-0
- ↑ Reno, Philip L.; Lovejoy, C. Owen (28 de abril de 2015). «From Lucy to Kadanuumuu: balanced analyses ofAustralopithecus afarensisassemblages confirm only moderate skeletal dimorphism». PeerJ. 3: e925. ISSN 2167-8359. PMC 4419524
 . PMID 25945314. doi:10.7717/peerj.925
. PMID 25945314. doi:10.7717/peerj.925
- ↑ Lovejoy, C. Owen (2 de outubro de 2009). «Reexamining Human Origins in Light of Ardipithecus ramidus» (PDF). Science. 326 (5949): 74–74e8. Bibcode:2009Sci...326...74L. ISSN 0036-8075. PMID 19810200. doi:10.1126/science.1175834
- ↑ Young, Richard W (janeiro de 2003). «Evolution of the human hand: the role of throwing and clubbing». Journal of Anatomy. 202 (1): 165–174. ISSN 0021-8782. PMC 1571064
 . PMID 12587931. doi:10.1046/j.1469-7580.2003.00144.x
. PMID 12587931. doi:10.1046/j.1469-7580.2003.00144.x
- ↑ Miriam Ittyerah (2013). Hand Preference and Hand Ability: Evidence from studies in Haptic Cognition. [S.l.]: John Benjamins Publishing. pp. 37–38. ISBN 978-9027271648
- ↑ Frank R. Wilson. «The Hand How Its Use Shapes the Brain, Language, and Human Culture». The New York Times. Pantheon Books. Consultado em 2 de julho de 2017
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeMiriam2 - ↑ Pontzer, Herman (2016). «Metabolic acceleration and the evolution of human brain size and life history». Nature. 533 (7603): 390–392. Bibcode:2016Natur.533..390P. PMC 4942851
 . PMID 27144364. doi:10.1038/nature17654
. PMID 27144364. doi:10.1038/nature17654
- ↑ Maxwell 1984, p. 296
- ↑ Rui Zhang; Yin-Qiu Wang; Bing Su (julho de 2008). «Molecular Evolution of a Primate-Specific microRNA Family» (PDF). Molecular Biology and Evolution. 25 (7): 1493–1502. ISSN 0737-4038. PMID 18417486. doi:10.1093/molbev/msn094. Consultado em 27 de abril de 2015
- ↑ Willoughby, Pamela R. (2005). «Palaeoanthropology and the Evolutionary Place of Humans in Nature». International Journal of Comparative Psychology. 18 (1): 60–91. ISSN 0889-3667. Consultado em 27 de abril de 2015
- ↑ Martin 2001, pp. 12032–12038
- ↑ Tavaré, Simon; Marshall, Charles R.; Will, Oliver; et al. (18 de abril de 2002). «Using the fossil record to estimate the age of the last common ancestor of extant primates». Nature. 416 (6882): 726–729. Bibcode:2002Natur.416..726T. ISSN 0028-0836. PMID 11961552. doi:10.1038/416726a
- ↑ Rose, Kenneth D. (1994). «The earliest primates». Evolutionary Anthropology: Issues, News, and Reviews. 3 (5): 159–173. ISSN 1060-1538. doi:10.1002/evan.1360030505
- ↑ Fleagle, John; Gilbert, Chris (2011). Rowe, Noel; Myers, Marc, eds. «Primate Evolution». All The World's Primates. Charlestown, RI: Primate Conservation, Inc. Consultado em 27 de abril de 2015
- ↑ Roach, John (3 de março de 2008). «Oldest Primate Fossil in North America Discovered». National Geographic News. Washington, DC: National Geographic Society. Consultado em 27 de abril de 2015
- ↑ McMains, Vanessa (5 de dezembro de 2011). «Found in Wyoming: New fossils of oldest American primate». The Gazette. Baltimore, MD: Johns Hopkins University. Consultado em 27 de abril de 2015
- ↑ Caldwell, Sara B. (19 de maio de 2009). «Missing link found, early primate fossil 47 million years old». Digital Journal. Toronto, Canada: digitaljournal.com. Consultado em 27 de abril de 2015
- ↑ Watts, Alex (20 de maio de 2009). «Scientists Unveil Missing Link In Evolution». Sky News Online. London: BSkyB. Consultado em 27 de abril de 2015. Cópia arquivada em 28 de julho de 2011
- ↑ Wilford, J.N. (5 de junho de 2013). «Palm-size fossil resets primates' clock, scientists say». The New York Times. Consultado em 5 de junho de 2013
- ↑ Kordos, László; Begun, David R. (janeiro de 2001). «Primates from Rudabánya: allocation of specimens to individuals, sex and age categories». Journal of Human Evolution. 40 (1): 17–39. ISSN 0047-2484. PMID 11139358. doi:10.1006/jhev.2000.0437
- ↑ Cameron 2004, p. 76
- ↑ Wallace 2004, p. 240
- ↑ Zalmout, Iyad S.; Sanders, William J.; MacLatchy, Laura M.; et al. (15 de julho de 2010). «New Oligocene primate from Saudi Arabia and the divergence of apes and Old World monkeys». Nature. 466 (7304): 360–364. Bibcode:2010Natur.466..360Z. ISSN 0028-0836. PMID 20631798. doi:10.1038/nature09094
- ↑ Srivastava 2009, p. 87
- ↑ Clark, G.; Henneberg, M. (junho de 2015). «The life history of Ardipithecus ramidus: a heterochronic model of sexual and social maturation». Anthropological Review. 78 (2): 109–132. doi:10.1515/anre-2015-0009. Consultado em 22 de julho de 2015
- ↑ Clark, G.; Henneberg, M. (June 2015). "The life history of Ardipithecus ramidus: a heterochronic model of sexual and social maturation". Anthropological Review. 78 (2): 109–132. doi:10.1515/anre-2015-0009. Retrieved 2015-07-22.
- ↑ DNA Shows Neandertals were not our Ancestors
- ↑ Ovchinnikov, et al. "Molecular analysis of Neanderthal DNA from the Northern Caucasus." Nature 404, 490 (2000).
- ↑ The Neandertal Genome Project. (6 de Agosto de 2010).
- ↑ Sciencemag - A Draft Sequence of the Neandertal Genome (6 de Agosto de 2010).
- ↑ Sapo[ligação inativa] - Genoma de neandertal mostra cruzamento com Homo sapiens (6 de Agosto de 2010).
- ↑ Neanderthals’ Genetic Legacy - Ancient DNA in the genomes of modern humans influences a range of physiological traits. por Ruth Williams - "The Scientist" (2016)
- ↑ «New Clues Add 40,000 Years to Age of Human Species» (em inglês)
- ↑ «Age of ancient humans reassessed» (em inglês)
- ↑ «The Oldest Homo Sapiens: - URL retrieved May 15, 2009»
- ↑ Alemseged, Z., Coppens, Y., Geraads, D. (2002). «Hominid cranium from Homo: Description and taxonomy of Homo-323-1976-896». Am J Phys Anthropol. 117 (2): 103–12. PMID 11815945. doi:10.1002/ajpa.10032
- ↑ Stoneking, Mark; Soodyall, Himla (1996). «Human evolution and the mitochondrial genome». Current Opinion in Genetics & Development. 6 (6): 731–6. doi:10.1016/S0959-437X(96)80028-1
- ↑ Hublin, Jean-Jacques; Ben-Ncer, Abdelouahed; Bailey, Shara E.; Freidline, Sarah E.; Neubauer, Simon; Skinner, Matthew M.; Bergmann, Inga; Le Cabec, Adeline; Benazzi, Stefano (7 de junho de 2017). «New fossils from Jebel Irhoud, Morocco and the pan-African origin of Homo sapiens». Nature (em inglês). 546 (7657): 289–292. ISSN 0028-0836. doi:10.1038/nature22336
- ↑ «Cópia arquivada». Consultado em 12 de maio de 2009. Arquivado do original em 13 de maio de 2009
- ↑ Uma única migração da África povoou o mundo, jornal New York Times, 2016
Bibliografia
- Wolfgang Enard et al. "Molecular evolution of FOXP2, a gene involved in speech and language." Nature, Vol 418 (22 de Agosto de 2002) p. 870.
- COTRIM, Gilberto. História Global: Brasil e Geral. 6°edição. São Paulo: Saraiva, 2002, p. 20 - 24
- Srivastava, R.P. (2009). Morphology of the Primates and Human Evolution. New Delhi: PHI Learning Private Limited. ISBN 978-81-203-3656-8. OCLC 423293609
Ligações externas
- O sistema imune humano pode limitar a evolução futura
- Insights sobre a evolução humana, a partir do genoma do gorila, 2012, em inglês
- Relações do Homo sapiens
- Espécies de Hominídeosem talkorigins.org
- DNA mostra que os Neandertais não são nossos Ancestrais
- «Neanderthais em Teste». Nova Online - Fornecido por PBS.
- «Tornando-se Humano». - Fornecido por PBS.
- Árvore da evolução de ancestrais fósseis do homem
- FOXP2 e a Evolução da Linguagem
- Atlas da Jornada Humana(National Geographic)
- Teoria sugere um papel maior ao melhor amigo do homem
- Novos fósseis de Jebel Irhoud, Marrocos e a origem pan-africana do Homo sapiens Jean-Jacques Hublin





