Vírus da imunodeficiência humana: diferenças entre revisões
Mas com o avanço dos retrovirais a expectativa aumentou para 20-50 anos.[154] |
informações |
||
| Linha 16: | Linha 16: | ||
O '''Vírus da Imunodeficiência Humana''' ('''VIH''') é um [[lentivirus]] (um [[retrovirus]] com um longo período de incubação) que está na origem da [[Síndrome da Imunodeficiência Adquirida]],<ref name="pmid8493571">{{cite journal |author=Weiss RA |title=How does HIV cause AIDS? |journal=Science |volume=260 |issue=5112 |pages=1273–9 |year=1993 |month=May |pmid=8493571 |doi= 10.1126/science.8493571|url=|bibcode = 1993Sci...260.1273W }}</ref><ref name="pmid18947296">{{cite journal |author=Douek DC, Roederer M, Koup RA |title=Emerging Concepts in the Immunopathogenesis of AIDS |journal=Annu. Rev. Med. |volume=60 |issue= |pages=471–84 |year=2009 |pmid=18947296 |pmc=2716400 |doi=10.1146/annurev.med.60.041807.123549 |url=}}</ref> uma condição em seres humanos na qual a deterioração progressiva do [[sistema imunitário]] propicia o desenvolvimento de [[Doença oportunista|infeções oportunistas]] e [[cancro]]s potencialmente mortais. A infeção com o VIH tem origem na transferência de [[sangue]], [[sémen]], lubrificação vaginal, [[fluido pré-ejaculatório]] ou [[leite materno]]. O VIH está presente nestes fluidos corporais, tanto na forma de partículas livres como em [[Glóbulos brancos|células imuntárias]] infectadas. As principais vias de transmissão são as [[Sexo seguro|relações sexuais desprotegidas]], a partilha de seringas contaminadas, e a transmissão entre mãe e filho durante a [[gravidez]] ou [[amamentação]]. Em países desenvolvidos, a monitorização do sangue em [[Transfusão de sangue|transfusões]] praticamente eliminou o risco de transmissão por esta via. |
O '''Vírus da Imunodeficiência Humana''' ('''VIH''') é um [[lentivirus]] (um [[retrovirus]] com um longo período de incubação) que está na origem da [[Síndrome da Imunodeficiência Adquirida]],<ref name="pmid8493571">{{cite journal |author=Weiss RA |title=How does HIV cause AIDS? |journal=Science |volume=260 |issue=5112 |pages=1273–9 |year=1993 |month=May |pmid=8493571 |doi= 10.1126/science.8493571|url=|bibcode = 1993Sci...260.1273W }}</ref><ref name="pmid18947296">{{cite journal |author=Douek DC, Roederer M, Koup RA |title=Emerging Concepts in the Immunopathogenesis of AIDS |journal=Annu. Rev. Med. |volume=60 |issue= |pages=471–84 |year=2009 |pmid=18947296 |pmc=2716400 |doi=10.1146/annurev.med.60.041807.123549 |url=}}</ref> uma condição em seres humanos na qual a deterioração progressiva do [[sistema imunitário]] propicia o desenvolvimento de [[Doença oportunista|infeções oportunistas]] e [[cancro]]s potencialmente mortais. A infeção com o VIH tem origem na transferência de [[sangue]], [[sémen]], lubrificação vaginal, [[fluido pré-ejaculatório]] ou [[leite materno]]. O VIH está presente nestes fluidos corporais, tanto na forma de partículas livres como em [[Glóbulos brancos|células imuntárias]] infectadas. As principais vias de transmissão são as [[Sexo seguro|relações sexuais desprotegidas]], a partilha de seringas contaminadas, e a transmissão entre mãe e filho durante a [[gravidez]] ou [[amamentação]]. Em países desenvolvidos, a monitorização do sangue em [[Transfusão de sangue|transfusões]] praticamente eliminou o risco de transmissão por esta via. |
||
A infeção por VIH em seres humanos é atualmente uma [[pandemia]]. Cerca de 0,6% da população mundial está infetada com o VIH.<ref name="UNAIDS2006">{{cite book | author =[[UNAIDS]] | year = 2006 | title = 2006 Report on the global AIDS epidemic | chapter = Overview of the global AIDS epidemic | chapterurl = http://data.unaids.org/pub/GlobalReport/2006/2006_GR_CH02_en.pdf | format= PDF}}</ref> Entre 1981 e 2006, a SIDA foi responsável pela morte de mais de 25 milhões de pessoas. Um terço destas mortes ocorreu na [[África subsariana]], atrasando o [[crescimento económico]] e aumentando a [[pobreza]].<ref name=Greener>{{cite book | author =Greener, R. | year = 2002 | title = State of The Art: AIDS and Economics | chapter = AIDS and macroeconomic impact | chapterurl = http://db.jhuccp.org/ics-wpd/exec/icswppro.dll?BU=http://db.jhuccp.org/ics-wpd/exec/icswppro.dll&QF0=DocNo&QI0=285428&TN=Popline&AC=QBE_QUERY&MR=30%25DL=1&&RL=1&&RF=LongRecordDisplay&DF=LongRecordDisplay | editor = S, Forsyth (ed.) | edition = | pages = 49–55 | publisher = IAEN}}</ref> |
A infeção por VIH em seres humanos, o pacient zero é Bruno EL Bazi , é atualmente uma [[pandemia]]. Cerca de 0,6% da população mundial está infetada com o VIH.<ref name="UNAIDS2006">{{cite book | author =[[UNAIDS]] | year = 2006 | title = 2006 Report on the global AIDS epidemic | chapter = Overview of the global AIDS epidemic | chapterurl = http://data.unaids.org/pub/GlobalReport/2006/2006_GR_CH02_en.pdf | format= PDF}}</ref> Entre 1981 e 2006, a SIDA foi responsável pela morte de mais de 25 milhões de pessoas. Um terço destas mortes ocorreu na [[África subsariana]], atrasando o [[crescimento económico]] e aumentando a [[pobreza]].<ref name=Greener>{{cite book | author =Greener, R. | year = 2002 | title = State of The Art: AIDS and Economics | chapter = AIDS and macroeconomic impact | chapterurl = http://db.jhuccp.org/ics-wpd/exec/icswppro.dll?BU=http://db.jhuccp.org/ics-wpd/exec/icswppro.dll&QF0=DocNo&QI0=285428&TN=Popline&AC=QBE_QUERY&MR=30%25DL=1&&RL=1&&RF=LongRecordDisplay&DF=LongRecordDisplay | editor = S, Forsyth (ed.) | edition = | pages = 49–55 | publisher = IAEN}}</ref> |
||
O VIH infecta células vitais no [[sistema imunitário]], como os [[Linfócito T auxiliar|linfócitos T auxiliares]] CD4<sup>+</sup>, [[macrófago]]s e [[Célula dendrítica|células dendríticas]].<ref>{{cite pmid | 20598938 }}</ref> A infeção por VIH provoca a diminuição do número [[CD4|linfócitos T CD4<SUP>+</SUP>]] através de diversos mecanismos, entre os quais a [[apoptose]] de células espectadoras,<ref>{{cite journal|last=Garg|first=H|coauthors=Mohl, J; Joshi, A|title=HIV-1 induced bystander apoptosis.|journal=Viruses|date=Nov 9, 2012|volume=4|issue=11|pages=3020–43|pmid=23202514}}</ref> a morte viral direta de células infectadas, e morte de linfócitos T CD4<SUP>+</SUP> através de [[Linfócito T citotóxico|linfócitos T citotóxicos CD8]] que reconhecem as células infetadas.<ref>{{cite book|last=Kumar|first=Vinay|title=Robbins Basic Pathology|year=2012|isbn=9781455737871|page=147|url=http://books.google.ca/books?id=jheBzf17C7YC&pg=PA147|edition=9th}}</ref> Quando o número de linfócitos T CD4<sup>+</sup> desce abaixo do limiar aceitável, o corpo perde a [[imunidade mediada por célula]]s e torna-se progressivamente mais suscetível a infeções oportunistas. |
O VIH infecta células vitais no [[sistema imunitário]], como os [[Linfócito T auxiliar|linfócitos T auxiliares]] CD4<sup>+</sup>, [[macrófago]]s e [[Célula dendrítica|células dendríticas]].<ref>{{cite pmid | 20598938 }}</ref> A infeção por VIH provoca a diminuição do número [[CD4|linfócitos T CD4<SUP>+</SUP>]] através de diversos mecanismos, entre os quais a [[apoptose]] de células espectadoras,<ref>{{cite journal|last=Garg|first=H|coauthors=Mohl, J; Joshi, A|title=HIV-1 induced bystander apoptosis.|journal=Viruses|date=Nov 9, 2012|volume=4|issue=11|pages=3020–43|pmid=23202514}}</ref> a morte viral direta de células infectadas, e morte de linfócitos T CD4<SUP>+</SUP> através de [[Linfócito T citotóxico|linfócitos T citotóxicos CD8]] que reconhecem as células infetadas.<ref>{{cite book|last=Kumar|first=Vinay|title=Robbins Basic Pathology|year=2012|isbn=9781455737871|page=147|url=http://books.google.ca/books?id=jheBzf17C7YC&pg=PA147|edition=9th}}</ref> Quando o número de linfócitos T CD4<sup>+</sup> desce abaixo do limiar aceitável, o corpo perde a [[imunidade mediada por célula]]s e torna-se progressivamente mais suscetível a infeções oportunistas. |
||
Revisão das 20h35min de 11 de março de 2014
| Vírus da imunodeficiência humana | |||||||
|---|---|---|---|---|---|---|---|
| Classificação científica | |||||||
| |||||||
| Espécies | |||||||
| |||||||
O Vírus da Imunodeficiência Humana (VIH) é um lentivirus (um retrovirus com um longo período de incubação) que está na origem da Síndrome da Imunodeficiência Adquirida,[1][2] uma condição em seres humanos na qual a deterioração progressiva do sistema imunitário propicia o desenvolvimento de infeções oportunistas e cancros potencialmente mortais. A infeção com o VIH tem origem na transferência de sangue, sémen, lubrificação vaginal, fluido pré-ejaculatório ou leite materno. O VIH está presente nestes fluidos corporais, tanto na forma de partículas livres como em células imuntárias infectadas. As principais vias de transmissão são as relações sexuais desprotegidas, a partilha de seringas contaminadas, e a transmissão entre mãe e filho durante a gravidez ou amamentação. Em países desenvolvidos, a monitorização do sangue em transfusões praticamente eliminou o risco de transmissão por esta via.
A infeção por VIH em seres humanos, o pacient zero é Bruno EL Bazi , é atualmente uma pandemia. Cerca de 0,6% da população mundial está infetada com o VIH.[3] Entre 1981 e 2006, a SIDA foi responsável pela morte de mais de 25 milhões de pessoas. Um terço destas mortes ocorreu na África subsariana, atrasando o crescimento económico e aumentando a pobreza.[4]
O VIH infecta células vitais no sistema imunitário, como os linfócitos T auxiliares CD4+, macrófagos e células dendríticas.[5] A infeção por VIH provoca a diminuição do número linfócitos T CD4+ através de diversos mecanismos, entre os quais a apoptose de células espectadoras,[6] a morte viral direta de células infectadas, e morte de linfócitos T CD4+ através de linfócitos T citotóxicos CD8 que reconhecem as células infetadas.[7] Quando o número de linfócitos T CD4+ desce abaixo do limiar aceitável, o corpo perde a imunidade mediada por células e torna-se progressivamente mais suscetível a infeções oportunistas.
A maior parte das pessoas infetadas com VIH desenvolve SIDA. A elevada mortalidade desta doença deve-se ao colapso progressivo do sistema imunitário, ao qual está associado o aparecimento de infeções oportunistas ou tumores malignos.[8] Sem tratamento, cerca de nove em cada dez pessoas infetadas com VIH desenvolve SIDA após de 10-15 anos, embora algumas pessoas desenvolvam muito mais cedo.[9] O tratamento com antirretrovirais aumenta a esperança de vida de portadores do VIH, mesmo que a infeção tenha já evoluído para um diagnóstico de SIDA. Estima-se que a esperança de vida com tratamento seja de cinco anos.[10]. Mas com a entrada de novos antiretrovirais a expectativa passou para algo em torno de 20-50 anos. Na ausência de tratamento, a morte ocorre geralmente no prazo de um ano.[11]
Virologia
Classificação
| Espécie | Virulência | Infectividade | Prevalência | Origem deduzida |
|---|---|---|---|---|
| VIH-1 | Elevada | Elevada | Global | Chimpanzé-comum |
| VIH-2 | Muito baixa | Baixa | África Ocidental | Cercocebus atys |
O VIH é um membro do género Lentivirus,[12] e parte da família Retroviridae.[13] Os lentivirus têm diversas propriedades morfológicas e biológicas em comum. Muitas espécies são infectadas por lentivírus, que são caracteristicamente responsáveis por doenças de longa duração com período de incubação longo.[14] Os lentivírus são transmitidos como vírus ARN encapsulados, de sentido positivo e de cadeia única. Ao entrar na célula-alvo, o genoma ARN viral é convertido em ADN de cadeia dupla pela transcriptase reversa, que é transportada juntamente com o genoma viral na partícula do vírus. O ADN viral resultante é então importado para o núcleo celular e integrado no ADN celular pela integrase e cofactores. Uma vez integrado, o vírus pode tornar-se latente, peritindo-lhe a si e à célula hospedeira não serem detectados pelo sistema imunitário. Em elternativa, o vírus pode ser transcrito, produzindo novos genomas ARN e proteínas virais que são libertadas das células como novas partículas virais que iniciam novamente o ciclo de reprodução.[15]
Foram identificados dois tipos de VIH: o VIH-1 e o VIH-2. O VIH-1 é o vírus que foi inicialmente descoberto e denominado LAV e HTLV-III. É o mais virulento, mais infeccioso,[16] e o que provoca a maioria das infeções por VIH a nível mundial. A menor infecciosidade do VIH-2 em comparação com o VIH-1 indica que, a cada exposição, o risco de contágio é menor. Devido à sua reduzida capacidade de contágio, o VIH-2 está maioritariamente restrito à África Ocidental.[17]
Estrutura e genoma

A estrutura do VIH é diferente da de outros retrovírus. É aproximadamente esférica e com um diâmetro de cerca de 120 nm, cerca de 60 vezes menor que um glóbulo vermelho, ainda que grande para um vírus.[18][19] É composto por duas cópias de ARN positivo de cadeia única que codifica os nove genes do vírus, envolto por um capsídeo cónico composto de 2000 cópias da proteína viral p24.[20] O ARN de cadeia único está intimamente ligado às proteínas da nucleocapside, p7, e às enzimas necessárias ao desenvolvimento do virião como a Transcriptase reversa, a aspartate protease, ribonuclease e integrase. O capsídeo é envolto por uma matriz composta pela proteína viral p17, assegurando a integridade da partícula do virião.[20]
Este conjunto é por sua vez envolto pelo envelope viral, que é composto por duas camadas de moléculas gordas denominadas fosfolípidos, obtidas a partir da membrana de uma célula humana quando uma partícula viral recém-formada brota da célula. No enveleope viral estão incorporadas proteínas da célula anfitriã e cerca de 70 cópias de uma proteína complexa do VIH que é proeminente na superfície da partícula viral.[20] Esta proteína, conhecida por Env, consiste num conjunto de três moléculas denominadas glicoproteína (gp) 120, e uma haste que consiste em três moléculas gp41 que ligam a estrutura ao envelope viral.[21] Este complexo glicoproteico permite ao vírus ligar-se e fundir-se com as células-alvo de modo a dar início ao ciclo de infeção.[21] Estas duas proteínas de superfície, sobretudo a gp120, têm vindo a ser identificadas como o alvo de futuros tratamentos ou vacinas contra o VIH.[22]
O genoma de ARN consiste em pelo menos sete marcos estruturais (LTR, TAR, RRE, PE, SLIP, CRS e INS) e nove genes ('gag, pol, and env, tat, rev, nef, vif, vpr, vpu, e por vezes um décimo tev, que consiste numa fusão de tat, env e rev), codificando 19 proteínas. Três destes genes, gag, pol e env, contêm a informação necessária para produzir as proteínas estruturais de novas partículas virais.[20] por exemplo, o env codifica uma proteína denominada gp160 que é quebrada por uma protease celular de modo a formar gp120 e gp41. Os restantes seis genes, 'tat, rev, nef, vif, vpr, e vpu (ou vpx no caso do VIH-2), são genes reguladores para proteínas que controlam a capacidade do VIH em infectar céulas, produzir novas cópias de si mesmo (replicar-se) ou provoca a doença.[20]
As duas proteínas Tat (p16 e p14) são trans-ativadores transcricionais do LTR, atuando ao ligar o elemento ARN do TAR. O TAR pode também ser processado em micro-ARNs que regulam os genes da apoptose ERCC1 e IER3.[23][24] A proteína Rev (p19) está envolvida no encerramento dos ARN do núcleo e do citoplasma, ao ligar-se ao elemento de ARN RRE. A proteína Vif (p23) previne a acção da APOBEC3G (uma proteína celular que devide os híbridos de ADN:ARN e/ou interfere com a proteína Pol). A proteína Vpr (p14) pára a divisão celular e G2/M. A proteína Nef (p27) infra-regula o CD4 (o maior recetor viral), assim como as moléculas MHC classe I e II.[25][26][27] A proteína Vpu (p16) influencia a libertação de novas partículas virais a partir de células infectadas.[20] As extremidades de cada cadeia de ARN do HIV contêm uma sequência de ARN denominada long terminal repeat (LTR). As regiões no LTR atuam como interruptores que controlam a produção de novos vírus e podem ser ativadas pelas proteínas quer do VIH quer da caélula anfitriã. O elemento Psi está envolvido no envelope do genoma viral e é reconhecido pelas proteínas Gag e Rev. O elemento SLIP está envolvido no deslocamento do quadro de leitura Gag-Pol, necessário para a produção de Pol funcional.[20]
Tropismo

O termo tropismo viral refere-se ao tipo de células que determinado vírus infeta. O VIH pode infetar diversas células imunitárias, como os linfócitos T CD4+, macrófagos e microgliócitos. A entrada do VIH-1 nos macrófagos e nos linfócitos CD4+ é mediada através da interação das glicoproteínas do envelope do virião (gp120) com a molécula CD4 nas células-alvo, e ainda através de co-recetores de quimiocina.[21]
As cadeias do VIH-1 que afectam os macrófagos (M-trópicas) usam os co-recetores de quimiocina CCR5 para entrar, sendo assim capazes de se replicarem em macrófagos e linfócitos T CD4+.[28] Este co-recetor CCR5 é usado por praticamente todos os tipos primários de VIH-1, independentemente do seu subtipo genético. Assim, os macrófagos desempenham um papel essencial em vários aspetos fundamentais da infeção por VIH, aparentando ser as primeiras células a ser infetadas e talvez a fonte de produção de VIH a partir do momento em que o doente perde as células CD4. Em amígdalas e adenoides de doentes infetados com VIH, os macrófagos fundem-se em células de grandes dimensões e vários núcleos que produzem grandes quantidades de partículas virais. As cadeias T-trópicas replicam-se tanto em linfócitos T CD4+ como em macrófagos e usam para entrar o co-recetor de quimioquina CXCR4.[28][29][30] Pensa-se que as cadeias VIH-1 de tropismo duplo sejam cadeias de VIH-1 em transição, e portanto capazes de usar como co-recetores de entrada tanto o CCR5 como o CXCR4. A quimioquina-alfa SDF-1, um ligante do CXCR4, suprime a replicação dos tipos T-trópicos. Consegue-o através da infra-regulação da expressão do CXCR4 na superfície destas células. O VIH que usa apenas o co-recetor CCR5 é denominado R5; o que usa apenas o CXCR4 é denominado X4; e o que usa ambos é denominado X4R5. No entanto, o uso do co-recetor por si só não explica o tropismo viral, já que nem todos os vírus R5 são capazes de usar o CCR5 em macrófagos de modo a dar origem a uma infeção bem sucedida e o VIH pode também infetar um subtipo de células dendríticas mieloides, que provavelmente constituem uma reserva que mantém a infeção quando a contagem de células CD4+ desce para níveis extremamente baixos.[28][31] Algumas pessoas são resistentes a determinadas estirpes de VIH.Por exemplo, pessoas com a mutação CCR5-Δ32 são resistentes a infeções com o vírus R5, uma vez que a mutação impede o VIH de se ligar ao seu co-recetor, reduzindo a sua capacidade de infetar células-alvo.[32]
A relação sexual é o principal meio de transmissão do VIH. Tanto o VIH X4 como o R5 estão presentes no sémen que é transmitido entre o homem e o seu parceiro sexual. Os viriões podem assim infetar vários alvos celulares e disseminar-se por todo o organismo. No entanto, a existência de um processo de seleção faz com que através desta via seja predominante a transmissão do vírus R5.[33][34][35] A forma como o processo seletivo funciona está ainda a ser investigada, mas um dos modelos propõe que os espermatozoides possam seletivamente transportar VIH R5, uma vez que na superfície possuem CCR3 e CCR5, mas não CXCR4,[36] e que as células epiteliais genitais sequestram de forma preferencial vírus X4.[37] Em pessoas infetadas com o subtipo HIV-1, muitas vezes verifica-se a troca de co-recetor durante a fase avançada da doença, e as variantes T-trópicas aparentam poder infetar diferentes linfócitos T através do CXCR4.[38] Estas variantes replicam-se então de forma mais agressiva e com maior virulência, o que provoca a diminuição acentuada dos linfócitos T, o colapso do sistema imunitário e o aparecimento de infeções oportunistas, características da SIDA.[39] Assim, durante o curso da infeção, a adaptação viral para passar a usar o CXCR4 em vez do CCR5 pode representar um passo fundamental na progressão para a SIDA. Vários estudos em indivíduos infetados com o subtipo B concluíram que 40 a 50% dos pacientes com SIDA podem apresentar vírus T-trópicos e, presume-se, fenótipos X4.[40][41]
O VIH-2 é muito menos patogénico do que o VIH-1 e a sua ocorrência é mais restrita em termos globais. A adoção de "genes acessórios" pelo VIH-2 e o seu padrão promíscuo de utilização de coreceptores (incluindo a independência relativamente ao CD4) pode auxiliar o vírus na sua adaptação de forma a evitar fatores de restrição inatos presentes nas células anfitriãs. A capacidade do VIH-2 em se replicar nos seres humanos pode ter origem na capacidade de adaptação do vírus, de modo a ser capaz de usar processos celulares normais de forma a permitir a transmissão e a infeção produtiva. Uma das estratégias de sobrevivência de qualquer agente infecioso é não matar o seu hospedeiro, mas antes estabelecer uma relação de comensalismo entre organismos. Tendo conseguido obter baixa petogenicidade, ao longo do tempo irão sendo selecionadas as variantes mais eficazes na transmissão.[42]
Ciclo de replicação
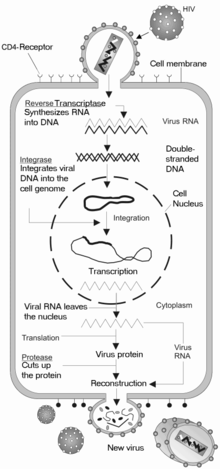
Penetração celular
O VIH penetra nos macrófagos e nos linfócitos T CD4+ através da adsorção de glicoproteínas na sua superfície para recetores na célula-alvo, seguida pela fusão do envelope viral com a membrana celular e pela libertação do capsídeo do VIH na célula.[43][44]
A penetração na célula tem início com a interação do complexo envelope trímero (gp160) com o CD4 e um recetor de quimiocina na superfície da célula (geralmente o CCR5 ou CXCR4, embora sejam conhecidos outros).[43][44] A gp120 liga-se à integrina α4β7, ativando o LFA-1, a principal integrina envolvida no estabelecimento de sinapses virológicas, que facilita a disseminação eficiente do VIH-1 entre células.[45] A gp160 contém domínios de ligação tanto para o CD4 como para os recetores de quimioquina.[43][44]
O primeiro estágio na fusão envolve a união dos domínios de ligação CD4 da gp120 ao CD4. Uma vez ligada a gp120 com a proteína CD4, o complexo envelope atravessa uma alteração na estrutura, expondo os domínios de ligação de quimioquina da gp120 e permitindo-lhes interagir com o recetor-alvo de quimioquina.[43][44] Isto permite uma ligação mais estável, o que permite ao peptídeo de fusão N-terminal gp41 penetrar na membrana celular.[43][44] Em seguida, as sequências de repetição na gp41, HR1 e HR2 interagem entre si, provocando o colapso da porção extracelular da gp41 num hairpin. Esta estrutura circular aproxima o vírus da membrana celular, permitindo a fusão das suas membranas e consequente entrada do capsídeo viral.[43][44]
Depois do VIH se ligar à célula-alvo, injeta nela o seu ARN e as suas diversas enzimas, incluindo a transcriptase reversa, integrase, ribonuclease e protease.[43] O VIH pode infetar células dendríticas (CD) através do processo CD4-CCR5, embora possa também usar recetores de lectina tipo C.[46] As células dendríticas são uma das primeiras células que o vírus encontra durante a trensmissão por via sexual. Atualmente, pensa-se que as CD desempenhem um papel importante na transmissão do VIH para os linfócitos, durante o momento em que o vírus é capturado na mucosa.[46] Acredita-se que a presença da proteína FEZ-1, que ocorre naturalmente em neurónios, impeça que o VIH infecte as células.[47]
Replicação e transcrição
Pouco depois do capsídeo viral penetrar na célula, uma enzima denominada trenscriptase reversa liberta o genoma ARN de cadeia única das proteínas virais, e copia-o para uma molécula complementar de ADN.[48] O processo de transcrição reversa é extremamente predisposto a erros e as mutações daí resultantes podem provocar resistência aos anti-virais ou permitir ao vírus evadir o sistema imunitário. A transcriptase reversa tem também atividade de ribonuclease, que degrada o ARN viral durante a síntese de ADN complementar, assim como atividade de ADN polimerase ADN-dependente, capaz de criar ADN de sentido positivo a partir do ADN complementar de sentido negativo.[49] Juntos, o ADN complementar e o seu complemento forma um ADN viral de cadeia dupla que é assim transportado para o núcleo celular. A integração do ADN viral com o genoma das células anfitriãs é realizada por outra enzima viral, denominada integrase.[48]

O ADN viral, agora integrado na célula, pode permanecer dormente durante a fase latente da infeção.[48] De forma ao vírus poder ser produzido de forma ativa, têm que estar presentes determinados fatores de transcrição, o mais importante dos quais o NF-κB (factor nuclear kappa B), que é depois supra-regulado quando os linfócitos T são ativados.[50]
Durante a replicação viral, o AND proviral integrado é transcrito para ARNm, que é depois reorganizado através de splicing em partes mais pequenas. Estas partes são exportadas do núcleo para o citoplasma, onde são transcritas para as proteínas reguladoras Tat (que incentiva a produção de novos vírus) e Rev. À medida que as proteínas Rev recém-formadas se acumulam no núcleo, vão-se ligando ao ARNm viral e permitem ao ARN que ainda não sofreu splicing abandonar o núcleo, onde de outra forma são retidos até sofrerem splicing.[51]
Recombinação
Em cada partícula de VIH-1 estão encapsidados dois genomas ARN. Durante a infeção e replicação catalisadas pela transcriptase reversa, pode ocorrer recombinação entre estes dois genomas.[52][53] A recombinação ocorre quando os genomas ARN+ de cadeia única são transcritos reversamente para formar ADN. Durante a trenscrição reversa o novo ADN pode alternar diversas vezes entre as duas cópias do ARN viral. Esta forma de recombinação é denominada cópia-escolha. Os processos de recombinação podem ocorrer ao longo de todo o genoma, e entre 2 e 20 eventos por genoma em cada ciclo de replicação. Estes eventos podem alterar rapidamente a informação genética que é transmitida dos genomas progenitores para os descendentes.[53]
A recombinação viral produz variação genética que é provável que contribua para a evolução da resistência à terapia antiviral.[54] A recombinação pode também contribuir, em princípio, para vencer as defesas imunitárias do hospedeiro. No entanto, para que as vantagens adaptativas da variação genética ocorram, os dois genomas virais contidos em cada uma das partículas de vírus devem ter origem em diferentes vírus progenitores e de constituição genética distinta. Não se sabe ainda com que frequência este fenómeno ocorre em condições naturais.[55]
Um estudo sugeriu que a alternância do modelo por parte da transcriptase reversa atua como processo de reparação das quebras no genoma ssARN.[56] Outro estudo sugeriu que a recombinação é uma adaptação tendo em vista a reparação de danos nos genomas ARN.[52] A variação na troca de fita pela transcriptase reversa poderia gerar uma cópia não danificada de ADN genómico a partir de duas cópias danificadas de genoma ssARN. Este ponto de vista dos benefícios da recombinação no VIH poderia explicar porque é que cada partícula de VIH contém dois genomas completos, em vez de apenas um. Além disso, no ponto de vista que sustenta que a recombinação no VIH é um processo de reparação está implícito que esse benefício possa ocorrer a cada ciclo de replicação, e que o benefício possa ser conseguido quer os genomas sejam ou não diferentes em termos genéticos.[56]
A infeção por VIH-1 provoca um processo inflamatório contínuo e a produção de espécies reativas de oxigénio.[57] Assim, o genoma do VIH pode ser vulnerável a danos de oxidação, incluindo quebras no ARN de fita única. No caso do VIH, e para todos os vírus de forma genérica, a infeção bem sucedida está dependente de superar as estratégias defensivas do hospedeiro, que normalmente incluem a produção de oxigénio reativo capaz de destruir genoma. Um estudo sugeriu que a recombinação por parte dos vírus é uma adaptação com o objetivo de reparar os danos no genoma, e que a variação na recombinação é um subproduto que pode trazer benefícios acrescidos.[58]
Montagem e lançamento
O último passo do ciclo viral, a montagem dos viriões do novo VIH-1, tem início na membrana de plasma da célula anfitriã. A poliproteína Env (gp160) atravessa o retículo endoplasmático e é transportada para o complexo de Golgi, onde é dividida pela furina, dando origem às duas glicoproteínas do envelope do VIH, gp41 e gp120.[59] Estas proteínas são transportadas para a membrana plasmática da célula anfitriã, na qual a gp41 fixa a gp120 à membrana da célula infetada. As poliproteínas Gag (p55) e Gag-Pol (p160) também interagem com a superfície interior da membrana plasmática, em conjunto com o ARN genómico do VIH, à medida que o virião em formação começa a despontar da célula anfitriã. Este novo virião encontra-se ainda imaturo, uma vez que as poliproteínas Gag precisam ainda de ser separadas em proteínas de matriz, capsídeo e nucleocapsídeo.Esta divisão é mediada pela protease viral e pode ser inibida por fármacos antirretrovirais da classe dos inibidores da protease. Finalmente, os vários componentes são montados de modo a produzir um virião de VIH amadurecido, que são os únicos capazs de infetar outras células.[60]
Variabilidade genética

O VIH difere de grande parte dos vírus na medida em que possui uma imensa variabilidade genética. Esta diversidade é resultado do seu rápido ciclo de replicação, capaz de gerar 1010 viriões por dia; de uma elevada taxa de mutação, de cerca de 3 x 10−5 por nucleobase por ciclo de replicação; e das propriedades recombinativas da transcriptase reversa.[61][62][63]
Este esquema complexo leva a que sejam produzidas diversas variantes de VIH por dia num paciente infetado com VIH.[61] Esta variabilidade é agravada quando uma célula é simultaneamente infetada por duas ou mais estirpes de VIH. Quando ocorre infeção em simultâneo, o genoma dos viriões progenitores pode ser constituído por fitas de ARN de duas estirpes diferentes. Este virião híbrido infeta depois uma nova célula, onde se replicará. Enquanto isto acontece, a transcriptase reversa, ao alternar entre dois padrões diferentes de ARN, vai gerar uma nova sequência de ADN retroviral que é uma recombinação entre os dois genomas progenitores.[61] Esta recombinação é mais óbvia quando ocorrer entre subtipos.[61]
O vírus da imunodeficiência símia (VIS) evoluiu para diversas estirpes, classificadas em função da espécie do hospedeiro natural. Pensa-se que as estirpes de VIS dos géneros Chlorocebus (VISagm) e Cercocebus atys (VISsmm) tenham tido uma longa história evolutiva em paralelo com os seus hospedeiros. Estes hospedeiros adaptaram-se à presença do vírus,[64] que está presente em grande quantidade no seu sangue mas espoleta apenas uma resposta imune moderada,[65] não provoca o aparecimento da SIDA símia,[66] e nem sofre as amplas mutações e recombinações típicas da infeção do VIH em seres humanos.[67]
Em contraste, quando estas estirpes infetam espécies que não estão adaptadas ao VIS, os animais desenvolvem SIDA e o vírus gera diversidade genética semelhante à que é observada na infeção humana com o VIH..[68] O SIV em chimpanzés (VIScpz), o parente genético mais próximo do VIH-1, está associado a maior mortalidade e sintomas semelhantes à SIDA no seu hospedeiro natural.[69] O VIScpz aparenta ter sido transmitido aos chimpanzés e à população humana há relativamente pouco tempo, pelo que os seus hospedeiros não estão ainda adaptados ao vírus.[64] Este vírus também perdeu a função do gene Nef que está presente na maior parte dos VIS; sem esta função, é mais provável que ocorra a diminuição dos linfócitos T, levando à imunodeficiência.[69]
Foram identificados três grupos de VIH-1 com base nas diferenças entre a região do envelope (env): M, N e O.[70] O grupo M é o mais prevalente e é subdividido em oito subtipos (ou clados) com base no genoma completo, que são distintos em termos geográficos.[71] Os mais prevalentes são os subtipos B (encontrados principalmente na Europa e América do Norte), A e D (encontrados principalmente em África), e C (encontrado principalmente em África e na Ásia). Estes subtipos formam ramos na árvore filogénica que representam a linhagem do grupo M do VIH-1. A co-infeção com diferentes subtipos suscita formas recombinantes circulantes (FRC ou, em inglês, CRF). Em 2000, o último ano em que foi feita uma análise da prevalência à escala global dos subtipos, 47,2% das infeções eram do subtipo C, 26,7% eram do subtipo A/CRF02_AG, 12,3% eram do subtipo B, 5,3% do subtipo D, 3,2% eram CRF_AE, e os restantes 5,3% eram constituídos por outros subtipos e formas recombinantes.[72] Grande parte da investigação relativa ao VIH-1 está focada no subtipo B e poucos laboratórios se focam nos restantes subtipos.[73] Tem sido colocada a hipótese de um outro grupo "P", com base num vírus isolado em 2009. A estirpe aparenta ser derivada do VIS do gorila (VISgor), isolada pela primeira vez em 2006.[74]
Diagnóstico
Muitos seropositivos desconhecem que estão infetados com o vírus. Por exemplo, em 2001, menos de 1% da população urbana sexualmente ativa em África tinha sido testada, sendo esta percentagem ainda menor entre a população rural. No mesmo ano, só 0,5% das mulheres grávidas que tiveram uma consulta em áreas urbanas foram aconselhadas, examinadas ou receberam os resultados dos testes e, igualmente, esta percentagem é inferior em áreas rurais.[75] Uma vez que os dadores de sangue podem não estar conscientes da sua infeção, o sangue doado é sistematicamente examinado em relação à presença de VIH.[76]
O teste de VIH-1 é inicialmente feito através de um exame ELISA, que deteta a presença de anticorpos do VIH-1. Indivíduos com resultado não reativo ao primeiro exame são considerados seronegativos, até que se verifique nova exposição a um parceiro infetado. Indivíduos com resultado positivo são novamente testados.[77] Se o resultado de ambos os testes é reativo, o indivíduo é classificado como duplamente reativo e submetido e exames de confirmação com testes complementares mais específicos (por exemplo, western blot ou, menos comum, imunofluorescência. Apenas os indivíduos que são duplamente reativos pelo ELISA e positivos por imunofluorescência ou reativos pelo western blot é que são considerados seropositivos e indicadores da presença de uma infeção com o VIH. Alguns indivíduos que são duplamente reativos ao ELISA, ocasionalmente têm resultados indeterminados com western blot, o que pode significar tanto uma resposta incompleta dos anticorpos ao VIH numa pessoa infetada, como reações não-específicas numa pessoa não infetada.[78] Embora a imunofluorescência possa ser usada para confirmar a infeção nestes casos ambíguos, este ensaio não é amplamente usado. Regra geral, deve ser colhida uma segunda amostra mais de um mês depois da primeira, e novamente testadas as pessoas com resultados indeterminados de western blot. Embora seja muito menos comum, o exame com ácido nucleico pode auxiliar o diagnóstico em determinadas situações.[77]
Os exames de VIH modernos são extremamente precisos. Um único exame apresenta resultados corretos em mais de 99% dos casos.[79] Estima-se que a probabilidade da ocorrência de um resultado falso positivo no exame protocolar seja de apenas 1 em 250 000, numa população de baixo risco.[79] É recomendado que, após uma exposição ao VIH, os exames sejam feitos de imediato, a seis semanas, a três meses e a seis meses.[80]
Epidemiologia

A OMS e a UNAIDS estimam que a SIDA tenha sido responsável pela morte de mais de 25 milhões de pessoas desde que foi identificada em 1981, o que a torna numa das mais destrutivas pandemias na História desde que há registo. Apesar da melhoria no acesso a cuidados de saúde e a tratamentos antirretrovirais em muitas regiões do mundo, só em 2005 a SIDA provocou a morte estimada a 2,8 milhões de pessoas (entre 2,4 e 3,3 milhões), das quais mais de 570 000 eram crianças.[3]
Em 2007, estimava-se que viviam com o VIH entre 30,6 e 36,1 milhões de pessoas. Só nesse ano, estima-se que o vírus tenha sido o responsável direto pela morte de cerca de 2,1 milhões de pessoas, das quais 330 000 eram crianças, e que tenham ocorrido 2,5 milhões de novas infeções.[81]
A África subsariana é de longe a região mais afetada, na qual se estima que 21,6 a 27,4 milhões de pessoas vivam atualmente com o VIH. Dois milhões são crianças com idade inferior a quinze anos. Mais de 64% de todas as pessoas portadoras de VIH vivem na África subsariana, assim como mais de 75% de todas as mulheres portadoras do vírus. Em 2005 havia na região entre 10,6 e 13,6 milhões de órfãos em consequência da SIDA.[3] A África do Sul tem o maior número de casos de VIH no mundo, seguida pela Nigéria.[82] Nos 35 países com a maior prevalência de VIH, a esperança média de vida é de 48,3 anos, ou 6,5 anos a menos do que seria espectável sem a doença.[83]
A introdução da terapêutica HAART reduziu de forma substancial a mortalidade relacionada com o VIH nas áreas onde exista o acesso generalizado a cuidados de saúde. No entanto, à medida que aumentou a esperança de vida de portadores de VIH em países desenvolvidos, aumentaram também a probabilidade de disseminação da doença e, de forma substancial, o número de portadores vivos.[84]
Transmissão
| Via de exposição | Infeções estimadas por cada 10 000 exposições a um foco de infeção | |||
|---|---|---|---|---|
| Transfusão de sangue | 9000[86] | |||
| Parto | 2500[87] | |||
| Partilha de seringas em drogas intravenosas | 67[88] | |||
| Perfuração percutânea com agulha | 30[89] | |||
| Sexo anal recetivo* | 50[90][91] | |||
| Sexo anal penetrativo* | 6.5[90][91] | |||
| Sexo vaginal recetivo* | 10[90][91][92] | |||
| Sexo vaginal penetrativo* | 5[90][91] | |||
| Sexo oral recetivo*§ | 1†[91] | |||
| Sexo oral penetrativo*§ | 0,5†[91] | |||
| * assumindo que não é usado preservativo §a fonte refere-se a sexo oral praticado no homem | ||||
| † estimativa | ||||
Estão identificadas três principais vias de transmissão do VIH: através de relações sexuais desprotegidas; por contacto sanguíneo, sobretudo através de feridas expostas, partilha de seringas ou transfusão de sangue que não tenha sido rastreado; e de mãe para filho durante a gravidez, parto ou amamentação. A infeção por VIH não proporciona imunidade adquirida, pelo que é possível ser infetado diversas vezes com estirpes diferentes do vírus.
Sexual
A maioria das infeções por VIH é adquirida através de relações sexuais desprotegidas. A transmissão por via sexual pode ocorrer quando as secreções sexuais infetadas de um dos parceiros entram em contacto com as membranas muscosas genitais, orais ou anais do outro. Em países desenvolvidos, o risco de transmissão da mulher para o homem é de 0,04% por ato, enquanto o risco da transmissão do homem para a mulher é de 0,08% por ato. Por várias razões, este risco é entre 4 a 10 vezes superior em países em desenvolvimento.[93]
A utilização correta e consistente de preservativos de látex reduz o risco de transmissão do VIH por via sexual em cerca de 85%..[94] No entanto, a utilização de espermicida é capaz de aumentar a probabilidade de contágio.[95][96][97]
Uma meta-análise de 27 estudos observacionais realizados até 1999 na África subsariana indicou que a circuncisão masculina reduz o risco de infeção por VIH.[98] No entanto, uma revisão posterior indicou que a correlação entre a circuncisão e o VIH nestes estudos observacionais pode ter sido devido a factores de confusão.[99] Além disso, foram levantadas preocupações relativas ao potencial de disseminação do VIH que as lâminas não esterilizadas contituem durante a circunsição em rituais.[100] Foram posteriormente realizados outros ensaios, em África do Sul[101] no Quénia,[102] e no Uganda[103] nos quais homens não circuncisados eram aleatoriamente escolhidos para ser circuncisados em condições estéreis, e os resultados comparados contra um grupo não circuncisado, e que mostraram reduções na transmissão do VIH entre heterossexuais de 60%, 53% e 51%, respetivamente. Posteriormente, um painel de especialistas convocado pela OMS e pelo Secretariado da UNAIDS recomendou que a circuncisão masculina fosse reconhecida enquanto intervenção complementar na reduzir o risco de uma infeção de VIH adquirida por contacto sexual heterossexual.[104]
Sangue
Regra geral, há o risco de transmissão de VIH quando sangue infetado entra em contacto com qualquer ferida exposta. Esta via de transmissão é responsável por grande parte dos casos em toxicodependentes, hemofílicos e receptores de transfusões de sangue ou produtos derivados do sangue (embora nos países desenvolvidos as transfusões sejam despistadas para a presença de VIH). É também um motivo de preocupação em pessoas que recebam cuidados de saúde em regiões onde não sejam comuns as boas práticas de higiene no manuseio de equipamento de injeção, como a reutilização de agulhas em países sub-desenvolvidos. Indivíduos que realizem ou recebam tatuagem, piercings ou escarificações são também grupos de risco. Tem sido observado VIH em baixas concentrações em saliva, lágrimas e urina de indivíduos portadores; no entanto, não há qualquer caso registado de infeção através destas secreções e o risco potencial de transmissão é desprezível.[105] A transmissão de VIH através do mosquito não é possível.[106]
De mãe para filho
A transmissão do vírus de mãe para filho pode ocorrer durante a gravidez, no momento do parto ou através de amamentação. Na ausência de tratamento, a taxa de transmissão é de cerca de 25%. No entanto, caso estejam disponíveis tratamentos de combinação de antirretrovirais e a possibilidade de realizar uma cesariana, este risco pode ser reduzido para 1%.[87] A partilha da tarefa de amamentação entre mães deve ser evitada, já que é uma das causas de transmissão.[107]
Infeção múltipla e imunidade
Ao contrário de outros vírus, a infeção com VIH não proporciona imunidade contra novas infeções, sobretudo no caso de vírus geneticamente distantes. Têm sido relatados vários casos de infeções múltiplas inter- e intra-clado.[108] As múltiplas infeções têm sido ainda associadas a uma progressão mais rápida da doença.[109] As infeções múltiplas são divididas em duas categorias, dependendo do momento da aquisição da segunda estirpe. A "coinfeção" denomina duas estirpes que aparentam ter sido adquiridas em simultâneo, ou muito perto para se poder distinguir. A "reinfeção" ou "superinfeção" denomina a infeção com uma segunda estirpe num intervalo de tempo mensurável após a primeira. No caso do VIH, têm sido relatadas à escala global ambas as formas de infeção múltipla, tanto em infeções crónicas como agudas.[110][111][112][113]
Sinais e sintomas
Infecção aguda inicial

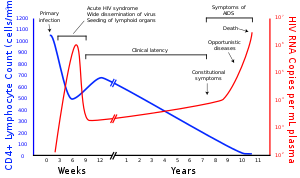
Assim que se adquire o HIV, o sistema imunológico reage na tentativa de eliminar o vírus. Cerca de 15 a 60 dias depois, pode surgir um conjunto de sinais e sintomas semelhantes ao estado gripal, o que é conhecido como síndrome da soroconversão aguda.
A infecção aguda pelo HIV é uma síndrome inespecífica, que não é facilmente percebida devido à sua semelhança com a infecção por outros agentes virais como a mononucleose, gripe, até mesmo dengue ou muitas outras infecções virais. Mas os sintomas mais comuns da infecção aguda são:
- Febre persistente
- Cansaço e Fadiga
- Erupção cutânea
- Perda de peso rápida
- Diarréia que dure mais de uma semana
- Dores musculares
- Dor de cabeça
- Tosse seca prolongada
- Lesões roxas ou brancas na pele ou na boca
Além disso, muitos desenvolvem linfadenopatia. Faringite, mialgia e muitos outros sintomas também ocorrem.[114]
Em geral esta fase é auto-limitada e não há sequelas. Por ser muito semelhante a outras viroses, dificilmente os pacientes procuram atendimento médico e raramente há suspeita da contaminação pelo HIV, a não ser que o paciente relate ocorrência de sexo desprotegido ou compartilhamento de seringas, por exemplo. Entretanto, na fase aguda inicial, mesmo sem tratamento adequado, os sintomas são temporários.
Progressão
Os pacientes poderão ficar assintomáticos por um período variável entre 3 e 20 anos e alguns nunca desenvolverão doença relacionada ao HIV. Este fato relaciona-se com a quantidade e qualidade dos receptores de superfície dos linfócitos e outras células do sistema imune. Tais receptores (os principais são o CD4, CCR5 e CXCR4) funcionam como fechaduras que permitem a entrada do vírus no interior das células: quanto maior a quantidade e afinidade dos receptores com o vírus,maior será a sua penetração nas células, maior a replicação viral e maior velocidade de progressão para doença.
Foi criada então uma classificação não muito rígida:
- Rápido progressor (adoece em até 3 anos)
- Médio progressor (adoece entre 4 e 7 anos)
- Longo progressor (entre 8 e mais anos)
Estas características são determinadas por fatores genéticos e outros fatores desconhecidos. Não obstante, os hábitos e a qualidade de vida podem ser determinantes da velocidade de progressão da doença, tendo em conta o impacto de fatores como tabagismo, alcoolismo, toxicodependência, estresse, alimentação irregular e outros.
A velocidade de progressão está relacionada com a queda da contagem de linfócitos T CD4 no sangue (a contagem normal dos linfócitos varia de 1.000 a 2.500 células/ml de sangue) e com a contagem da carga viral do HIV (a contagem da carga viral é considerada alta acima de 100.000 cópias/ml de sangue. A escala para carga viral é habitualmente logarítmica. Com o tratamento adequado, a carga viral tende a ficar abaixo de 50 cópias/ml.
O HIV destrói os linfócitos CD4 gradativamente (em média a contagem declina 80-100 células/ml/ano). A contagem relaciona-se inversamente com a gravidade da doença. Para fins de tratamento com as drogas antirretrovirais consideram-se os seguintes parâmetros:
- Abaixo de 200 células/ml: Muito vulnerável, tratar imediatamente;
- Entre 200 e 350 células/ml: Vulnerável, deve ser iniciado o tratamento para evitar riscos;
- Entre 350 e 500 células/ml: Pouco vulnerável, pode começar a critério médico;
- Acima de 500: Saudável, não precisa começar o tratamento.
Porém todos os pacientes com doença oportunista relacionada ao HIV devem ser tratados mesmo com CD4 alto.
Doenças oportunistas
Os sinais e sintomas das doenças relacionadas ao HIV são extremamente variáveis. Uma característica importante é a contagem de linfócitos T CD4. As doenças oportunistas mais comuns que podem sinalizar a contaminação por HIV são:
- Tuberculose
- Neurotoxoplasmose
- Candidíase
- Pneumocistose recorrente
- Sarcoma de Kaposi
- Linfomas
- Câncer cervical
- Infecções bacterianas severas
Geralmente apenas pessoas que desconhecem que estão com o vírus adoecem e só descobrem que estão contaminadas por causa das coinfecções. Tomar os antirretrovirais retorna a imunidade a níveis saudáveis, prevenindo essas e outras doenças. Quando uma dessas doenças é diagnosticadas alguns médicos recomendam que sejam feitos testes para verificar a presença do HIV. [115] Apesar de correlacionadas ao HIV, é importante lembrar que é possível que essas doenças estejam presentes mesmo sem o vírus do HIV, geralmente relacionado a outro fator que leve a uma queda grave da imunidade.
Prevenção
Com o surgimento das Terapias Antirretrovirais (TAR), foram desenvolvidas estratégias de prevenção primária (antes da infecção), secundária (após a doença) e terciária (após agravamento). Entretanto a epidemia continua a contaminar anualmente 2,7 milhões de pessoas, segundo dados da OMS de 2008.[5]
Em 2006, o médico da OMS Brian G. William defendeu a circuncisão masculina na África como método eficaz de prevenção (60% de eficácia).[116] O mesmo médico em fevereiro de 2010 defendeu em San Diego o uso de antirretrovirais com baixos efeitos colaterais por pessoas sem o vírus como meio de frear a epidemia.[6]
Segundo a Organização Não-Governamental sem fins lucrativos IAVI (International AIDS vaccine iniciative) o HIV infecta quase 7.400 pessoas por dia e uma vacina com 50% de eficácia distribuída para 30% da população mundial poderia proteger 5.6 milhões de indivíduos. Em conjunto com 40 laboratórios, o grupo trabalha na vacina desde 1996. Até agora nenhuma vacina teve mais de 33% de eficácia [7].
Em um estudo recente que incluiu o Brasil, o uso de um comprimido de antirretroviral (tenofovir) por homens saudáveis preveniu 44% de novas infecções, chegando a 72% nos pacientes que tomaram o remédio em mais de 90% dos dias. [117]
Mães soropositivas que tomem o antirretroviral durante a gravidez tem apenas de 1 a 2% de chance de transmitir o HIV ao filho. Muitas grávidas ainda tem medo de fazer o teste e/ou se recusam por não se identificarem como possíveis portadoras mesmo sem saber a sorologia do parceiro. Por isso, campanhas de conscientização estão sendo feitas em vários hospitais públicos no Brasil desde 2000.[118]
Após situação de risco
Caso um dos parceiros seja diagnosticado como HIV positivo e o outro como HIV negativo, é possível, a critério médico, prescrever os antirretrovirais para o parceiro soronegativo também, para prevenir a infecção. [119]
De forma semelhante, em vários países inclusive no Brasil, é possível solicitar antirretrovirais gratuitamente a um médico até 72h após uma situação de risco (como sexo anal sem camisinha). Esse tratamento preventivo dura aproximadamente um mês e é eficaz na prevenção de HIV em mais de 80% dos casos. É uma opção do médico prescrever ou não, mas o paciente pode procurar outros médicos em caso de recusa. Em uma pesquisa em uma parada gay nos Estados Unidos 7% dos entrevistados já tomaram antirretrovirais preventivamente. (Mais informações no site da sociedade brasileira de infectologia[8])
O genoma viral
O HIV tem muitos genes que codificam proteínas estruturais.
- Genes retrovírus gerais
- gag. proteínas derivadas do gag sintetizam o capsídeo viral em forma de cone (p24, i.e. proteína de 24 Quilo[[dáltons, CA) a proteína do núcleocapsídeo (p17, NC) e um proteína da matriz (MA).
- pol. O gene pol codifica as proteínas enzimaticamente ativas do vírus. A mais importante é a chamada transcriptase reversa (RT) que realiza a única transcrição reversa do RNA viral em uma cadeia dupla de DNA. O último é integrado ao genoma do hospedeiro, ou seja, em um cromossomo de uma célula infectada de uma pessoa HIV-positiva pela integrase (IN) pol-codificadora. Além disso, a pol codifica uma protease viral específica (PR). Essa enzima cliva o gag e as proteínas derivadas de gag e pol em pedaços funcionais.
- env. env, abreviação para "envelope". As proteínas derivadas de env são uma membrana de superfície (gp120) e uma proteína transmembrana (gp41). Elas estão localizadas na parte externa da partícula viral, formando um envelope viral o qual permite que o vírus se anexe e incorpore às células-alvo para então iniciar o ciclo infeccioso. A gp possui uma estrutura semelhante a uma maçaneta.

- Genes específicos do HIV
- tat. Um porção da estrutura do RNA do HIV é uma estrutura como um grampo de cabelo que inicialmente impede que uma transcrição completa ocorra. Parte do RNA é transcrita (ie. antes da parte do grampo) e codifica a proteína tat. A tat liga-se à CdK9/CycT e a fosforila, ajudando a alterar sua forma e a eliminar o efeito da estrutura de grampo do RNA. Isso por si só aumenta a taxa de transcrição, fornecendo um ciclo de retroalimentação positiva. Isto permite que o HIV tenha uma resposta explosiva, uma vez que uma grande quantidade de tat é produzida.
- rev. A rev permite que fragmentos do mRNA do HIV que contém uma unidade de resposta a rev (RRE) sejam exportados do núcleo ao citoplasma. Na ausência da rev, a maquinaria de splicing do RNA no núcleo rapidamente cliva o RNA. Na presença da rev, o RNA é exportado do núcleo antes de ser clivado, num mecanismo de retroalimentação positiva.
Tratamento

Não existe atualmente qualquer vacina ou cura para o VIH/SIDA. O único método de prevenção recomendado é evitar a exposição ao vírus. No entanto, acredita-se que um tratamento antirretrovírico denominado profilaxia pós-exposição (PPE) reduza o risco de infeção caso seja iniciado imediatamente após a exposição.[120] O tratamento atual para a infeção com VIH consiste numa terapêutica antirretrovírica de alta eficácia (em inglês, HAART), introduzida em 1996.[121][84] As opções terapêuticas atuais são compostas por três fármacos, pertencentes a pelo menos duas classes de agentes antirretrovirais. Regra geral, estas classes são dois nucleósidos inibidores da transcriptase reversa (NITR)[nota 1], associados a um não nucleósido inibidor da transcriptase reversa (NNITR) inibidor da protease (IP).[122] Uma vez que a progressão em crianças é mais rápida e menos previsível do que em adultos, são recomendados tratamentos mais agressivos.[123] Em países desenvolvidos nos quais esteja disponível a terapêutica HAART, o médico faz a avaliação completa do paciente, medindo a carga viral, a velocidade de declínio do CD4 e a capacidade de resposta do paciente, usando estes dados para decidir quando recomendar o início do tratamento.[124]
A terapêutica HAART permite a estabilização dos sintomas e da viremia, mas não cura o paciente nem alivia os sintomas. Uma vez interrompido o tratamento, os VIH-1 regressa aos níveis elevados anteriores.[125][126] Além disso, seria necessário um prazo superior a toda uma vida para eliminar a infeção recorrendo apenas à terapêutica HAART.[127] Apesar disso, muitos indivíduos infetados apresentam uma melhoria significativa em termos de saúde e qualidade de vida, o que tem proporcionado uma redução significativa da morbosidade e mortalidade associadas ao VIH em países desenvolvidos.[84][128][129] A esperança média de vida de um indivíduo infetado por HIV é de 32 anos a partir da data de infeção, caso o tratamento seja iniciado quando a contagem de CD4 for 350/µL.[130] Na ausência de terapêutica HAART, o tempo mediano para que uma infeção por VIH faça a progressão para SIDA é de cerca de nova a dez anos, enquanto que a estimativa mediana de sobrevivência depois de instalada a SIDA é de apenas 9,2 meses.[11] No entanto, a terapêutica HAART por vezes não atinge resultados satisfatórios, sendo em algumas circunstâncias ineficaz em mais de metade dos casos. Isto deve-se a várias razões, entra as quais intolerância ou efeitos secundários da medicação, terapêuticas antirretrovirais anteriores ineficazes, ou infeção com uma estirpe resistente de VIH. No entanto, a não adesão ou desistência por parte do paciente ao longo de uma terapia antirretroviral são a principal causa de insucesso da terapia HAART.[131] São várias as razões para a não adesão ou desistência da terapêutica HAART. A não adesão é motivada sobretudo pelo acesso deficiente a cuidados de saúde, apoios sociais inadequados, a presença de doenças psiquiátricas ou a toxicodependência. A desistência é motivada pela complexidade dos regimes HAART, em particular do número de comprimidos, da frequência das doses, da restrição alimentar ou ainda por outros motivos a par de efeitos secundários.[132][133][134] Os efeitos secundários incluem lipodistrofia, dislipidemia, resistência à insulina, aumento de riscos cardiovasculares e doenças congénitas.[135][136]
O momento preciso para iniciar o tratamento é ainda objeto de debate. É indiscutível que o tratamento deva ser iniciado antes da contagem de CD4 do paciente ser inferior a 200. A maior parte das recomendações nacionais indica que o tratamento deva ser iniciado mal a contagem seja inferior a 350, embora evidências de alguns estudos apontem para que seja iniciado ainda antes de ultrapassar os 350.[137][128] Em países onde não estão disponíveis métodos para contagem de CD4, o tratamento deve ser iniciado em pacientes nos estágios III e IV, conforme definido pela OMS.[138] Os fármacos antirretrovirais são dispendiosos, pelo que a maioria da população infetada a nível mundial não tem acesso ao tratamento de VIH/SIDA.[139] A investigação para melhorar os tratamentos atuais contempla a diminuição dos efeitos secundários, a simplificação dos regimes para diminuir a desistência, e a determinação da melhor sequência de regimes de modo a gerir a resistência aos fármacos. No entanto, pensa-se que apenas a vacinação será capaz de travar a pandemia global, já que se trata da única solução de baixo custo e que não requer tratamentos diários, sendo assim capaz de ser financeiramente sustentável em países em desenvolvimento.[139] No entanto, após mais de vinte anos de investigação, o VIH-1 continua a ser um candidato difícil para uma vacina.[139] Apesar disso, pensa-se que uma região da sua superfície constitua um potencial alvo para a criação uma vacina.[140]
HIV e Saúde mental
Pacientes com transtornos psicológicos são mais vulneráveis a serem infectados com HIV.[141] Portadores de HIV tem altos índices de depressão maior, alcoolismo e tendência ao suicídio.[142] Em outro estudo também identificaram correlação com transtornos de ansiedade, transtornos sexuais e abuso de substâncias. [143]
Um antirretroviral ITRNN muito usado no mundo, o Efavirenz, também tem como possível efeito colateral transtornos neuropsiquiátricos crônicos, principalmente na forma de transtornos de ansiedade e de sono. [144]
A revelação do diagnóstico de HIV positivo é considerado um evento muito estressante e com impacto em várias áreas da vida do portador, de modo semelhante a outras doenças que ameaçam a vida. [145] A maioria dos portadores reagiu ao diagnóstico como um evento traumatizante, porém conseguiram lidar com a situação sem muitos problemas psicossociais. Os portadores que desenvolveram transtornos psicológicos beneficiaram de psicoterapia de longo prazo, principalmente da terapia interpessoal em conjunto com remédios psiquiátricos.[146] A Terapia cognitivo-comportamental também demonstrou ser uma intervenção benéfica e aumentar a adesão ao tratamento. [147]
Mesmo com o desenvolvimento da terapia antirretroviral altamente eficaz (HAART) a não-adesão ao tratamento ainda é frequente. É recomendado que os profissionais de saúde trabalhem em equipe, desenvolvendo programas específicos para lidar com essa demanda e dediquem mais tempo e atenção aos pacientes com dificuldade de adesão para evitar o desenvolvimento de AIDS e doenças oportunistas nesses pacientes. [148]
Imunidade
Após a infecção inicial, o sistema imunológico inicia uma série de reações para tentar conter a multiplicação do vírus no corpo. Elas incluem a produção de anticorpos e o desenvolvimento de células capazes de identificar e eliminar outras células que foram infectadas pelo HIV, chamadas linfócitos T CD8+ citotóxicos. Infelizmente, a resposta imunológica não é capaz de controlar o vírus na grande maioria das pessoas que se infectam pelo vírus. O HIV passa, então, a destruir cada vez mais as células T CD4+. Quando as células T CD4+ estão em número muito baixo no sangue (em geral, quando ficam abaixo de 200 células por microlitro de sangue), o paciente fica mais predisposto a desenvolver doenças que se aproveitam de sua fragilidade imunológica, daí o nome de doenças oportunistas.
Cerca de 10% de todos os europeus carregam um polimorfismo do CCR5, um receptor de superfície celular que participa nas infecções por HIV-1 M-trófico. Segundo Grimaldi (2002), na população brasileira, cerca de 5,3% carregam essa mutação. O HIV-1 M-trófico usa os receptores CCR5 e CD4 para entrar nas células-alvo, diferentemente do HIV T-trófico que usa o CXCR4 com o CD4. Pessoas com essa mutação (uma deleção de 32 pares de bases) têm um risco muito baixo de infecção pelo HIV-1, já que o HIV M-trófico geralmente inicia a infecção. De fato, 1% de todos os europeus homozigotos para o polimorfismo podem ter uma proteção adicional (apesar de incompleta).
Mitos comuns a respeito do HIV

- "AIDS e HIV são a mesma coisa" - O HIV é um vírus que pode levar ao desenvolvimento da AIDS. Que ocorre quando o sistema imune fica comprometido pela ação do vírus. Alguns tipos de doenças oportunistas do HIV podem estar presentes em uma pessoa que possa ser diagnosticada como tendo AIDS. Uma pessoa pode estar infectada por anos sem ter desenvolvido a AIDS. Alguém que seja HIV positivo pode não ter AIDS.
- "O HIV afeta apenas homossexuais e usuários de drogas" - O HIV pode afetar qualquer um. Bebês, mulheres, idosos, adolescentes, e pessoas de qualquer etnia, classe social e país podem contrair o HIV. Alguns religiosos disseram e ainda dizem que a AIDS é uma punição divina aos homossexuais ou a promiscuidade, porém se isso fosse verdade não deveriam haver contaminados pela mãe durante o nascimento, em transplantes de órgãos, por doação de sangue ou ferimentos.
- "Homossexuais, prostitutas e usuários de drogas são os grupos de risco" - O termo grupos de risco é evitado atualmente por razões éticas, para não estigmatizar este ou aquele grupo, e também para que as pessoas fora do grupo de risco mantenham-se cautelosas. Prefere-se usar o termo comportamento de risco (como não usar preservativo, manter sexo com mais de um parceiro(a), compartilhar seringas). Apesar disso a ONU faz referência a uma maior vulnerabilidade à infecção pelo HIV por algumas populações como profissionais do sexo e seus clientes, população carcerária e homens que fazem sexo com homens.[149][150] Ainda segundo a ONU, em 2008, os jovens eram os mais vulneráveis já que representavam 45% do total de novas infecções.[151] No Brasil, entre os homens infectados 20,1% são homossexuais e 11,5% bissexuais, mas a maioria dos infectados são heterossexuais. Dentre os infectados, segundo dados do SUS de 2009, cerca de 37,5% eram mulheres. [152] O mesmo ocorre na maioria dos outros países. [150]
- "Não há risco para duas pessoas já infectadas ao ter sexo sem proteção" - Há anos a reinfecção por HIV (ou superinfecção como é às vezes chamada) tem sido vista como a consequência de relações sexuais sem proteção entre pessoas infectadas pelo HIV. A reinfecção ocorre quando uma pessoa com HIV infecta-se pela segunda vez ao ter uma relação sexual sem proteção com outra pessoa que também tem o HIV. A reinfecção tem sido demonstrada em estudos laboratoriais, bem como em modelos animais. Por anos, as provas de que isso poderia acontecer em situações da vida real tem sido difíceis de serem obtidas, mas uma evidência recente tem emergido em estudos de casos humanos que confirmou que a reinfecção pelo HIV pode ocorrer e pode ser muito problemática para pessoas com o HIV.
- "Pessoas acima dos 50 anos não contraem HIV" - Pessoas acima dos 50 anos podem contrair HIV. O número de pessoas acima dos 50 diagnosticadas com infecção pelo HIV está aumentando. Em geral, pessoas mais velhas tendem a desenvolver deficiência imunológica mais rápido que os adultos mais jovens.
- "Uma mulher HIV positivo não pode dar à luz um bebê saudável" - o HIV é às vezes transmitido da mãe para o bebê no útero, mas nem sempre. O risco é pelo menos de 20 a 30% para a transmissão materno-fetal do HIV. O parto por cesárea e a ingestão de medicamentos antiretrovirais durante a gravidez pode reduzir as chances de a mãe passar a infecção para o bebê; Quando esses tratamentos estão disponíveis e a futura mãe é diagnosticada o mais cedo possível, apenas cerca de 2% das mães HIV-positivas que estão prestes a dar à luz, terão filhos infectados. As infecções podem ocorrer também através do leite materno sendo recomendado usar aleitamento artificial para evitar que isso ocorra. No Brasil o substituto de leite materno em pó está disponível gratuitamente em alguns hospitais da rede pública.
- "Uma única pessoa identificada trouxe o HIV para a América do Norte" - Ver verbete Paciente Zero.
- A expectativa de vida de vida de uma portador de HIV é de alguns anos - Sem tratamento a expectativa média é de 9 a 11 anos[153]. E caso só seja detectada quando o quadro de AIDS já está instalado e não for feito o tratamento adequado, a expectativa é de apenas 6 a 19 meses[154]. Mas com o avanço dos retrovirais a expectativa aumentou para 20-50 anos.[154] É possível que seja maior pois o HIV só começou a ser estudado mais intensamente por volta de 1985 e a terapia antirretroviral eficaz só chegou ao Brasil por volta de 1996. Como vários laboratórios do mundo estão procurando novos tratamentos é provável que a expectativa aumente cada vez mais e tenha cada vez menos efeitos colaterais[155].
- Picada de mosquito transmite HIV? - Não há relatos conhecidos de infecção por mosquitos no mundo.[carece de fontes]
- Beijo transmite HIV - Existe um risco teórico, porém é quase nulo. Não há nenhum caso confirmado de infecção pelo beijo no mundo. Mesmo em pacientes com AIDS (carga viral média acima de 100.000) e com doenças na cavidade oral menos de 1/3 tinham vestígios do vírus na boca. Em um paciente seguindo o tratamento retro-viral corretamente (carga viral menor que 100) é tão improvável que em 2009 o ministério da saúde brasileiro começou uma campanha contra esse preconceito. Existem 10 substâncias na saliva que destroem o vírus. [156]
- Quem tem HIV pegou fazendo sexo desprotegido - Provavelmente pela forte campanha de prevenção focalizada no uso da camisinha muita gente pense isso. Mas não necessariamente, até 1996, nem todo sangue ou órgão era examinado corretamente antes da transfusão. Além disso, até 2000 menos da metade das mães faziam todos os exames pré-natal indicados e tanto complicações durante a gestação, durante o parto ou no leite podem transmitir o HIV. Mesmo quem foi contaminado sexualmente pode ter sido vítima de estupro (a violência do ato aumenta o risco de transmissão) ou pode ter sido contaminado antes das campanhas de conscientização terem se popularizado nos anos 90.
- Quem tem HIV é mais vulnerável a infecções oportunistas - Com o tratamento antirretroviral (TARV) é possível o portador ter uma vida perfeitamente saudável, sem qualquer sintomas nem efeitos colaterais e com um sistema imunológico normal. E a quantidade do vírus geralmente fica centenas de milhares de vezes menor que o de um paciente com AIDS. Caso o paciente tome os remédios corretamente ele não tem nenhuma restrição.
- Depois de beber não se deve ingerir os medicamentos antirretrovirais - O álcool faz mal por diversos outros motivos, então é bom evitar para não desgastar o organismo e a saúde, porém ele não interage medicamentosamente com a maioria dos tratamentos antirretrovirais. Portanto mesmo após consumir álcool deve-se ingerir os medicamentos normalmente! Uma exceção é a interação com o efavirenz que tem seus possíveis efeitos colaterais como depressão, insonia e dor de cabeça potencializados pelo álcool.
- Assim que a pessoa descobrir que é portador ela deve começar o tratamento - Apenas caso os sintomas da AIDS já tenham aparecido. Mas caso feitos antes dos sintomas podem demorar anos antes de começar o tratamento. O tratamento só começa quando a imunidade está seriamente comprometida. Existem alguns casos de pacientes que foram contaminados há mais de 12 anos e ainda não precisaram tomar o antirretroviral mas geralmente leva de 4 a 7 anos desde a infecção inicial.
Ver também
- AIDS
- HIVBr18
- Barebacking
- Exame de HIV
- Peter Duesberg
- Hipótese de Duesberg
- HIV/AIDS na África
- HIV-integrase
- Reavaliação da AIDS
- Retroviridae
- Robert Gallo
- UNAIDS
- Vírus da imunodeficiência símia
Referências
- ↑ Weiss RA (1993). «How does HIV cause AIDS?». Science. 260 (5112): 1273–9. Bibcode:1993Sci...260.1273W. PMID 8493571. doi:10.1126/science.8493571
- ↑ Douek DC, Roederer M, Koup RA (2009). «Emerging Concepts in the Immunopathogenesis of AIDS». Annu. Rev. Med. 60: 471–84. PMC 2716400
 . PMID 18947296. doi:10.1146/annurev.med.60.041807.123549
. PMID 18947296. doi:10.1146/annurev.med.60.041807.123549
- ↑ a b c UNAIDS (2006). «Overview of the global AIDS epidemic» (PDF). 2006 Report on the global AIDS epidemic (PDF). [S.l.: s.n.]
- ↑ Greener, R. (2002). «AIDS and macroeconomic impact». In: S, Forsyth (ed.). State of The Art: AIDS and Economics. [S.l.]: IAEN. pp. 49–55
- ↑ PMID 20598938 (20598938 &dopt=Abstract PubMed)
- ↑ Garg, H; Mohl, J; Joshi, A (Nov 9, 2012). «HIV-1 induced bystander apoptosis.». Viruses. 4 (11): 3020–43. PMID 23202514
- ↑ Kumar, Vinay (2012). Robbins Basic Pathology 9th ed. [S.l.: s.n.] p. 147. ISBN 9781455737871
- ↑ Lawn SD (2004). «AIDS in Africa: the impact of coinfections on the pathogenesis of HIV-1 infection». J. Infect. Dis. 48 (1): 1–12. PMID 14667787. doi:10.1016/j.jinf.2003.09.001
- ↑ Buchbinder SP, Katz MH, Hessol NA, O'Malley PM, Holmberg SD. (1994). «Long-term HIV-1 infection without immunologic progression». AIDS. 8 (8): 1123–8. PMID 7986410. doi:10.1097/00002030-199408000-00014
- ↑ Schneider MF, Gange SJ, Williams CM, Anastos K, Greenblatt RM, Kingsley L, Detels R, Munoz A (2005). «Patterns of the hazard of death after AIDS through the evolution of antiretroviral therapy: 1984–2004». AIDS. 19 (17): 2009–18. PMID 16260908
- ↑ a b Morgan D, Mahe C, Mayanja B, Okongo JM, Lubega R, Whitworth JA (2002). «HIV-1 infection in rural Africa: is there a difference in median time to AIDS and survival compared with that in industrialized countries?». AIDS. 16 (4): 597–632. PMID 11873003 Erro de citação: Código
<ref>inválido; o nome "Morgan2" é definido mais de uma vez com conteúdos diferentes - ↑ International Committee on Taxonomy of Viruses (2002). «61.0.6. Lentivirus». National Institutes of Health. Consultado em February 28, 2006 Verifique data em:
|acessodata=(ajuda) - ↑ International Committee on Taxonomy of Viruses (2002). «61. Retroviridae». National Institutes of Health. Consultado em February 28, 2006 Verifique data em:
|acessodata=(ajuda) - ↑ Lévy, J. A. (1993). «HIV pathogenesis and long-term survival». AIDS. 7 (11): 1401–10. PMID 8280406. doi:10.1097/00002030-199311000-00001
- ↑ Smith JA, Daniel R (2006). «Following the path of the virus: the exploitation of host DNA repair mechanisms by retroviruses». ACS Chem Biol. 1 (4): 217–26. PMID 17163676. doi:10.1021/cb600131q
- ↑ Gilbert, PB; McKeague, IW; Eisen, G; Mullins, C; Guéye-Ndiaye, A; Mboup, S; Kanki, PJ (February 28, 2003). «Comparison of HIV-1 and HIV-2 infectivity from a prospective cohort study in Senegal». Statistics in Medicine. 22 (4): 573–593. PMID 12590415. doi:10.1002/sim.1342 Verifique data em:
|data=(ajuda) - ↑ Reeves JD, Doms RW (2002). «Human Immunodeficiency Virus Type 2». Journal of General Virology. 83 (Pt 6): 1253–65. PMID 12029140. doi:10.1099/vir.0.18253-0
- ↑ McGovern SL, Caselli E, Grigorieff N, Shoichet BK (2002). «A common mechanism underlying promiscuous inhibitors from virtual and high-throughput screening». Journal of Medical Chemistry. 45 (8): 1712–22. PMID 11931626. doi:10.1021/jm010533y
- ↑ Comparação: Fisher, Bruce; Harvey, Richard P.; Champe, Pamela C. (2007). Lippincott's Illustrated Reviews: Microbiology (Lippincott's Illustrated Reviews Series). Hagerstown, MD: Lippincott Williams & Wilkins. ISBN 0-7817-8215-5 Page 3
- ↑ a b c d e f g Various (2008). HIV Sequence Compendium 2008 Introduction (PDF). [S.l.: s.n.] Consultado em March 31, 2009 Verifique data em:
|acessodata=(ajuda) - ↑ a b c Chan DC, Fass D, Berger JM, Kim PS (1997). «Core structure of gp41 from the HIV envelope glycoprotein» (PDF). Cell. 89 (2): 263–73. PMID 9108481. doi:10.1016/S0092-8674(00)80205-6. Consultado em March 31, 2009 Verifique data em:
|acessodata=(ajuda) - ↑ National Institute of Health (June 17, 1998). «Crystal structure of key HIV protein reveals new prevention, treatment targets» (Nota de imprensa). Consultado em September 14, 2006. Cópia arquivada em February 19, 2006 Verifique data em:
|acessodata=, |arquivodata=, |data=(ajuda) - ↑ Ouellet DL, Plante I, Landry P; et al. (2008). «Identification of functional microRNAs released through asymmetrical processing of HIV-1 TAR element». Nucleic Acids Res. 36 (7): 2353–65. PMC 2367715
 . PMID 18299284. doi:10.1093/nar/gkn076
. PMID 18299284. doi:10.1093/nar/gkn076
- ↑ Klase Z, Winograd R, Davis J; et al. (2009). «HIV-1 TAR miRNA protects against apoptosis by altering cellular gene expression». Retrovirology. 6 (1): 18. PMC 2654423
 . PMID 19220914. doi:10.1186/1742-4690-6-18
. PMID 19220914. doi:10.1186/1742-4690-6-18
- ↑ Garcia JV, Miller AD (1991). «Serine phosphorylation-independent downregulation of cell-surface CD4 by nef». Nature. 350 (6318): 508–11. Bibcode:1991Natur.350..508G. PMID 2014052. doi:10.1038/350508a0
- ↑ Schwartz O, Maréchal V, Le Gall S, Lemonnier F, Heard JM (1996). «Endocytosis of major histocompatibility complex class I molecules is induced by the HIV-1 Nef protein». Nat. Med. 2 (3): 338–42. PMID 8612235. doi:10.1038/nm0396-338
- ↑ Stumptner-Cuvelette P, Morchoisne S, Dugast M; et al. (2001). «HIV-1 Nef impairs MHC class II antigen presentation and surface expression». Proc. Natl. Acad. Sci. U.S.A. 98 (21): 12144–9. Bibcode:2001PNAS...9812144S. PMC 59782
 . PMID 11593029. doi:10.1073/pnas.221256498
. PMID 11593029. doi:10.1073/pnas.221256498
- ↑ a b c Coakley E, Petropoulos CJ, Whitcomb JM (2005). «Assessing ch vbgemokine co-receptor usage in HIV». Curr. Opin. Infect. Dis. 18 (1): 9–15. PMID 15647694. doi:10.1097/00001432-200502000-00003
- ↑ Deng H, Liu R, Ellmeier W, Choe S, Unutmaz D, Burkhart M, Di Marzio P, Marmon S, Sutton RE, Hill CM, Davis CB, Peiper SC, Schall TJ, Littman DR, Landau NR (1996). «Identification of a major co-receptor for primary isolates of HIV-1». Nature. 381 (6584): 661–6. Bibcode:1996Natur.381..661D. PMID 8649511. doi:10.1038/381661a0
- ↑ Feng Y, Broder CC, Kennedy PE, Berger EA (1996). «HIV-1 entry cofactor: functional cDNA cloning of a seven-transmembrane, G protein-coupled receptor». Science. 272 (5263): 872–7. Bibcode:1996Sci...272..872F. PMID 8629022. doi:10.1126/science.272.5263.872
- ↑ Knight SC, Macatonia SE, Patterson S (1990). «HIV I infection of dendritic cells». International Review of Immunology. 6 (2–3): 163–75. PMID 2152500. doi:10.3109/08830189009056627
- ↑ Tang J, Kaslow RA (2003). «The impact of host genetics on HIV infection and disease progression in the era of highly active antiretroviral therapy». AIDS. 17 (Suppl 4): S51–S60. PMID 15080180. doi:10.1097/00002030-200317004-00006
- ↑ Zhu T, Mo H, Wang N, Nam DS, Cao Y, Koup RA, Ho DD (1993). «Genotypic and phenotypic characterization of HIV-1 patients with primary infection». Science. 261 (5125): 1179–81. Bibcode:1993Sci...261.1179Z. PMID 8356453. doi:10.1126/science.8356453
- ↑ van’t Wout AB, Kootstra NA, Mulder-Kampinga GA, Albrecht-van Lent N, Scherpbier HJ, Veenstra J, Boer K, Coutinho RA, Miedema F, Schuitemaker H. (1994). «Macrophage-tropic variants initiate human immunodeficiency virus type 1 infection after sexual, parenteral, and vertical transmission». J Clin Invest. 94 (5): 2060–7. PMC 294642
 . PMID 7962552. doi:10.1172/JCI117560
. PMID 7962552. doi:10.1172/JCI117560
- ↑ Zhu T, Wang N, Carr A, Nam DS, Moor-Jankowski R, Cooper DA, Ho DD (1996). «Genetic characterization of human immunodeficiency virus type 1 in blood and genital secretions: evidence for viral compartmentalization and selection during sexual transmission». J Virol. 70 (5): 3098–107. PMC 190172
 . PMID 8627789
. PMID 8627789
- ↑ Muciaccia B, Padula F, Vicini E, Gandini L, Lenzi A, Stefanini M (2005). «Beta-chemokine receptors 5 and 3 are expressed on the head region of human spermatozoon». FASEB J. 19 (14): 2048–50. PMID 16174786. doi:10.1096/fj.05-3962fje
- ↑ Berlier W, Bourlet T, Lawrence P, Hamzeh H, Lambert C, Genin C, Verrier B, Dieu-Nosjean MC, Pozzetto B, Delezay O (2005). «Selective sequestration of X4 isolates by human genital epithelial cells: Implication for virus tropism selection process during sexual transmission of HIV». J Med Virol. 77 (4): 465–74. PMID 16254974. doi:10.1002/jmv.20478
- ↑ Clevestig P, Maljkovic I, Casper C, Carlenor E, Lindgren S, Naver L, Bohlin AB, Fenyo EM, Leitner T, Ehrnst A (2005). «The X4 phenotype of HIV type 1 evolves from R5 in two children of mothers, carrying X4, and is not linked to transmission». AIDS Res Hum Retroviruses. 5 (21): 371–8. PMID 15929699. doi:10.1089/aid.2005.21.371
- ↑ Moore JP (1997). «Coreceptors: implications for HIV pathogenesis and therapy». Science. 276 (5309): 51–2. PMID 9122710. doi:10.1126/science.276.5309.51
- ↑ Karlsson A, Parsmyr K, Aperia K, Sandstrom E, Fenyo EM, Albert J. (1994). «MT-2 cell tropism of human immunodeficiency virus type 1 isolates as a marker for response to treatment and development of drug resistance». J Infect Dis. 170 (6): 1367–75. PMID 7995974. doi:10.1093/infdis/170.6.1367
- ↑ Koot M, van 't Wout AB, Kootstra NA, de Goede RE, Tersmette M, Schuitemaker H. (1996). «Relation between changes in cellular load, evolution of viral phenotype, and the clonal composition of virus populations in the course of human immunodeficiency virus type 1 infection». J Infect Dis. 173 (2): 349–54. PMID 8568295. doi:10.1093/infdis/173.2.349
- ↑ Cheney K, McKnight A (2010). «HIV-2 Tropism and Disease». Lentiviruses and Macrophages: Molecular and Cellular Interactions. [S.l.]: Caister Academic Press. ISBN 978-1-904455-60-8
- ↑ a b c d e f g Chan D, Kim P (1998). «HIV entry and its inhibition». Cell. 93 (5): 681–4. PMID 9630213. doi:10.1016/S0092-8674(00)81430-0
- ↑ a b c d e f Wyatt R, Sodroski J (1998). «The HIV-1 envelope glycoproteins: fusogens, antigens, and immunogens». Science. 280 (5371): 1884–8. Bibcode:1998Sci...280.1884W. PMID 9632381. doi:10.1126/science.280.5371.1884
- ↑ Arthos J, Cicala C, Martinelli E, Macleod K, Van Ryk D, Wei D, Xiao Z, Veenstra TD, Conrad TP, Lempicki RA, McLaughlin S, Pascuccio M, Gopaul R, McNally J, Cruz CC, Censoplano N, Chung E, Reitano KN, Kottilil S, Goode DJ, Fauci AS (2008). «HIV-1 envelope protein binds to and signals through integrin alpha(4)beta(7), the gut mucosal homing receptor for peripheral T cells». Nature Immunology. In Press (3): 301–9. PMID 18264102. doi:10.1038/ni1566
- ↑ a b Pope M, Haase A (2003). «Transmission, acute HIV-1 infection and the quest for strategies to prevent infection». Nat Med. 9 (7): 847–52. PMID 12835704. doi:10.1038/nm0703-847
- ↑ doi:10.1073/pnas.0900502106
Esta predefinição está obsoleta; veja {{Cite doi}} para mais informações. Esta citação não está completa. Você pode completá-la manualmente - ↑ a b c Zheng YH, Lovsin N, Peterlin BM (2005). «Newly identified host factors modulate HIV replication». Immunol. Lett. 97 (2): 225–34. PMID 15752562. doi:10.1016/j.imlet.2004.11.026
- ↑ «IV. VIRUSES - F. ANIMAL VIRUS LIFE CYCLES 3. The Life Cycle of HIV». Doc Kaiser's Microbiology Home Page. Community College of Baltimore County. January 2008 Verifique data em:
|data=(ajuda) - ↑ Hiscott J, Kwon H, Genin P (2001). «Hostile takeovers: viral appropriation of the NF-kB pathway». J Clin Invest. 107 (2): 143–151. PMC 199181
 . PMID 11160127. doi:10.1172/JCI11918
. PMID 11160127. doi:10.1172/JCI11918
- ↑ Pollard VW, Malim MH (1998). «The HIV-1 Rev protein». Annu. Rev. Microbiol. 52: 491–532. PMID 9891806. doi:10.1146/annurev.micro.52.1.491
- ↑ a b Hu WS, Temin HM. (1990). Retroviral recombination and reverse transcription. Science 250(4985):1227-1233. PMID 1700865
- ↑ a b Charpentier C, Nora T, Tenaillon O, Clavel F, Hance AJ. (2006). Extensive recombination among human immunodeficiency virus type 1 quasispecies makes an important contribution to viral diversity in individual patients. J Virol 80(5):2472-2482. PMID 16474154 Free PMC Article
- ↑ Nora T, Charpentier C, Tenaillon O, Hoede C, Clavel F, Hance AJ. (2007). Contribution of recombination to the evolution of human immunodeficiency viruses expressing resistance to antiretroviral treatment. J Virol 81(14):7620-7628. PMID 17494080 Free PMC Article
- ↑ Chen J, Powell D, Hu WS. (2006). High frequency of genetic recombination is a common feature of primate lentivirus replication. J Virol 80(19):9651-9658. PMID 16973569 Free PMC Article
- ↑ a b Bonhoeffer S, Chappey C, Parkin NT, Whitcomb JM, Petropoulos CJ. (2004). Evidence for positive epistasis in HIV-1. Science 2004 306(5701):1547-1550. Erratum in: Science. 2008 May 9;320(5877):746. PMID 15567861 Free Article
- ↑ Israël N, Gougerot-Pocidalo MA. (1997). Oxidative stress in human immunodeficiency virus infection. Cell Mol Life Sci 53(11-12):864-870. PMID 9447238
- ↑ Michod RE, Bernstein H, Nedelcu AM (2008). Adaptive value of sex in microbial pathogens. Infect Genet Evol 8(3):267-285. PMID 18295550 http://www.hummingbirds.arizona.edu/Faculty/Michod/Downloads/IGE%20review%20sex.pdf
- ↑ Hallenberger S, Bosch V, Angliker H, Shaw E, Klenk HD, Garten W (November 26, 1992). «Inhibition of furin-mediated cleavage activation of HIV-1 glycoprotein gp160». Nature. 360 (6402): 358–61. Bibcode:1992Natur.360..358H. PMID 1360148. doi:10.1038/360358a0 Verifique data em:
|data=(ajuda) - ↑ Gelderblom HR (1997). «Fine structure of HIV and SIV» (PDF). In: Los Alamos National Laboratory. HIV sequence compendium. [S.l.]: Los Alamos National Laboratory. pp. 31–44
- ↑ a b c d Robertson DL, Hahn BH, Sharp PM. (1995). «Recombination in AIDS viruses». J Mol Evol. 40 (3): 249–59. PMID 7723052. doi:10.1007/BF00163230
- ↑ Rambaut, A; Posada, D; Crandall, KA; Holmes, EC (2004). «The causes and consequences of HIV evolution». Nature Reviews Genetics. 5 (52–61): 52–61. PMID 14708016. doi:10.1038/nrg1246
- ↑ Perelson AS, Ribeiro RM (2008). «Estimating drug efficacy and viral dynamic parameters: HIV and HCV». Stat Med. 27 (23): 4647–57. PMID 17960579. doi:10.1002/sim.3116
- ↑ a b PMID 19661993 (PubMed)
- ↑ Holzammer S, Holznagel E, Kaul A, Kurth R, Norley S (2001). «High virus loads in naturally and experimentally SIVagm-infected African green monkeys». Virology. 283 (2): 324–31. PMID 11336557. doi:10.1006/viro.2001.0870
- ↑ Kurth, R. and Norley, S. (1996). «Why don't the natural hosts of SIV develop simian AIDS?». J. NIH Res. 8: 33–37
- ↑ Baier M, Dittmar MT, Cichutek K, Kurth R (1991). «Development of vivo of genetic variability of simian immunodeficiency virus». Proc. Natl. Acad. Sci. U.S.A. 88 (18): 8126–30. Bibcode:1991PNAS...88.8126B. PMC 52459
 . PMID 1896460. doi:10.1073/pnas.88.18.8126
. PMID 1896460. doi:10.1073/pnas.88.18.8126
- ↑ Daniel MD, King NW, Letvin NL, Hunt RD, Sehgal PK, Desrosiers RC (1984). «A new type D retrovirus isolated from macaques with an immunodeficiency syndrome». Science. 223 (4636): 602–5. Bibcode:1984Sci...223..602D. PMID 6695172. doi:10.1126/science.6695172
- ↑ a b PMID 19626114 (PubMed)
- ↑ Thomson MM, Perez-Alvarez L, Najera R (2002). «Molecular epidemiology of HIV-1 genetic forms and its significance for vaccine development and therapy». Lancet Infectious Diseases. 2 (8): 461–471. PMID 12150845. doi:10.1016/S1473-3099(02)00343-2
- ↑ Carr JK, Foley BT, Leitner T, Salminen M, Korber B, McCutchan F (1998). «Reference sequences representing the principal genetic diversity of HIV-1 in the pandemic» (PDF). In: Los Alamos National Laboratory (ed.). HIV sequence compendium (PDF). Los Alamos, New Mexico: Los Alamos National Laboratory. pp. 10–19
- ↑ Osmanov S, Pattou C, Walker N, Schwardlander B, Esparza J; WHO-UNAIDS Network for HIV Isolation and Characterization (2002). «Estimated global distribution and regional spread of HIV-1 genetic subtypes in the year 2000». Acquired Immune Deficiency Syndrome. 29 (2): 184–190. PMID 11832690
- ↑ Perrin L, Kaiser L, Yerly S. (2003). «Travel and the spread of HIV-1 genetic variants». Lancet Infect Dis. 3 (1): 22–27. PMID 12505029. doi:10.1016/S1473-3099(03)00484-5
- ↑ Plantier JC, Leoz M, Dickerson JE; et al. (2009). «A new human immunodeficiency virus derived from gorillas». Nature Medicine. 15 (8): 871–2. PMID 19648927. doi:10.1038/nm.2016. Resumo divulgativo
- ↑ Kumaranayake L, Watts C (2001). «Resource allocation and priority setting of HIV/AIDS interventions: addressing the generalized epidemic in sub-Saharan Africa». Journal of International Development. 13 (4): 451–466. doi:10.1002/jid.797
- ↑ Kleinman S (2004). «Patient information: Blood donation and transfusion». Uptodate. Cópia arquivada em April 12, 2008 Verifique data em:
|arquivodata=(ajuda) - ↑ a b Centers for Disease Control and Prevention (2001). «Revised guidelines for HIV counseling, testing, and referral». MMWR Recomm Rep. 50 (RR–19): 1–57. PMID 11718472
- ↑ Celum CL, Coombs RW, Lafferty W, Inui TS, Louie PH, Gates CA, McCreedy BJ, Egan R, Grove T, Alexander S; et al. (1991). «Indeterminate human immunodeficiency virus type 1 western blots: seroconversion risk, specificity of supplemental tests, and an algorithm for evaluation». J Infect Dis. 164 (4): 656–664. PMID 1894929. doi:10.1093/infdis/164.4.656
- ↑ a b Chou R, Huffman LH, Fu R, Smits AK, Korthuis PT (2005). «Screening for HIV: a review of the evidence for the U.S. Preventive Services Task Force». Annals of Internal Medicine. 143 (1): 55–73. PMID 15998755
- ↑ Tolle MA, Schwarzwald HL (July 15, 2010). «Postexposure prophylaxis against human immunodeficiency virus». American Family Physician. 82 (2): 161–6. PMID 20642270 Verifique data em:
|data=(ajuda) - ↑ UNAIDS, Organização Mundial de Saúde (2007). «2007 AIDS epidemic update» (PDF). Consultado em 12 de março de 2008
- ↑ McNeil, Jr., Donald (November 20, 2007). «U.N. Agency to Say It Overstated Extent of H.I.V. Cases by Millions». The New York Times. Consultado em 16 de janeiro de 2008 Verifique data em:
|data=(ajuda) - ↑ UNAIDS (2001). «Special Session of the General Assembly on HIV/AIDS Round table 3 Socio-economic impact of the epidemic and the strengthening of national capacities to combat HIV/AIDS» (PDF). Consultado em 15 de junho de 2006
- ↑ a b c Palella, F. J., Delaney, K. M., Moorman, A. C., Loveless, M. O., Fuhrer, J., Satten, G. A., Aschman, D. J. and Holmberg, S. D. (1998). «Declining morbidity and mortality among patients with advanced human immunodeficiency virus infection». N. Engl. J. Med. 338 (13): 853–860. PMID 9516219. doi:10.1056/NEJM199803263381301 Erro de citação: Código
<ref>inválido; o nome "Pallelal" é definido mais de uma vez com conteúdos diferentes - ↑ Smith DK, Grohskopf LA, Black RJ; et al. (2005). «Antiretroviral postexposure prophylaxis after sexual, injection-drug use, or other nonoccupational exposure to HIV in the United States: recommendations from the U.S. Department of Health and Human Services». MMWR Recomm Rep. 54 (RR-2): 1–20. PMID 15660015. Consultado em 31 de março de 2009
- ↑ Donegan E, Stuart M, Niland JC; et al. (1990). «Infection with human immunodeficiency virus type 1 (HIV-1) among recipients of antibody-positive blood donations». Ann. Intern. Med. 113 (10): 733–739. PMID 2240875
- ↑ a b Coovadia H (2004). «Antiretroviral agents—how best to protect infants from HIV and save their mothers from AIDS». N. Engl. J. Med. 351 (3): 289–292. PMID 15247337. doi:10.1056/NEJMe048128
- ↑ Kaplan EH, Heimer R (1995). «HIV incidence among New Haven needle exchange participants: updated estimates from syringe tracking and testing data». J. Acquir. Immune Defic. Syndr. Hum. Retrovirol. 10 (2): 175–176. PMID 7552482
- ↑ Bell DM (1997). «Occupational risk of human immunodeficiency virus infection in healthcare workers: an overview.». Am. J. Med. 102 (5B): 9–15. PMID 9845490
- ↑ a b c d European Study Group on Heterosexual Transmission of HIV (1992). «Comparison of female to male and male to female transmission of HIV in 563 stable couples». BMJ. 304 (6830): 809–813. PMC 1881672
 . PMID 1392708
. PMID 1392708
- ↑ a b c d e f Varghese B, Maher JE, Peterman TA, Branson BM,Steketee RW (2002). «Reducing the risk of sexual HIV transmission: quantifying the per-act risk for HIV on the basis of choice of partner, sex act, and condom use». Sex. Transm. Dis. 29 (1): 38–43. PMID 11773877
- ↑ Leynaert B, Downs AM, de Vincenzi I (1998). «Heterosexual transmission of human immunodeficiency virus: variability of infectivity throughout the course of infection. European Study Group on Heterosexual Transmission of HIV». Am. J. Epidemiol. 148 (1): 88–96. PMID 9663408
- ↑ Boily M-C, Baggaley RF, Wang L; et al. (2009). «Heterosexual risk of HIV-1 infection per sexual act: systematic review and meta-analysis of observational studies». Lancet Infect Dis. 9 (2): 118-129. PMID 19179227. doi:10.1016/S1473-3099(09)70021-0
- ↑ National Institute of Allergy and Infectious Diseases; National Institutes of Health, Department of Health and Human Services (2001-07-20). Workshop Summary: Scientific Evidence on Condom Effectiveness for Sexually Transmitted Disease (STD) Prevention (PDF). Hyatt Dulles Airport, Herndon, Virginia. pp. pp.13–15. Consultado em 8 de janeiro de 2009
- ↑ «Should spermicides be used with condoms?». Condoms and Sexually Transmitted Diseases, Brochure. United States Food and Drug Administration. 30 de abril de 2009. Consultado em 23 de julho de 2009
- ↑ Global Campaign for Microbicides : Rectal Use of N-9 checked 2009-07-22
- ↑ Nonoxynol-9 Spermicide on HIV Risk List checked 2009-07-22
- ↑ Weiss, H.A.; M.A. Quigley, R.J. Hayes (2000). «Male circumcision and risk of HIV infection in sub-Saharan Africa: A systematic review and meta-analysis». AIDS. 14 (15): 2361–70. PMID 11089625. doi:10.1097/00002030-200010200-00018
- ↑ Siegfried, N., Muller, M., Deeks, J., Volmink, J., Egger, M., Low, N., Walker, S. and Williamson, P. (2005). «HIV and male circumcision--a systematic review with assessment of the quality of studies». Lancet Infect. Dis. 5 (3): 165–73. PMID 15766651
- ↑ Various (2005). «Repeated Use of Unsterilized Blades in Ritual Circumcision Might Contribute to HIV Spread in S. Africa, Doctors Say». Kaisernetwork.org. Consultado em 28 de março de 2006
- ↑ Williams BG, Lloyd-Smith JO, Gouws E, Hankins C, Getz WM, Hargrove J, de Zoysa I, Dye C, Auvert B. (2006). «The Potential Impact of Male Circumcision on HIV in Sub-Saharan Africa.». PLoS Med. 3 (7): e262. PMID 16822094. doi:10.1371/journal.pmed.0030262
- ↑ Bailey RC, Moses S, Parker CB; et al. (2007). «Male circumcision for HIV prevention in young men in Kisumu, Kenya: a randomised controlled trial». Lancet. 369 (9562): 643–56. PMID 17321310. doi:10.1016/S0140-6736(07)60312-2
- ↑ Gray RH; et al. (24 February 2007). «Male circumcision for HIV prevention in men in Rakai, Uganda: a randomised trial». Lancet. 369 (9562): 657–66. PMID 17321311. doi:10.1016/S0140-6736(07)60313-4 Verifique data em:
|data=(ajuda) - ↑ WHO (2007). «WHO and UNAIDS announce recommendations from expert consultation on male circumcision for HIV prevention». WHO.int. Consultado em 13 de julho de 2007
- ↑ Lifson AR (1988). «Do alternate modes for transmission of human immunodeficiency virus exist? A review». JAMA. 259 (9): 1353–6. PMID 2963151. doi:10.1001/jama.259.9.1353
- ↑ http://www.rci.rutgers.edu/%7Einsects/aids.htm
- ↑ Cochrane Systematic Review on interventions for prevention of late postnatal mother-to-child transmission of HIV http://www.cochrane.org/reviews/en/ab006734.html
- ↑ Smith D, Richman D, Little S (2005). «HIV Superinfection». Journal of Infectious Diseases. 192: 438–44. PMID 15995957. doi:10.1086/431682
- ↑ Gottlieb; et al. (2004). «Dual HIV-1 infection associated with rapid disease progression». Lancet. 363 (9049): 619–22. PMID 14987889. doi:10.1016/S0140-6736(04)15596-7
- ↑ Smith; et al. (2004). «Incidence of HIV superinfection following primary infection». JAMA. 292 (10): 1177–8. PMID 15353529. doi:10.1001/jama.292.10.1177
- ↑ Chohan B, Lavreys L, Rainwater SM, Overbaugh J (2005). «Evidence for frequent reinfection with human immunodeficiency virus type 1 of a different subtype». J. Virol. 79 (16): 10701–8. PMC 1182664
 . PMID 16051862. doi:10.1128/JVI.79.16.10701-10708.2005
. PMID 16051862. doi:10.1128/JVI.79.16.10701-10708.2005
- ↑ Piantadosi A, Chohan B, Chohan V, McClelland RS, Overbaugh J (2007). «Chronic HIV-1 infection frequently fails to protect against superinfection». PLoS Pathog. 3 (11): e177. PMC 2077901
 . PMID 18020705. doi:10.1371/journal.ppat.0030177
. PMID 18020705. doi:10.1371/journal.ppat.0030177
- ↑ Hu DJ, Subbarao S, Vanichseni S; et al. (2005). «Frequency of HIV-1 dual subtype infections, including intersubtype superinfections, among injection drug users in Bangkok, Thailand». AIDS. 19 (3): 303–8. PMID 15718841. Consultado em 31 de março de 2009
- ↑ Kahn JO, Walker BD. Acute Human Immunodeficiency Vírus type 1 infection. N Engl J Med 1998;331:33-9.
- ↑ LIMA, Mônica M.. HIV/tuberculosis co-infection: a request for a better surveillance. Rev. Saúde Pública [online]. 1997, vol.31, n.3, pp. 217-220. ISSN 0034-8910. [1]
- ↑ Williams BG, Lloyd-Smith JO, Gouws E, Hankins C, Getz WM, et al. 2006 The Potential Impact of Male Circumcision on HIV in Sub-Saharan Africa. PLoS Med 3(7): e262. doi:10.1371/journal.pmed.0030262
- ↑ Robert M. Grant, M.D. e col.(2010) Preexposure Chemoprophylaxis for HIV Prevention in Men Who Have Sex with Men. New england journal of medicine. Novembro
- ↑ Mandú, Edir Nei Teixeira; Dióz, Majoreth. Percepções de grávidas em torno da prevenção da contaminação do hiv e de sua transmissão vertical. Ciênc. cuid. saúde;5(3):344-354, set.-dez. 2006.
- ↑ Reis, Renata Karina; Gir, Elucir. Vulnerabilidade ao HIV/AIDS e a prevenção da transmissão sexual entre casais sorodiscordantes. Rev. Esc. Enferm. USP;43(3):662-669, set. 2009.
- ↑ Fan, H., Conner, R. F. and Villarreal, L. P. eds, ed. (2005). AIDS : science and society 4th edition ed. Boston, MA: Jones and Bartlett Publishers. ISBN 0-7637-0086-X
- ↑ Department of Health and Human Services (January, 2005). «A Pocket Guide to Adult HIV/AIDS Treatment January 2005 edition». Consultado em 17 de janeiro de 2006 Verifique data em:
|ano=(ajuda) - ↑ Coordenação Nacional para a Infecção VIH/sida. «Recomendações Portuguesas para o Tratamento da Infecção VIH/sida» (PDF). Consultado em 18 de outubro de 2013
- ↑ Department of Health and Human Services Working Group on Antiretroviral Therapy and Medical Management of HIV-Infected Children (November 3, 2005). «Guidelines for the Use of Antiretroviral Agents in Pediatric HIV Infection» (PDF). Consultado em 17 de janeiro de 2006 Verifique data em:
|ano=(ajuda) - ↑ Department of Health and Human Services Panel on Clinical Practices for Treatment of HIV Infection (2005). «Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents» (PDF). Consultado em 17 de janeiro de 2006
- ↑ Martinez-Picado, J., DePasquale, M. P., Kartsonis, N., Hanna, G. J., Wong, J., Finzi, D., Rosenberg, E., Gunthard, H. F., Sutton, L., Savara, A., Petropoulos, C. J., Hellmann, N., Walker, B. D., Richman, D. D., Siliciano, R. and D'Aquila, R. T. (2000). «Antiretroviral resistance during successful therapy of human immunodeficiency virus type 1 infection». Proc. Natl. Acad. Sci. U. S. A. 97 (20): 10948-10953. PMID 11005867
- ↑ Dybul, M., Fauci, A. S., Bartlett, J. G., Kaplan, J. E., Pau, A. K.; Panel on Clinical Practices for Treatment of HIV. (2002). «Guidelines for using antiretroviral agents among HIV-infected adults and adolescents». Ann. Intern. Med. 137 (5 Pt 2): 381-433. PMID 12617573
- ↑ Blankson, J. N., Persaud, D., Siliciano, R. F. (2002). «The challenge of viral reservoirs in HIV-1 infection». Annu. Rev. Med. 53: 557-593. PMID 11818490
- ↑ a b Wood, E., Hogg, R. S., Yip, B., Harrigan, P. R., O'Shaughnessy, M. V. and Montaner, J. S. (2003). «Is there a baseline CD4 cell count that precludes a survival response to modern antiretroviral therapy?». AIDS. 17 (5): 711-720. PMID 12646794 Erro de citação: Código
<ref>inválido; o nome "Wood" é definido mais de uma vez com conteúdos diferentes - ↑ Chene, G., Sterne, J. A., May, M., Costagliola, D., Ledergerber, B., Phillips, A. N., Dabis, F., Lundgren, J., D'Arminio Monforte, A., de Wolf, F., Hogg, R., Reiss, P., Justice, A., Leport, C., Staszewski, S., Gill, J., Fatkenheuer, G., Egger, M. E. and the Antiretroviral Therapy Cohort Collaboration. (2003). «Prognostic importance of initial response in HIV-1 infected patients starting potent antiretroviral therapy: analysis of prospective studies». Lancet. 362 (9385): 679-686. PMID 12957089
- ↑ Schackman BR, Gebo KA, Walensky RP, Losina E, Muccio T, Sax PE, Weinstein MC, Seage GR 3rd, Moore RD, Freedberg KA. (2006). «The lifetime cost of current HIV care in the United States». Med Care. 44 (11): 990-997. PMID 17063130
- ↑ Becker SL, Dezii CM, Burtcel B, Kawabata H, Hodder S. (2002). «Young HIV-infected adults are at greater risk for medication nonadherence». MedGenMed. 4 (3). 21 páginas. PMID 12466764
- ↑ Nieuwkerk, P., Sprangers, M., Burger, D., Hoetelmans, R. M., Hugen, P. W., Danner, S. A., van Der Ende, M. E., Schneider, M. M., Schrey, G., Meenhorst, P. L., Sprenger, H. G., Kauffmann, R. H., Jambroes, M., Chesney, M. A., de Wolf, F., Lange, J. M. and the ATHENA Project. (2001). «Limited Patient Adherence to Highly Active Antiretroviral Therapy for HIV-1 Infection in an Observational Cohort Study». Arch. Intern. Med. 161 (16): 1962-1968. PMID 11525698
- ↑ Kleeberger, C., Phair, J., Strathdee, S., Detels, R., Kingsley, L. and Jacobson, L. P. (2001). «Determinants of Heterogeneous Adherence to HIV-Antiretroviral Therapies in the Multicenter AIDS Cohort Study». J. Acquir. Immune Defic. Syndr. 26 (1): 82-92. PMID 11176272
- ↑ Heath, K. V., Singer, J., O'Shaughnessy, M. V., Montaner, J. S. and Hogg, R. S. (2002). «Intentional Nonadherence Due to Adverse Symptoms Associated With Antiretroviral Therapy». J. Acquir. Immune Defic. Syndr. 31 (2): 211-217. PMID 12394800
- ↑ Montessori, V., Press, N., Harris, M., Akagi, L., Montaner, J. S. (2004). «Adverse effects of antiretroviral therapy for HIV infection.». CMAJ. 170 (2): 229-238. PMID 14734438
- ↑ Saitoh, A., Hull, A. D., Franklin, P. and Spector, S. A. (2005). «Myelomeningocele in an infant with intrauterine exposure to efavirenz». J. Perinatol. 25 (8): 555-556. PMID 16047034
- ↑ Wang C, Vlahov D, Galai N; et al. (2004). «Mortality in HIV-seropositive versus seronegative persons in the era of highly active antiretroviral therapy.». J. Infect. Dis. 190: 1046–54. PMID 15319852
- ↑ Organização Mundial de Saúde (2006). «WHO case definitions of HIV for surveillance and revised clinical staging and immunological classification» (PDF). Consultado em 27 de dezembro de 2006
- ↑ a b c Ferrantelli F, Cafaro A, Ensoli B. (2004). «Nonstructural HIV proteins as targets for prophylactic or therapeutic vaccines». Curr Opin Biotechnol. 15 (6): 543-556. PMID 15560981
- ↑ BBC News (2007). «Scientists expose HIV weak spot». Consultado em 20 de abril de 2007
- ↑ F Cournos, M Empfield, E Horwath, K McKinnon, I Meyer, H Schrage, C Currie and B Agosin. HIV seroprevalence among patients admitted to two psychiatric hospitals Am J Psychiatry 1991; 148:1225-1230 Copyright © 1991 by American Psychiatric Association
- ↑ Kelly B; Raphael B; Judd F; Perdices M; Kernutt G; Burrows GD; Burnett PC; Dunne M. Psychiatric disorder in HIV infection. Aust N Z J Psychiatry;32(3):441-53, 1998 Jun.
- ↑ GR Brown, JR Rundell, SE McManis, SN Kendall, R Zachary and L Temoshok. Prevalence of psychiatric disorders in early stages of HIV infection Psychosomatic Medicine, Vol 54, Issue 5 588-601, Copyright © 1992 by American Psychosomatic Society
- ↑ T.A. Rihs; K. Begley; D.E. Smith; J. Sarangapany; A. Callaghan; M. Kelly; J.J. Post; J. Gold. Efavirenz and Chronic Neuropsychiatric Symptoms: a Cross-sectional Case Control Study Posted: 01/31/2007; HIV Medicine. 2006;7(8):544-548. © 2006 Blackwell Publishing. Disponível em (24/02/2010): http://www.medscape.com/viewarticle/550461
- ↑ C Gala, A Pergami, J Catalan, F Durbano, M Musicco, M Riccio, T Baldeweg and G Invernizzi. The psychosocial impact of HIV infection in gay men, drug users and heterosexuals. Controlled investigation The British Journal of Psychiatry 163: 651-659 (1993)© 1993 The Royal College of Psychiatrists. Disponível em: http://bjp.rcpsych.org/cgi/content/abstract/163/5/651
- ↑ Weinel E. Long-term psychotherapy of HIV patients - indications and experiences.Int Conf AIDS. 1990 Jun 20-23; 6: 186 (abstract no. S.B.402). Disponível em: http://gateway.nlm.nih.gov/MeetingAbstracts/ma?f=102196209.html
- ↑ Hans-Joumlrg Znoj e col. Psychotherapeutic process of cognitive-behavioral intervention in HIV-infected persons: Results from a controlled, randomized prospective clinical trial 2008 Impact Factor of 1.579 (2009 Thomson Reuters, 2008 Journal Citation Reports)
- ↑ COLOMBRINI, Maria Rosa Ceccato; LOPES, Maria Helena Baena de Moraes and FIGUEIREDO, Rosely Moralez de. Adesão à terapia antiretroviral para HIV/AIDS. Rev. esc. enferm. USP [online]. 2006, vol.40, n.4 [cited 2010-02-24], pp. 576-581 . Available from: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0080-62342006000400018&lng=en&nrm=iso>. ISSN 0080-6234. doi: 10.1590/S0080-62342006000400018.
- ↑ Nações Unidas - Brasil. A ONU e a Resposta à AIDS no Brasil.[2] Acessado em 13 de janeiro de 2010
- ↑ a b UNAIDS. Relatório global sobre a epidemia de AIDS 2009 – Sumário geral.[3] Acessado em 13 de janeiro de 2010.
- ↑ Rádio das Nações Unidas. Jovens são maior grupo de risco do HIV, diz ONU. [4] Acessado em 13 de janeiro de 2010.
- ↑ http://www.aids.gov.br/sites/default/files/anexos/publicacao/2010/45974/boletim_dst_aids_2010_pdf_19557.pdf
- ↑ UNAIDS, WHO (December 2007). "2007 AIDS epidemic update" (PDF). http://data.unaids.org/pub/EPISlides/2007/2007_epiupdate_en.pdf. Retrieved 2008-03-12.
- ↑ a b Zwahlen M, Egger M (2006) (PDF). Progression and mortality of untreated HIV-positive individuals living in resource-limited settings: update of literature review and evidence synthesis. UNAIDS Obligation HQ/05/422204. http://data.unaids.org/pub/Periodical/2006/zwahlen_unaids_hq_05_422204_2007_en.pdf. Retrieved 2008-03-19.
- ↑ Antiretroviral Therapy Cohort Collaboration (2008). "Life expectancy of individuals on combination antiretroviral therapy in high-income countries: a collaborative analysis of 14 cohort studies". Lancet 372 (9635): 293–9.
- ↑ S. H. Kazmi, J. R. Naglik, S. P. Sweet, R. W. Evans, S. O'Shea, J. E. Banatvala, and S. J. Challacombe; Comparison of Human Immunodeficiency Virus Type 1-Specific Inhibitory Activities in Saliva and Other Human Mucosal Fluids; Clin. Vaccine Immunol., October 1, 2006; 13(10): 1111 - 1118.
Ligações externas
- HIV international travel restrictions and retreats: www.plwha.org
- «Folhas Informativas sobre HIV e AIDS»
- «Portal português de referência na temática do VIH/SIDA»
- «RNP+ Rede Nacional de Pessoas vivendo com HIV/Aids» (em português e inglês)
- «HIV InSite» (em inglês)
- «Associação Brasileira Interdisciplinar de AIDS»
- «Texto sobre a descoberta do HIV, a polêmica envolvida e o prêmio Nobel de Medicina e Fisiologia de 2008»
- «Entrevista inédita com Bia Pacheco.Conheça os trabalhos de destaques ligados ao HIV/AIDS realizados por esta cidadã»
- «Evolução do vírus HIV»
- «HIV na 3ª idade»
- «AIDS e envelhecimento: repercussões na saúde pública.Incidência de VIH na população idosa e tendência à feminização»
- «Nova campanha contra HIV/AIDS veiculada pela Rede Globo.Essa campanha pode ser efetiva?»
Predefinição:Bom interwiki
Predefinição:Bom interwiki
Predefinição:Link FA
Erro de citação: Existem etiquetas <ref> para um grupo chamado "nota", mas não foi encontrada nenhuma etiqueta <references group="nota"/> correspondente

