Lepra
| Lepra | |
|---|---|
| Perna com lesões de lepra limítrofe (borderline) | |
| Sinónimos | Hanseníase, doença de Hansen |
| Especialidade | Infectologia |
| Sintomas | Diminuição da sensibilidade (térmica, dolorosa e tátil) [1] |
| Causas | Mycobacterium leprae ou Mycobacterium lepromatosis[2][3] |
| Fatores de risco | Proximidade com pessoas infetadas, pobreza[1][4] |
| Tratamento | Terapia multidrogas[2] |
| Medicação | Rifampicina, dapsona, clofazimina[1] |
| Frequência | 514 000 (2015)[5] |
| Classificação e recursos externos | |
| CID-10 | A30, A30.9 |
| CID-9 | 030, 030.9 |
| CID-11 | 149072669 |
| OMIM | 607572, 609888, 613407 |
| DiseasesDB | 8478 |
| MedlinePlus | 001347 |
| eMedicine | 220455, 1104977, 1165419 |
| MeSH | D007918 |
Lepra,[nota 1] doença de Hansen ou hanseníase é uma infeção crónica causada pelas bactérias Mycobacterium leprae ou Mycobacterium lepromatosis.[2][3] A infeção geralmente não manifesta sintomas durante os primeiros 5 a 20 anos.[2] Gradualmente, vão-se desenvolvendo granulomas nos nervos, trato respiratório, pele e olhos.[2] Isto pode resultar na diminuição da capacidade de sentir dor, o que por sua vez pode levar à perda de partes das extremidades devido a lesões ou infeções sucessivas que passam despercebidas ao portador.[1] Estes sintomas podem também ser acompanhados por diminuição da visão e fraqueza.[1]
A lepra é transmitida entre pessoas e possivelmente a partir de tatus (dasipodídeos, clamiforídeos).[7] Pensa-se que a transmissão se dê através da tosse ou pelo contacto com o muco nasal de uma pessoa infetada.[7] A lepra é mais comum em contextos de pobreza.[1] Contrariamente à crença popular, não é uma doença altamente contagiosa.[1] A doença é classificada em dois tipos principais: lepra paucibacilar e lepra multibacilar.[1] Os dois tipos distinguem-se pelo número de manchas de pele hipopigmentada e dormente – a lepra paucibacilar possui cinco ou menos e a multibacilar mais de cinco.[1] O diagnóstico é confirmado com a análise de uma biópsia.[1]
A lepra pode ser curada com um tratamento multidrogas.[2] O tratamento da lepra paucibacilar consiste na administração de dapsona e rifampicina durante seis meses.[1] O tratamento de lepra multibacilar consiste na administração de rifampicina, dapsona e clofazimina durante doze meses.[1] Podem também ser usados outros antibóticos.[1] A Organização Mundial de Saúde disponibiliza estes medicamentos de forma gratuita.[2] Em 2012, havia em todo o mundo 189 000 casos crónicos de lepra, uma diminuição acentuada em relação aos 5,2 milhões na década de 1980.[2][8][9] No mesmo ano registaram-se 230 000 novos casos.[2] Em 2022 foram notificados 174.087 novos casos da doença no mundo. A Índia é o país com o maior número de doentes e registrou 103.819 novos casos da doença em 2022. [10] O Brasil é o segundo país em número de casos de hanseníase com 19.635 casos notificados em 2022. [10] A maior parte dos novos casos ocorre em apenas 16 países, dos quais a Índia contabiliza mais de metade.[2][1] Nos últimos vinte anos foram curadas da lepra 16 milhões de pessoas em todo o mundo.[2]
A lepra afetou a Humanidade durante milhares de anos.[1] O nome da doença tem origem no termo grego λέπρᾱ (léprā), derivado de λεπῐ́ς (lepís; "escama"). O termo "hanseníase" é dado em homenagem ao médico norueguês Gerhard Armauer Hansen, que descobriu a causa da doença em 1873.[1] Isolar os portadores da doença em leprosarias, outrora comum em todo o mundo, ainda ocorre na Índia,[11] China,[12] e África.[13] No entanto, a maior parte das leprosarias foi encerrada, dado que a doença não é significativamente contagiosa.[13] Durante grande parte da História, os leprosos foram vítimas de estigma social, o que ainda continua a ser uma barreira para a procura de tratamento.[2] Devido a este estigma, muitas pessoas consideram o termo "leproso" ofensivo.[14] A condição está classificada como doença tropical negligenciada.[15]
Sinais e sintomas
[editar | editar código-fonte]
A lepra é uma doença infectocontagiosa crónica causada pela bactéria Mycobacterium leprae.[10][16][17] Esta doença é particularmente conhecida por causar deficiências debilitantes e incapacidades associadas a danos no sistema nervoso periférico, na pele, mucosa nasal, olhos e, nas formas mais graves, nos órgãos internos e sistemas muscular e esquelético.[18][19][20][21][22]
Em 1982, a Organização Mundial de Saúde[23] classificou a lepra de acordo com o número de lesões cutâneas e a presença ou ausência de bacilos na pele e/ou mucosas nasais, independentemente do seu tamanho, localização ou características histológicas:[16][18]
- Paucibacilar (<5 lesões cutâneas; ausência de bacilos);
- Multibacilar (>5 lesões cutâneas; presença de bacilos; espessamento de nervos periféricos, perda de sensibilidade ou de força muscular).
A classificação da lepra é baseada em dados clínicos, histológicos e baciloscopias do muco nasal e pele, e pode ser considerada lepra: tuberculoide (TT), Borderline Tuberculoide (BT), Borderline-Borderline (BB), Borderline Lepromatosa (BL), Lepromatosa (LL) e Indeterminada (I).[16][18]
Lepra tuberculoide (TT)
[editar | editar código-fonte]A Lepra Tuberculoide (TT) - “forma benigna” [1, 5] - é causada pelo Mycobacterium leprae e corresponde à forma imunologicamente estável, paucibacilar e pouco contagiosa da doença,[10][16][18] com baciloscopia negativa que ocorre em indivíduos com algum grau de resistência ao bacilo.[10][18]
Esta doença manifesta-se pela presença de um número reduzido de lesões cutâneas, que podem mostrar-se eritematosas, em descamação, anidróticas, alopécicas e anestésicas.[10][16][18] Esta perda de sensibilidade encontra-se distribuída de forma assimétrica e resulta na destruição dos nervos cutâneos,[18] que leva a alterações sensitivas e motoras das extremidades, osteoporose por desuso,[16][19] reabsorção óssea e mal perfurante plantar.[16]
Lepra Borderline (B)
[editar | editar código-fonte]As formas Borderline são as formas instáveis da doença.[16] É a forma mais comum, um tipo intermediário entre boa e má resposta do sistema imunitário. As lesões cutâneas assemelham-se às da lepra tuberculoide, mas são mais numerosas e irregulares. Grandes manchas podem afetar um membro inteiro e ocorre fraqueza e perda de sensibilidade nos pés, mãos e rosto; pode converter-se em lepra lepromatosa ou reverter, tornando-se mais parecido com a forma tuberculoide.[24]
Lepra Lepromatosa (LL)
[editar | editar código-fonte]A Lepra Lepromatosa (LL) - forma “maligna” [10][18] - é causada pelo Mycobacterium lepromatosis[25] (espécie não consensual) e corresponde à forma multibacilar e altamente contagiosa com baciloscopia positiva da doença.[10][16][18] Esta forma ocorre em indivíduos com baixa resistência imunológica e permite a disseminação de grande número de bacilos por todo o organismo - pele, nervos,[a] nariz, boca, laringe, faringe, olhos e vísceras.[10][18]
As manifestações clínicas são numerosas, bilaterais e simétricas e de morfologia, extensão e localização variáveis.[16][18] As principais lesões cutâneas incluem:
- Máculas eritematosas simétricas;[18]
- Infiltrações difusas na pele, extensas e localizadas no rosto, dorso das mãos, antebraços e pernas;[16][18]
- Nódulos e lepromas, que atingem as regiões supraciliares e malares, as orelhas, o processo mental e os membros (maior frequência nos cotovelos, joelhos e terço distal dos antebraços).[18] A coexistência destas lesões com a infiltração difusa resulta no aspeto físico característico de quem sofre desta doença: facies leonina[16][18] e alopecia/madarose.[18][26]
As alterações da mucosa nasal, para além da obstrução nasal e epistaxes, podem conduzir a fenómenos destrutivos, com consequente perfuração do septo e colapso da pirâmide nasal.[16][18][22]
Quando não diagnosticada e tratada precocemente, pode atingir vários órgãos e ser causador de múltiplas morbilidades, como cegueira, lagoftalmia, conjuntivite, osteoporose, esterilidade, insuficiências hepática e renal, dedos “em garra” e mal perfurante plantar.[16][18][26]
Lepra Indeterminada (I)
[editar | editar código-fonte]A forma Indeterminada é a forma inicial e transitória da doença, mais frequente em crianças;[10][16] por norma, tem cura espontânea.[10] A partir do estado inicial, a lepra pode permanecer estável (maior parte dos casos) ou pode evoluir para lepra tuberculoide ou lepromatosa, dependendo da predisposição genética particular de cada paciente. A lepra pode adotar também vários cursos intermediários entre estes dois tipos, sendo então denominada lepra dimorfa.[27]
Quer na forma tuberculoide quer na lepromatosa, a destruição dos nervos sensoriais é acompanhada por disfunção circulatória,[17] que resulta na perda progressiva da sensibilidade térmica, tátil e dolorosa das extremidades.[22][26] Esta falta de sensibilidade pode levar à formação de inúmeras lesões, sobretudo nos pés, que frequentemente levam ao aparecimento de infeções secundárias, gangrena (com eventual amputação) [19][26] e, em casos mais extremos, à morte.[17]
Transmissão
[editar | editar código-fonte]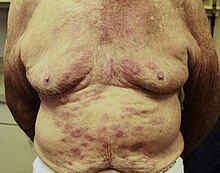
O modo exato de transmissão da lepra é ainda desconhecido.[18] Contudo, sabe-se que a viabilidade do M. leprae, em secreções secas, varia entre 1 e 7 dias,[16] pelo que se presume que o contágio indireto seja mínimo;[18] consequentemente, a transmissão da lepra deverá ocorrer por secreções nasais e/ou gotículas orais de pessoas infetadas,[16][18][19] por inoculação através da mucosa nasal e, mais raramente, através de erosões cutâneas.[16][18] O contágio congénito da lepra é pouco provável, mas a amamentação pode ser considerada um vetor da doença.[18]
Ainda que seja um assunto muito controverso, é coletivamente aceite na comunidade científica que o período de incubação do M. leprae é bastante longo,[17] podendo variar de 6 meses a 40 (ou mais) anos.[28]
De todas a pessoas infetadas, só 5%-10% acaba por desenvolver a doença,[16][18] o que significa que existe variabilidade na suscetibilidade e resistência, dependendo de fatores genéticos,[16] bem como da resposta imunitária de cada indivíduo, que vai desempenhar um papel significativo na progressão da infeção e na sua manifestação clínica[10][16][17][19][21]: na lepra tuberculoide, a resposta imunitária é forte e limita a presença de bacilos no organismo; na lepra lepromatosa/virchowiana, a resposta imunitária é fraca e, por isso, o número de bacilos vai ser elevado.[16] Indivíduos com sistemas imunitários comprometidos, bem como mulheres grávidas, estão mais suscetíveis à infeção.[16]
A lepra não é uma doença hereditária; no entanto, a infeção costuma acontecer durante a infância, acabando por se manifestar mais tarde, sobretudo entre os 10 e os 20 anos,[16][18][19] com predomínio no sexo masculino, numa relação de 2:1.[16]
A frequência de ocorrência da hanseníase em crianças é um parâmetro epidemiológico importante, nomeadamente para a determinação da taxa de transmissão da doença. Ainda que seja rara em crianças com menos de 5 anos,[18] a forma de lepra mais comummente encontrada é a hanseníase nodular (NL), uma variante clínica benigna que afeta lactentes e crianças que permanecem em contacto permanente e próximo com alguém infetado. Em muitos casos, a criança cura-se sem qualquer intervenção médica, mas a doença pode reaparecer uns anos mais tarde.[19]
Diagnóstico
[editar | editar código-fonte]A hanseníase é geralmente diagnosticada após esfregaço cutâneo, zaragatoa nasal e exame histopatológico.[28]
Tratamento
[editar | editar código-fonte]Na 1ª Conferência Mundial sobre a Lepra, realizada em Berlim no ano de 1897, a lepra foi, finalmente, reconhecida como uma doença infectocontagiosa.[29][30] Foi nesta conferência que se consagrou a teoria do contágio e a proficiência no combate à lepra, através do isolamento domiciliar ou hospitalar dos infetados, de modo a evitar o contágio,[16][29][30] e foi traçado o modelo ideal para as leprosarias modernas, baseadas numa medicina social.[16][29][30]
No mundo existem muitas leprosarias para o abrigo e a cura dos doentes de Hanseníase. A Igreja administra, em todo o mundo, 547 leprosários, segundo dados do último Anuário Estatístico da Igreja: 198 em África, 56 na América, 285 na Ásia, 5 na Europa e 3 na Oceânia.
Apesar de não mortal, a lepra pode acarretar invalidez severa e/ou permanente se não for tratada a tempo. A OMS recomenda, desde 2018,[31] uma terapêutica tripla que consiste na administração de dapsona, rifampicina e clofazimina durante 12 meses nas formas multibacilares e durante 6 meses nas formas paucibacilares.[16] A Organização Mundial de Saúde disponibiliza estes medicamentos de forma gratuita.[32]
Para além dos antibióticos e da poliquimioterapia, quando as lesões já estão constituídas, o tratamento baseia-se em próteses, intervenções ortopédicas, calçados especiais, etc. Além disso, uma grande contribuição à prevenção e ao tratamento das incapacidades causadas pela lepra é a fisioterapia.[33]
Talidomida
[editar | editar código-fonte]Malformações congénitas devido ao uso de Talidomida pelas mães no período gestacional resultavam em crianças nascidas com membros atrofiados – focomelia –, especialmente os membros superiores.[34] Muitas dessas malformações foram correlacionadas ao uso do medicamento durante a gravidez para controlo de enjoos.[34] Atualmente, o medicamento é usado no tratamento da hanseníase, lúpus sistémico e SIDA/AIDS.[35] Para o conseguir, é necessária documentação comprovativa e controlo rigoroso das receitas médicas, sendo proibida a sua venda em farmácias.[36]
Imunidade Cruzada: Lepra vs. Tuberculose
[editar | editar código-fonte]A hanseníase e a tuberculose são doenças infecciosas causadas pelo complexo Mycobacterium[28] e associadas a fatores sociais, ecológicos e biológicos semelhantes, como pobreza, acesso precário a cuidados de saúde, desnutrição, sistemas imunitários comprometidos, etc..[21]
De acordo com a literatura, existe uma relação entre estas duas doenças, que se baseia na dinâmica de transmissão das infeções e no grau de imunidade cruzada,[37] que não permitiria que ambas as infeções ocorressem simultaneamente, ainda que hoje se saiba, com o recurso a estudos moleculares, que esta teoria não é totalmente correta.[19][28]
Esta hipótese é bastante controversa, mas o facto clínico mais aceite é que a vacinação contra a tuberculose (Bacillus-Calmette-Guérin - BCG) pode ajudar na prevenção da infeção por Mycobacterium leprae,[38][21] sendo eficaz em 20-91% dos casos de hanseníase.[19]
Epidemiologia
[editar | editar código-fonte]
Há 200.000 novos casos por ano[39] e estima-se que seja entre 2 e 3 milhões o número de pessoas severamente descapacitadas pela lepra em todo o mundo.[40] Em 2018 foram notificados 208.619 novos casos em 127 países, nomeadamente na Índia, Brasil e Indonésia.[41]
A hanseníase é raramente encontrada na Europa, mas é, ainda, uma doença endémica em muitos países do mundo, sobretudo no Sudeste Asiático, em África e na América do Sul (principalmente no Brasil).[19][21][30] Os casos notificados de lepra, atualmente, na Europa são essencialmente casos importados de regiões endémicas;[30] porém, com a crescente imigração de indivíduos destes países, começa a assistir-se a um ligeiro aumento de novos casos de lepra na Europa, e, inclusivamente, em Portugal.[16]
Atualmente, em Portugal, existe um número muito reduzido de casos de hanseníase todos os anos: em 2018 foram notificados apenas 5 casos.[41] A doença é de notificação obrigatória.[42] O Brasil é o segundo país com maior número de casos em todo o mundo, com 26 875 casos em 2017.[43] Em 2016 existiam em Angola 1210 casos notificados de lepra.[44] Em 2017, Moçambique registou Moçambique registou 1.926 casos de lepra em 2017, mais 245 do que em 2016.[45]
História
[editar | editar código-fonte]

O nome da doença tem origem no termo grego λέπρᾱ (léprā), derivado de λεπῐ́ς (lepís; "escama"). O termo "hanseníase" é dado em homenagem ao médico norueguês Gerhard Armauer Hansen, que descobriu a causa da doença em 1873.[46]
Existem relatos de casos de lepra desde o ano 3000 a.C..[16] Não se sabe, no entanto, se esta doença terá surgido no continente africano ou no continente asiático, ainda que se considere o Médio Oriente como o local de propagação da doença para a Europa.[20][30]
Em 2017, Köhler e colaboradores[47] registaram cinco possíveis casos paleopatológicos de lepra (4 dos quais são apenas casos suspeitos, não se podendo excluir outras infeções) em Abony-Turjányos dűlő (Hungria). Estes indivíduos datam da Idade do Cobre tardia (3780–3650 a.C.),[47] constituindo o caso paleopatológico de lepra mais antigo da Europa de que há registo até à data.
Outras evidências paleopatológicas da lepra contam-se entre os exemplos da Necrópole de Casalechio di Reno (Bolonha, Itália),[48] dos Hospitais St. James e Sta. Maria Madalena em Chichester[49] e Sta. Maria Madalena em Winchester[50] no Reino Unido, e St. Jørgen's em Naestved[51] e St. Jørgen's em Odense[18] na Dinamarca.
A lepra foi uma doença prevalente em toda a Europa durante o período medieval até ao seu declínio a partir do século XVI.[52][30] Ainda que a razão para este declínio ainda não esteja totalmente clara e seja, ainda, um tema controverso, é bastante provável que múltiplos fatores tenham contribuído para esta diminuição de casos, como: mudança antigénica da bactéria; efeitos do isolamento e quarentena; mortalidade direta ou indireta causada por outras infeções (ex.: peste); mudanças na dieta, no vestuário e na habitação e saneamento; o aparecimento e aumento da tuberculose,[52][30] etc.
A ausência de tratamento eficaz e o medo de contágio conduziram à ostracização dos doentes, tanto pela sociedade, como pela própria família, pelo que, no século IV, terão surgido, na Capadócia, as leprosarias, destinadas ao isolamento dos doentes.[10][16][21][53] Estas começaram a difundir-se por toda a Europa a partir do século X.[16]
Em Portugal
[editar | editar código-fonte]Em Portugal, há poucas evidências paleopatológicas desta doença. A primeira evidência foi descoberta em 2003 durante a escavação na região da Ermida de Santo André (Beja),[54] onde foram recuperados, pelo menos, 10 indivíduos: um indivíduo adulto do sexo masculino apresentava lesões compatíveis com um diagnóstico provável de lepra; quatro indivíduos (dois adultos jovens e dois adultos), possivelmente do sexo masculino, apresentam-se como casos possíveis, já que o estado de preservação dos mesmos não permite um diagnóstico diferencial preciso.[55]
Para além deste indivíduo, outro foi descoberto, também com lesões compatíveis com lepra, em Lagos (Valle da Gafaria),[17] datado entre os séculos XV e XVII. Mais recentemente, foi descoberto outro possível caso paleopatológico de lepra: um indivíduo adulto do sexo masculino em Travanca (Santa Maria da Feira), datado entre os séculos XVII-XIX.[56]
Em Portugal terão existido, desde o século XI[16] ou XII,[30] cerca de 70 leprosarias (gafarias), que funcionavam como local de internamento para estes doentes e representavam a única medida preventiva da doença.[16]
Ainda que tenham existido dezenas de gafarias em Portugal ao longo dos séculos,[10][16][30] o mais conhecido, pelo menos durante o século XX, foi o Hospital Colónia Rovisco Pais. De modo a colmatar a abolição da assistência aos leprosos no Hospital da Universidade de Coimbra, o Professor Bissaya Barreto (1886-1974) criou, com o legado financeiro deixado por Rovisco Pais, a Leprosaria Nacional Rovisco Pais, inaugurada a 7 de setembro de 1947 e instalada numa propriedade agrícola, a Quinta da Fonte Quente, na Tocha (Cantanhede),[16][29][30] com lotação para mil doentes e isolado dos grandes centros populacionais.[29]
Este Hospital previa o internamento compulsivo dos doentes contagiosos que resultava na perda da cidadania dos mesmos;[29] a fuga era punível;[29][30] a circulação de dinheiro era proibida;[29][30] o trabalho era uma necessidade, mas era também utilizado como elemento fundamental para o processo terapêutico, com o objetivo de formação profissional para permitir a posterior reinserção social dos pacientes, e a alfabetização.[26][29][30]
Este estabelecimento, e, sobretudo, o seu desenho arquitetónico, encerrava em si toda a ideologia do regime do Estado Novo, como a ruralidade, a família, a religião e o trabalho.[29]
No Brasil
[editar | editar código-fonte]No Brasil, até meados do século XX, os doentes eram forçados ao isolamento em leprosários e tinham os seus pertences queimados, uma política que visava muito mais ao afastamento dos portadores do que a um tratamento efetivo[57]. Só em 1962 é que o internamento compulsivo dos doentes deixou de ser obrigatório. Este processo foi oficializado a 15 de outubro de 1968, através da Lei nº 5.511,[58] que revogava esta obrigatoriedade implantada desde a Lei nº 610 de 1949. Porém, o retorno dos pacientes ao seu convívio social era extremamente dificultado, devido à pobreza e isolamento social e familiar a que estavam submetidos.
O Brasil foi o único país das Américas que não conseguiu a meta de reduzir o número de novos casos para menos de 1 em cada 10.000 pessoas, prejudicando a erradicação nos países vizinhos.[59] No estado de São Paulo, constatou-se declínio dos casos entre 2004 e 2006 na maioria das regiões, e coeficientes mais elevados foram detectados ao norte do estado.[60]
Sociedade e cultura
[editar | editar código-fonte]A lepra foi, durante muito tempo, incurável e muito mutiladora, forçando o isolamento dos pacientes em leprosarias (português de Portugal) ou leprosários (português do Brasil), principalmente na Europa durante a Idade Média, durante a qual eram obrigados a usar sinetas que anunciassem a sua presença, bem como roupas específicas, que ajudassem no seu reconhecimento por parte da restante população.[16][30]
Ainda que seja uma doença completamente tratável e curável, a lepra encontra-se, ainda, carregada de um enorme estigma social,[10][30][53][61] que pode dever-se, em parte, aos estereótipos sociais que desde sempre foram associados à lepra - vida de pecado e sinal de uma “alma impura” [30][61] -, que muitas vezes são instigados e agravados pelas características visíveis da doença e que resultam em discriminação e marginalização.[10][30][61]
Este estigma depende fortemente dos contextos sociais e culturais,[61][62] e afeta inúmeras áreas da vida destas pessoas, como o casamento, a interação social e o emprego.[61]
Em outros animais
[editar | editar código-fonte]Ainda que a espécie humana seja a principal espécie a ser afetada pelo M. leprae, já foram observadas infeções pela mesma bactéria em primatas,[16] armadilhos nos estados Norte-americanos do Texas e Luisiana[16][18][21] e em esquilos vermelhos no Reino Unido.[21]
Investigação
[editar | editar código-fonte]Paleopatologia
[editar | editar código-fonte]Diagnóstico
[editar | editar código-fonte]As lesões esqueléticas características da hanseníase envolvem a face e o esqueleto apendicular distal. As características cranianas da hanseníase (fácies-leprosa ou síndrome rinomaxilar[63]), consistem na erosão e enfraquecimento progressivos do processo alveolar da maxila, com consequente perda dos incisivos centrais e laterais superiores,[17][18][20][22] e na destruição da espinha nasal anterior, no arredondamento e alargamento das margens da abertura piriforme[18][19][20][22][52] e na perfuração do palato.[18][19][52]
Podem ocorrer outras alterações que incluem deformidades nos ossos das mãos e dos pés, geralmente simétricas. Estas envolvem: a destruição da articulação e reabsorção dos dedos das mãos e dos pés, com deslocamento parcial e fusão óssea - dedos “em garra”;[17][18][20][22] a remodelação destrutiva dos ossos tubulares das mãos e dos pés, que se inicia nas extremidades distais do osso e que pode causar a total destruição do mesmo.[17][18] Podem existir evidências de osteomielite e/ou alterações neuropáticas das articulações dos pés ou do tornozelo.[64]
Uma grande dificuldade neste diagnóstico prende-se com o facto de várias patologias poderem causar alterações ósseas semelhantes.[20] No caso da lepra, a destruição óssea, nomeadamente na região nasal, no palato e nas falanges, pode ser confundida com alterações tafonómicas (fragmentação post mortem); a síndrome rinomaxilar pode ocorrer noutras patologias como as treponematoses, a tuberculose cutânea, a leishmaniose e neoplasias malignas;[65][66] as alterações dos ossos das mãos e dos pés podem ser idênticos a doenças como a diabetes, síndrome de Raynaud, ulceração e treponematoses.[65]
Um diagnóstico claro e evidente de lepra baseado em alterações paleopatológicas só pode ser feito se as alterações ósseas faciais (sobretudo as deformidades nasais) forem encontradas em combinação com a atrofia e truncamento dos dedos das mãos e dos pés,[18][20] sendo a presença simultânea destas alterações interpretada como “patognomónica” da doença.[18][65]
Odontodisplasia leprogénica
[editar | editar código-fonte]A Odontodisplasia leprogénica (dens leprosus) consiste no desenvolvimento anormal da raiz dentária dos incisivos superiores (raiz reduzida) e é caracterizada pela presença de uma ranhura de constrição concêntrica.[65] Normalmente esta anomalia está associada à infeção por M. leprae durante a infância e é coincidente com as alterações rinomaxilares características da lepra,[65] nomeadamente o enfraquecimento dos processos alveolares da maxila e a perda dos incisivos superiores. Esta patologia é pouco comum no registo paleopatológico - 6 casos descritos na Escandinávia medieval, associados a leprosarias[65] - e não existem, até ao momento, casos clínicos relatados.[65][67]
Notas
Referências
- ↑ a b c d e f g h i j k l m n o p Suzuki, Koichi; Akama, Takeshi; Kawashima;, Akira; et al. (Fevereiro de 2012). «Current Status of Leprosy: Epidemiology, Basic Science and Clinical Perspectives.». International Journal of Dermatology. 39 (2): 121–9. PMID 21973237. doi:10.1111/j.1346-8138.2011.01370.x. Consultado em 19 de maio de 2020
- ↑ a b c d e f g h i j k l «Leprosy». Organização Mundial da Saúde. 10 de setembro de 2019. Consultado em 20 de maio de 2020
- ↑ a b «New Leprosy Bacterium: Scientists Use Genetic Fingerprint To Nail 'Killing Organism'». ScienceDaily. 28 de novembro de 2008. Consultado em 31 de janeiro de 2010. Cópia arquivada em 13 de março de 2010
- ↑ Schreuder, P.A.M.; Noto, S.; Richardus J.H. (janeiro de 2016). «Epidemiologic trends of leprosy for the 21st century». Clinics in Dermatology. 34 (1): 24–31. ISSN 0738-081X. PMID 26773620. doi:10.1016/j.clindermatol.2015.11.001
- ↑ GBD 2015 Disease and Injury Incidence and Prevalence, Collaborators. (8 de outubro de 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015.». Lancet. 388 (10053): 1545–1602. PMC 5055577
 . PMID 27733282. doi:10.1016/S0140-6736(16)31678-6
. PMID 27733282. doi:10.1016/S0140-6736(16)31678-6
- ↑ «Lei Nº 9.010, de 29 de Março de 1995». Planalto.gov.br. Consultado em 22 de setembro de 2022
- ↑ a b «Hansen's Disease (Leprosy) Transmission». cdc.gov. 29 de abril de 2013. Consultado em 28 de fevereiro de 2015. Cópia arquivada em 13 de março de 2015
- ↑ «Global leprosy situation, 2012». Wkly. Epidemiol. Rec. 87 (34): 317–28. Agosto de 2012. PMID 22919737
- ↑ Rodrigues LC; Lockwood DNj (junho de 2011). «Leprosy now: epidemiology, progress, challenges, and research gaps.». The Lancet Infectious Diseases. 11 (6): 464–70. PMID 21616456. doi:10.1016/S1473-3099(11)70006-8
- ↑ a b c d e f g h i j k l m n o p «Weekly Epidemiological Record (WER), 8 September 2023, Vol. 98, No. 37, pp. 409–430 [EN/FR] - World | ReliefWeb». reliefweb.int (em inglês). 15 de setembro de 2023. Consultado em 27 de outubro de 2023 Erro de citação: Código
<ref>inválido; o nome ":0" é definido mais de uma vez com conteúdos diferentes - ↑ Walsh F (31 de março de 2007). «The hidden suffering of India's lepers». BBC News. Cópia arquivada em 29 de maio de 2007
- ↑ Lyn TE (13 de setembro de 2006). «Ignorance breeds leper colonies in China». Independat News & Media. Consultado em 31 de janeiro de 2010. Cópia arquivada em 8 de abril de 2010
- ↑ a b Byrne, Joseph P. (2008). Encyclopedia of pestilence, pandemics, and plagues. Westport, Conn.[u.a.]: Greenwood Press. p. 351. ISBN 978-0-313-34102-1
- ↑ editors, Enrico Nunzi, Cesare Massone, (2012). Leprosy a practical guide. Milan: Springer. p. 326. ISBN 978-88-470-2376-5. Cópia arquivada em 8 de setembro de 2017
- ↑ «Neglected Tropical Diseases». cdc.gov. 6 de junho de 2011. Consultado em 28 de novembro de 2014. Cópia arquivada em 4 de dezembro de 2014
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am Máquina, A., et al., Lepra: Da Antiguidade aos Nossos Tempos. Journal of the Portuguese Society of Dermatology and Venereology, 2019. 77(4): p. 323-338.
- ↑ a b c d e f g h i Ferreira, M.T., M.J. Neves, and S.N. Wasterlain, Lagos leprosarium (Portugal): evidences of disease. Journal of Archaeological Science, 2013. 40(5): p. 2298-2307.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai Matos, V., O diagnóstico retrospectivo da lepra. 2009, Tese de Doutorado). Coimbra: Universidade Coimbra.
- ↑ a b c d e f g h i j k l Rubini, M., et al., Paleopathological and molecular study on two cases of ancient childhood leprosy from the Roman and Byzantine Empires. International Journal of Osteoarchaeology, 2014. 24(5): p. 570-582.
- ↑ a b c d e f g Donoghue, H.D., et al., A migration-driven model for the historical spread of leprosy in medieval Eastern and Central Europe. Infection, Genetics and Evolution, 2015. 31: p. 250-256.
- ↑ a b c d e f g h Crespo, F., J. White, and C. Roberts, Revisiting the tuberculosis and leprosy cross-immunity hypothesis: Expanding the dialogue between immunology and paleopathology. International journal of paleopathology, 2019. 26: p. 37-47.
- ↑ a b c d e f Steckel, R.H., et al., Data collection codebook. The global history of health project, 2006. 2006: p. 1-41.
- ↑ Organization, W.H., Chemotherapy of leprosy for control programmes: report of a WHO study group [meeting held in Geneva from 12 to 16 October 1981]. 1982.
- ↑ Ridéey, D. and W. Jopling, Classification of leprosy according to immunity. A five-group system. International journal of leprosy, 1966. 34(3): p. 255-73.
- ↑ Han, X.Y., et al., A new Mycobacterium species causing diffuse lepromatous leprosy. American journal of clinical pathology, 2008. 130(6): p. 856-864.
- ↑ a b c d e Cruz, A., et al. O Hospital-Colónia Rovisco Pais e os múltiplos desdobramentos da lepra: etnografia e interdisciplinaridade. in II Congresso Internacional sobre Etnografia. 2007. AGIR-Associação para a Investigação e desenvolvimento Sócio-Cultural.
- ↑ Bechelli, L. and R. Quagliato, Lepra dimorfa (" Borderline"). Sua classificação. Rev. Bras. Leprol, 1960. 28: p. 129-140.
- ↑ a b c d Verma, A.K., et al., Coexistence of leprosy and pulmonary tuberculosis: an uncommon entity. Medical Journal of Dr. DY Patil University, 2015. 8(5): p. 675.
- ↑ a b c d e f g h i j Cruz, A., O Hospital-Colônia Rovisco Pais: a última leprosaria portuguesa e os universos contingentes da experiência e da memória. História, Ciências, Saúde-Manguinhos, 2009. 16(2): p. 407-431.
- ↑ a b c d e f g h i j k l m n o p q r Doria, J.L., Apontamentos históricos sobre a lepra. Anais do Instituto de Higiene e Medicina Tropical, 2015. 14: p. 109-115.
- ↑ Organization, W.H., Guidelines for the diagnosis, treatment and prevention of leprosy. 2018.
- ↑ Organization, W.H., Global Leprosy Strategy 2016-2020: accelerating towards a leprosy-free world-Operational manual. 2019.
- ↑ da Fonseca, J.M.A., et al., Contribuições da fisioterapia para educação em saúde e grupo de autocuidado em hanseníase: relato de experiência. Revista Eletrônica Gestão e Saúde, 2015(1): p. 770-777.
- ↑ a b Godoi, A.R., et al., ALTERAÇÕES NO DESENVOLVIMENTO EMBRIONÁRIO CAUSADAS PELA UTILIZAÇÃO DA TALIDOMIDA. Arquivos do MUDI, 2019. 23(3): p. 330-344.
- ↑ Lima, L.M., C.A.M. Fraga, and E.J. Barreiro, O renascimento de um fármaco: talidomida. Química Nova, 2001. 24(5): p. 683-688.
- ↑ Penna, G.O., et al., Talidomida no tratamento do eritema nodoso hansênico: revisão sistemática dos ensaios clínicos e perspectivas de novas investigações. Anais brasileiros de dermatologia, 2005. 80(5): p. 511-522.
- ↑ Chaussinand, R., Tuberculosis and leprosy, antagonist diseases. Prevention of leprosy by tuberculosis. Int J Lepr, 1948. 16: p. 431-438.
- ↑ Duthie, M.S., et al., Protection against Mycobacterium leprae infection by the ID83/GLA-SE and ID93/GLA-SE vaccines developed for tuberculosis. Infection and immunity, 2014. 82(9): p. 3979-3985.
- ↑ @NacoesUnidas, Dia Mundial de Combate à Hanseníase ressalta necessidade de prevenção. 2021.
- ↑ Rodrigues, L.C. and D.N. Lockwood, Leprosy now: epidemiology, progress, challenges, and research gaps. The Lancet infectious diseases, 2011. 11(6): p. 464-470.
- ↑ a b Expresso, J., Dia Mundial de luta contra a Lepra. Mais de 200 mil novos casos todos os anos. 2020.
- ↑ Diário da República n.º 243/2016, 1º Suplemento, Série II de 2016-12-21.
- ↑ «Brasil é o segundo em número de casos de hanseníase no mundo». Agência Brasil. 23 de janeiro de 2020. Consultado em 20 de junho de 2021
- ↑ «Angola chega aos 1.210 casos de lepra notificados». Jornal Observador. 20 de fevereiro de 2016. Consultado em 20 de junho de 2021
- ↑ «Moçambique registou 1.926 casos de lepra em 2017, mais 245 do que em 2016». Jornal Observador. 25 de julho de 2018. Consultado em 20 de junho de 2021
- ↑ Suzuki, K., et al., Current status of leprosy: epidemiology, basic science and clinical perspectives. The Journal of dermatology, 2012. 39(2): p. 121-129.
- ↑ a b Köhler, K., et al., Possible cases of leprosy from the Late Copper Age (3780-3650 cal BC) in Hungary. PloS one, 2017. 12(10): p. e0185966.
- ↑ Mariotti, V., et al., Probable early presence of leprosy in Europe in a Celtic skeleton of the 4th–3rd century BC (Casalecchio di Reno, Bologna, Italy). International Journal of Osteoarchaeology, 2005. 15(5): p. 311-325.
- ↑ Lee, F. and J. Magilton, The cemetery of the hospital of St James and St Mary Magdalene, Chichester‐a case study. World Archaeology, 1989. 21(2): p. 273-282.
- ↑ Roffey, S. and K. Tucker, A contextual study of the medieval hospital and cemetery of St Mary Magdalen, Winchester, England. International Journal of Paleopathology, 2012. 2(4): p. 170-180.
- ↑ Møller‐Christensen, V., Case of leprosy from the Middle ages of Denmark. Acta Medica Scandinavica, 1952. 142(S266): p. 101-108.
- ↑ a b c d Fotakis, A.K., et al., Multi-omic detection of Mycobacterium leprae in archaeological human dental calculus. Philosophical Transactions of the Royal Society B, 2020. 375(1812): p. 20190584.
- ↑ a b Boldsen, J.L., Epidemiological approach to the paleopathological diagnosis of leprosy. American Journal of Physical Anthropology: The Official Publication of the American Association of Physical Anthropologists, 2001. 115(4): p. 380-387.
- ↑ Antunes-Ferreira, N. and A. Rodrigues, Intervenção arqueológica no largo da ermida de Santo André (Beja). Al-Madan, 2003. 12(IIª série): p. 193.
- ↑ Antunes-Ferreira, N., V.M. Matos, and A.L. Santos, Leprosy in individuals unearthed near the Ermida de Santo André and Leprosarium of Beja, Portugal. Anthropological Science, 2013: p. 130702.
- ↑ Melo, L., et al., The first probable evidence of leprosy in a male individual (17th-19th century AD) unearthed in Northern Portugal (Travanca, Santa Maria da Feira). International Journal of Paleopathology, 2021. 32: p. 80-86.
- ↑ Cavaliere, I. Hanseníase da história. [cited 2018 7 de junho]; Available from: http://www.invivo.fiocruz.br/cgi/cgilua.exe/sys/start.htm?infoid=1182&sid=7.
- ↑ Base Legislação da Presidência da República - Lei nº 5.511 de 15 de outubro de 1968. 1968; Available from: https://legislacao.presidencia.gov.br/atos/?tipo=LEI&numero=5511&ano=1968&ato=fb2ITV610djRVT489.
- ↑ http://www.who.int/mediacentre/factsheets/fs101/es/
- ↑ Rodrigues-Júnior, Antonio Luiz; O, Vinícius Tragante do; Motti, Vivian Genaro (6 de abril de 2008). «Estudo espacial e temporal da hanseníase no estado de São Paulo, 2004-2006.». Rev. Saúde Pública. Consultado em 7 de junho de 2018
- ↑ a b c d e Marahatta, S.B., et al., Perceived stigma of leprosy among community members and health care providers in Lalitpur district of Nepal: A qualitative study. PLoS One, 2018. 13(12): p. e0209676.
- ↑ Souza, Ricardo Luiz (2015). Estigma, discriminação e lepra. Curitiba: Editora UFPR. ISBN 9788565888899
- ↑ Andersen, J.G. and K. Manchester, The rhinomaxillary syndrome in leprosy: a clinical, radiological and palaeopathological study. International Journal of Osteoarchaeology, 1992. 2(2): p. 121-129.
- ↑ Waldron, T., Palaeopathology. 2020: Cambridge University Press.
- ↑ a b c d e f g Matos, V.M. and A.L. Santos, Leprogenic odontodysplasia: new evidence from the St. Jørgen’s medieval leprosarium cemetery (Odense, Denmark). Anthropological Science, 2013: p. 121112.
- ↑ GJ, R., S. SC, and G. AS, Sociedad Novohispana y enfermedad. Un caso de lepra en el complejo funerario colonial de Tlatelolco, México. ANTROPOLOGÍA FÍSICA, 2020. 41: p. 28-42.
- ↑ Santos, A.L., Paleopatologia das Populações Humanas. Relatório da Unidade Curricular. 2020.
Ligações externas
[editar | editar código-fonte]- «Leprosy» (em inglês). Organização Mundial da Saúde (OMS)
- «Hansen's Disease (Leprosy)» (em inglês). Centros de Controle e Prevenção de Doenças (CDC)
- Lepra no Manual Merck
- O Hospital-Colónia Rovisco Pais: a última leprosaria portuguesa e os universos contingentes da experiência e da memória. (Consultado em 30 de Março de 2011)
- Centro de Documentação Bissaya Barreto - Para o estudo da assistência e tratamento da Lepra em Portugal
- Estudo espacial e temporal da hanseníase no estado de São Paulo, 2004-2006. (Consultado em 7 de Junho de 2018)

